Влияние наноструктурированной системы хитозан–пчелиный яд–наночастицы золота на активность свободнорадикальных процессов, адаптацию системы крови и рост новообразования у крыс с перевитой опухолью PC-1
Цель исследования — оценить по показателям системы крови адаптогенные и антиоксидантные свойства, а также противоопухолевую эффективность наноструктурированного препарата хитозан–пчелиный яд–наночастицы золота на лабораторных животных с перевитой опухолью штамма РС-1.
Материалы и методы. Влияние нанопрепарата хитозан–пчелиный яд–наночастицы золота на антиоксидантный, адаптогенный, противоопухолевый эффекты исследовали при инъекционном введении животным (35 белых крыс) с перевитой опухолью РС-1 (альвеолярный рак печени). В динамике эксперимента осуществляли анализ физиологических и биохимических показателей крови. На 28-е сутки после введения препаратов определяли площадь внешней поверхности опухолей животных контрольных и опытной групп.
Результаты. Проведена сравнительная оценка свободнорадикального окисления по количеству конечных продуктов перекисного окисления липидов и активности антиоксидантной системы в плазме крови, а также уровня стресса по лейкоцитарной формуле и лейкоцитарному коэффициенту крови и площади внешней поверхности опухоли у лабораторных животных после окончания введения препаратов. Выявлена противоопухолевая, антиоксидантная и адаптогенная активность препарата хитозан–пчелиный яд–наночастицы золота.
Заключение. Наноструктурированный препарат хитозан–пчелиный яд–наночастицы золота в терапевтических дозах (на порядок меньше токсичных) эффективно ингибирует рост перевитой опухоли PC-1 (альвеолярный рак печени), проявляя при этом выраженную антиоксидантную и адаптогенную активность.
Развитие злокачественных образований сопровождается нарушением целого ряда систем организма. Опухоль в первую очередь оказывает негативное воздействие на иммунную систему. Известно, что при развитии злокачественных новообразований происходит нарушение равновесия в системе свободнорадикальное окисление липидов–антиоксидантная защита организма, сопровождаемое возникновением так называемого окислительного стресса.
Лекарства, применяемые для химиотерапии, имеют очень узкий диапазон терапевтического действия. Дозы, необходимые для достижения противоопухолевого эффекта, не сильно отличаются от доз, способных вызвать токсический эффект. В связи с этим весьма актуален поиск терапевтических средств с полифункциональными свойствами, которые при малой токсичности проявляли бы противоопухолевый, антиоксидантный, адаптогенный, иммунотропный эффекты.
В последнее время активно используются антиоксидантные и адаптогенные эффекты хитозана, системы хитозан–наночастицы золота при действии экстремальных факторов различной природы, установлено положительное влияние комплекса олигосахарида хитозана сукцинат-аскорбата на активность свободнорадикальных процессов, стимуляцию деструкции ткани опухоли на экспериментальной модели злокачественного роста [1].
Учеными Медицинской школы Вашингтонского университета успешно инкапсулирован основной токсин пчелиного яда мелиттин и продемонстрированы возможности его применения в противораковой терапии у мышей [2]. Известно, что биологическая эффективность пчелиного яда при использовании его в качестве комплексной многокомпонентной системы гораздо выше, чем эффективность отдельных компонентов [3]. Данных по изучению влияния цельного пчелиного яда на опухолевые процессы в доступной научной литературе не найдено.
Вследствие белковой природы пчелиный яд способен разрушаться различными протеазами организма. Это ограничивает время его нахождения и проявления действия в тканях [4, 5]. В связи с этим на кафедре химии высокомолекулярных соединений химического факультета ННГУ им. Н.И. Лобачевского был синтезирован комплексный наноструктурированный препарат хитозан–пчелиный яд–наночастицы золота, в котором хитозан выполняет функции стабилизатора наночастиц золота, обеспечивает проникновение лекарственных средств в межклеточное пространство и экранирует белковый компонент пчелиного яда от разрушающего действия протеаз, увеличивая при этом время жизни комплексного препарата, а золото выполняет функции нанопереносчика [6, 7].
Система крови одной из первых реагирует и наиболее полно отражает состояние и характер метаболизма всего организма. В качестве основных индикаторных показателей, характеризующих функциональное состояние организма (стресс, реакция активации, тренировка), используют лейкоцитарную формулу и лейкоцитарный коэффициент [8].
Цель исследования — изучить влияние наноструктурированной системы хитозан–пчелиный яд–наночастицы золота на активность свободнорадикальных процессов и адаптацию организма крыс с перевитой опухолью штамма РС-1, оцениваемых по показателям системы крови, а также влияние нанокомплекса на рост новообразования.
Материалы и методы. Работа была проведена на белых нелинейных крысах-самках трехмесячного возраста массой 150–200 г (n=20). Все процедуры на лабораторных животных осуществлялись в соответствии с требованиями Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях (Страсбург, 18 марта 1986); Международных рекомендаций по проведению медико-биологических исследований с использованием животных (1993); Правил лабораторной практики в Российской Федерации (Приказ МЗ РФ №267 от 19.06.2003) и Правил проведения работ с использованием экспериментальных животных (Приказ МЗ №755 от 12.03.1977).
В работе применялись водные растворы дисперсии наночастиц золота, стабилизированные пчелиным ядом и хитозаном с молекулярной массой 1,3·105 кДа и степенью деацетилирования 0,80–0,82. Наночастицы золота получали в растворе хитозана («Биопрогресс», Россия) при УФ-индуцированном восстановлении золотохлористоводородной кислоты (HАuCl4). Средний размер наночастиц золота в биопрепарате составлял от 5 до 10 нм, поскольку есть данные, что наночастицы золота практически не токсичны в интервале размеров от 3 до 20 нм [9, 10]. Пчелиный яд был получен на пасеках Борского района Нижегородской области методом электростимуляции. DL50 яда составила 8–10 мг/кг.
Перевивку опухоли (0,5 мл 30% взвеси опухолевых клеток в растворе Хенкса) осуществляли подкожно в паховую область справа. Штамм альвеолярного рака печени РС-1 получен из банка опухолевых штаммов РОНЦ им. Н.Н. Блохина РАМН. Животные были разделены на 4 группы по 5 особей в каждой: 1) интактные (относительная норма); 2) контроль 1 — животные-опухоленосители без лечения; 3) контроль 2 — животные-опухоленосители, которым вводили препарат хитозан–наночастицы золота (хитозан — 100 мг/кг; золото — 0,25 мг/кг); 4) опытная группа — животные-опухоленосители, которым вводили препарат хитозан–пчелиный яд–наночастицы золота (хитозан — 100 мг/кг; пчелиный яд — 0,5 мг/кг; золото — 0,25 мг/кг). Препарат вводили спустя неделю после перевивки опухоли путем ее обкалывания, пятикратно, через день, в объеме 0,25 мл на животное.
Забор крови проводили из подъязычной вены на 1, 14 и 28-е сутки после окончания курсового введения препарата.
В крови определяли: количество лейкоцитов при помощи гематологического анализатора Abacus Junior 30 (Diatron, Австрия); индикаторные показатели — лимфоциты, сегментоядерные нейтрофилы на мазках крови общепринятым методом с окраской мазков по Романовскому–Гимзе [11]. Дополнительно рассчитывали значение лейкоцитарного коэффициента (отношение количества лимфоцитов к относительному содержанию сегментоядерных нейтрофилов), которое снижается при стрессе и увеличивается при адаптационной реакции устойчивой активации [8]. В плазме крови определяли: содержание одного из конечных продуктов перекисного окисления липидов (ПОЛ) — оснований Шиффа (ОШ) методом И.А. Волчегорского (1989); интенсивность свободнорадикального окисления и активность антиоксидантной системы биохемилюминесцентным методом [12]. Влияние наноструктурированной системы на рост опухолей оценивали по их массе у животных контрольных и опытной групп, которую определяли путем взвешивания на 28-е сутки после окончания введения препаратов.
Результаты исследований статистически обрабатывали с помощью программы BIOSTAT. Независимые выборки сравнивали с помощью однофакторного анализа, t-критерия Стьюдента и непараметрического критерия Крускала–Уоллиса. При расчете t-критерия Стьюдента применяли поправку Бонферрони, позволяющую установить ошибку первого рода, возникающую при сравнении более чем двух выборок данным методом [13].
Результаты. На 1-е сутки после окончания введения препаратов статистически значимых различий в значениях Imax и 1/S, характеризующих соответственно максимальную активность свободнорадикальных процессов и емкость (активность) антиоксидантной системы, у животных всех групп не наблюдалось, за исключением контрольной группы 2 (хитозан–наночастицы золота), у животных которой значение 1/S было выше, чем у животных других групп (табл. 1).
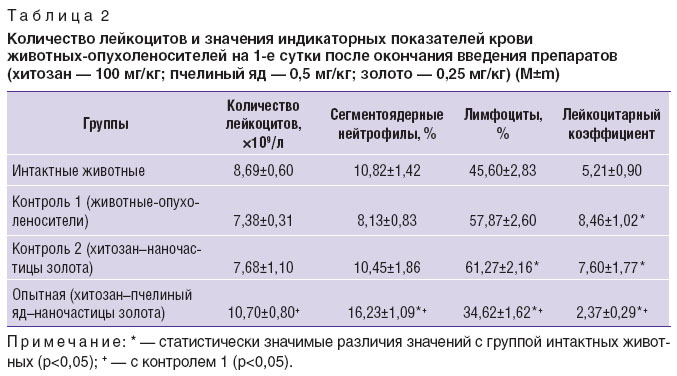
 Таблица 1. Показатели Imax и 1/S плазмы крови животных-опухоленосителей на 1-е сутки после окончания введения препаратов (хитозан — 100 мг/кг; пчелиный яд — 0,5 мг/кг; золото — 0,25 мг/кг) (M±m) Таблица 1. Показатели Imax и 1/S плазмы крови животных-опухоленосителей на 1-е сутки после окончания введения препаратов (хитозан — 100 мг/кг; пчелиный яд — 0,5 мг/кг; золото — 0,25 мг/кг) (M±m)
|
Содержание конечных продуктов липопероксидации (ОШ) в опытной группе (хитозан–пчелиный яд–наночастицы золота) было статистически значимо выше, чем в других группах (рис. 1).
Значения индикаторных показателей (количество сегментоядерных нейтрофилов, лимфоцитов и значение лейкоцитарного коэффициента) в контрольных группах 1 и 2 указывали, что эти животные-опухоленосители находятся в состоянии стойкой активации, близкой к состоянию нормы, в опытной группе — свидетельствовали, что животные находятся в состоянии стресса (табл. 2).
На 14-е сутки в контрольной группе 2 значение показателя Imax, характеризующего способность системы к свободнорадикальному окислению, не отличалось от значений интактных животных, а в контрольной группе 1, напротив, было статистически значимо выше. В опытной группе оно было статистически значимо ниже, чем в контрольных и интактной группах. Значение 1/S у животных контрольной группы 1 не отличалось от значений у интактных животных. В контрольной группе 2 (хитозан–наночастицы золота) емкость антиоксидантной системы была статистически значимо ниже, чем у животных интактной группы и контрольной группы 1. У крыс опытной группы значение 1/S было статистически значимо выше, чем в других группах (р<0,05) (табл. 3).
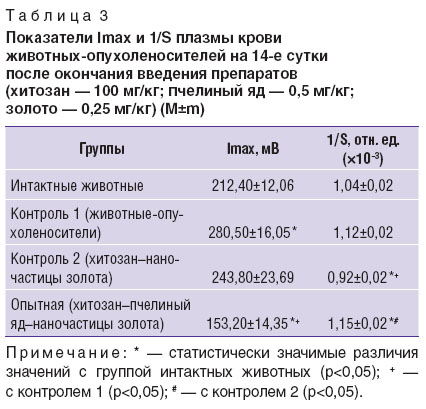 Таблица 3. Показатели Imax и 1/S плазмы крови животных-опухоленосителей на 14-е сутки после окончания введения препаратов (хитозан — 100 мг/кг; пчелиный яд — 0,5 мг/кг; золото — 0,25 мг/кг) (M±m) Таблица 3. Показатели Imax и 1/S плазмы крови животных-опухоленосителей на 14-е сутки после окончания введения препаратов (хитозан — 100 мг/кг; пчелиный яд — 0,5 мг/кг; золото — 0,25 мг/кг) (M±m)
|
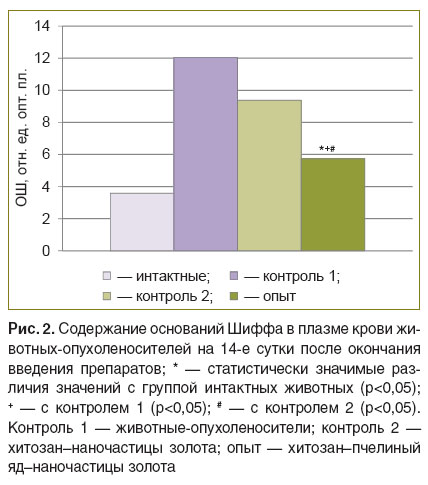
Содержание конечных продуктов ПОЛ (ОШ) в плазме крови животных контрольных групп 1 и 2 было статистически значимо выше, чем у интактных крыс; у крыс опытной группы — ниже, чем в контрольных группах, и не имело статистически значимых различий с интактными животными (рис. 2).
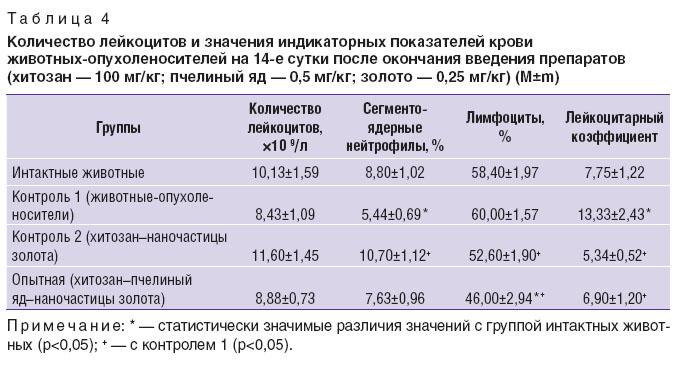
Количество лейкоцитов и лимфоцитов в контрольной группе 1 статистически значимо не отличалось от их числа у интактных животных, но наблюдалось снижение количества сегментоядерных нейтрофилов и увеличение значения лейкоцитарного коэффициента (р<0,05) (табл. 4). В контрольной группе 2 количество сегментоядерных нейтрофилов было выше, а значение лейкоцитарного коэффициента и лимфоцитов — ниже, чем в контроле 1, но при этом они не отличались от таковых показателей у интактных животных. В опытной группе количество лимфоцитов и значение лейкоцитарного коэффициента были ниже, чем в контрольной группе 1, но при этом количество лейкоцитов, сегментоядерных нейтрофилов, значение лейкоцитарного коэффициента за исключением количества лимфоцитов не отличались от аналогичных показателей у интактных животных.
На 28-е сутки после окончания введения нанопрепаратов значение Imax у животных обеих контрольных групп было статистически значимо выше, чем в интактной группе. У животных опытной группы данный показатель был статистически значимо ниже, чем в контрольных группах, и не отличался от значений у интактных животных (р>0,05). Характерно, что и емкость антиоксидантной системы (1/S) у животных опытной группы была также статистически значимо выше, чем у крыс интактной и контрольных групп (табл. 5).
 Таблица 5. Показатели Imax и 1/S плазмы крови животных-опухоленосителей на 28-е сутки после окончания введения препаратов (хитозан — 100 мг/кг; пчелиный яд — 0,5 мг/кг; золото — 0,25 мг/кг) (M±m) Таблица 5. Показатели Imax и 1/S плазмы крови животных-опухоленосителей на 28-е сутки после окончания введения препаратов (хитозан — 100 мг/кг; пчелиный яд — 0,5 мг/кг; золото — 0,25 мг/кг) (M±m)
|
Различий в содержании ОШ между всеми группами не наблюдалось.
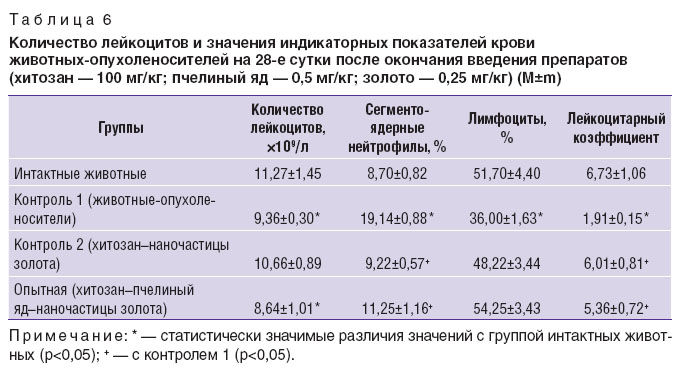
Значения индикаторных показателей (количество сегментоядерных нейтрофилов, лимфоцитов и лейкоцитарный коэффициент) у животных, получавших нанопрепараты (контроль 2, опыт), не имели статистически значимых различий со значениями у животных интактной группы (табл. 6).
У животных-опухоленосителей контрольных групп эти показатели статистически значимо отличались от значений как интактных, так и животных, получавших препараты (см. табл. 6).
На 28-е сутки было проведено определение массы опухолей. У животных контрольной группы 1 она составила 32,34±12,90 г, группы 2 — 17,92±4,35 г, опытной группы — 4,62±1,58 г (р<0,05 при сравнении с обеими группами контроля).
У животных контрольной группы 2 масса опухоли была ниже, чем у животных контрольной группы 1, хотя эти различия статистически не значимы. Это свидетельствовало об определенном, хотя и слабом, ингибирующем влиянии комплекса хитозан–наночастицы золота на рост опухоли. У животных опытной группы, получавших препарат хитозан–пчелиный яд–наночастицы золота, масса опухолей была в несколько раз меньше, чем в контроле 1 и 2 (р<0,05).
Обсуждение. Отсутствие статистически значимых различий между показателями, характеризующими интенсивность свободнорадикального окисления, функциональное состояние животных интактной и контрольных групп на следующие сутки после окончания терапии, может быть связано с малыми размерами, начальной стадией роста опухоли, еще не оказывающей стрессорного воздействия на организм. Более высокие, чем в других группах, значения емкости антиоксидантной системы в контрольной группе 2, по всей видимости, обусловлены антирадикальной активностью золота, не экранированного пчелиным ядом [14]. В опытной группе животных, которым вводили наноструктурированный препарат хитозан–пчелиный яд–наночастицы золота, количество ОШ было выше, чем в других группах. Можно полагать, что пчелиный яд, покрывая наночастицы золота, уменьшает проявление его антирадикальной активности. Нахождение животных опытной группы в состоянии стресса может быть связано с действием пчелиного яда, поскольку известно, что этот зоотоксин является стресс-фактором [7].
На 14-е сутки после окончания введения препаратов интенсивность свободнорадикального окисления в контрольной группе 1 была статистически значимо выше, чем в других группах, а активность антиоксидантной системы — практически такой же, как у интактных животных. Этим можно объяснить статистически значимо более высокое количество ОШ в плазме крови этих животных (см. рис. 3, табл. 5). Повышенное значение Imax в контрольной группе 1 обусловлено ростом опухоли и ее токсическим действием на организм. В опытной группе интенсивность свободнорадикальной активности была ниже, а емкость антиоксидантной системы — выше, чем в других группах. Введение зоотоксина и рост опухоли сопровождаются активацией стрессреализующих симпатико-адреналовой, гипоталамо-гипофизарно-надпочечниковой систем и, как следствие, последующим увеличением мощности стресслимитирующих систем, в том числе и антиоксидантной, а в результате — снижением активности процессов липопероксидации [15]. Повышенная активность антиоксидантной системы у животных опытной группы обеспечивает в конечном итоге более низкое количество ОШ у них, чем в контроле 1 и 2 (р<0,05), и не отличающееся от значений интактной группы. Значения индикаторных показателей свидетельствовали, что животные опытной группы начали выходить из состояния стресса. Исследуемые параметры у животных контрольной группы 2 занимали промежуточное положение между аналогичными показателями контрольной группы 1 и опытной группы. Это свидетельствовало об определенном положительном действии наноструктурированной системы хитозан–наночастицы золота на организм при опухолевом процессе.
На 28-е сутки уровень свободных радикалов (Imax) в группе, получавшей препарат хитозан–пчелиный яд–наночастицы золота, снижался, мощность антиоксидантной системы (1/S) также снижалась. Поэтому в конечном итоге количество ОШ к этому времени становилось одинаковым во всех четырех группах. При этом животные контрольной группы 1 находились в состоянии стресса, а животные опытной и контрольной группы 2 выходили из него (см. табл. 6). Это с большой долей вероятности связано с адаптогенными и антирадикальными эффектами наноструктурированных препаратов, которые были показаны и при воздействии других экстремальных факторов, в частности ионизирующей радиации и гипоксии [15]. Очень важным является факт ингибирования роста опухоли препаратом хитозан–пчелиный яд–наночастицы золота. Основные компоненты пчелиного яда — мелиттин и фосфолипаза А2 — в комплексе проявляют высокую мембранолитическую и цитотоксическую активность [3]. Эти два эффекта яда пчелы как активного компонента нанокомплекса при обкалывании опухоли, кооперативно усиливая друг друга, вызывают нарушения функций мембран клеток новообразования и таким образом ингибируют ее рост. Противоопухолевые эффекты основного компонента пчелиного яда — мелиттина — были показаны на других видах опухоли и с другими средствами доставки [2]. Золото, как носитель биологически активных веществ, имеет целый ряд преимуществ: будучи индифферентным, оно проявляет высокую антирадикальную активность, что особенно важно при злокачественных новообразованиях. Экранирование яда хитозаном от разрушающего действия протеаз обеспечивает дозированное выделение компонентов апитоксина в ткани и пролонгированность их действия.
Заключение. Наноструктурированный препарат хитозан–пчелиный яд–наночастицы золота в терапевтических дозах (на порядок меньше токсичных) эффективно ингибирует рост перевитой опухоли PC-1 (альвеолярный рак печени), проявляя при этом выраженную антиоксидантную и адаптогенную активность.
Финансирование исследования. Работа была частично поддержана грантом (соглашение от 27 августа 2013 года №02.В.49.21.0003 между Минобрнауки РФ и ННГУ).
Конфликт интересов. У авторов нет конфликта интересов.
Литература
- Московцева О.М., Иванова Н.Л., Щербатюк Т.Г. Влияние сукцинатсодержащих веществ на активность свободно-радикальных процессов организма, структуру печени и на опухоли крыс с лимфосаркомой Плисса. Современные технологии в медицине 2010; 3: 24–27.
- Soman N.R., Baldwin S.L., Hu G., Marsh J.N., Lanza G.M., Heuser J.E., et al. Molecularly targeted nanocarriers deliver the cytolytic peptide melittin specifically to tumor cells in mice, reducing tumor growth. J Clin Invest 2009; 119(9): 2830–2842, http://dx.doi.org/10.1172/jci38842.
- Крылов В.Н. Пчелиный яд. Свойства, получение, применение. Н. Новгород: Изд-во ННГУ; 1995; 224 с.
- Корягин А.С., Ерофеева Е.А., Александрова О.И. Адаптогенные свойства пчелиного яда при действии экстремальных факторов различной природы. Вестник ННГУ 2007; 3: 113–115.
- Шабалин М.А., Иванова И.П., Ягин В.В., Крылов В.Н. Изменение морфологического состава белой крови при действии пчелиного яда в условиях теплового стресса у крыс-опухоленосителей. В мире научных открытий 2012; 2: 142–144.
- Корягин А.С., Ерофеева Е.А., Якимович Н.О., Александрова Е.А., Смирнова Л.А., Мальков А.В. Анализ антиоксидантных свойств хитозана и его олигомеров. Бюллетень экспериментальной биологии и медицины 2006; 142(10): 444–446.
- Koryagin A.S., Mochalova A.E., Salomatina E.V., Eshkova O.Yu., Smirnova L.A. Adaptogenic effects of chitosan-gold nanocomposites under simulated hypoxic conditions. Inorg Mater Appl Res 2013; 4(2): 127–130, http://dx.doi.org/10.1134/s2075113313020081.
- Гаркави Л.Х. Активационная терапия. Ростов-на-Дону: Изд-во Ростовского университета; 2006; 256 с.
- Хлебцов Б.Н. Плазменно-резонансные наночастицы для биомедицинских приложений. Автореф. дис. … докт. физ-мат. наук. Саратов; 2010.
- Якимович Н.О. Синтез и свойства полимерных нанокомпозитов на основе метакрилатов и хитозана, содержащих наночастицы золота, и органо-неорганических композитов на основе поли (титаноксида). Автореф. дис. … канд. хим. наук. Н. Новгород; 2008.
- Козинец Г.И., Макаров В.И. Исследование системы крови в клинической практике. М: Триада; 1998; 480 с.
- Рахманова Т.И., Матасова Л.В., Семенихина А.В., Сафонова О.А., Макеева А.В., Попова Т.Н. Методы оценки оксидативного статуса: учебно-методическое пособие для вузов. Воронеж: Изд-во ВГУ; 2009; 64 с.
- Гланц С. Медико-биологическая статистика. М: Практика; 1999; 459 с.
- Якимович Н.О., Ерофеева Е.А., Александрова Е.А., Корягина Е.А., Мальков А.В., Корягин А.С., Смирнова Л.А. Антиоксидантные свойства наночастиц золота в условиях нормы и действия ионизирующей радиации. Вестник ННГУ 2006; 5(1): 60–68.
- Александрова О.И., Ерофеева Е.А., Корягин А.С., Гамова О.Н. Влияние пчелиного яда на интенсивность перекисного окисления липидов и энергетический обмен у крыс при многократном введении в условиях относительной нормы. Естествознание и гуманизм 2006; 3(4): 36.