Роль энергетических субстратов в кальциевой активности астроцитов гиппокампа крыс раннего постнатального онтогенеза
Цель исследования — изучить функциональную активность астроглии в срезах гиппокампа крыс разного постнатального развития при моделировании метаболических изменений мозга.
Материалы и методы. Исследования проводили на переживающих срезах гиппокампа крыс линии Wistar трех возрастных групп: 5–10 дней, 10–20 дней и более 20 дней постнатального развития животного с использованием метода функционального кальциевого имиджинга.
Результаты. Установлено, что на ранних стадиях развития для нормальной кальциевой активности астроглии необходимо наличие специфических энергетических субстратов. Изменение метаболического состояния мозга при понижении температурного уровня не оказывает значительного влияния на кальциевую активность астроцитов во всех исследуемых периодах постнатального развития.
Заключение. Исследование кальциевой динамики астроцитов в разные периоды постнатального развития может служить методом оценки функциональной активности глиальных систем при моделировании метаболических нарушений мозга.
Астроглия — самый многочисленный тип глиальных клеток — выполняет ряд важных функций в мозге. Астроциты участвуют в буферизации ионов калия, регулируют локальный кровоток, вызывая при этом вазоконстрикцию или вазодилатацию, в них экспрессируются трофические факторы, влияющие на рост нейронов и формирование новых синапсов. Важную роль астроциты играют в питании нейронов, поставляя им глюкозу и другие вещества, которые могут служить энергетическими субстратами для нейронов [1]. Они также служат основным депо гликогена в мозге [2].
Астроциты являются электрически неактивными клетками, но имеют свою сигнальную систему, представленную генерацией кальциевых ответов, длительность которых может составлять несколько секунд [3]. Недавние исследования [4] показали, что астроциты играют немаловажную роль и в формировании памяти посредством поставки лактата к нейронам. При активной работе нейронов и при некоторых патологиях нервной системы в астроцитах интенсивно происходит синтез лактата, который служит источником энергии для нейронов. Поскольку нейрональная активность зависит от доступности энергетических субстратов, этот процесс также может рассматриваться как механизм регуляции астроцитами функционирования нейронов [5].
Лактат и пируват являются основными энергетическими субстратами в развивающемся мозге, а также во взрослом мозге, когда уровень глюкозы ограничен [6]. Кроме того, показано [7], что в качестве энергетического субстрата в мозге молодых животных могут выступать кетоновые тела. Они представляют собой группу органических соединений, являющихся промежуточными продуктами жирового, углеводного и белкового обмена, — ацетоуксусная кислота (ацетоацетат), β-оксимасляная кислота (β-оксибутират или D-3-гидроксибутират) и ацетон. В молоке крысы содержится большое количество жирных кислот, при расщеплении которых образуются кетоновые тела. По всей видимости, они оказывают влияние на активность нейронов в раннем постнатальном развитии [8]. Однако возрастные изменения кальциевой активности в астроцитах, а также влияние метаболических изменений мозга остаются недостаточно изученными.
Цель исследования — изучить влияние метаболических изменений мозга, таких как возраст постнатального развития животного, температурные условия и наличие специфических энергетических субстратов, на функциональную (кальциевую) активность астроцитов в гиппокампе крыс.
Материалы и методы. В работе использованы переживающие срезы гиппокампа крыс линии Wistar трех возрастных групп: 5–10 дней, 10–20 дней и более 20 дней постнатального развития животного. Основные правила содержания и ухода за экспериментальными животными соответствовали нормативам, указанным в приказе Минздрава России №267 от 19.06.03 «Об утверждении правил лабораторной практики в Российской Федерации». Исследование проведено в соответствии с принципами, установленными Европейской конвенцией по защите позвоночных животных, используемых для экспериментальных и других научных целей (принятой в Страсбурге 18.03.1986 г. и подтвержденной в Страсбурге 15.06.2006 г.), и одобрено Этическим комитетом Нижегородского государственного университета им. Н.И. Лобачевского.
Животные были анестезированы эфиром и декапитированы, затем мозг закреплялся в специальной камере, заполненной модифицированным раствором Рингера при температуре, близкой к 0°C. Раствор постоянно насыщался карбогеном (5% СО2 + 95% О2). Состав раствора (в ммоль): NaCl — 124,0; KCl — 2,5; MgSO4 — 8,48; NaH2PO4 — 1,24; NaHCO3 — 26,2; CaCl2 — 0,5; D-Glucose — 11,0. Приготовление срезов гиппокампа толщиной 350 мкм осуществляли с помощью вибратома Microm (Германия). До переноса в камеру срезы хранили в растворе с повышенным содержанием ионов магния, ослабляющего последствия резки. В состав раствора входили (в ммоль): NaCl — 124,0; KCl — 2,5; MgSO4 — 1,3; NaH2PO4 — 1,0; NaHCO3 — 26,2; CaCl2 — 1,0; MgCl2 — 1,6; D-Glucose — 11,0. Температуру раствора устанавливали в зависимости от условий эксперимента («комнатная» — 22–24°C или «близкая к физиологической» — 32–34°C). Регистрацию кальциевой динамики в астроцитах осуществляли с помощью конфокального лазерного сканирующего микроскопа Zeiss LSM 510 (Германия). В качестве флюоресцентных красителей использовали кальциевый индикатор Oregon Green 488 (0,7 мкмоль) и специфичный маркер астроцитов Sulforhodamine 101 (5 мкмоль). Изменения интенсивности флюоресценции кальциевого индикатора, регистрируемые покадровыми записями (1 кадр в секунду в течение 20 мин), использовали для измерения кальциевой активности в астроцитах. Для количественной оценки кальциевой динамики учитывали два параметра: длительность и частоту кальциевых сигналов. Данные параметры анализировали с помощью специально разработанного программного пакета Astroman. Поскольку амплитуда флюоресцентных сигналов является комплексным параметром, зависящим не только от концентрации кальция, но и от концентрации красителя, а также от мощности излучения лазера, достигающего клетки в глубине ткани, этот параметр не учитывался в оценке кальциевой динамики в астроцитах. Значения представлены в виде среднего ± стандартная ошибка среднего, n — число срезов. Достоверность статистических различий выборок проверяли с помощью непараметрического теста Манна–Уитни.
Результаты
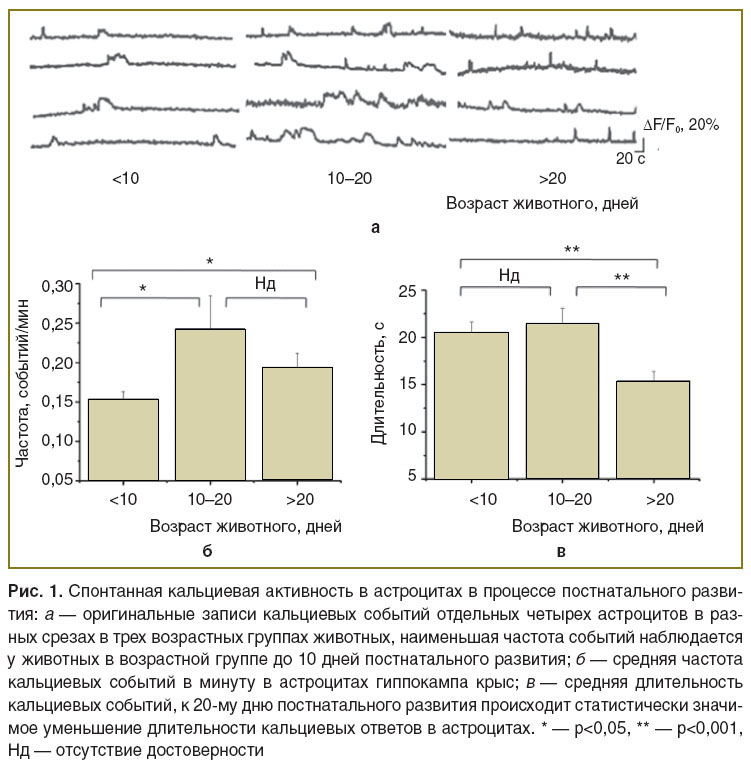
Кальциевая активность астроцитов в процессе постнатального развития. Частота и длительность кальциевых сигналов были изучены в астроцитах трех возрастных групп крыс (рис. 1, a). Наименьшая частота кальциевых событий наблюдалась у тестовой группы животных в возрасте до 10 дней и составляла 0,153±0,009 событий/мин (рис. 1, б). У животных более позднего развития (10–20 дней постнатального развития) частота событий увеличивалась до 0,244±0,040 событий/мин (p=0,05 при сравнении с тестовой группой до 10 дней постнатального развития, тест Манна–Уитни) и далее статистически значимо не изменялась. У возрастной группы животных более 20 дней постнатального развития средняя частота кальциевых событий составила 0,194±0,017 событий/мин (p=0,01 при сравнении с возрастной группой животных до 10 дней и p=0,007 при сравнении с группой животных в возрасте 10–20 дней, тест Манна–Уитни).
Средняя длительность кальциевых событий составила 20,48±1,15 с у тестовой группы животных до 10 дней постнатального периода и 21,45±1,66 с — у животных от 10 до 20 дней (p=0,1 при сравнении с тестовой группой животных до 10 дней, тест Манна–Уитни), но к периоду более 20 дней уменьшалась до 15,43±0,91 с (p=0,008 при сравнении с тестовой группой животных до 10 дней и p=0,008 при сравнении с группой 10–20 дней постнатального развития, тест Манна–Уитни) (рис. 1, в).
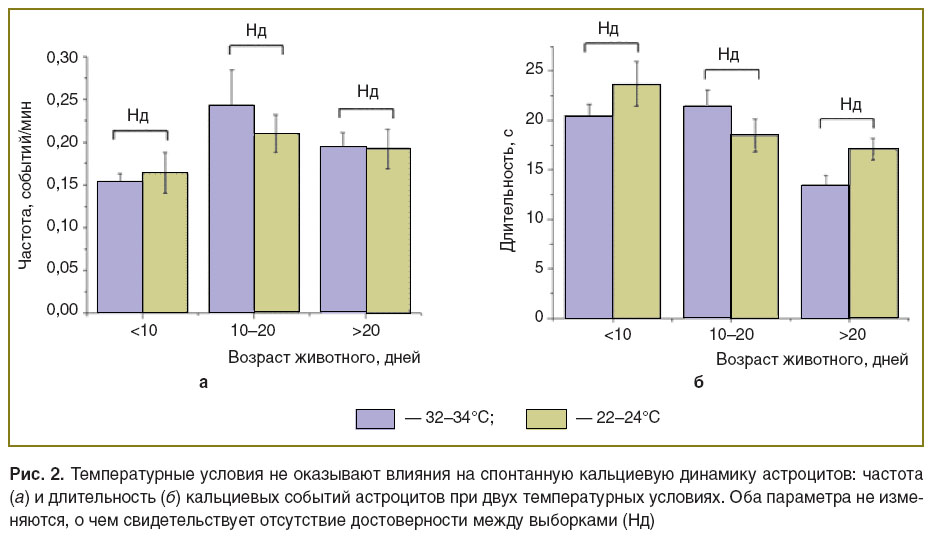
Влияние температурных условий на спонтанную кальциевую динамику в астроцитах. Одним из вероятных механизмов изменения кальциевых событий в астроцитах при развитии мозга является изменение метаболической активности клеток. Изменение уровня метаболической активности в срезах может быть достигнуто при изменении температуры. Мы сравнили кальциевую динамику в астроцитах при температуре, близкой к физиологической (32–34°C), с событиями при комнатной температуре (22–24°C). Такое изменение температуры приводит к существенному снижению спонтанных синаптических событий. Однако оказалось, что данные температурные условия не влияют ни на частоту, ни на длительность кальциевых ответов в астроцитах ни в одной возрастной группе (рис. 2). Этот результат оказался неожиданным, так как традиционно считалось, что изменение уровня нейрональной активности служит сигналом для активации астроцитов. Возможно, что базовый уровень активности астроцитов в срезах является спонтанным и не зависит от нейрональной активности, так как температурное снижение нейрональной активности не оказывает влияния на кальциевую динамику в астроцитах.
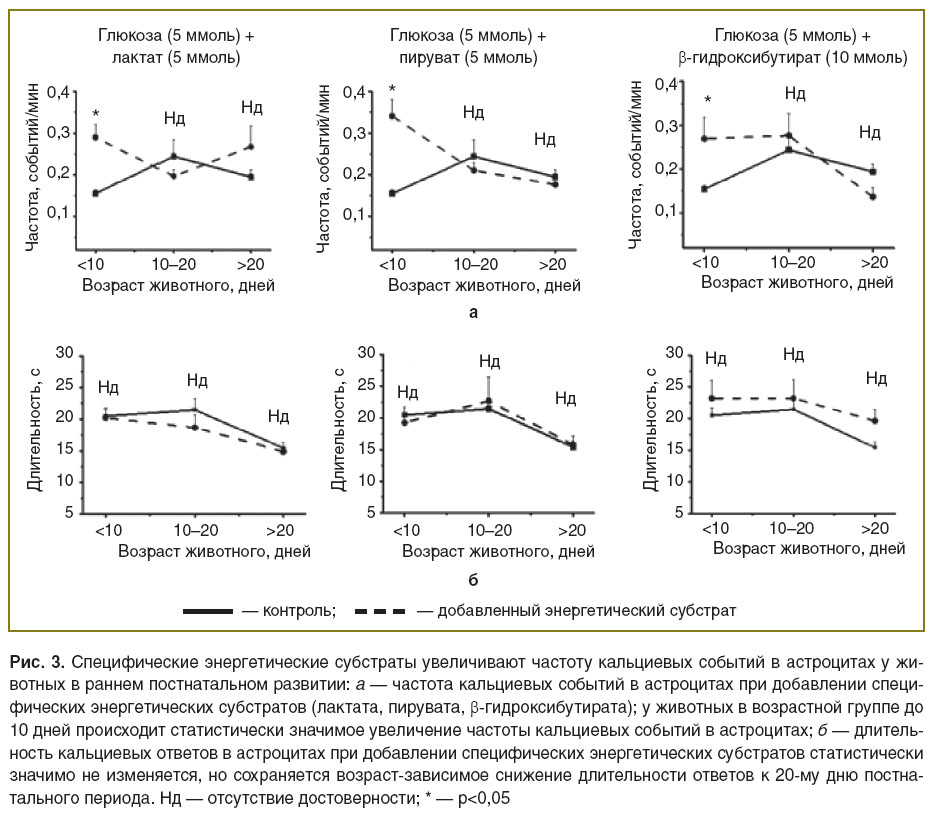
Влияние специфических энергетических субстратов на частоту кальциевых событий в астроцитах у животных в раннем постнатальном развитии. Данную часть исследования проводили путем изменения во внеклеточном растворе энергетических субстратов. В качестве контроля использовали раствор с глюкозой. При этом глюкоза не является основным субстратом в развивающемся мозге [9]. Мы предположили, что энергетические субстраты, используемые мозгом во время кормления материнским молоком, могут оказывать влияние на кальциевую активность в астроцитах. Для исследования частоты и длительности кальциевых событий в астроцитах в дополнение к глюкозе добавляли разные энергетические субстраты: контроль — глюкоза (10 ммоль); глюкоза (5 ммоль) + лактат (5 ммоль); глюкоза (5 ммоль) + пируват (5 ммоль); глюкоза (5 ммоль) + β-гидроксибутират (10 ммоль) (рис. 3). Полученные данные свидетельствуют, что специфические энергетические субстраты статистически значимо увеличивают частоту кальциевых событий в астроцитах у животных в возрастной группе до 10 дней постнатального развития, но достоверно не изменяют исследуемые параметры кальциевой динамики астроцитов у животных последующих двух тестовых групп.
Обсуждение. В развивающемся мозге многие процессы способны оказывать влияние на активность астроцитов. Изменения кальциевой активности астроцита могут быть обусловлены разными уровнями экспрессии рецепторов и транспортеров в постнатальном развитии, изменением морфологии самого астроцита [10]. Наши данные свидетельствуют, что у животных до 10 дней постнатального развития частота кальциевых событий определяется не только периодом развития животного, но и поступлением в мозг специфических энергетических субстратов из материнского молока (пирувата, лактата, β-гидроксибутирата). Если срезы от таких животных перфузировать раствором на основе глюкозы (энергетический субстрат, не характерный для этого возраста), то частота кальциевых событий в астроцитах снижается. Добавление специфических энергетических субстратов увеличивает частоту кальциевых событий до уровня, характерного для более взрослых животных. Таким образом, для нормального функционирования мозга, в частности астроцитов, на ранних стадиях постнатального развития необходимо наличие энергетических субстратов, поступающих с материнским молоком. Это очень важно, потому что именно астроциты поставляют питательные вещества к нейронам и вследствие этого регулируют их активность. Таким образом, питание материнским молоком необходимо в этот период жизни для поддержания необходимого уровня астроцитарной активности и, вследствие этого, доставки питания к нейронам. Эти данные могут обосновать необходимость материнского молока для нормального развития головного мозга на ранних этапах.
Следует также отметить, что к 20-му дню постнатального развития происходит уменьшение длительности кальциевых событий. По всей вероятности, к этому периоду в клетках уже сформированы основные системы утилизации ионов кальция, что может послужить причиной такого уменьшения. Изменения параметров кальциевых ответов в астроцитах могут быть связаны с изменениями метаболизма в них. В этом случае понижение общего уровня метаболизма в мозге при снижении температуры должно оказывать влияние на кальциевую активность в астроцитах. Однако снижение температуры срезов от близкой к физиологической до комнатной не оказало влияния на кальциевую динамику в астроцитах. Кинетика многих биохимических реакций изменяется при повышении или понижении температуры. Так, например, ферменты, катализирующие большинство биохимических реакций, обладают термолабильностью — изменением своей активности при колебаниях температуры. При определенных оптимальных значениях температура может влиять на скорость образования фермент-субстратного комплекса, вызывая ее увеличение. Это пример одной из многих других температурно-зависимых реакций, которые оказывают влияние на метаболические реакции в клетке. Однако такие изменения происходят в диапазоне микросекунд. Длительность кальциевых сигналов регистрируется в диапазоне секунд и, возможно, именно из-за значительного различия временных шкал существенных изменений в кальциевой динамике астроцитов не наблюдается.
Регуляция активности астроцитов метаболическими процессами мозга является одним из важных вопросов в нейробиологии, который не изучен в достаточном объеме. Уже ясно, что специфические энергетические субстраты, необходимые клеткам мозга на ранних стадиях постнатального развития, должны присутствовать в питательных средах, поэтому так важно контролировать наличие таких энергетических субстратов в детском питании. Если младенцев очень рано перевести с материнского молока на искусственное питание, возможно снижение активности астроцитов, в результате чего может замедлиться развитие всего мозга.
Метаболизм мозга на более поздних стадиях постнатального развития (более 10 дней) практически не зависит от добавления специфических энергетических субстратов. Поэтому при голодании и физических нагрузках, которые также приводят к повышению в мозге кетоновых тел, активность астроцитов не должна меняться. Наши данные тоже могут пролить свет на события, происходящие в мозге при понижении температуры. Астроциты при этом выступают в роли регуляторов нормального функционирования мозга, не меняя динамики параметров основной сигнальной системы. Это важно учитывать при исследованиях процессов переохлаждения человека и в трансплантологии.
Заключение. Кальциевая динамика астроцитов в разные периоды постнатального развития может служить методом оценки функциональной активности глиальных систем при моделировании метаболических нарушений мозга.
Финансирование исследования. Работа выполнена при финансовой поддержке государства в лице Министерства образования и науки РФ в рамках Федеральной целевой программы «Уникальная научная установка для исследования информационных процессов в головном мозге с использованием методов оптогенетики», уникальный идентификатор проекта RFMEFI59114X0004, соглашение о предоставлении субсидии от 01.12.2014 №14.591.21.0004 между Министерством образования и науки РФ и ННГУ с использованием оборудования уникальной научной установки.
Конфликт интересов. У авторов нет конфликта интересов.
Литература
- Parri H.R., Crunelli V. The role of Ca2+ in the generation of spontaneous astrocytic Ca2+ oscillations. Neuroscience 2003; 120(4): 979–992, http://dx.doi.org/10.1016/S0306-4522(03)00379-8.
- Brown A.M., Ransom B.R. Astrocyte glycogen and brain energy metabolism. Glia 2007; 55(12): 1263–1271, http://dx.doi.org/10.1002/glia.20557.
- Nett W.J., Oloff S.H., McCarthy K.D. Hippocampal astrocytes in situ exhibit calcium oscillations that occur independent of neuronal activity. J Neurophysiology 2002; 87(1): 528–537.
- Newman L.A., Korol D.L., Gold P.E. Lactate produced by glycogenolysis in astrocytes regulates memory processing. PLoS One 2011; 6(12): e28427, http://dx.doi.org/10.1371/journal.pone.0028427.
- Gladden L.B. Lactate metabolism: a new paradigm for the third millennium. J Physiol 2004; 558(Pt 1): 5–30, http://dx.doi.org/10.1113/jphysiol.2003.058701.
- Schurr A. Hippocampal slices and their electrophysiogy in the study of brain energy metabolism. In: Electrophysiology — from plants to heart. Edited by Saeed Oraii. InTech; 2012, p. 51–82, http://dx.doi.org/10.5772/27992.
- Cotter D.G., d’Avignon D.A., Wentz A.E., Weber M.L., Crawford P.A. Obligate role for ketone body oxidation in neonatal metabolic homeostasis. J Biol Chem 2011; 286(9): 6902–6910, http://dx.doi.org/10.1074/jbc.M110.192369.
- Ivanov A., Mukhtarov M., Bregestovski P., Zilberter Y. Lactate effectively covers energy demands during neuronal network activity in neonatal hippocampal slices. Front Neuroenergetics 2011; 3: 2, http://dx.doi.org/10.3389/fnene.2011.00002.
- Morken T.S., Brekke E., Håberg A., Widerøe M., Brubakk A.M., Sonnewald U. Neuron-astrocyte interactions, pyruvate carboxylation and the pentose phosphate pathway in the neonatal rat brain. Neurochem Res 2014; 39(3): 556–569, http://dx.doi.org/10.1007/s11064-013-1014-3.
- Barker A.J., Ullian E.M. New roles for astrocytes in developing synaptic circuits. Commun Integr Biol 2008; 1(2): 207–211, http://dx.doi.org/10.4161/cib.1.2.7284.