Оценка режущих свойств лазерного скальпеля, оснащенного сильно поглощающим покрытием оптического волокна
Цель исследования — оценка режущих свойств лазерного скальпеля при нанесении на рабочий торец кварцевого волокна сильно поглощающих покрытий (СПП).
Материалы и методы. Для проведения исследования использовали лазерный скальпель с длиной волны 0,97 мкм и выходной мощностью 3 и 7 Вт. Рассечение ткани выполняли чистым торцом волокна с нанесенным на него слоем угля или СПП на основе графита.
Результаты. При оценке скорости рассечения тканей ex vivo установлено, что лазерный скальпель с нанесенным на торец волокна СПП обеспечивает максимальную скорость резки. Кроме того, такой режим характеризуется наименьшей зоной коагуляции. Ширина разреза незначительно больше, чем при использовании волокна с чистым торцом. СПП было более устойчивым к механическому и лазерному воздействию и сохранялось на торце волокна значительно дольше, чем уголь. При исследовании на коже животного in vivo установлено, что все используемые режимы рассечения ткани обладали хорошей коагулирующей способностью. Гистологический анализ показал, что при выполнении лазерной резки волокном, имеющим разные покрытия торца, формировались однотипные структурные изменения ткани. В коже отмечалась ожоговая деструкция эпидермиса по ширине действия лазера. В дерме наблюдались видимые коагуляционные морфологические изменения структуры. Под участком коагуляции располагались коллагеновые волокна с измененными свойствами: встречались участки с набухшими волокнами, а также участки деструкции в виде расслоения и разрывов. Использование СПП позволило снизить мощность лазерного излучения для проведения эффективного рассечения тканей.
Исследования воздействия лазерного излучения на биоткани ведутся с появления первых лазеров. С целью минимизации его последствий создан широкий арсенал мощных источников оптического излучения [1–2]. Сложность строения биологических объектов, значительное разнообразие характера их взаимодействия со светом обусловливают необходимость использования в хирургии большого количества разных типов лазеров и лазерных систем. На сегодняшний день лазерная хирургия пережила этап исследования режимов воздействия и стала стабильной медицинской технологией [3–5].
Одним из основных элементов лазерного скальпеля является оптическое волокно, которое не только служит средством доставки излучения к объекту, но и непосредственно контактирует с биотканью, выполняя роль скальпеля. Разработанное в 1970 г. американской фирмой Corning кварцевое волокно с малым затуханием (20 дБ/км) стало технологическим прорывом. В наши дни волоконно-оптические световоды находят применение в качестве передающей среды в системах оптической связи, датчиках физических величин, биомедицинских приложений; для лазерной хирургии используются многомодовые кварцевые волокна, которые передают лазерное излучение в широком диапазоне длин волн — от 300 до 2400 нм. Обычно режущей частью лазерного скальпеля является очищенный от защитной оболочки торец сердцевины кварцевого волокна. Кварцевые волокна обладают рядом характеристик, обусловливающих перспективность их использования в лазерной хирургии. Сердцевина таких волокон обладает высокой прочностью, но сохраняет механическую гибкость, необходимую для позиционирования режущей части. Кроме того, она способна выдерживать высокие температуры, возникающие при карбонизации биоткани в процессе лазерного воздействия. Кварцевые волокна способны передавать излучение высокой мощности. Нужно отметить, что стандартная средняя мощность хирургического скальпеля составляет до нескольких десятков ватт.
Для повышения эффективности воздействия излучения на торце волокна применяют разного рода фокусирующие устройства [6, 7]. Кроме того, существуют специальные насадки, позволяющие контролировать температуру в области взаимодействия [8]. Для некоторых видов биоткани, например хрящевой, определены оптимальные параметры режимов работы лазера, однако применительно к онкохирургии и кардиохирургии поиск оптимальных хирургических методик с использованием лазерной техники ведется и в настоящее время, что обусловливает актуальность разработки новых видов лазерных скальпелей [9]. Разработанная нами ранее методика лазерной резекции [10] основывалась на использовании лазерного источника с перестраиваемой длиной волны и достаточно высокой выходной мощностью (до 30 Вт). Согласно этой методике рассечение выполнялось чистым торцом кварцевого волокна, находящимся в соприкосновении с тканью. Под воздействием лазерного излучения происходит разогрев биоткани, а затем она механически раздвигается торцом волокна. При использовании достаточной мощности излучения со временем отмечается загрязнение торца световода продуктами горения, что приводит к увеличению поглощения излучения, и торец световода разогревается до высокой температуры. В этом случае на биоткань осуществляется сочетанное воздействие лазерного излучения и раскаленного конца световода.
Предложенные другими авторами методики основаны на использовании лазерного излучения с длинами волн, хорошо поглощаемых биотканью, как правило за счет содержащейся воды или гемоглобина [11]. Представляемая нами модификация основана на нанесении на рабочий торец волокна специального сильно поглощающего покрытия (СПП), состоящего из смеси порошка графита и кремнийорганического лака. Графит характеризуется большим коэффициентом поглощения в широкой области спектра и имеет высокую термостабильность. Кремнийорганический лак обеспечивает прочную связь графита с материалом световода (кварцем).
В данной работе мы приводим первые результаты применения СПП, позволяющих получить унифицированные режимы воздействия для лазеров любых длин волн, у которых средством доставки излучения к объекту воздействия служит кварцевое волокно.
Материалы и методы. В работе использован лазерный скальпель ЛСП-0,97/10 (ООО «Азор», Россия), работающий в непрерывном режиме генерации излучения на длине волны 970 нм. Для доставки излучения к ткани применяли сменные кварцевые волокна диаметром 550 мкм. Предварительную оценку режущей способности лазерного скальпеля проводили ex vivo на мышечной ткани курицы. Было исследовано три режима резки ткани:
1) с чистым рабочим торцом волокна;
2) с торцом, инициированным слоем угля;
3) с торцом, инициированным жидким СПП.
Для инициации слоем угля использовали специально разработанные угольсодержащие таблетки ф. Dental Photonics (США) согласно методике производителя [11]. Также использовали разработанное нами СПП, которое представляет собой смесь порошка графита с фракциями размером менее 0,5 мкм (5–20%) и кремнийорганического лака на основе полиметилфенилсилоксановой смолы (80–95%). Методика инициации торца волокна аналогична методике Dental Photonics с небольшими изменениями: капля смеси наносится на поверхность стекла и рабочий торец световода окунается в нее. Включается лазерный источник мощностью 0,5–1,0 Вт на время до 1 мин и подсушивается нанесенный слой. Для получения более толстого слоя операцию повторяют.
С целью унификации разрезов была изготовлена установка, позволяющая проводить торцом волокна по биоткани с одинаковым усилием 0,44 Н (45 г). Установка состоит из основания и вертикальной направляющей, на которой подвижно закреплена каретка с держателем волокна. Рабочий торец волокна, закрепленный горизонтально, подводился к поверхности биоткани, далее под действием силы тяжести выполнялся линейный разрез. Оценку режущей способности лазерного скальпеля проводили по нескольким параметрам:
1) скорость резания ткани;
2) ширина получаемого разреза;
3) глубина разреза;
4) ширина зоны коагуляции;
5) наличие карбонизации ткани в разрезе.
Подобранные режимы были апробированы на коже самцов белых нелинейных крыс. Предварительно животным удаляли волосяной покров кожи с участка предполагаемого лазерного воздействия. Затем животное наркотизировали раствором Золетила из расчета 50 мг/кг. Разрез кожи выполняли лазерным скальпелем с использованием нескольких режимов работы:
с чистым торцом рабочего волокна и выходной мощностью 3 Вт;
с чистым торцом рабочего волокна и выходной мощностью 7 Вт;
с торцом рабочего волокна, модифицированным СПП, и выходной мощностью 3 Вт;
с торцом рабочего волокна, модифицированным углем, и выходной мощностью 3 Вт.
После выполнения разреза проводили документирование повреждения кожного покрова с помощью USB-микроскопа «Микмед 2000 R» (Китай) и его оценку по приведенным выше пяти параметрам. После осуществления всех указанных процедур образцы забирали на гистологическое исследование. Для этого из области воздействия при всех изученных режимах иссекали фрагменты кожи, фиксировали в 10% нейтральном формалине, обезвоживали в спиртах восходящей концентрации и заключали в парафин, ориентируя материал так, чтобы получить срез ткани перпендикулярно направлению движения лазерного скальпеля. Гистологические срезы толщиной 5–7 мкм получали на микротоме Leica SM 2000 (Германия). Для оценки состояния коллагеновых волокон в дерме после лазерного воздействия гистологические препараты окрашивали по методу Ван-Гизона. Для изучения структурных нарушений кожи в месте лазерного воздействия использовали световой микроскоп Leica DM 1000 (Германия), видеоизображения получали с помощью цифровой видеокамеры Leica DFC 290 (Германия).
Результаты
Контактное воздействие лазерного излучения торцом кварцевого световода на ex vivo образцы с дозированным усилием. Предварительное исследование ex vivo на образцах мышечной ткани курицы показало, что скорость резки ткани чистым рабочим торцом волокна при выходной мощности 3 Вт составляла 4 мм/мин. Глубина разреза — 1 мм. Вокруг разреза формировалась зона коагуляции шириной 2,0 мм. Карбонизации ткани не отмечено. Увеличение мощности до 4 Вт приводило к повышению скорости резки ткани до 11,4 мм/мин, а также к уменьшению ширины зоны коагуляции до 1,1–1,3 мм. При этом возрастала глубина разреза до 2,5 мм и появлялась карбонизация ткани. Разрез биоткани, выполненный лазерным скальпелем с выходной мощностью 7 Вт, характеризовался шириной 2,0 мм и глубиной 2,0 мм. Зона коагуляции составляла 6,8 мм, а скорость резки — 22 мм/мин.
Оптическое волокно с нанесенными на торец СПП и выходной мощностью 2 Вт позволяло сделать разрез ткани шириной 1,2 мм и зоной коагуляции 1,3 мм. Глубина такого разреза варьировала от 1,5 до 2,0 мм. Скорость резки в данном режиме равнялась 11 мм/мин. При увеличении выходной мощности до 3 Вт скорость резки ткани возрастала до 30 мм/мин. Ширина зоны коагуляции увеличивалась незначительно — до 1,5 мм.
Оптическое волокно с нанесенным на рабочий торец слоем угля характеризуется большей скоростью резки. При его использовании были получены следующие результаты: при выходной мощности 2 Вт скорость составляла 9,9 мм/мин, а при 3 Вт — 16,2 мм/мин. Ширина разреза и зоны коагуляции при 2 Вт — 1,7 мм и 1,8 мм соответственно, а глубина разреза — 3,0 мм. Увеличение мощности до 3 Вт приводило к увеличению ширины разреза до 2,0 мм, ширина зоны коагуляции при этом уменьшалась до 1,3 мм. Глубина разреза не изменялась.
Контактное воздействие лазерного излучения торцом кварцевого световода на кожу крысы. При выполнении разрезов кожи inv ivo обнаружено, что все используемые режимы обладали хорошей коагулирующей способностью. Кровотечения не отмечено ни в одном случае. Также для всех исследованных режимов наблюдалось образование зоны карбонизации ткани. Глубина формирующихся разрезов не зависела от используемого режима и составляла около 1 мм, тогда как ширина разреза изменялась. Наименьшей шириной характеризовались разрезы, выполненные оптическим волокном с чистым рабочим торцом. Так, при выходной мощности 3 Вт она составляла 1,1 мм, а при 7 Вт — 1,3 мм. Нанесение на рабочий торец лазерного скальпеля СПП приводило к увеличению ширины разреза до 1,5 мм при выходной мощности скальпеля 3 Вт, тогда как наличие на торце волокна слоя угля приводило к образованию разреза шириной 2,2 мм при аналогичной выходной мощности.
Рассечение ткани торцом волокна с нанесенным СПП проходило значительно легче и с большей скоростью. Кроме того, СПП являлось более устойчивым к механическому и лазерному воздействию. Так, если покрытие из угля практически полностью исчезало после 5 мин контакта рабочего торца волокна с биотканью в режиме рассечения, то покрытие из СПП при тех же условиях теряло свою эффективность через 15 мин.
При микроскопическом изучении образцов кожи в месте воздействия разных типов лазерного волокна выявлены изменения структуры тканей, характерные для термического повреждения.
После выполнения лазерного разреза чистым рабочим торцом волокна при мощности 3 Вт на поверхности кожи происходила карбонизация и слущивание эпителиального слоя. Ткань дермы в подэпителиальном слое находилась в состоянии коагуляции с выраженным ее уплотнением, нарушением тинкториальных свойств (ослабление фуксинофилии). Структура коллагеновых волокон не определялась, происходило разрушение клеток и их ядер. Под плотной зоной наблюдалась нерезко очерченная область дермы с сохранением ее структурных признаков, набуханием и гомогенизацией коллагеновых волокон. При этом сохранялось нормальное восприятие коллагеном фуксина.
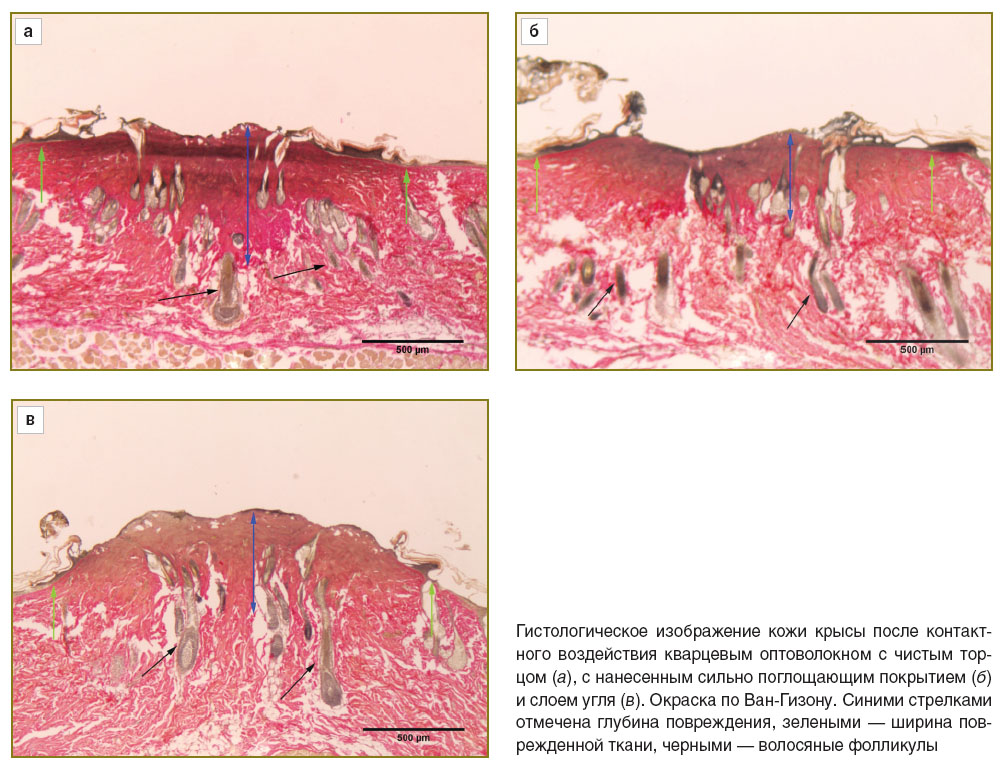
В просвете сосудов отмечался гемолиз эритроцитов. Кроме того, имелись признаки потери жидкости в тканях в месте воздействия, видимо под действием высокой температуры, в виде разрежения ткани дермы и отслоения компонентов соединительной ткани вокруг волосяных фолликулов. Ширина дефекта по поверхности образца составила 1989 мкм, глубина с учетом зоны коагуляционных изменений и зоны с набуханием и гомогенизацией коллагеновых волокон — от 267 до 486 мкм (см. рисунок, а).
При воздействии лазера мощностью 7 Вт с чистым рабочим торцом волокна на поверхности кожи тоже происходили карбонизация и слущивание эпителиального слоя. В поверхностном слое дермы также определялись признаки обугливания тканей, этот слой имел ячеистую структуру. Зона коагуляции с полной потерей тканеспецифичности распространялась на бóльшую глубину по сравнению с воздействием лазера мощностью 3 Вт и была более плотной. Признаки набухания и гомогенизации коллагеновых волокон также выявлялись до большей глубины. Нарушения структуры вследствие термического воздействия отмечены и в подкожной жировой клетчатке в виде разрушения клеток, фрагментации и разволокнения коллагеновых волокон. Дегидратация тканей, окружающих дефект, носила более выраженный характер по сравнению с воздействием лазера с чистым рабочим торцом волокна мощностью 3 Вт. Ширина дефекта по поверхности образца составила 1700 мкм, общая глубина с учетом зоны карбонизации (80 мкм), коагуляционных изменений (638 мкм) и зоны с набуханием и гомогенизацией коллагеновых волокон — 1170 мкм.
После выполнения лазерного разреза оптическим волокном с нанесенными на торец СПП на поверхности образца в зоне воздействия сохранялась зона карбонизации эпителия, которая сливалась с зоной коагуляционных изменений. Последняя была менее выражена по сравнению с аналогичной зоной после выполнения лазерного разреза чистым рабочим торцом волокна. В то же время нарушения в подлежащей зоне в виде набухания и гомогенизации волокон коллагена были более выражены, сама зона более четко выделялась на фоне окружающих структур. Признаки дегидратации тканей также определялись более четко: наблюдалось расслоение их до уровня мышечной ткани. Ширина области воздействия лазера по поверхности составила 2210 мкм, общая его глубина — 663 мкм, зона карбонизации — 44 мкм, зона коагуляции — от 221 до 266 мкм (см. рисунок, б).
Выполнение разреза оптическим волокном с нанесенным на рабочий торец слоем угля характеризовалось карбонизацией эпидермального слоя кожи и его слущиванием. Зона коагуляционных изменений в области, прилегающей к эпидермису, имела ячеистую структуру. Эта зона плавно переходит в небольшую по глубине зону дермы, сохранившую свои структурные признаки. Однако отмечается набухание и гомогенизация коллагеновых волокон. При этом сохраняется нормальное восприятие коллагеном фуксина. Выраженных признаков дегидратации окружающих тканей не наблюдалось. Ширина повреждения ткани кожи по поверхности образца составила 1503 мкм, общая глубина зоны воздействия — всего 399 мкм, зона коагуляции — от 177 до 239 мкм (см. рисунок, в).
Гистологический анализ показал, что при выполнении рассечения лазерным скальпелем с чистым торцом и скальпелем, имеющим на торце волокна покрытие, формируются однотипные повреждения. Однако в случае СПП глубина формирующегося разреза выше по сравнению с чистым торцом и торцом, имеющим слой угля, что позволяет сократить количество прохождений скальпелем по одному месту и ускорить процесс рассечения.
Заключение. Нанесение сильно поглощающего покрытия на рабочий торец оптического волокна позволяет оптимизировать режимы резки тканей за счет снижения выходной мощности лазерного излучения. Сильно поглощающее покрытие на основе графита и кремнийорганического лака обеспечивает более высокую скорость резки ткани в сравнении с применением чистого торца и торца, модифицированного углем. Данное покрытие также значительно дольше сохраняется на волокне по сравнению с покрытием из угля. Инициация покрытий торцевой поверхности оптического волокна при использовании его в режиме лазерного скальпеля позволяет оптимизировать режимы воздействия лазерного излучения на биоткань.
Финансирование исследования. Работа профинансирована за счет гранта Российского научного фонда «Использование лазеро-индуцированных неравновесных процессов в медицинских технологиях» №14-15-00840 от 20 мая 2014 г.
Конфликт интересов. У авторов нет конфликта интересов.
Литература
- Steiner R. Laser-tissue interactions. In: Laser and IPL technology in dermatology and aesthetic medicine. Edited by Raulin C. and Karsai S. Springer-Verlag Berlin Heidelberg; 2011, http://dx.doi.org/10.1007/978-3-642-03438-1_2.
- Тучин В.В. Лазеры и волоконная оптика в биомедицинских исследованиях. М: ФИЗМАЛИТ; 2010; 488 с.
- Скобелкин O.K. Лазеры в хирургии. М: Медицина; 1989; 256 с.
- Лазерная инженерия хрящей. Под ред. Баграташвили В.Н., Соболя Э.Н., Шехтера А.Б. М: ФИЗМАТЛИТ; 2006; 342 с.
- Lasers for medical applications: diagnostics, therapy, and surgery. Edited by Jelinkova H. Woodhead: Oxford, UK; 2013; p. 832.
- Беликов А.В., Скрипник А.В. Лазерные биомедицинские технологии. СПб: СПбГУ ИТМО; 2009; 100 с.
- Stock K., Stegmayer T., Graser R., Förster W., Hibst R. Comparison of different focusing fiber tips for improved oral diode laser surgery. Lasers Surg Med 2012; 44(10): 815–823, http://dx.doi.org/10.1002/lsm.22091.
- Asah B., Balle-Petersen O., Dolleris C. Apparatus for tissue treatment. US 6533776 B2. 2003.
- Freebody M. Fiber lasers at the cutting edge of surgery. Biophotonics 2013; 20(3), URL: http://www.photonics.com/Article.aspx?PID=1&VID=108&IID=681&Tag=Features&AID=53575.
- Shakhov A.V., Terentjeva A.B., Kamensky V.A., Snopova L.B., Gelikonov V.M., Feldchtein F.I., Sergeev A.M. Optical coherence tomography monitoring for laser surgery of laryngeal carcinoma. J Surg Oncol 2001; 77(4): 253–258, http://dx.doi.org/10.1002/jso.1105.
- Alta® Modular Laser System. URL: http://altamls.com/applications/soft-tissue-surgery/how-top-surgery-works/.