Современные молекулярно-генетические технологии в надзоре за циркуляцией субтипов ВИЧ-1
Цель исследования — оценить возможности современных технологий в осуществлении мониторинга генетических вариантов ВИЧ-1, циркулирующих на отдельных административных территориях (на примере Приволжского федерального округа (ПФО) за период 2008–2014 гг.).
Материалы и методы. Проведен молекулярно-генетический анализ 647 образцов плазмы крови пациентов, инфицированных ВИЧ-1, из 13 регионов ПФО (Россия). Для генотипирования использовали тест-систему ViroSeqТМ HIV-1 и программное обеспечение Genotyping System Software v.2.8 (Celera Diagnostic, США). Субтипирование выполнено онлайн с использованием программ COMET HIV-1/2 и REGA HIV-1 Subtyping Tool. Филогенетический анализ, включая референсные нуклеотидные последовательности из GenBank стран Европы, Америки, Австралии, СНГ и регионов России, осуществляли с помощью программы MEGA 5.2, статистическим методом Maximum Likelihood analysis и модели Kimura (bootstrap level 1000).
Результаты. Изучение пейзажа вариантов ВИЧ-1 в ПФО выявило тенденцию к доминированию субтипа А ВИЧ-1 как в период 2008–2010 гг. (91,3%), так и в 2011–2014 гг. (95,6%). Вторым по частоте обнаружения является субтип В (8,7 и 2% соответственно). Установлено увеличение субтипового разнообразия генетических вариантов ВИЧ-1 в образцах периода 2011–2014 гг., в основном за счет появления рекомбинантных вариантов (AB, AG, CRF06_cpx, CRF01_AE) и штамма субтипа С.
Отмечено филогенетическое родство и подтверждены молекулярно-эпидемиологические связи между нуклеотидными последовательностями вирусов, выделенных у ВИЧ-позитивных лиц Приволжья, и последовательностями, взятыми в качестве референсных из международной базы GenBank.
Заключение. Современные молекулярно-генетические методы, используемые в эпидемиологическом надзоре за ВИЧ-инфекцией, в том числе и при изучении субтиповой структуры ВИЧ, могут служить основным инструментом мониторинга текущей ситуации и прогнозирования эпидемии, позволяют выполнять оценку, анализ и принимать решения с целью разработки профилактических и противоэпидемических мероприятий и стабилизации эпидемии ВИЧ-инфекции.
Использование комплекса современных молекулярно-генетических технологий, характеризующихся высокой чувствительностью и специфичностью, расширяет возможности эпидемиологической диагностики инфекции, в том числе вызванной вирусом иммунодефицита человека (ВИЧ), в плане изучения биолого-генетических характеристик возбудителя. Эти технологии позволяют изучать субтиповое разнообразие ВИЧ, являющееся одним из биологических показателей при надзоре за ВИЧ-инфекцией [1].
Изучение циркуляции субтипов ВИЧ-1 в России, проводимое различными исследователями, позволило выявить, что в середине 90-х годов прошлого столетия в России циркулировали варианты ВИЧ-1 субтипов А–H с доминированием субтипа В среди группы мужчин, имеющих секс с мужчинами, и субтипа G, выделенного от инфицированных детей из нозокомиального очага на юге России. В дальнейшем вспышка ВИЧ-инфекции, произошедшая в середине 1996 г. среди лиц, практикующих внутривенное употребление психотропных препаратов, была вызвана вирусом субтипа А, который впоследствии вышел за пределы данной уязвимой группы населения и стал распространяться среди половых партнеров потребителей инъекционных наркотиков (ПИН), а также среди детей с перинатальным контактом по ВИЧ и занял доминирующее положение в РФ [2–8]. В последующие годы в стране широкое распространение получили рекомбинантные формы, возникшие в результате обмена генетическим материалом различных вариантов вируса как на территории России, так и с привнесенными с территорий других стран [9, 10].
Особый интерес в плане изучения распространенности субтипов ВИЧ представляет Приволжский федеральный округ (ПФО) РФ в связи с высоким уровнем пораженности и значительными показателями заболеваемости населения ВИЧ-инфекцией, с 2000 г. превышающими среднероссийский уровень. ПФО является одним из экономически развитых округов России, обладает уникальным транзитным положением, так как расположен на перекрестке международных транспортных коридоров «Север–Юг» и «Восток–Запад», соединяющих Сибирь и Дальний Восток, а также страны Восточной Азии с Европейской Россией и государствами Европы. Последнее, несомненно, вносит определенный вклад в спектр циркулирующих вариантов ВИЧ в округе.
Применение современных лабораторных методов, позволяющих получить необходимую информацию об уровне генетической изменчивости и распространенности вариантов ВИЧ в субъектах ПФО, как дополнение к классическим эпидемиологическим методам мониторинга эпидемии имеет актуальное научное и практическое значение.
Цель исследования — оценить возможности современных технологий в осуществлении мониторинга генетических вариантов ВИЧ-1, циркулирующих на отдельных административных территориях (на примере Приволжского федерального округа за период 2008–2014 гг.).
Материалы и методы. Проведен молекулярно-генетический анализ 647 образцов плазмы крови из 13 регионов ПФО от ВИЧ-инфицированных пациентов, состоящих на диспансерном учете в территориальных центрах по профилактике и борьбе со СПИД и инфекционными заболеваниями. Нуклеотидные последовательности генома ВИЧ-1 определяли с использованием тест-системы ViroSeqТМ HIV-1 Genotyping System (Celera Diagnostic, Abbott Laboratories, США) методом секвенирования амплифицированных фрагментов гена pol на генетическом анализаторе ABI Prism 3100 (Applied Biosystems, США). Анализ полученных фрагментов проводили с использованием программного обеспечения ViroSeq HIV-1 Genotyping System Software v.2.8 (Celera Diagnostic, США) согласно инструкции производителя. Для идентификации близкородственных штаммов ВИЧ-1 полученные нуклеотидные последовательности, включая референсные нуклеотидные последовательности из GenBank стран Европы, Америки, Австралии, СНГ и регионов России, анализировались в программе BLAST [http://www.ncbi.nlm.iv.gov/BLAST/]. Филогенетический анализ выполняли с помощью программы MEGA 5.2 и статистическим методом Maximum Likelihood analysis модели Kimura (bootstrap level 1000).
Субтипирование штаммов ВИЧ-1 проводили в онлайн-программах COMETHIV-1/2 and HCV и REGA HIV-1 Subtyping Tool.
Полученные в данной работе нуклеотидные последовательности участков генома изолятов ВИЧ были впоследствии депонированы в международной базе GenBank (JX 141197–JX 141233; KF257850–KF257884; KJ722070–KJ722139; KP090065–KP090099) и в Российской базе данных устойчивости ВИЧ к антиретровирусным препаратам.
Результаты исследования обрабатывали с использованием методов вариационной статистики. Оценку степени различия двух выборок проводили с помощью критерия Стьюдента. Выявленные различия считали статистически значимыми при p<0,05.
Результаты и обсуждение. Применение современных компьютерных программ и технологий в данном исследовании позволило установить, что распределение субтипов ВИЧ-1 в изучаемых регионах ПФО в разные сроки наблюдения имело некоторые различия. Так, образцы, поступившие на исследование в 2008–2010 гг. (первый период), в 91,3±1,7% случаев генотипировались как вариант А, в 8,7±1,6% — как В (рис. 1, а). Других вариантов вируса в этот период времени не наблюдалось.
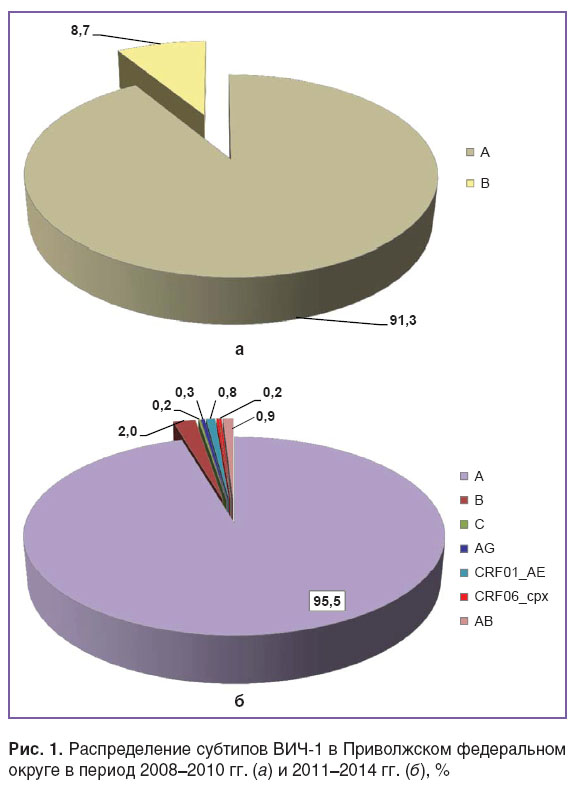 Рис. 1. Распределение субтипов ВИЧ-1 в Приволжском федеральном округе в период 2008–2010 гг. (а) и 2011–2014 гг. (б), % Рис. 1. Распределение субтипов ВИЧ-1 в Приволжском федеральном округе в период 2008–2010 гг. (а) и 2011–2014 гг. (б), %
|
Субтип А встречался преимущественно (90,7±1,7% случаев) в группе лиц, употребляющих психоактивные вещества парентерально, из Нижегородской, Самарской, Кировской, Пензенской, Ульяновской, Саратовской областей и республик Удмуртия, Чувашия, Марий Эл, Мордовия. Вариант В был обнаружен только у лиц из группы мужчин, имеющих секс с мужчинами, проживающих на территории Нижегородской и Пензенской областей.
Во второй период (2011–2014 гг.) спектр субтипов ВИЧ-1 значительно расширился, в основном за счет появления различных рекомбинантных вариантов и штамма субтипа С (рис. 1, б).
Появление как новых субтипов ВИЧ-1, так и их рекомбинантных форм в том или ином регионе отражает определенные закономерности в развитии эпидемического процесса. Это связано и с особенностями эволюции вируса, с вовлечением в эпидемический процесс новых групп населения с разнообразными путями передачи инфекции [11], с расширением экономических и политических связей между странами и с развитием активных миграционных процессов и международного туризма [5]. Вместе с тем появление новых субтипов ВИЧ влияет на развитие эпидемии в целом, что требует дальнейшего изучения их роли.
Субтипы ВИЧ-1, выделенные в образцах, полученных с территорий округа в 2011–2014 гг., представлены следующими вариантами (см. таблицу).
 Территориальное распределение субтипов ВИЧ-1 в Приволжском федеральном округе в 2011–2014 гг. Территориальное распределение субтипов ВИЧ-1 в Приволжском федеральном округе в 2011–2014 гг.
|
Результаты исследования, проведенные с помощью современных молекулярно-генетических методов, позволили установить, что в период 2011–2014 гг. субтип А продолжал сохранять лидирующее положение, выявляясь в 95,6±0,9% случаев на всех территориях округа, приславших свои образцы для исследования, но с наибольшей частотой представлен у позитивных лиц, проживающих на территории Нижегородской, Ульяновской, Самарской областей и Удмуртской Республики (p≤0,05).
Развитие эпидемического процесса ВИЧ-инфекции во времени и последовательное вовлечение в эпидемию общей популяции населения нашло свое отражение в большей, чем в первый период, частоте выявления субтипа А у лиц, инфицированных половым (гетеросексуальным) путем, — 20,3±1,7% (p≤0,05) и, как следствие, в обнаружении данного варианта у детей с перинатальным контактом по ВИЧ во второй период наблюдения — 2,4±0,6%. Данный вариант вируса по сравнению с периодом 2008–2010 гг. был выявлен в группе ВИЧ-позитивных ПИН в меньшем числе случаев — 77,3±1,8% (p≤0,05), сохраняя при этом доминирующее положение.
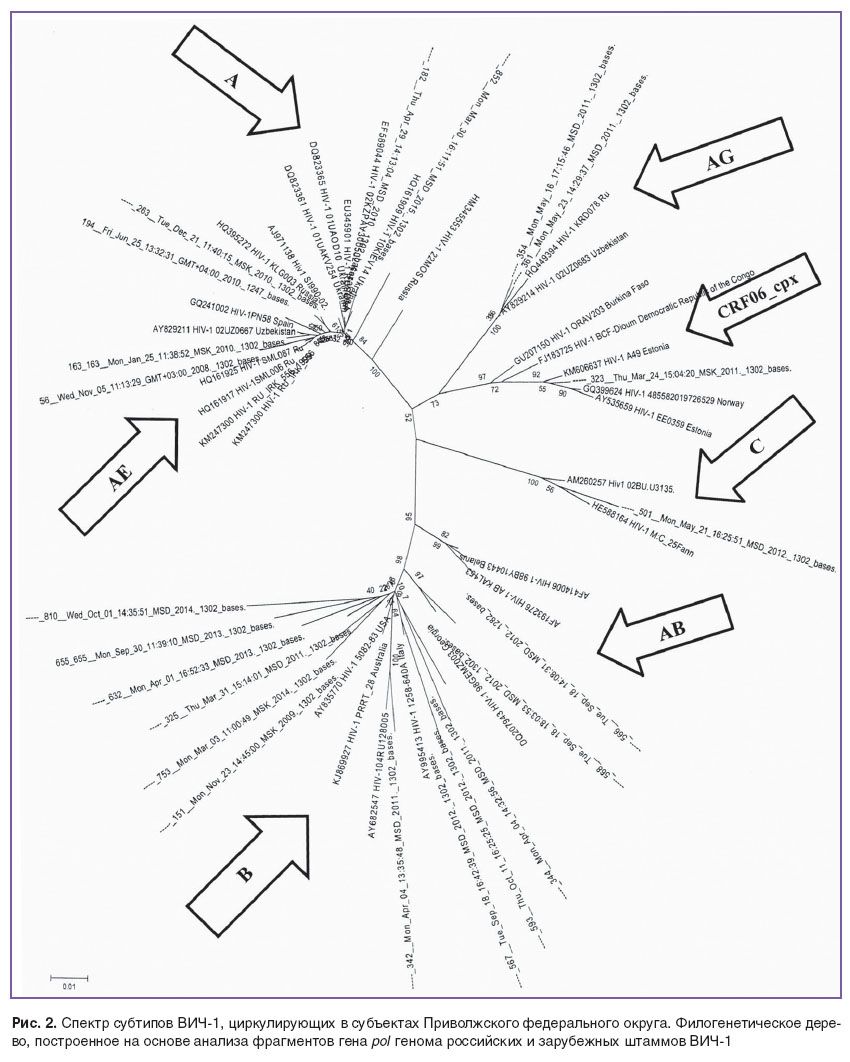
Применение современных технологий, позволяющих установить генетическое родство между нуклеотидными последовательностями исследуемых и референсных образцов (филогенетический анализ), свидетельствует, что большинство вариантов субтипа А, выделенных от ВИЧ-позитивных пациентов ПФО, кластеризовались вокруг «украинских» и «российских» консенсусных образцов, как в первый, так и во второй период наблюдения (рис. 2).
Вторым по частоте выявления в 2011–2014 гг. (2,0±0,6%) был вариант В, циркулирующий на пяти территориях округа (Нижегородская, Пензенская, Кировская области, республики Удмуртия и Чувашия). В этот период субтип В также доминировал в среде мужчин, имеющих секс с мужчинами (53,8±2,2%), но вместе с тем в 38,4% случаев был выделен у гетеросексуальных мужчин и женщин, имеющих в анамнезе беспорядочные половые связи с гражданами Европы, Азии, Америки как в России, так и за ее пределами, таким образом его распространение выходило за пределы группы гомо- и бисексуалов (см. рис. 2). В оба периода наблюдения полученные нами нуклеотидные последовательности варианта В кластеризовались с последовательностями субтипа В, взятыми в качестве референсных из GenBank, из стран Европы, Америки, Австралии, стран СНГ и других регионов России.
Субтип С ВИЧ-1 в ПФО среди исследуемых образцов обнаружен в одном случае — у ВИЧ-позитивного пациента из Самарской области, работавшего на территории Эфиопии и заразившегося там половым путем. Это подтверждается проведенным филогенетическим анализом (см. рис. 2): образец, полученный от данного пациента, образует общую ветвь с вариантами того же субтипа из Сенегала (Западная Африка) и Бурунди (Восточная Африка).
Рекомбинантная форма АВ в России впервые была обнаружена у ПИН Калининградской области [12, 13] и относительно долго встречалась только там. Впоследствии отдельные заносы этого вируса были выявлены и в других субъектах РФ, что подтверждено в наших исследованиях проведенным филогенетическим анализом. Данный вариант определялся на четырех территориях ПФО (Нижегородская, Кировская, Саратовская, Ульяновская области) с преимущественной частотой (66,7%) у женщин, инфицированных от мужей, имеющих большое количество сексуальных контактов («вахтовики», дальнобойщики), и наркопотребителей, находившихся в учреждениях пенитенциарной системы. Нуклеотидные последовательности изученных штаммов вируса варианта АВ образуют общую ветвь с рекомбинантами из Калининградской области, России и Белоруссии (см. рис. 2).
Вариант AG, имеющий широкое распространение в странах Средней Азии, выявлен у двух ВИЧ-позитивных пациенток из Самарской области. В обоих случаях инфицирование произошло в результате половых контактов с малознакомыми партнерами из других регионов страны. Нуклеотидные последовательности рассматриваемых нами вариантов AG вполне ожидаемо формируют общую ветвь со штаммами из Узбекистана и российским штаммом из Краснодара.
Нуклеотидные последовательности CRF01_AE ВИЧ-1, выделенные у пациентов из Нижегородской области и Республики Чувашия, формируют общий кластер с рекомбинантными штаммами из европейских стран (Словения, Испания), стран Средней Азии (Казахстан, Узбекистан) и с российскими штаммами (Иркутск, Смоленск). В 2/3 случаев данный рекомбинант выявлялся у ВИЧ-позитивных наркопотребителей.
Циркулирующая рекомбинантная форма CRF06_cpxбыла обнаружена в одном случае у жительницы Кировской области, заразившейся в результате сексуальных контактов с ВИЧ-позитивным партнером из Санкт-Петербурга, имеющим в анамнезе беспорядочные половые связи. Это согласуется с данными литературы [14], в которой констатируется, что с 2000 г. в Санкт-Петербурге относительно часто регистрируется вариант CRF06_cpx. Такой факт со всей очевидностью объясняется географическим соседством с Эстонией, где в среде ПИН доминирует именно данный рекомбинант ВИЧ-1 [15], имевший широкое распространение в 80–90-х гг. прошлого века в странах Западной Африки [16]. Проведенный филогенетический анализ подтвердил генетическую близость исследуемого образца (см. рис. 2) со штаммами из Эстонии, Норвегии и стран Центральной и Западной Африки (Демократическая Республика Конго и Буркина Фасо), образующими общий кластер.
Таким образом, современные молекулярно-генетические методы позволили установить, что распространение субтипов ВИЧ-1 в ПФО подчиняется общим закономерностям, связанным как с генетической изменчивостью ВИЧ, так и, в большей степени, с экономическими и эпидемиологическими особенностями пандемии инфекции ВИЧ-1.
Необходимо отметить, что в дальнейшем в связи с расширением миграционных потоков населения спектр субтипов ВИЧ в округе будет значительно расширяться. Так, в 2014 г. на ВИЧ-инфекцию согласно статистической отчетной форме №4 «Сведения о результатах исследований крови на антитела к ВИЧ» было протестировано 30 550 человек, прибывших на административные территории ПФО по гуманитарным обстоятельствам из Украины. Это стало причиной увеличения в 2,5 раза доли выявленных ВИЧ-позитивных лиц: до 0,3% — среди всех иностранных граждан, до 0,6% — среди граждан Украины. Указанные обстоятельства, несомненно, будут вносить определенный вклад в развитие эпидемического процесса ВИЧ-инфекции в округе в плане большего разнообразия субтиповой структуры вируса, спектра выявляемых мутаций резистентности ВИЧ к антиретровирусным препаратам и т.д. Применение современных методов молекулярной биологии для изучения на генетическом уровне особенностей вируса иммунодефицита человека может служить важным инструментом мониторинга текущей ситуации и прогнозирования эпидемии. Эти методы позволят с большой точностью и эффективностью проводить оценку, анализ и принимать решения с целью разработки профилактических и противоэпидемических мероприятий, являясь диагностической составляющей эпидемиологического надзора за ВИЧ-инфекцией.
Благодарности. Авторы выражают благодарность сотрудникам территориальных и республиканских центров по профилактике и борьбе со СПИД и инфекционными заболеваниями ПФО: Кировской, Нижегородской, Пензенской, Самарской, Саратовской, Ульяновской областей, республик Удмуртия и Чувашия за предоставленные сведения и материалы.
Финансирование исследования и конфликт интересов. Исследование не финансировалось какими-либо источниками, и конфликты интересов, связанные с данным исследованием, отсутствуют.
Литература
- Анализ эпидемиологической ситуации по ВИЧ-инфекции и сопутствующим заболеваниям (туберкулез, ИППП, гепатиты): методические рекомендации №6964-РХ. М; 2007.
- Богачев В.В., Тотменин А.В., Барышев П.Б., Мещерякова Ю.В., Черноусова Н.Я., Гашникова Н.М. Молекулярно-генетическая характеристика вариантов ВИЧ-1 субтипов А и В, выделенных на территории Новосибирской области. Журнал микробиологии, эпидемиологии и иммунобиологии 2012; 6: 45–52.
- Богословская Е.В. Комплекс молекулярно-генетических методов для мониторинга ВИЧ-инфекции. Автореф. дис. … докт. мед. наук. СПб; 2011.
- Богословская Е.В., Волошина П.В., Браславская С.И., Мызникова А.И., Шипулин Г.А. Изучение распространенности различных субтипов ВИЧ на территории РФ. В кн.: Материалы VII Всероссийской научно-практической конференции «Молекулярная диагностика». М; 2010; с. 16–19.
- Казеннова Е.В., Бобков А.Ф. Подтипы вируса иммунодефицита человека 1 типа: классификация, происхождение и распространение в Европе. Журнал микробиологии, эпидемиологии и иммунобиологии 2003; 1: 90–96.
- Лопатухин А.Э., Киреев Д.Е., Шипулин Г.А. Изучение распространенности вариантов ВИЧ различных субтипов на территории Российской Федерации с использованием базы данных лекарственной устойчивости ВИЧ. В кн.: Материалы международной конференции «Общие угрозы — совместные действия. Ответ государств БРИКС на вызовы опасных инфекционных болезней». М; 2015; c. 241–243.
- Мусатов В.Б., Яковлев А.А., Тыргина Т.В., Ладная Н.Н. Прогностическое значение результатов генотипирования вирусов иммунодефицита человека, выделенных от больных первичной ВИЧ-инфекцией в 2009 и 2011 годах в Санкт-Петербурге. Вестник Санкт-Петербургского университета. Серия 11: Медицина 2013; 1: 171–178.
- Суханова А.Л., Казеннова Е.В., Бобкова М.Р., Кравченко А.В., Селимова Л.М., Ханина Т.А., Бобков А.Ф., Покровский В.В. Варианты вируса иммунодефицита человека типа 1, обнаруживаемые в России среди инфицированных половым путем. Вопросы вирусологии 2004; 49(1): 4–7.
- Бобков А.Ф., Казеннова Е.В., Селимова Л.М., Ханина Т.А., Бобкова М.Р., Ладная Н.Н., Кpавченко А.В., Покpовский В.В., Вебеp Дж.Н. Нуклеотидные последовательности генов и изолятов вируса иммунодефицита человека типа 1, выявленных в России: обнаружение новых рекомбинантных вариантов. Вопросы вирусологии 2000; 6: 17–20.
- Казеннова Е.В., Нешумаев Д.А., Лага В.Ю., Лаповок И.А., Глущенко Н.В., Лебедев А.В., Бобкова М.Р. Молекулярно-эпидемиологическая характеристика эпидемии ВИЧ-инфекции в регионах Сибири и Дальнего Востока России. В кн.: Сборник материалов VIII Всероссийской научно-практической конференции. М; 2014; с. 45–46.
- Покровский В.В. Эпидемиология и профилактика ВИЧ-инфекции/СПИД. М: Медицина; 1996; 248 с.
- Бобков А.Ф., Казеннова Е.В., Селимова Л.М., Ладная Н.Н., Бобкова М.Р., Кравченко А.В, Покровский В.В. Субтипы ВИЧ-1 в России в 1987–1998 гг. Журнал микробиологии, эпидемиологии и иммунобиологии 1999; 1: 43–45.
- Bobkov A., Kazennova E., Selimova L., Bobkova M., Khanina T., Ladnaya N., Kravchenko A., Pokrovsky V., Cheingsong-Popov R., Weber J. A sudden epidemic of HIV type 1 among injecting drug users in the former Soviet Union: identification of subtype A, subtype B, and novel gagA/envB recombinants. AIDS Res Hum Retroviruses 1998; 14(8): 669–676.
- Дементьева Н.Е., Сизова Н.В., Лисицина З.Н., Беляков Н.А. Молекулярно-эпидемиологическая характеристика ВИЧ-инфекции в Санкт-Петербурге. Медицинский академический журнал 2012; 12(2): 97–104.
- Laisaar K.T., Avi R., DeHovitz J., Uusküla A. Estonia at the threshold of the fourth decade of the AIDS era in Europe. AIDS Res Hum Retroviruses 2011; 27(8): 841–851, http://dx.doi.org/10.1089/AID.2010.0223.
- Delatorre E., Bello G. Spatiotemporal dynamics of the HIV-1 CRF06_cpx epidemic in Western Africa. AIDS 2013; 27(8): 1313–1320, http://dx.doi.org/10.1097/QAD.0b013e32835f1df4.