Роль патоморфологических и молекулярно-генетических факторов в развитии экстрабульбарного роста увеальной меланомы
Цель исследования — выявление ассоциации экстрабульбарного роста опухоли с патоморфологическими и молекулярно-генетическими изменениями у больных увеальной меланомой.
Материалы и методы. Обследовано и пролечено 134 пациента с увеальной меланомой в возрасте от 22 до 84 лет. Средняя высота опухоли составила 9,2±2,9 мм, диаметр основания — 15,3±3,5 мм. В 97,8% случаев выполнена энуклеация пораженного глаза. По гистологическому строению выделяли веретеноклеточные (n=61; 45,6%), смешанноклеточные (n=46; 34,3%) и эпителиоидноклеточные (n=27; 20,1%) опухоли. Методами ПЦР–ПДРФ (полимеразная цепная реакция–полиморфизм длины рестрикционных фрагментов) и делеционного картирования проведено определение полной и частичной моносомии хромосомы 3, делеции короткого плеча хромосомы 1 и метилирования гена RASSF1A (n=134). Пациенты разделены на две группы — с наличием (n=15) и отсутствием (n=119) экстрабульбарного роста.
Результаты. Показана значимо меньшая частота (20 против 47,9%) относительно благоприятного веретеноклеточного типа увеальной меланомы в группе с экстрабульбарным ростом. Частота полной или частичной моносомии хромосомы 3 в этой группе значимо выше (80 против 50,4%). При сопоставлении групп по таким признакам, как возраст и пол пациентов, высота и диаметр основания опухоли, вовлечение в опухолевый процесс цилиарного тела, пигментация опухоли, наличие гемофтальма, отслойки сетчатки, субретинального экссудата, отягощенный семейный анамнез, делеция короткого плеча хромосомы 1 и метилирование гена RASSF1A, значимых отличий не выявлено.
Заключение. На статистически значимой выборке пациентов с увеальной меланомой подтверждены благоприятный характер течения опухоли при ее веретеноклеточном типе и отрицательная роль моносомии хромосомы 3, показана взаимосвязь этих показателей с экстрабульбарным ростом опухоли.
Увеальная меланома — наиболее частая первичная внутриглазная злокачественная опухоль во взрослой популяции. В РФ ее частота колеблется от 6,2 до 8 новых случаев на 1 млн населения в год [1]. В литературе отмечены единичные случаи развития увеальной меланомы у детей и подростков [2]. Опухоль характеризуется агрессивным характером течения, метастазы в печень и другие органы развиваются в течение пяти лет после проведенного лечения [3]. Увеальная меланома может развиваться как de novo, так и из существующего невуса хориоидеи или наследственного окулодермального меланоцитоза [4, 5]. Клинически увеальная меланома манифестирует как проминирующий очаг на глазном дне округлой формы, желтовато-коричневого или аспидно-серого цвета (рис. 1). В ряде случаев увеальная меланома сопровождается вторичной отслойкой сетчатки, появлением друзов и полей оранжевого пигмента на поверхности опухоли как результата трофических нарушений и отложений зерен липофусцина в пигментном эпителии сетчатки [4].
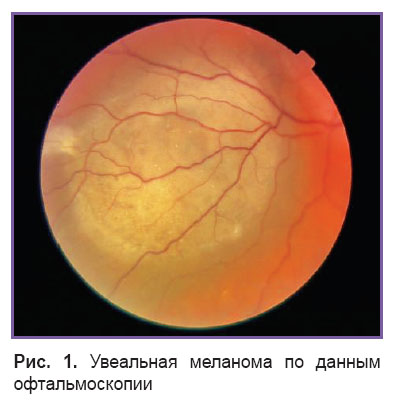 Рис. 1. Увеальная меланома по данным офтальмоскопии Рис. 1. Увеальная меланома по данным офтальмоскопии
|
Как и для меланомы кожи, ранняя диагностика увеальной меланомы крайне важна для предотвращения развития метастатической болезни и гибели пациента [3]. По мере накопления данных о патогенезе этого заболевания были выделены факторы риска развития и прогрессирования опухоли. Условно факторы риска можно разделить на несколько групп: клинические, патогистологические, молекулярные, хромосомные аберрации и мутации в генах. К клиническим относят возраст пациента, размеры (высота и диаметр основания) опухоли, вовлечение в опухолевый процесс цилиарного тела и экстрабульбарный рост [3, 6–10]. Патогистологические факторы включают эпителиоидноклеточный и смешанноклеточный варианты опухоли, ее переднюю локализацию, диффузный характер роста, большое число митотических фигур, умеренную пигментацию опухоли, а также некротические и воспалительные компоненты в сосудистой сети увеальной меланомы [3, 9, 11].
Из молекулярных прогностических факторов выделяют наличие тирозиназы м-РНК, сосудистого эндотелиального фактора роста (VEGF), фактора роста гепатоцитов (HGF) и инсулиноподобного фактора роста-1 (ILGF-1) [12–15]. К группе хромосомных аберраций и мутаций в генах относят полную потерю одной копии (моносомию) хромосомы 3, удвоение хромосомы 8, мутации в генах GNAQ и GNA11, генотип СС полиморфного маркера C3435T гена ABCB1 и ряд других изменений [3, 10, 16–19].
В результате роста увеальная меланома может «прорывать» стекловидную пластинку (мембрану Бруха) или прорастать сетчатку, однако в ряде случаев возможен рост опухоли в сторону склеры и ее выход за пределы склероувеального кольца, при этом происходит формирование экстрабульбарного узла (рис. 2). Чаще всего экстрасклеральную инвазию увеальной меланомы отмечают при больших и средних размерах опухоли, однако отмечены случаи экстрабульбарного роста и при малых увеальных меланомах [6].
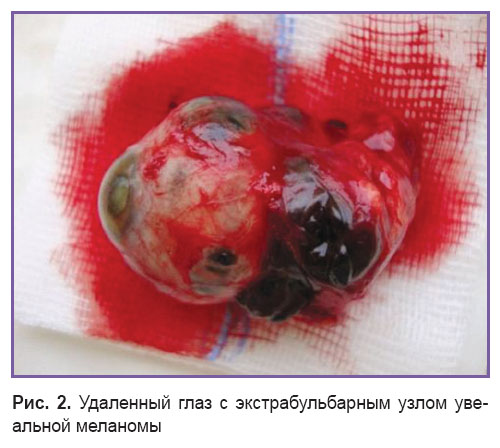 Рис. 2. Удаленный глаз с экстрабульбарным узлом увеальной меланомы Рис. 2. Удаленный глаз с экстрабульбарным узлом увеальной меланомы
|
В ряде работ показана значимость экстрабульбарного роста опухоли как крайне неблагоприятного прогностического фактора, сокращающего ожидаемую продолжительность жизни больного в два раза, что обусловлено увеличением риска гематогенной и лимфогенной диссеминации опухоли [6–8]. Существует несколько путей прорастания увеальной меланомы в орбиту: через передние и задние цилиарные артерии, вортикозные вены, длинные и короткие цилиарные нервы, через дренажную систему глаза (шлеммов канал), зрительный нерв и путем перфорации склеры. При этом выявление экстрабульбарного роста увеальной меланомы требует немедленного удаления (энуклеации) пораженного глаза даже при малых размерах опухоли [6, 7]. С целью определения витального прогноза у пациентов с увеальной меланомой, а также выбора оптимальной тактики хирургического лечения при начальных формах опухоли вызывает интерес изучение взаимосвязи экстрабульбарного роста увеальной меланомы с патоморфологическими и молекулярно-генетическими изменениями в опухоли, о чем в доступной литературе недостаточно сведений [6].
Цель исследования — анализ ассоциации экстрабульбарного роста опухоли с патоморфологическими молекулярно-генетическими изменениями у больных увеальной меланомой.
Материалы и методы. В период 2005–2007 гг. и в 2012 г. обследовано и пролечено 134 пациента с увеальной меланомой (50 мужчин и 84 женщины) в возрасте от 22 до 84 лет (средний возраст — 52,9±11,9 года). Всем пациентам при поступлении в стационар проводилось стандартное офтальмологическое обследование, включающее сбор анамнеза, визометрию, тонометрию по Маклакову, компьютерную периметрию, биомикроскопию и офтальмоскопию в условиях мидриаза, а также эхографическое исследование. Высота опухоли составляла от 1 до 17 мм (9,2±2,9 мм), диаметр основания — от 7,3 до 21,9 мм (15,3±3,5 мм). При сборе анамнеза выясняли факт проживания в местах с неблагоприятной экологической обстановкой, наличие профессиональных вредностей, отягощенной наследственности по онкологическим заболеваниям, сопутствующей патологии, время от начала появления первых жалоб до обращения к врачу.
Исследование проведено в соответствии с Хельсинкской декларацией (принятой в июне 1964 г. (Хельсинки, Финляндия) и пересмотренной в октябре 2000 г. (Эдинбург, Шотландия)) и одобрено Этическим комитетом Московского государственного медико-стоматологического университета им. А.И. Евдокимова. От каждого пациента получено информированное согласие.
По локализации выделяли опухоли цилиохориоидальной зоны (n=31; 23,1%), хориоидеи (n=89; 66,4%), иридоцилиохориоидальной зоны (n=10; 7,5%) и радужки (n=4; 3%). Опухоли анализировали по ряду клинических параметров: наличие (n=31; 23,1%) и отсутствие (n=103; 76,9%) гемофтальма; наличие невысокой (n=55; 41%), высокой (n=39; 29,1%) отслойки сетчатки и ее отсутствие (n=40; 29,9%); наличие (n=34; 25,4%) и отсутствие (n=100; 74,6%) субретинального экссудата, наличие (n=30; 22,4%) и отсутствие (n=104; 77,6%) отягощенного семейного анамнеза по онкологической патологии. Критерием формирования групп явилось наличие (n=15; 11,2% — 1-я группа) и отсутствие (n=119; 88,8% — 2-я группа) экстрабульбарного роста опухоли по данным биомикроскопии, эхографии, а также как случайная находка во время проведения органосохранного (брахитерапии) и ликвидационного лечения (рис. 3).
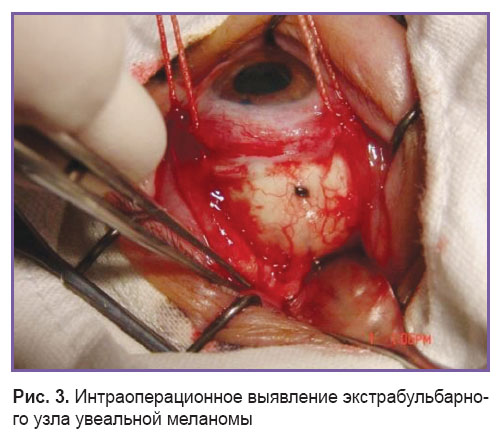 Рис. 3. Интраоперационное выявление экстрабульбарного узла увеальной меланомы Рис. 3. Интраоперационное выявление экстрабульбарного узла увеальной меланомы
|
При непрозрачных оптических средах, малых размерах опухоли по показаниям проводили дуплексное сканирование в режиме цветного доплеровского картирования с измерением акустической плотности опухоли в области ее верхушки, середины и основания (рис. 4), флюоресцентную ангиографию, оптическую когерентную томографию и компьютерную томографию орбит (по стандартной методике). В подавляющем большинстве случаев (n=131) по показаниям проведена энуклеация, при этом в восьми случаях из них энуклеации предшествовало органосохранное лечение (брахитерапия с Rh/Ru-аппликаторами). В трех случаях проводили органосохранное лечение (блокэксцизия опухоли с пластикой радужки).
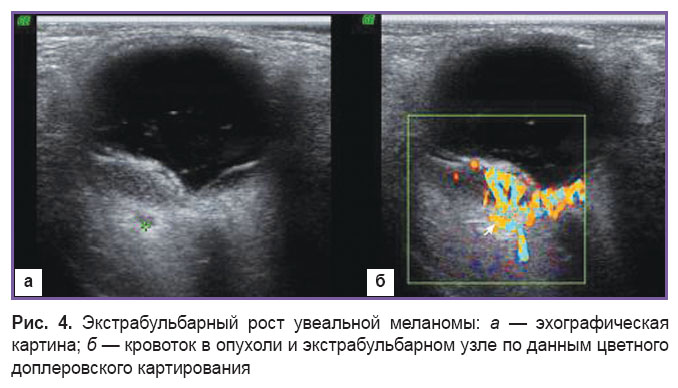 |
Рис. 4. Экстрабульбарный рост увеальной меланомы: а — эхографическая картина; б — кровоток в опухоли и экстрабульбарном узле по данным цветного доплеровского картирования |
Морфологическая верификация выполнена в отделе патологической анатомии и гистологии МНИИ глазных болезней им. Гельмгольца, во всех случаях подтверждена увеальная меланома. По наличию пигмента выделяли опухоли с выраженной (n=59; 44%), умеренной пигментацией (n=55; 41%) и малопигментные (n=20; 15%). По гистологическому строению выделяли веретеноклеточные (n=61; 45,6%), смешанноклеточные (n=46; 34,3%) и эпителиоидноклеточные (n=27; 20,1%) опухоли (рис. 5). Проведена макро- и микроскопическая оценка наличия экстрабульбарных узлов опухоли.
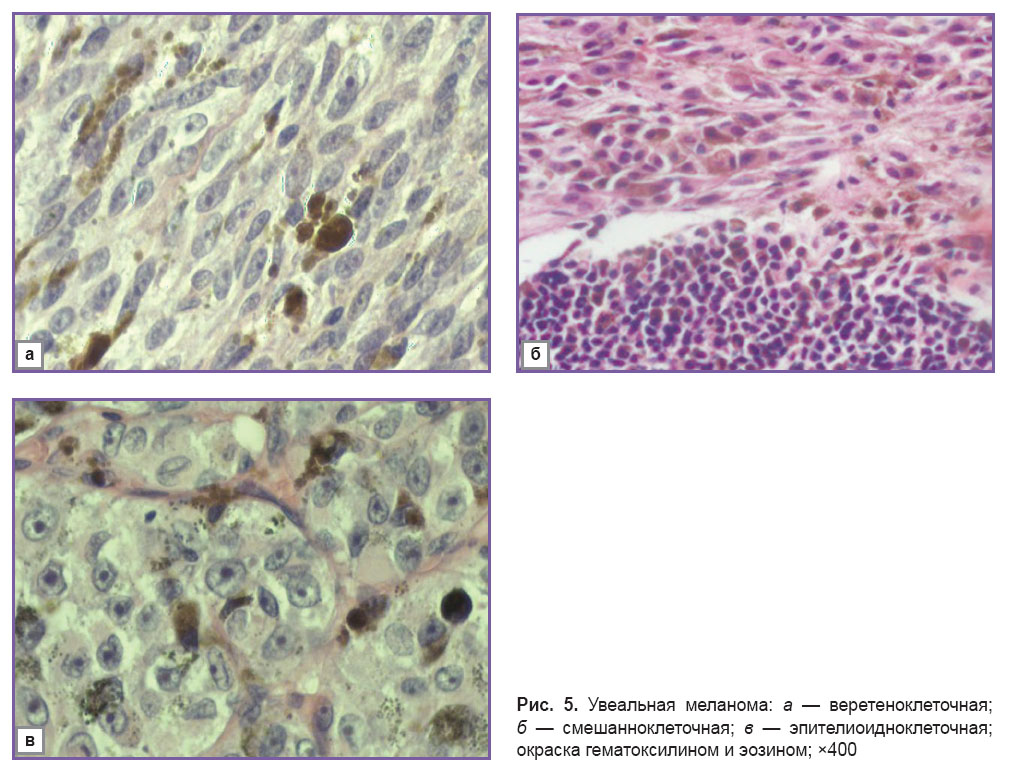 Рис. 5. Увеальная меланома: а — веретеноклеточная; б — смешанноклеточная; в — эпителиоидноклеточная; окраска гематоксилином и эозином; ×400 Рис. 5. Увеальная меланома: а — веретеноклеточная; б — смешанноклеточная; в — эпителиоидноклеточная; окраска гематоксилином и эозином; ×400
|
Во всех случаях на момент поступления в стационар проведено соматическое обследование, при этом ни у одного из пациентов не выявлено метастазов в регионарные лимфатические узлы, а также в отдаленные органы и ткани.
После энуклеации пораженного глаза биопсийный материал опухоли и относительно неповрежденной хориоидеи, а также образцы периферической крови (консервант — 0,5 М раствор ЭДТА) сохраняли при –20оС. Для молекулярно-генетического исследования образцов материал брали с цитологических препаратов, полученных после тонкоигольной аспирационной биопсии.
Молекулярно-генетический анализ, включавший определение полной моносомии хромосомы 3, делеции всего короткого плеча хромосомы 1 и метилирования гена RASSF1A, проводили у 104 пациентов, получавших лечение в 2005–2007 гг., на базе лаборатории молекулярной генетики Первого МГМУ им. А.И. Сеченова. У 30 пациентов, получавших лечение в 2012 г., анализ выполняли по расширенной методике, включая помимо названных показателей частичную моносомию хромосомы 3, делецию всего короткого плеча хромосомы 8, мутации в генах GNAQ и GNA11, SEMA3B и полиморфизм гена ABCB1 на базе лаборатории молекулярной диагностики и геномной дактилоскопии НИИ генетики и селекции промышленных микроорганизмов (Москва).
Геномную ДНК из образцов опухолей, условно интактной хориоидеи и периферической крови выделяли с помощью протеиназы К с последующей фенол-хлороформной экстракцией. При выделении ДНК из цитологических препаратов собранный со стекла материал обрабатывали лизирующим буфером, содержащим протеиназу К, и полученный лизат использовали в качестве матрицы для постановки полимеразной цепной реакции (ПЦР).
Потерю гетерозиготности в хромосомных районах 1p36, 1р31.3, 3p25.3, 3p21.3, 3p14.2, 3q12, 3q26.3, 3q28 идентифицировали с использованием высокополиморфных маркеров D1S243, D1S2145, D1S1635, D1S407, D1S3669, D1S438, D3S1038, D3S1317, D3S1568, D3S966, D3S1300, D3S1234, D3S2459, 16xTG_3q26.31, D3S3520, D3S2398. Контролем служила ДНК лейкоцитов периферической крови.
Для определения метилирования СpG-островков промоторных областей генов применяли метод метилчувствительной ПЦР. В качестве матрицы для ПЦР использовали ДНК из клеток увеальной меланомы, предварительно гидролизованную рестриктазами HpaII (для генов RASSF1A, SEMA3B). Мутации в генах GNAQ и GNA11 и полиморфизм гена ABCB1 определяли методом анализа полиморфизма длины рестрикционных фрагментов.
Срок динамического наблюдения составил 41–84 (60,9±8,8) мес для пациентов, оперированных в 2005–2007 гг., и 13–23 (17,4±3,1) мес для пациентов, оперированных в 2012 г. Диспансерное наблюдение осуществляли в соответствии с Приказом №135 Министерства здравоохранения РФ от 19.04.1999 г. один раз в 3 мес в течение первого года, затем один раз в 6 мес в течение второго года, в дальнейшем — один раз в год во взрослом консультативно-поликлиническом отделении МНИИ глазных болезней им. Гельмгольца. Пациенты, которые по различным причинам не могли приехать на осмотр, сообщали о себе по телефону, факсу и через родственников путем передачи справок от врачей по месту жительства. Часть данных получена путем запросов в департаменты здравоохранения по месту жительства пациентов.
Статистическую обработку результатов при оценке полиморфизма генов проводили с использованием закона генетического равновесия Харди–Вайнберга для аутосомных признаков. При сравнении частот встречаемости генотипов применяли критерий Пирсона, а для малых выборок — точный критерий Фишера. Комплексную оценку взаимосвязей между исследуемыми группами выполняли с использованием логистической регрессии, определяя отношение шансов (OR) с 95% доверительным интервалом (CI) с уровнем значимости, принятым равным 0,05. Рассматривали также результаты статистически маргинально значимые (0,05<p≤0,1), что соответствует CI=94% (в отличие от стандартного доверительного интервала 95% при р=0,05). Расчеты проводили с помощью пакета программ для Windows (Microsoft Excel, Statistica 10.1).
Результаты и обсуждение. После разделения пациентов на две группы — с наличием (1-я группа) и отсутствием (2-я группа) экстрабульбарного роста опухоли (см. таблицу) проведен анализ взаимосвязей между группами по основным клиническим, патоморфологическим и молекулярно-генетическим параметрам опухоли.
 Клиническая, патоморфологическая и молекулярно-генетическая характеристика пациентов c увеальной меланомой, абс. число/% Клиническая, патоморфологическая и молекулярно-генетическая характеристика пациентов c увеальной меланомой, абс. число/%
|
Группы стандартизированы по возрасту, полу, высоте и диаметру основания опухоли. По ряду клинических и патоморфологических признаков (пигментация опухоли, гемофтальм, отслойка сетчатки, субретинальный экссудат, отягощенный семейный анамнез) статистически значимых различий между группами не выявлено. В литературе имеются данные об отрицательной роли цилиохориоидальной и иридоцилиохориоидальной локализации увеальной меланомы в витальном прогнозе, а вовлечение цилиарного тела наряду с экстрабульбарным ростом опухоли традиционно расценивается как неблагоприятный прогностический фактор [10, 11]. В нашем исследовании взаимосвязи между вовлечением цилиарного тела и экстрабульбарным ростом не выявлено.
Следует отметить, что в 1-ю группу включены все случаи экстрабульбарного роста, независимо от размеров узлов увеальной меланомы на поверхности склеры:
единичные опухолевые клетки — 1;
единичные узелки на эписклере без прорастания — 5;
менее 2×2 мм — 2;
от 2×2 мм до 3×4 мм — 2;
от 3×4 мм до 4×5 мм — 3;
5×7 мм — 1;
6×7 мм — 1.
Отдельный интерес представляет анализ частоты клеточных типов опухоли в группах. Так, частота наиболее благоприятного веретеноклеточного типа в 1-й группе составила всего 20% против 47,9% во 2-й группе, при этом отличия статистически значимы (OR=0,27; F=0,053611; ξ2=4,19). В работе А.Г. Амирян и соавт. [6] из 14 исследованных случаев экстрабульбарного роста увеальной меланомы всего в одном случае подтвержден веретеноклеточный тип опухоли. Однако авторы не проводили сопоставление гистологических типов опухоли в группах с наличием и отсутствием экстрабульбарного роста. B. Damato и соавт. [9] сообщают о значимо меньшей частоте веретеноклеточного типа в группе с экстрабульбарным ростом опухоли. Таким образом, полученные нами результаты свидетельствуют об относительно меньшей злокачественности веретеноклеточного типа увеальной меланомы и его взаимосвязи с вероятностью выхода опухоли за пределы склерального кольца. Вместе с тем взаимосвязи с наименее благоприятными гистологическими типами увеальной меланомы, смешанноклеточным и эпителиоидноклеточным, выявить не удалось.
При анализе частоты молекулярно-генетических изменений статистически значимые различия между группами выявлены для полной или частичной моносомии хромосомы 3, одному из наименее благоприятных прогностических факторов [3, 18, 19] (рис. 6). Различий по таким признакам, как делеция короткого плеча хромосомы 1 или метилирование гена RASSF1A, не выявлено. Частота полной или частичной моносомии хромосомы 3 в 1-й группе составила 80%, а во 2-й группе — 50,4% (OR=3,93; F=0,051573; ξ2=4,69). Впервые показано, что выявление моносомии хромосомы 3 в клетках опухоли определяет повышенный риск экстрабульбарного ее роста, что обусловливает необходимость раннего лечения пораженного глаза и тщательного динамического наблюдения. Наши результаты свидетельствуют также о крайне неблагоприятной роли моносомии хромосомы 3 в прогнозе пациентов с увеальной меланомой, однако остается по-прежнему неясным порядок молекулярно-генетических и патоморфологических изменений при онкогенезе опухоли, а также молекулярный механизм, обусловливающий прорыв опухоли за пределы склерального кольца. В настоящей работе в связи с однородностью обеих групп высота и диаметр основания опухоли значимо не отличались. В ряде работ [16, 20] показано, что первичная мутация в генах GNAQ/GNA11 может являться пусковым механизмом злокачественной трансформации меланоцитов при онкогенезе опухоли, обсуждается роль полиморфизма гена ABCB1 [17]. В нашем исследовании анализ мутаций в указанных генах проводили только у 30 пациентов, что не позволяет делать вывод по общей выборке. Для определения взаимосвязи между вероятностью экстрабульбарного роста опухоли и другими молекулярно-генетическими изменениями (делеция короткого плеча хромосомы 8, мутации в генах GNAQ/GNA11, полиморфизм гена ABCB1) необходимы дальнейшие исследования.
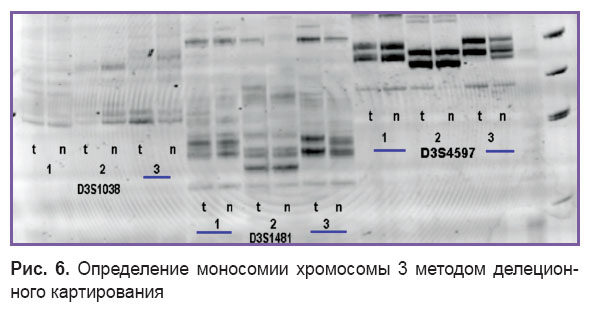 Рис. 6. Определение моносомии хромосомы 3 методом делеционного картирования Рис. 6. Определение моносомии хромосомы 3 методом делеционного картирования
|
Заключение. Исследование патоморфологических и молекулярно-генетических особенностей увеальной меланомы в группах с наличием и отсутствием экстрабульбарного роста опухоли показало значимо меньшую частоту (20 против 47,9%) благоприятного веретеноклеточного типа увеальной меланомы в группе с экстрабульбарным ростом. Частота полной или частичной моносомии хромосомы 3 в группе с экстрабульбарным ростом опухоли значимо выше (80 против 50,4%). Это может служить прогностическим признаком экстрабульбарного роста увеальной меланомы.
Финансирование исследования и конфликт интересов. Исследование не финансировалось какими-либо источниками, и конфликты интересов, связанные с данным исследованием, отсутствуют.
Литература
- Бровкина А.Ф. Офтальмоонкология. М: Медицина; 2002; 424 с.
- Саакян С.В., Амирян А.Г., Цыганков А.Ю. Увеальная меланома у детей и подростков: анализ собственных наблюдений у 21 больного. Российская педиатрическая офтальмология 2015; 10(3): 33–36.
- Саакян С.В., Амирян А.Г., Цыганков А.Ю., Склярова Н.В., Залетаев Д.В. Клинические, патоморфологические и молекулярно-генетические особенности увеальной меланомы с высоким риском метастазирования. Российский офтальмологический журнал 2015; 8(2): 47–52.
- Бровкина А.Ф. Дифференциальная диагностика меланомы хориодеи. Офтальмологическиеведомости 2008; 4(1): 68–76.
- Shields C.L., Furuta M., Berman E.L., Zahler J.D., Hoberman D.M., Dinh D.H., Mashayekhi A., Shields J.A. Choroidal nevus transformation into melanoma: analysis of 2514 consecutive cases. Arch Ophthalmol 2009; 127(8): 981–987, http://dx.doi.org/10.1001/archophthalmol.2009.151.
- Амирян А.Г., Саакян С.В., Вальский В.В. Экстрабульбарный рост после органосохраняющего лечения увеальной меланомы. Российский офтальмологический журнал 2011; 4(3): 15–19.
- Нероев В.В., Саакян С.В., Амирян А.Г., Вальский В.В. Факторы риска экстрабульбарного роста после локального лечения увеальной меланомы. Вестник офтальмологии 2011; 2: 21–25.
- Саакян С.В., Цыганков А.Ю., Амирян А.Г., Склярова Н.В., Залетаев Д.В. Выживаемость при увеальной меланоме: роль молекулярно-генетических факторов. Вестник офтальмологии. 2016; 132(1): 3–9.
- Damato B., Coupland S.E. A reappraisal of the significance of largest basal diameter of posterior uveal melanoma. Eye (Lond) 2009; 23: 2152–2160.
- Цыганков А.Ю., Саакян С.В., Амирян А.Г. Роль молекулярно-генетических факторов в выживаемости пациентов с увеальной меланомой цилиохориоидальной локализации. Медицинский вестник Башкортостана 2014; 9(2): 147–150.
- Weis E., Shah C.P., Lajous M., Shields J.A., Shields C.L. The association between host susceptibility factors and uveal melanoma: a meta-analysis. Arch Ophthalmol 2006; 124: 54–60, http://dx.doi.org/10.1001/archopht.124.1.54.
- Frenkel S., Zloto O., Pe’er J., Barak V. Insulin-like growth factor-1 as a predictive biomarker for metastatic uveal melanoma in humans. Invest Ophthalmol Vis Sci 2013; 54(1): 490–493, http://dx.doi.org/10.1167/iovs.12-10228.
- el Filali M., Missotten G.S., Maat W., Ly L.V., Luyten G.P., van der Velden P.A., Jager M.J. Regulation of VEGF-A in uveal melanoma. Invest Ophthalmol Vis Sci 2010; 51(5): 2329–2337, http://dx.doi.org/10.1167/iovs.09-4739.
- Mallikarjuna K., Pushparaj V., Biswas J., Krishnakumar S. Expression of epidermal growth factor receptor, ezrin, hepatocute growth factor, and c-Met in uveal melanoma: an immunohistochemical study. Curr Eye Res 2007; 32(3): 281–290, http://dx.doi.org/10.1080/02713680601161220.
- Pinzani P., Mazzini C., Salvianti F., Massi D., Grifoni R., Paoletti C., Ucci F., Molinara E., Orlando C., Pazzagli M., Neri B. Tyrosinase mRNA levels in the blood of uveal melanoma patients: correlation with the number of circulating tumor cells and tumor progression. Melanoma Res 2010; 20(4): 303–310, http://dx.doi.org/10.1097/cmr.0b013e32833906e3.
- Саакян С.В., Амирян А.Г., Цыганков А.Ю., Логинов В.И., Бурденный А.М. Мутации в онкогенах GNAQ и GNA11 у больных увеальной меланомой. Молекулярная медицина 2014; 2: 34–37.
- Саакян С.В., Амирян А.Г., Цыганков А.Ю., Логинов В.И., Бурденный А.М. Ассоциация гена ABCB1 с риском развития увеальной меланомы. Архив патологии 2014; 76(2): 3–7.
- Prescher G., Bornfeld N., Hirche H., Horsthemke B., Jockel K.H., Becher R. Prognostic implications of monosomy 3 in uveal melanoma. Lancet 1996; 347(9010): 1222–1225, http://dx.doi.org/10.1016/s0140-6736(96)90736-9.
- Worley L.A., Onken M.D., Person E., Robirds D., Branson J., Char D.H., Perry A., Harbour J.W. Transcriptomic versus chromosomal prognostic markers and clinical outcome in uveal melanoma. Clin Cancer Res 2007; 13(5): 1466–1471, http://dx.doi.org/10.1158/1078-0432.ccr-06-2401.
- Van Raamsdonk C.D., Griewank K.G., Crosby M.B., Garrido M.C., Vemula S., Wiesner T., Obenauf A.C., Wackernagel W., Green G., Bouvier N., Sozen M.M., Baimukanova G., Roy R., Heguy A., Dolgalev I., Khanin R., Busam K., Speicher M.R., O’Brien J., Bastian B.C. Mutations in GNA11 in uveal melanoma. N Engl J Med 2010; 363(23): 2191–2199, http://dx.doi.org/10.1056/nejmoa1000584.










