Разработка способа патоморфологической оценки давности развития инфаркта миокарда
Цель исследования — разработать простой и доступный для практического применения способ патоморфологической оценки давности инфаркта миокарда с широким диапазоном регистрируемых сроков.
Материалы и методы. С использованием антител к матриксной металлопротеиназе 9 (ММР9) проведено иммуногистохимическое исследование образцов зоны экспериментального инфаркта миокарда (модель диатермокоагуляции околоконусной межжелудочковой артерии крысы; n=50) в сроки от 2 ч до 30 сут и post mortem образцов 30 человек, умерших от трансмурального инфаркта миокарда и постинфарктного кардиосклероза в сроки от 6 ч до 30 сут.
Результаты. Установлено, что локализация MMP9 в зоне инфаркта миокарда позволяет с достаточно высокой точностью определить срок, прошедший с момента инфаркта. При летальных исходах, развившихся в течение нескольких часов после инфаркта, цитоплазма нейтрофилов в зоне инфаркта имела интенсивную окраску. На 1–2-е сутки в зоне инфаркта зафиксирована яркая окраска внеклеточного матрикса. В более поздние сроки (3–21-е сутки) отмечена окраска клеток фибробластического ряда в пограничной зоне (с максимумом на 7–14-е сутки). Динамика содержания и локализация MMP9 в миокарде умерших пациентов соответствуют данным, полученным при экспериментальных исследованиях.
Заключение. Предлагаемый способ позволяет четко дифференцировать срок давности инфаркта миокарда при патоморфологическом исследовании.
Точное установление срока давности инфаркта миокарда имеет большое значение [1]. «Рутинные» методы патологоанатомической диагностики не всегда объективны и достоверны, часто не позволяют определить время развития ишемического некроза миокарда. При осложненных формах течения — повторных и рецидивирующих инфарктах — задача определения срока давности усложняется.
Существуют различные методы патологоанатомической диагностики ишемии миокарда. На макроскопическом уровне используют пробы с теллуритом калия, нитросиним тетразолием, позволяющие выявить исчезновение ферментативной активности в ишемизированных участках.
На микроскопическом уровне используют специальные гистологические окраски. Так, трихромную окраску по Массону применяют для различения некротического миокарда (синее окрашивание) от цитоплазмы жизнеспособного миокарда (красное окрашивание цитоплазмы), часто имеющего фиолетовую окраску области, примыкающей к зоне некроза [2]. При этом установить время, прошедшее с момента развития некроза, не удается.
Одним из информативных методов, позволяющим обнаружить ранние изменения, считается гистохимический и, в частности, реакция, выявляющая активность фосфорилазы. Однако ее применение при аутопсии не нашло широкого распространения из-за того, что эта реакция диагностически значима лишь в пределах 3 ч после наступления смерти [3].
С развитием знаний о молекулярных основах деятельности кардиомиоцитов стали использоваться различные иммуногистохимические окраски: на терминальный комплекс комплемента C5b-9 [4], миоглобин, актин и тропомиозин [5], фибронектин [6], кардиальный тропонин I [7], кардиальный белок, связывающий жирные кислоты [8], окраска на дистрофин [9].
Для определения ранних стадий инфаркта миокарда перспективно использовать окраску на десмин, который начинает исчезать из цитоплазмы в зоне инфаркта в течение 30 мин после наступления ишемии и полностью исчезает через 90–120 мин [10].
C. Ortmann с соавт. (2000) исследовали зону ишемии миокарда на деплецию таких «кардиальных» антигенов, как тропонин С и Т, десмин, миоглобин, потерю CD59 и отложение из плазмы фибриногена, фибронектина и терминального комплекса комплемента C5b-9. Визуализация комплекса C5b-9 наблюдалась в тканях через 30 мин после развития симптомов инфаркта миокарда. Деплеция клеточных антигенов началась раньше, чем осаждение антигенов из плазмы крови [11].
Отсутствие «идеальных» способов морфологической диагностики инфаркта миокарда обусловливает проведение новых исследований в данной области.
Учитывая, что процессы ремоделирования миокарда резко активизируются сразу после эпизода, приводящего к некрозу, и эта активность сохраняется до установления новых взаимоотношений клеточного и межуточного компонентов миокарда, нами изучена возможность определения сроков давности инфаркта миокарда по динамике основных участников перестройки соединительнотканного каркаса — матриксных металлопротеиназ, в частности металлопротеиназы 9 (MMP9).
Цель исследования — разработать простой и доступный для практического применения способ патоморфологической оценки давности инфаркта миокарда с широким диапазоном регистрируемых сроков.
Материалы и методы. Экспериментальное моделирование инфаркта миокарда проведено на 9-месячных самках крыс линии Wistar весом 220–250 г (n=50) методом диатермокоагуляции околоконусной межжелудочковой артерии [12].
Эксперимент выполнялся в соответствии с нормами гуманного обращения с животными, которые регламентированы «Правилами проведения работ с использованием экспериментальных животных» (Приложение к приказу Министерства здравоохранения СССР от 12.08.1977 г. №755), согласно протоколу, одобренному Комитетом по биомедицинской этике Иркутского научного центра хирургии и травматологии, а также с учетом требований Европейской конвенции по защите позвоночных животных, используемых для экспериментальных и других научных целей (принятой в Страсбурге 18.03.1986 г. и подтвержденной в Страсбурге 15.06.2006 г.).
Выведение животных из эксперимента проводили в сроки от 2 ч до 30 сут после моделирования инфаркта миокарда. Сердце экспериментального животного фиксировали в растворе 10% нейтрального забуференного формалина в течение 24 ч при 20°С для дальнейшего гистохимического исследования.
Материалом для патоморфологического исследования послужили post mortem образцы 30 человек (29 — с трансмуральным инфарктом миокарда, 1 — с постинфарктным кардиосклерозом). Средний возраст — 63,7 года; мужчин — 18, женщин — 12. 16 пациентов умерли в сроки до 3 сут, 14 — в сроки от 3 сут до 1 мес. Вскрытия проводили в централизованной прозектуре Иркутского областного патологоанатомического бюро, принимающей летальные случаи из Областной клинической больницы Иркутска, которая имеет специализированное кардиореанимационное отделение. Исследование одобрено Комитетом по биомедицинской этике Иркутского научного центра хирургии и травматологии.
В 27 случаях диагноз острого инфаркта миокарда был установлен на основании клинической картины, данных электрокардиографии, реакции кардиоспецифических ферментов и подтвержден на вскрытии. В 3 случаях диагноз инфаркта миокарда первично выставлен на патологоанатомическом вскрытии. В 4 случаях диагноз острого инфаркта миокарда как одна из первоначальных причин смерти комбинирован с другими нозологическими формами (язвенной болезнью желудка, осложненной кровотечением; туберкулезом; мегалобластной анемией; кишечными свищами).
Оценка давности инфаркта миокарда проводилась на основании стандартных гистологических критериев: некроза кардиомиоцитов, нейтрофильной инфильтрации и характера ее распределения, инфильтрации лимфоцитами, макрофагами, плазматическими клетками, пролиферации кровеносных сосудов, фибробластов, состояния коллагеновых волокон. Образцы ткани из зоны инфаркта миокарда и пограничной к ней области фиксировали 10% раствором нейтрального забуференного формалина в течение 24 ч при 20°С и заливали в парафиновые блоки.
Для окраски на MMP9 применяли иммуногистохимический метод, описанный нами ранее [13]. Использован непрямой пероксидазный метод. Демаскировка и иммуногистохимическая окраска проводились ручным способом с использованием набора Novolink Polymer Detection System (Novocastra Laboratories Ltd., Великобритания), в качестве хромогена использован 3,3’-диаминобензидин (DAB). Ядра окрашивали гематоксилином Майера.
В качестве первичных антител применяли кроличьи моноклональные антитела IgG к ММР9 (Clone 1D:EP1254, Cat. No.2551-1, Lot YG 113001P, Epitomics Inc., США) в рабочем разведении от 1:100 до 1:250.
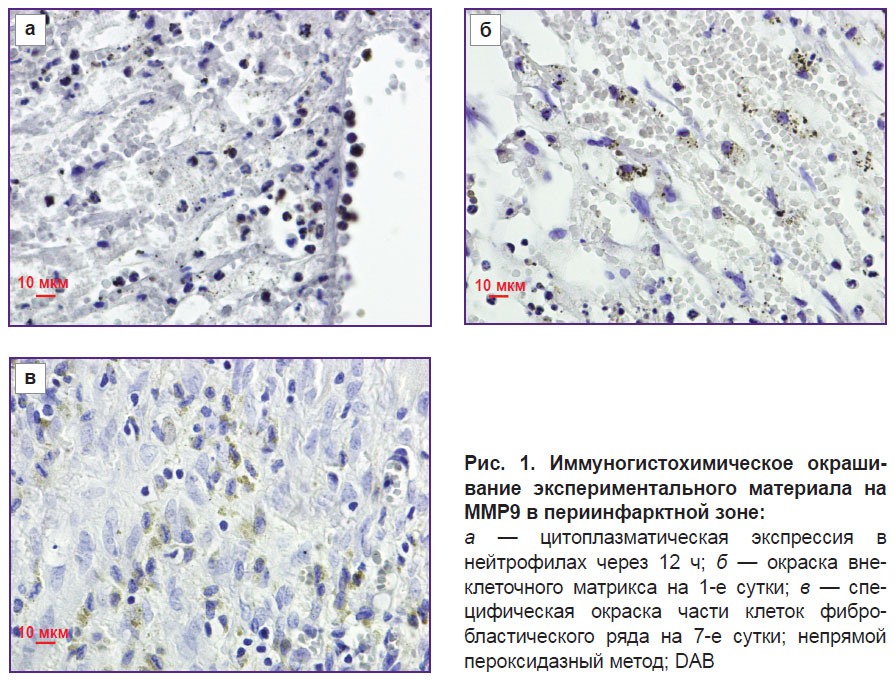
Результаты. На первом этапе оценена динамика окраски зоны инфаркта и периинфарктной зоны на ММР9 при экспериментальном инфаркте миокарда. Как известно, ММP9 в высоких концентрациях присутствует в нейтрофилах. При исследовании установлено, что в сроки от 2 ч до 1 сут после моделирования инфаркта миокарда выявлялись ярко окрашенные нейтрофилы в просвете сосудов в периинфарктной зоне и зоне инфаркта (рис. 1, а).
На 1-е сутки наблюдалась дегрануляция нейтрофилов с потерей окраски их цитоплазмы. Одновременно с этим обнаружено появление выраженной окраски внеклеточного матрикса в зоне ишемического повреждения, что свидетельствует о выходе ММР9 из нейтрофилов в ткани (рис. 1, б).
На 3–14-е сутки при экспериментальном инфаркте в периинфарктной зоне появляется специфическая окраска части клеток фибробластического ряда. Наличие MMP9 в этих клетках в указанные сроки патологического процесса, по-видимому, связано с необходимостью перестройки внеклеточного матрикса (ремоделирования) в новых условиях механических нагрузок на миокард. Максимальная интенсивность окраски клеточных элементов отмечена на 7–14-е сутки (рис. 1, в). На 30-е сутки экспериментального инфаркта миокарда специфическая окраска в зоне постинфарктного кардиосклероза не регистрировалась.
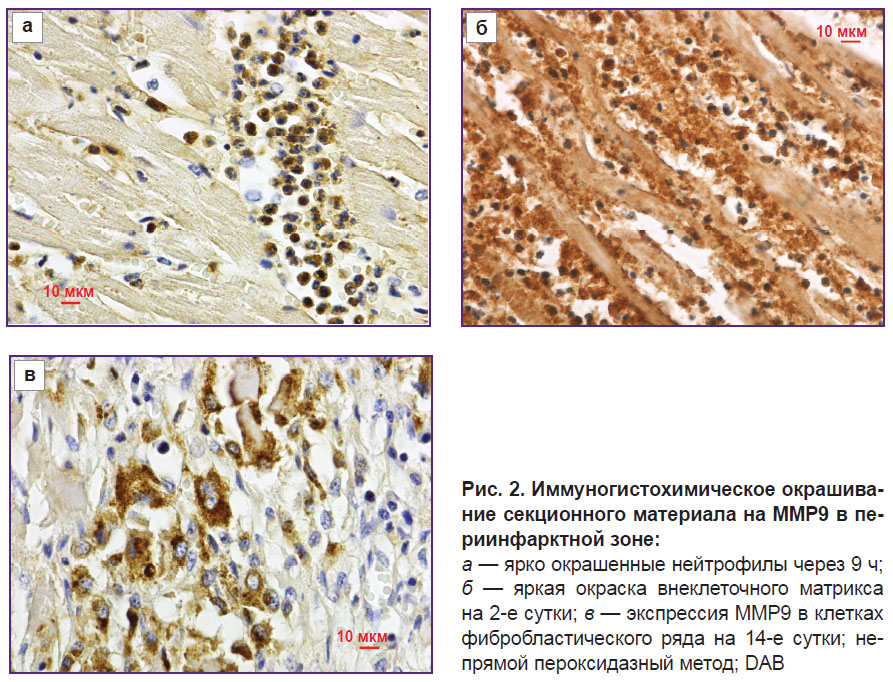
При исследовании патоморфологического материала установлено, что динамика содержания и локализация MMP9 в миокарде умерших пациентов соответствуют данным, полученным при экспериментальных исследованиях. При летальных исходах, развившихся в течение нескольких часов после инфаркта, регистрировали ярко окрашенные нейтрофилы в сосудах периинфарктной зоны и в зоне инфаркта (рис. 2, а).
При сроке давности инфаркта от 1 до 2 сут фиксировали дегрануляцию нейтрофилов, потерю окраски цитоплазмы нейтрофилов. Параллельно с этим зафиксирована яркая окраска внеклеточного матрикса в зоне инфаркта (рис. 2, б). В более поздние сроки (3–21-е сутки) отмечали экспрессию MMP9 в клетках фибробластического ряда в пограничной зоне. При этом максимальная выраженность окраски отмечена на 7–14-е сутки (рис. 2, в). Зона сформированного кардиосклероза (30-е сутки и более) не окрашивалась.
Таким образом, отмечена хорошая воспроизводимость предлагаемого способа — при окрашивании серийных срезов в разных партиях достигнуты идентичные результаты.
Обсуждение. Окрашивание гистологических препаратов миокарда на ММP9 позволяет визуализировать как динамику развития некротической фазы инфаркта и выход ММP9 в зону повреждения в ранние сроки патологического процесса, так и функциональную активность ряда клеток по ремоделированию фибриллярных белков в зоне формирования постинфарктного кардиосклероза в поздние сроки. При этом в ранние сроки основным источником ММP9 в зоне повреждения являются нейтрофилы, мигрирующие в очаг ишемического повреждения во время нейтрофильной фазы воспаления.
В более поздние сроки окраска на ММP9 клеток фибробластического ряда с максимумом окраски на 7–14-е сутки отражает процессы ремоделирования как в зоне формирования постинфарктного кардиосклероза, так и в прилегающих к ней областях миокарда. Клетки с фиброкластической активностью обеспечивают перестройку внеклеточного матрикса. Известно, что ремоделирование миокарда, происходящее после эпизода ишемического повреждения, имеет очень важный аспект — перестройку соединительнотканного каркаса сообразно новым условиям распределения механических нагрузок [14]. Наибольшую роль в этом процессе отводят ферментам группы металлопротеаз. Интенсивность окраски фиброкластов в зоне формирования постинфарктного кардиосклероза отражает активность перестройки внеклеточного матрикса. Снижение активности данного процесса сопровождается снижением интенсивности и последующим исчезновением специфической окраски.
В связи с четко выраженной стадийностью экспрессии MMP9 в миокарде этот маркер удобно использовать для определения давности возникновения инфаркта миокарда [15]. Он также позволяет проводить патоморфологическую дифференциальную диагностику при повторных и рецидивирующих инфарктах миокарда.
Заключение. Разработанный способ определения срока давности инфаркта миокарда позволяет четко дифференцировать время, прошедшее с момента инфаркта, при патоморфологическом исследовании.
Финансирование исследования. Работа выполнена при поддержке проектов на базовое финансирование ФГБНУ ИНЦХТ (рег. №01201280990) и ФГБУН ИНЦ СО РАН.
Конфликт интересов. Авторы подтверждают отсутствие конфликта интересов.
Литература
- Zech W.D., Schwendener N., Persson A., Warntjes M.J., Jackowski C. Postmortem MR quantification of the heart for characterization and differentiation of ischaemic myocardial lesions. Eur Radiol 2015; 25(7): 2067–2073, https://doi.org/10.1007/s00330-014-3582-2.
- Kostin S., Hein S., Arnon E., Scholz D., Schaper J. The cytoskeleton and related proteins in the human failing heart. Heart Fail Rev 2000; 5(3): 271–280, https://doi.org/10.1023/A:1009813621103.
- Кактурский Л.В., Рыбакова М.Г., Кузнецова И.А. Внезапная сердечная смерть (морфологическая диагностика). Библиотека патологоанатома 2008; 100: 45–61.
- Thomsen H., Held H. Immunohistochemical detection of C5b-9(m) in myocardium: an aid in distinguishing infarction-induced ischemic heart muscle necrosis from other forms of lethal myocardial injury. Forensic Sci Int 1995; 71(2): 87–95, https://doi.org/10.1016/0379-0738(94)01640-q.
- Campobasso C.P., Dell’Erba A.S., Addante A., Zotti F., Marzullo A., Colonna M.F. Sudden cardiac death and myocardial ischemia indicators: a comparative study of four immunohistochemical markers. Am J Forensic Med Pathol 2008; 29(2): 154–161, https://doi.org/10.1097/PAF.0b013e318177eab7.
- Hu B.J., Chen Y.C., Zhu J.Z. Study on the specificity of fibronectin for post-mortem diagnosis of early myocardial infarction. Med Sci Law 2002; 42(3): 195–199, https://doi.org/10.1177/002580240204200303.
- Sapouna R., Gourgiotis D., Athanaselis S., Papadodima S., Spiliopoulou C. Diagnostic value of cardiac troponin I in postmortem diagnosis of myocardial infarction. Am J Forensic Med Pathol 2013; 34(2): 139–141, https://doi.org/10.1097/PAF.0b013e3182880aa1.
- Meng X., Ming M., Wang E. Heart fatty acid binding protein as a marker for postmortem detection of early myocardial damage. Forensic Sci Int 2006; 160(1): 11–16, https://doi.org/10.1016/j.forsciint.2005.08.008.
- Hashmi S., Al-Salam S. Loss of dystrophin staining in cardiomyocytes: a novel method for detection early myocardial infarction. Int J Clin Exp Pathol 2013; 6(2): 249–257.
- Ouyang J., Guzman M., Desoto-Lapaix F., Pincus M.R., Wieczorek R. Utility of desmin and a Masson’s trichrome method to detect early acute myocardial infarction in autopsy tissues. Int J Clin Exp Pathol 2009; 3(1): 98–105.
- Ortmann C., Pfeiffer H., Brinkmann B. A comparative study on the immunohistochemical detection of early myocardial damage. Int J Legal Med 2000; 113(4): 215–220, https://doi.org/10.1007/s004149900094.
- Шурыгин М.Г., Шурыгина И.А., Дремина Н.Н. Динамика факторов роста эндотелия сосудов и фибробластического фактора роста при экспериментальном инфаркте миокарда. Бюллетень Восточно-Сибирского научного центра Сибирского отделения Российской академии медицинских наук 2007; 6: 169–174.
- Шурыгина И.А., Шурыгин М.Г., Аюшинова Н.И. Экспрессия маркеров апоптоза при развитии спаечного процесса в брюшной полости в эксперименте. Вестник Российской академии медицинских наук 2014; 69(5–6): 29–33.
- Ruiz-Villalba A., Simón A.M., Pogontke C., Castillo M.I., Abizanda G., Pelacho B., Sánchez-Domínguez R., Segovia J.C., Prósper F., Pérez-Pomares J.M. Interacting resident epicardium-derived fibroblasts and recruited bone marrow cells form myocardial infarction scar. J Am Coll Cardiol 2015; 65(19): 2057–2066, https://doi.org/10.1016/j.jacc.2015.03.520.
- Шурыгина И.А., Шурыгин М.Г., Дремина Н.Н., Каня О.В. Способ патоморфологического определения давности наступления инфаркта миокарда. Патент РФ 2518333 С1. 2012.