Структурное состояние мембран и функциональная активность перитонеальных макрофагов после воздействия газоразрядных устройств
Цель исследования — изучить в эксперименте влияние излучения газоразрядных устройств (плазмы искрового разряда и УФ-излучения кварцевой лампы) на структурное состояние мембран и функциональную активность перитонеальных макрофагов.
Материалы и методы. Объектом исследования являлись перитонеальные макрофаги крыс линии Wistar. В качестве действующего фактора использовали газоразрядное устройство «Пилимин» серии ИР-10 и ультрафиолетовую лампу ДБК-9. Суспензию перитонеальных макрофагов обрабатывали в течение 30, 60, 300, 600 и 1200 с. Анализ липидного состава проводили методом тонкослойной хроматографии. Микровязкость в области липид-липидных и белок-липидных контактов анализировали по флюоресценции пирена. Гидрофобность углеводородного слоя мембран определяли по флюоресценции 1,6-дифенил-1,3,5-гексатриена. Для оценки функционального состояния перитонеальных макрофагов изучали активность фагоцитоза по поглощению частиц латекса, состояние кислородзависимого метаболизма — по постановке НСТ-теста и по измерению люминолзависимой хемилюминесценции.
Результаты. Установлено, что при воздействии излучением плазмы искрового разряда окисление фосфолипидов происходит менее интенсивно, чем после воздействия излучением кварцевой лампы. Микровязкость мембран в области липид-липидных и белок-липидных контактов в большей степени увеличивается после воздействия УФ-излучением кварцевой лампы. Излучение плазмы искрового разряда приводит к снижению, а УФ-излучение кварцевой лампы — к увеличению плотности жирных кислот фосфолипидов. Воздействие излучением плазмы искрового разряда вызывает увеличение количества клеток, принимающих участие в фагоцитозе, возрастание поглотительной способности и кислородзависимого метаболизма перитонеальных макрофагов. Время наступления «кислородного взрыва» макрофагов сокращается после воздействия излучением плазмы, а после воздействия УФ-излучением кварцевой лампы увеличивается.
Заключение. Излучение плазмы искрового разряда по сравнению с УФ-излучением кварцевой лампы способствует активации фагоцитарной активности перитонеальных макрофагов при менее длительных режимах, наблюдаемые эффекты более выражены. Данные исследования позволяют выявить оптимальные режимы функциональной активности клеток после газоразрядного воздействия.
Клетки системы мононуклеарных фагоцитов имеют огромное значение для поддержания резистентности организма. От их функциональной активности зависит интенсивность иммунного ответа и гомеостаз организма [1]. Структурная организация и целостность мембраны макрофагов влияют на внутриклеточные процессы и различные метаболические реакции. Состояние структурных компонентов клеточных мембран, их расположение и взаимодействие определяют биофизические свойства мембран, а следовательно, и возможности рецепторного аппарата, целостность и полноценное функционирование мононуклеарных фагоцитов [2, 3]. Все сказанное обусловливает изучение физико-химических факторов, позволяющих увеличивать фагоцитарную активность при инфекционных или неопластических процессах. В последнее десятилетие исследуются биологические эффекты холодной газоразрядной плазмы [4, 5]. Установлено бактерицидное, цитотоксическое действие, а также активация мононуклеарных клеток после воздействия излучением газоразрядной плазмы [5–8]. Показано, что излучение газоразрядной плазмы избирательно влияет на структурно-функциональные компоненты мембран клеток, например не приводит к накоплению молекулярных продуктов пероксидации липидов, однако вызывает окислительную модификацию белков [9, 10]. В процессе генерации излучения газоразрядной плазмы, в частности УФ-диапазона, образуются радикальные продукты, участвующие в реакциях окисления и восстановления. Окислители и восстановители разнонаправленно влияют на модификацию макромолекул и метаболические процессы в клетке [11, 12]. Интересным является исследование и анализ влияния излучения газоразрядной плазмы и УФ-излучения кварцевой лампы на мембраны макрофагов, что позволит выявить механизмы их модификации после такого воздействия.
Цель исследования — изучить влияние излучения плазмы искрового разряда и УФ-излучения кварцевой лампы на структурное состояние мембран и функциональную активность перитонеальных макрофагов.
Материалы и методы. Эксперименты проведены in vitro. Объектом исследования являлись перитонеальные макрофаги крыс линии Wistar. Суспензию макрофагов получали через 20 мин после внутрибрюшинного введения стерильного физиологического раствора. УФ-излучение формировали с использованием ультрафиолетовой кварцевой лампы ДБК-9 (НПП «Солнышко», Россия). Характер спектра лампы ДБК-9 — монохроматический с максимумом в области λ=254 нм, непрерывная мощность — 9 Вт, средний поток фотонов — 5,4·10–8 моль(см2·с)–1. Излучение плазмы искрового разряда генерировали с помощью экспериментального устройства «Пилимин» серии ИР-10 (НИИ ядерной физики им. Д.В. Скобельцына МГУ им. М.В. Ломоносова, Россия) с заданными параметрами: длительность импульса — 100 мкс, напряжение источника питания — 11 кВ, емкость импульсного конденсатора — 3,3 нФ, энергия импульса — 5,9·10−2 Дж, частота — 10 Гц, спектр излучения сплошной с максимумом λ=220 нм, средний поток фотонов — (1,26±0,2)·10–10 моль(см2·с)–1. Суспензию перитонеальных макрофагов обрабатывали в течение 30, 60, 300, 600 и 1200 с. Контролем служили клетки, не подвергавшиеся воздействию.
На первом этапе исследования оценивали структурное состояние мембран перитонеальных макрофагов до и после газоразрядного воздействия: липидный состав, микровязкость и гидрофобность. Изучение липидного состава проводили методом тонкослойной хроматографии при последовательном применении двух систем растворителей [12]. Анализ и количественную обработку полученных хроматограмм выполняли с использованием программы GelAnalyzer 2010a. Сумму липидных фракций принимали за 100% и определяли процентное содержание каждого класса липидов. Дополнительно рассчитывали соотношение фракции холестерина (ХС) к суммарному количеству фосфолипидов (ФЛ) (ХС/ФЛ). Оценку микровязкости мембран макрофагов в зоне липид-липидных и белок-липидных контактов осуществляли методом регистрации латеральной диффузии гидрофобного зонда пирена (Sigma-Aldrich, США). Коэффициент эксимеризации обратно зависим от микровязкости и рассчитывается по формуле Кэкс=F470/F395 [13], где F — флюоресценция при длине волны 470 и 395 нм. Степень гидрофобности анализировали по флюоресценции зонда 1,6-дифенил-1,3,5-гексатриена (Sigma-Aldrich, США) [14]. Спектры флюоресценции мембранных зондов регистрировали с помощью спектрофлюориметра «Флюорат-02-Панорама» («Люмекс», Россия).
На втором этапе эксперимента изучали функциональное состояние перитонеальных макрофагов до и после воздействия. О фагоцитарной активности судили по поглощению частиц латекса размером 0,8 мкм. Подсчитывали процент активных клеток (фагоцитарный индекс) и среднее число частиц латекса, поглощенных одним фагоцитом (фагоцитарное число). Оценку состояния метаболической активности проводили по результатам постановки спонтанного и активированного зимозаном тестов с нитросиним тетразолием (НСТ-тест) [7]. Функциональную активность перитонеальных макрофагов определяли измерением люминолзависимой хемилюминесценции на хемилюминометре Luminoskan Ascent (Thermo Fisher Scientific, Финляндия). Ставили два параллельных теста: спонтанный и индуцированный со стимулятором фитогемагглютинином (200 мкг/мл). Измерения выполняли в течение 30 мин. Учитывали результат на пике хемилюминесценции и время наступления ее максимального уровня.
Результаты представляли в виде М±m, где М — среднее арифметическое, m — стандартная ошибка среднего. Достоверность различий определяли по критерию Манна–Уитни. Две выборки считались принадлежащими к разным генеральным совокупностям при р<0,05.
Результаты и обсуждение
Структурное состояние мембран перитонеальных макрофагов. На первом этапе исследования оценивали липидный спектр мембран перитонеальных макрофагов (табл. 1). При воздействии плазмы искрового разряда длительностью 60, 300, 600 и 1200 с выявлено последовательное увеличение фракции эфиров ХС (ЭфХС) на 23,7–34,0%. Установлено снижение фракции фосфатидилхолина на 40,0–46,8% при режимах воздействия 300, 600 и 1200 с. Кроме того, при воздействии в 1200 с наблюдается статистически значимое снижение количества холестерина на 14,7%, а также снижение количественного содержания таких групп ФЛ, как фосфатидилэтаноламина и лизофосфатидилхолина — на 49,0 и 60,4% соответственно. ЭфХС являются основной формой запаса ХС в клетке, и увеличение их доли может быть связано с возможными окислительными реакциями после воздействия излучения плазмы искрового разряда, так как известно, что увеличение в клетках суммарного ХС (ХС+ЭфХС) служит защитной реакцией клетки, обеспечивающей стабильность клеточным структурам и предохраняющей от продуктов окисления [15, 16]. В стабилизации бислоя мембран основную роль играют фосфатидилхолин и фосфатидилэтаноламин. Снижение их количества может быть связано с окислением отдельных фракций ФЛ и приводить к изменению биофизических свойств плазматической мембраны клеток. В связи с тем, что лизофосфатидилхолин обладает свойствами хемоаттрактанта и митогена макрофагов, его снижение может отразиться на функциональных возможностях клетки. В целом изменения липидного спектра при режиме воздействия длительностью 1200 с свидетельствуют о включении защитных реакций в клетке [15]. Кроме того, при воздействии в течение 1200 с увеличивается соотношение ХС/ФЛ в 1,4 раза. Это указывает на перераспределение соотношения основных структурообразующих липидных компонентов и может приводить к изменению функциональной активности клеточных мембран.

|
Таблица 1. Липидный состав перитонеальных макрофагов крыс после воздействия газоразрядными устройствами, % |
УФ-излучение кварцевой лампы в большей степени, чем излучение плазмы, влияет на липидный состав мембран перитонеальных макрофагов (см. табл. 1). Воздействие длительностью 1200 с вызывает статистически значимое снижение доли лизофосфатидилхолина, фосфатидилхолина и фосфатидилэтаноламина на 53,2, 72,9 и 52,4% соответственно. Происходит возрастание доли эфХС на 31,1%, увеличивается соотношение «ХС/ФЛ» в 1,7 раза. Подобные «защитные» перестройки липидного спектра характеризуются повышением жесткости клеточных мембран и могут приводить к ограничению функциональных возможностей клеток.
Действие излучения газоразрядной плазмы и УФ-излучения кварцевой лампы на изменения в липидном спектре перитонеальных макрофагов носит окислительный характер, происходит снижение доли ФЛ и увеличивается содержание эфХС. Однако отношение «ХС/ФЛ» после воздействия излучением кварцевой лампы выше на 36%, что свидетельствует о более интенсивном окислении ФЛ.
Изменение липидного состава перитонеальных макрофагов после физических воздействий может свидетельствовать об изменении вязкости мембран и ригидности клеток. Известно, что нормальное функционирование плазматической мембраны определяется микровязкостными свойствами. Поэтому далее для более детального изучения микровязкости мембран в зоне липид-липидных и белок-липидных контактов использовали флюоресцентный зонд пирен. Снижение коэффициента эксимеризации зонда пирена свидетельствует о возрастании микровязкости. Установлено, что излучение плазмы искрового разряда и УФ-излучение кварцевой лампы приводят к постепенному повышению микровязкости мембран перитонеальных макрофагов в липидном бислое при увеличении времени воздействия: после воздействия в течение 1200 с микровязкость увеличивается на 38 и 39,7% соответственно по сравнению с контрольной серией (табл. 2). В области белок-липидных контактов микровязкость увеличивается на 6,92–14,80% при всех режимах воздействия плазмой искрового разряда. Увеличение микровязкости после обработки УФ-излучением кварцевой лампы на 14,32–23,15% в области белок-липидных контактов наблюдается при режимах воздействия длительностью 300, 600 и 1200 с. Излучение кварцевой лампы приводит к более выраженному увеличению микровязкости в зоне белок-липидных контактов по сравнению с излучением плазмы, что, по-видимому, связано с более интенсивным потоком фотонов УФ-излучения кварцевой лампы [17]. Увеличение микровязкости мембран в области липид-липидных и белок-липидных контактов, как известно, может приводить к изменению конформационного состояния мембранных ферментов, подвижности и активности внутримембранных белков, нарушению селективной проницаемости и работы рецепторного аппарата клеток [18].
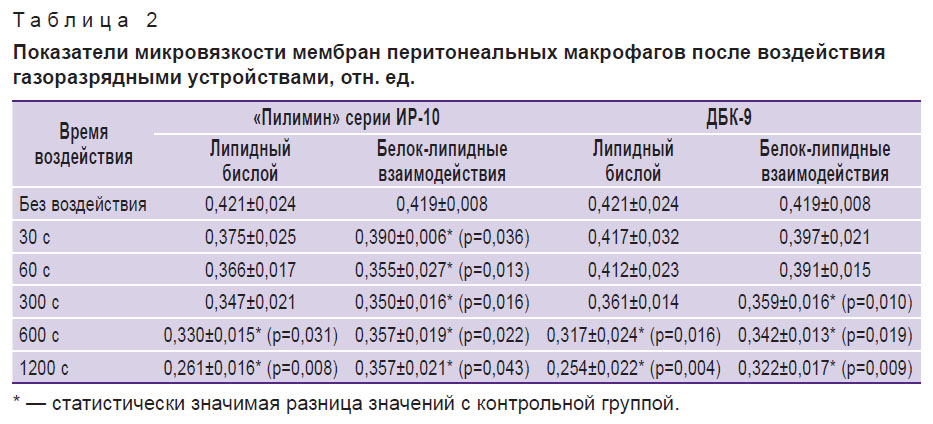
|
Таблица 2. Показатели микровязкости мембран перитонеальных макрофагов после воздействия газоразрядными устройствами, отн. ед. |
Жирные кислоты ФЛ обеспечивают текучие и пластические свойства бислоя. Поэтому дополнительно для оценки структурной организации жирных кислот ФЛ (фосфолипидных «хвостов») исследовали флюоресценцию зонда 1,6-дифенил-1,3,5-гексатриена, который позволяет проанализировать состояние гидрофобного углеводородного слоя плазматических мембран клеток. Установлено снижение гидрофобности жирных кислот ФЛ мембран после воздействия плазмой искрового разряда длительностью 600 и 1200 с на 56,3 и 68,5% соответственно (см. рисунок).
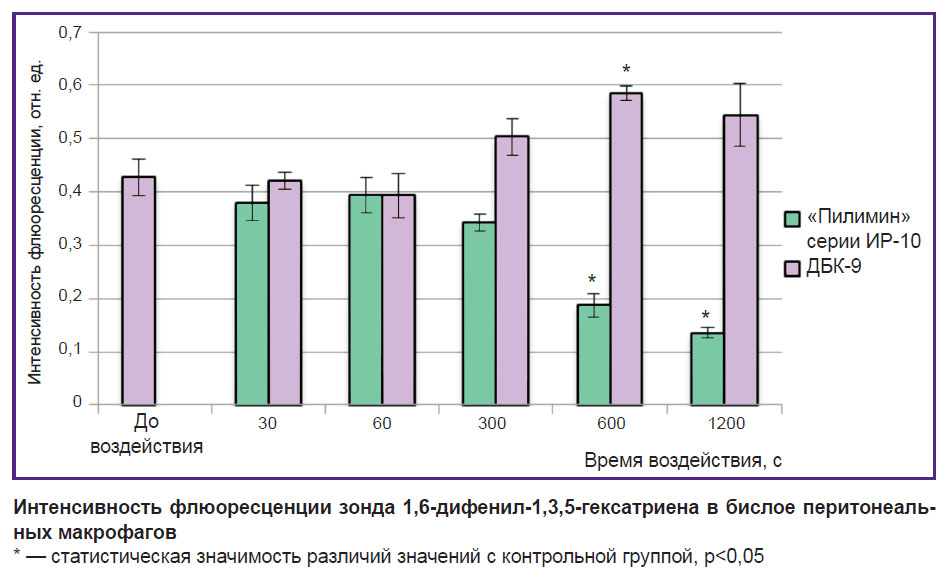
|
Интенсивность флюоресценции зонда 1,6-дифенил-1,3,5-гексатриена в бислое перитонеальных макрофагов * — статистическая значимость различий значений с контрольной группой, p<0,05 |
Известно, что зонд 1,6-дифенил-1,3,5-гексатриен располагается в гидрофобной зоне параллельно жирнокислотным цепям. Уменьшение гидрофобности может быть связано со снижением упорядоченности углеводородных «хвостов» ФЛ, образованием кластеров и динамических дефектов мембран, что приводит к увеличению неспецифической проницаемости клетки [19, 20].
После воздействия УФ-излучением кварцевой лампы наблюдается тенденция к увеличению гидрофобности мембран клеток при всех выбранных режимах воздействия. При режиме воздействия длительностью 600 с установлено статистически значимое возрастание гидрофобности на 36,7%. Увеличение гидрофобности может указывать на уплотнение фосфолипидного бислоя и снижение проницаемости мембраны [19, 20].
Излучение плазмы искрового разряда и УФ-излучение кварцевой лампы приводят к разнонаправленным изменениям гидрофобности жирных кислот ФЛ. Излучение газоразрядной плазмы снижает, а излучение кварцевой лампы увеличивает гидрофобность мембран, что может быть связано, во-первых, с различными механизмами действия используемых факторов, а во-вторых, известно, что излучение плазмы искрового разряда является импульсным и в 400 раз менее интенсивно, чем УФ-излучение кварцевой лампы [17].
Известно, что цитоплазматическая мембрана играет ключевую роль в детерминации нормального функционирования как отдельных клеточных органелл, так и клетки в целом. Изменения в структурных компонентах мембран можно назвать регуляторными, так как они определяют функциональное состояние клеток. Наблюдаемые перестройки в липидном спектре перитонеальных макрофагов, повышение микровязкости и изменения гидрофобности мембран могут приводить как к ограничению, так и к увеличению функциональных возможностей клеток [2, 15].
Функциональное состояние перитонеальных макрофагов. После обработки перитонеальных макрофагов плазмой искрового разряда в течение 60 с установлено статистически значимое возрастание фагоцитарного индекса на 8,3% (табл. 3). А при режиме воздействия длительностью 600 с наблюдается возрастание фагоцитарного числа на 8,8%. Повышение фагоцитарного индекса свидетельствует об увеличении количества клеток, принимающих участие в фагоцитозе, а возрастание фагоцитарного числа — о большей поглотительной способности [1].
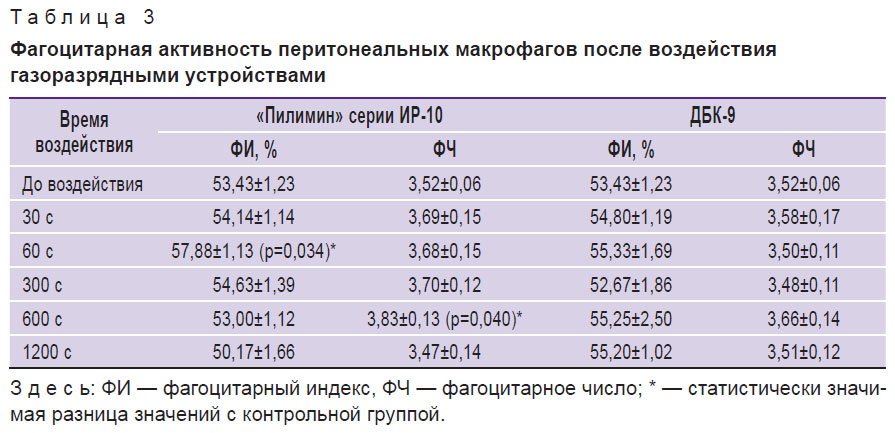
|
Таблица 3. Фагоцитарная активность перитонеальных макрофагов после воздействия газоразрядными устройствами |
При изучении показателей метаболической активности макрофагов наблюдается активация кислородзависимого метаболизма клеток после воздействия излучением искрового разряда длительностью 300 с (табл. 4). Интенсивность генерации клетками активных форм кислорода в основном определяется активностью NADPH-оксидазы, которая зависит от концентрации стимулирующего фактора и времени стимуляции [21]. УФ-излучение кварцевой лампы не оказывало влияния на фагоцитарную активность и состояние кислородзависимого метаболизма перитонеальных макрофагов.
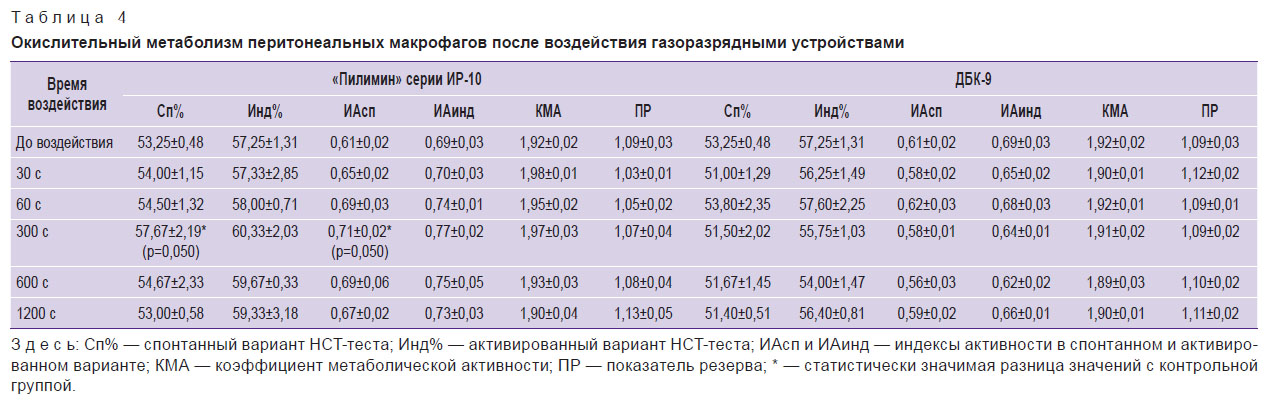
|
Таблица 4. Окислительный метаболизм перитонеальных макрофагов после воздействия газоразрядными устройствами |
При оценке фагоцитарной активности с помощью НСТ-теста возможно зафиксировать только поглотительную способность клеток и способность продуцировать супероксидный анион-радикал, поэтому на следующем этапе была исследована люминолзависимая хемилюминесценция клеток, которая позволяет оценить образование клетками активных форм кислорода, включая супероксидный анион-радикал, гидроксильный радикал, синглетный кислород, гипохлорид и общее функциональное состояние фагоцитов. В эксперименте установлено статистически значимое возрастание уровня спонтанной хемилюминесценции после воздействия плазмой искрового разряда в течение 60 и 300 с на 65,3 и 116,5% соответственно (табл. 5). При режимах воздействия длительностью 600 и 1200 с наблюдается тенденция к снижению уровня спонтанной хемилюминесценции. Отсутствует ярко выраженный пик, но время наступления максимального уровня сокращается на 70,7 и 74,6%. При воздействии УФ-излучением кварцевой лампы установлено возрастание уровня спонтанной хемилюминесценции на 62,9–74,7% при режимах воздействия длительностью 300, 600 и 1200 с. Время наступления максимального уровня хемилюминесценции увеличивается при воздействии в течение 1200 с на 29,6%. Люминолзависимая хемилюминесценция отражает активацию макрофагов, которая обусловлена взаимодействием клеток с образовавшимися в результате излучения активными формами кислорода. Считается, что фотобиологические эффекты реализуются через каскад окислительных реакций, а окислительный стресс небольшой интенсивности выполняет регуляторную функцию [22, 23].
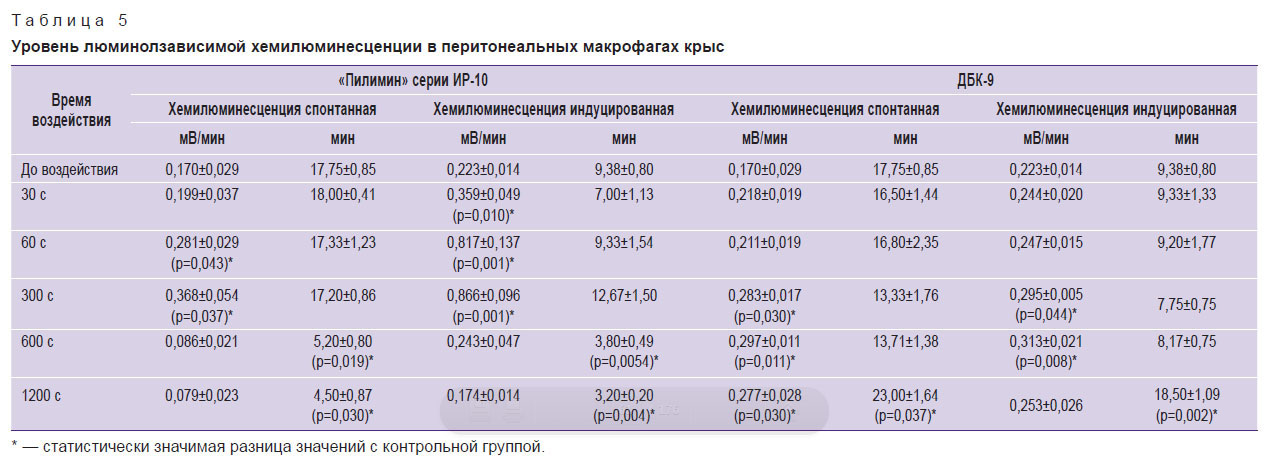
|
Таблица 5. Уровень люминолзависимой хемилюминесценции в перитонеальных макрофагах крыс |
Для оценки потенциальной способности клеток отвечать на стимуляцию был исследован уровень индуцированной хемилюминесценции. Установлено, что режимы воздействия плазмой искрового разряда в течение 30, 60 и 300 с способствуют активации хемилюминесценции в 1,6–3,9 раза. После обработки перитонеальных макрофагов УФ-излучением кварцевой лампы длительностью 300 и 600 с отмечено возрастание индуцированной хемилюминесценции в 1,3 и 1,4 раза соответственно. Показано, что излучение плазмы искрового разряда снижает время наступления максимального уровня хемилюминесценции, т.е. время наступления «кислородного взрыва», тогда как УФ-излучение кварцевой лампы увеличивает время реакции как в спонтанном, так и в индуцированном варианте теста.
Таким образом, при воздействии излучением плазмы искрового разряда менее интенсивно происходит окисление ФЛ. Микровязкость мембран в области липид-липидных и белок-липидных контактов в большей степени увеличивается после воздействия УФ-излучением кварцевой лампы. Излучение плазмы искрового разряда приводит к снижению, а УФ-излучение кварцевой лампы — к увеличению гидрофобности жирных кислот ФЛ. Воздействие излучением плазмы искрового разряда в отличие от УФ-излучения кварцевой лампы вызывает увеличение количества клеток, принимающих участие в фагоцитозе, возрастание поглотительной способности и кислородзависимого метаболизма перитонеальных макрофагов. Период наступления «кислородного взрыва» макрофагов сокращается после воздействия излучением плазмы, а после воздействия УФ-излучением кварцевой лампы — увеличивается.
Заключение. Излучение плазмы искрового разряда по сравнению с УФ-излучением кварцевой лампы способствует активации фагоцитарной активности перитонеальных макрофагов при менее длительных режимах, наблюдаемые эффекты более выражены. Данные исследования позволяют выявить оптимальные режимы функциональной активности клеток после газоразрядного воздействия.
Финансирование исследования и конфликт интересов. Исследование не финансировалось какими-либо источниками, и конфликты интересов, связанные с данным исследованием, отсутствуют.
Литература
- Лямина С.В., Малышев И.Ю. Поляризация макрофагов в современной концепции формирования иммунного ответа. Фундаментальные исследования 2014; 10(5): 930–935.
- Артюхов В.Г., Башарина О.В., Зимченкова О.В., Рязанцев С.В. Влияние УФ-света на субпопуляционный состав и экспрессию мембранных маркеров лимфоцитов крови человека. Радиационная биология. Радиоэкология 2016; 56(1): 73–81, https://doi.org/10.7868/s086980311506003x.
- Köberlin M.S., Heinz L.X., Superti-Furga G. Functional crosstalk between membrane lipids and TLR biology. Curr Opin Cell Biol 2016; 39: 28–36, https://doi.org/10.1016/j.ceb.2016.01.010.
- Sasai Y., Kondo S., Yamauchi Y., Kuzuya M. Plasma surface modification of polymer substrate for cell adhesion control. J Photopolym Sci Technol 2010; 23(4): 595–598, https://doi.org/10.2494/photopolymer.23.595.
- Rupf S., Lehmann A., Hannig M., Schäfer B., Schubert A., Feldmann U., Schindler A. Killing of adherent oral microbes by a non-thermal atmospheric plasma jet. J Med Microbiol 2009; 59(2): 206–212, https://doi.org/10.1099/jmm.0.013714-0.
- Иванова И.П., Заславская М.И. Биоцидный эффект некогерентного импульсного излучения искрового разряда в экспериментах in vitro и in vivo. Современные технологии в медицине 2009; 1: 28–31.
- Архипова Е.В., Иванова И.П. Воздействие некогерентного импульсного излучения на функциональное состояние мононуклеарных клеток в эксперименте. Современные технологии в медицине 2013; 5(1): 27–31.
- Архипова Е.В., Иванова И.П. Микровязкость и перекисное окисление липидов перитонеальных макрофагов после воздействия УФ-излучения и излучения газоразрядной плазмы. Медицинский академический журнал 2016; 16(4): 46–47.
- Трофимова С.В., Бурхина О.Е., Пискарев И.М., Ичеткина А.А., Соловьева Т.И., Астафьева К.А., Пугина Е.С., Иванова И.П. Влияние излучения газоразрядной плазмы на модификацию белков эритроцитов. Современные технологии в медицине 2014; 6(3): 14–21.
- Иванова И.П., Трофимова С.В., Карпель Вель Лейтнер Н., Аристова Н.А., Архипова Е.В., Бурхина О.Е., Сысоева В.А., Пискарев И.М. Анализ активных продуктов излучения плазмы искрового разряда, определяющих биологические эффекты в клетках. Современные технологии в медицине 2012; 2: 20–30.
- Kanazawa S., Kawano H., Watanabe S., Furuki T., Akamine S., Ichiki R., Ohkubo T., Kocik M., Mizeraczyk J. Observation of OH radicals produced by pulsed discharges on the surface of a liquid. Plasma Sources Sci Technol 2011; 20(3): 034010, https://doi.org/10.1088/0963-0252/20/3/034010.
- Творогова М.Г., Исаева Е.Л., Проказова Н.В., Рожкова Т.А., Кухарчук В.В., Титов В.Н. Определение липидного состава липопротеидов высокой плотности методом тонкослойной хроматографии на силикагеле. Клиническая лабораторная диагностика 1998; 4: 13–16.
- Самойлова А.А. Измерение микровязкости мембран эритроцитов методом латеральной диффузии гидрофобного зонда пирена. Метод. Разработка. Красноярск: Краснояр. гос. ун-т; 2006.
- Ranall M., Gabrielli B., Gonda T. High-content imaging of neutral lipid droplets with 1,6-diphenylhexatriene. Biotechniques 2011; 51(1), https://doi.org/10.2144/000113702.
- Киселев О.И., Сергеева И.В., Сологуб Т.В., Тихонова Е.П., Булыгин Г.В. Структурно-метаболические характеристики клеток и их функциональные возможности. Эпидемиология и инфекционные болезни 2015; 20(5): 52–56.
- Есимова И.Е., Новицкий В.В., Уразова О.И., Хасанова Р.Р., Кошкина А.А., Чурина Е.Г. Причины дисрегуляции иммунного ответа при туберкулезе легких: роль нарушений исходного состояния иммунологической реактивности организма. Бюллетень сибирской медицины 2012; 11(4): 93–98.
- Piskarev I.M., Ivanova I.P., Trofimova S.V. Comparison of chemical effects of UV radiation from spark discharge in air and a low-pressure mercury lamp. High Energy Chem 2013; 47(5): 247–250, https://doi.org/10.1134/s0018143913050093.
- Реброва Т.Ю., Афанасьев С.А., Путрова О.Д., Попов С.В. Возрастзависимые особенности микровязкости мембран эритроцитов при экспериментальном кардиосклерозе. Успехи геронтологии 2012; 25(4): 644–647.
- Loura L.M.S., Ramalho J.P.P. Recent developments in molecular dynamics simulations of fluorescent membrane probes. Molecules 2011; 16(12): 5437–5452, https://doi.org/10.3390/molecules16075437.
- do Canto A.M., Robalo J.R., Santos P.D., Carvalho A.J., Ramalho J.P., Loura L.M. Diphenylhexatriene membrane probes DPH and TMA-DPH: a comparative molecular dynamics simulation study. Biochim Biophys Acta 2016; 1858(11): 2647–2661, https://doi.org/10.1016/j.bbamem.2016.07.013.
- Sheppard F.R., Kelher M.R., Moore E.E., McLaughlin N.J., Banerjee A., Silliman C.C. Structural organization of the neutrophil NADPH oxidase: phosphorylation and translocation during priming and activation. J Leukoc Biol 2005; 78(5): 1025–1042.
- Gamaley I.A., Klyubin I.V. Roles of reactive oxygen species: signaling and regulation of cellular functions. Int Rev Cytol 1999; 203–255, https://doi.org/10.1016/s0074-7696(08)61568-5.
- Hattori H., Subramanian K.K., Sakai J., Jia Y., Li Y., Porter T.F., Loison F., Sarraj B., Kasorn A., Jo H., Blanchard C., Zirkle D., McDonald D., Pai S.Y., Serhan C.N., Luo H.R. Small-molecule screen identifies reactive oxygen species as key regulators of neutrophil chemotaxis. Proc Natl Acad Sci USA 2010; 107(8): 3546–3551, https://doi.org/10.1073/pnas.0914351107.










