Молекулярное типирование уропатогенных штаммов Escherichia сoli, выделенных у пациентов с использованием метода REP-ПЦР 71
Цель исследования — определить взаимосвязь между генетическими паттернами и штаммами Escherichia coli (E. coli) и оценить генетическое многообразие штаммов E. coli, выделенных у пациентов, поступивших в стационар Бакияталлах (Тегеран), с использованием метода полимеразной цепной реакции, основанного на амплификации повторяющихся последовательностей (REP-ПЦР).
Материалы и методы. Исследовано 100 штаммов E. coli в образцах от пациентов с инфекциями мочевыводящих путей. Штаммы E. coli обнаружили и выделили стандартными бактериологическими способами и извлекли их ДНК. Для типирования выделенных штаммов использовали метод REP-ПЦР с применением праймера REP1R.
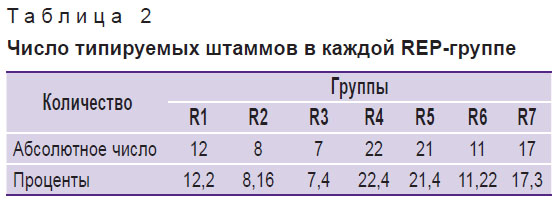
Результаты. Из 100 штаммов E. coli 98 оказались типируемыми и 2 — нетипируемыми. Анализ дендрограммы показал, что в ходе REP-ПЦР выделяется 7 REP-групп (R1–R7) дифференцированных штаммов с 70-процентной идентичностью. Наибольшее количество штаммов было обнаружено в группе R4 (22 штамма) и наименьшее — в группе R3 (7 штаммов).
Заключение. В Иране метод REP-ПЦР ранее не использовался для изучения уропатогенных штаммов E. Coli. В нашем исследовании данный метод проявил высокую дифференциальную точность. Обнаружено, что штаммы E. coli состоят из различных клонов, что свидетельствует о генетическом разнообразии бактерий у обследованных пациентов.
Инфекции мочевыводящих путей (ИМП) — это наиболее распространенные бактериальные инфекции, которые чаще встречаются у женщин всех возрастных групп и характеризуются бактериальной колонизацией мочевой системы. Штаммы уропатогенных Escherichia coli (E. coli) — наиболее распространенные инфекционные агенты, которые выявляются при ИМП, и их источником часто становится флора кишечника. Наиболее распространенный симптом ИМП — дизурия, форма которой может быть умеренной или тяжелой [1, 2]. Помимо наиболее распространенных симптомов инфекций нижних мочевыводящих путей пациенты с заболеваниями верхних отделов этих путей или пиелонефритом могут испытывать почечные колики, повышение температуры или тошноту и рвоту [1]. Доля E. coli в структуре всех ИМП составляет 80–90%; в остальных случаях возбудителями являются Staphylococcus saprophyticus, Citrobacter, Klebsiella, и Enterobacter [3]. E. coli образует пурпурные колонии на культуральной среде Мак-Конки, так как это лактозоположительная бактерия, которая ферментирует сахарозу, образуя кислоту. Этот же процесс происходит на культуральной среде ЭМС (агар с эозином и метиленовым синим), в которой E. coli образует темно-пурпурные колонии с зеленым металлическим блеском. Условно-патогенные разновидности E. coli в составе нормальной флоры кишечника обычно безопасны для организма и вызывают заболевание только у пациентов с ослабленным иммунитетом. Однако некоторые виды E. coli — это потенциальные высокопатогенные микроорганизмы, которые становятся возбудителями заболевания при приобретении свойств вирулентности [4].
При различных заболеваниях человека, вызванных E. coli, патогенные бактерии общепринято подразделять на две основные категории: диареегенные E. coli и внекишечные патогенные E. coli, которые представлены двумя основными патогенами, уропатогенными E. coli и E. coli менингита новорожденных. Внекишечные бактерии могут образовывать колонии различной локализации и вызывать инфекционные воспаления вне желудочно-кишечного тракта, при этом чаще всего возбудитель поражает мочевыводящие пути [5, 6]. Уропатогенные E. coli кодируют различные адгезивные структуры, так называемые пили и фимбрии, такие как F1C, S, P, и семейство адгезивных белков Dr [7]. Фимбрии играют важную роль в прикреплении бактерий на слизистой оболочке пищеварительного тракта, влагалища и уретры. Другие факторы, такие как бактериальные липополисахариды, капсулы, гемолизин и сидерофоры, усиливают вирулентность уропатогенных E. coli [8–10]. Один штамм таких бактерий может содержать несколько различных типов пилей и изменять один тип на другой в зависимости от условий окружающей среды. Добравшись до мочевыводящих путей, уропатогенные E. coliсвязываются в первую очередь с эпителиальными клетками организма, используя пили и фимбрии, чтобы избежать вымывания потоком мочи [11].
Молекулярное типирование применяется для выявления нозокомиальных инфекций и их источников, а также выделения специфических генотипов при конъюгации с конкретной бактерией. Этот метод расширяет границы наших знаний о принципах эпидемиологии, эволюции и распространения многих бактериальных заболеваний [12–15]. Повторяющаяся экстрагенная палиндромная последовательность (REP), первоначально обнаруженная в Salmonella typhimurium и E. coli, является повторяющейся последовательностью 39 п. н. и может повторяться до 282 раз в геноме E. coli. По всей вероятности, эти последовательности регулируют экспрессию генов посредством контролирования стабильности мРНК [16]. Метод REP-ПЦР основывается на том, что области, расположенные между повторяющимися сегментами, имеют различные размеры, поэтому создают различные паттерны при ПЦР и электрофорезе и штаммы можно легко дифференцировать и распознать, сравнив эти паттерны [17].
Преимущество данного метода заключается в отсутствии необходимости знания целевой последовательности синтеза праймеров для большинства бактерий. Из-за высокой воспроизводимости и дифференциальных возможностей такая технология в настоящее время считается оптимальным методом эпидемиологического исследования большинства бактерий наряду с градиентным электрофорезом в пульсирующем поле. Таким образом, технология REP-ПЦР — это быстрый доступный полуавтоматизированный способ молекулярного типирования, основанный на ПЦР, не сложный в применении для молекулярного технолога с некоторым опытом [18].
Бесспорным преимуществом технологии REP-ПЦР является то, что данный метод можно использовать для изучения многих грамотрицательных и некоторых грамположительных бактерий при отсутствии какой-либо информации о бактериальном геноме [19]. Кроме того, он надежен по сравнению с неточными и трудоемкими фенотипическими и биохимическими методами. Его преимущества — это легкость и быстрота осуществления, высокая дифференциальная точность, а также возможность применения в любой лаборатории. REP-ПЦР можно использовать с биомаркерами, такими как (GTG)5, REP1R-I и REP2R-I [20].
Цель исследования — определить молекулярные типы уропатогенных E. coli как одного из основных возбудителей инфекций мочевыводящих путей методом REP-ПЦР с использованием праймера REP1R.
Материалы и методы. Данное перекрестное исследование выполнялось в 2014 г. с участием пациентов с ИМП, поступивших в стационар Бакияталлах в Тегеране. Исследование проведено в соответствии с Хельсинкской декларацией, принятой в июне 1964 г. (Хельсинки, Финляндия) и пересмотренной в октябре 2000 г. (Эдинбург, Шотландия), и одобрено Baqiyatallah University of Medical Sciences. От каждого пациента получено информированное согласие.
Образцы культивировали на хромогенной агаровой культуральной среде и выдерживали в термостате в течение 24 ч. Если вырастали фиолетовые колонии, присутствие E. coli подтверждалось путем пересева колонии на агаровую среду ЭМС и культивирования в инкубаторе при 37°C в течение 18 ч. Колонии с зеленым металлическим блеском указывали на присутствие E. coli и подвергались дальнейшему изучению. Проводили пересев всех колоний из культуральной среды ЭМС на среду, обогащенную бульоном Лурия–Бертани, и выдерживали во встряхивающем инкубаторе в течение 18–24 ч. Затем очищали ДНК методом выварки. Полученный геномный раствор использовали непосредственно для ПЦР или хранили при 4°C для последующих тестов. Для длительного хранения полученный раствор следует хранить при –20°C, так как ДНК может подвергаться кислотному гидролизу.
После контроля чистоты ДНК с использованием анализатора NanoDrop (Thermo Fisher Scientific, США) и подтверждения ее пригодности для проведения ПЦР извлеченную ДНК подготавливали к ПЦР. Реакционная смесь содержала 1 мкл матричной ДНК, 2 мкл праймера REP1R, 1 мкл MgCl2, 6 мкл деионизированной дистиллированной воды и 10 мкл основной смеси (мастер-микс) в суммарном объеме 20 мкл. Амплификацию ПЦР выполняли в градиентном термоциклере Эппендорфа (Eppendorf, Германия), она состояла из первоначальной денатурации при 95°C в течение 7 мин и последующих 32 циклов, включающих денатурацию (1 мин при 95°C), отжиг (1 мин при 41°C), элонгацию (3 мин при 65°C) и фазу окончательной элонгации в течение 16 мин при 65°C. Для визуализации продуктов амплификации ПЦР 5 мкл полученного в итоге раствора смешивали с 1 мкл загрузочного буфера и выполняли электрофорез на 1,5% агарозном геле при напряжении 90 В в течение 70 мин. «Лестница» ДНК длиной 100 п. н. использовалась в качестве молекулярного стандарта для контроля соответствующих участков REP. Гель окрашивали бромидом этидия в течение 12 мин, и участки становились видимыми при ультрафиолетовом свете. Полосы REP-PCR были выражены в виде 0 и 1 для обозначения отсутствия и присутствия полос соответственно. Матрицу из цифр 0 и 1 выполнили в Excel и построили соответствующую дендрограмму, используя веб-сайт компьютерного моделирования.
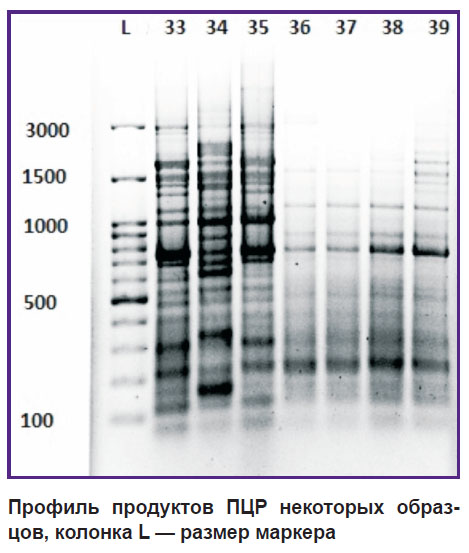
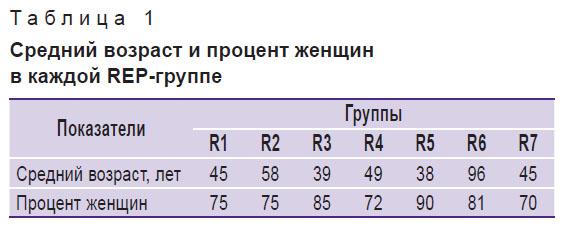
Результаты. В настоящем исследовании в общей сложности было изучено 100 штаммов E. coli, выделенных у пациентов с ИМП. Из них 98 штаммов оказались типируемыми и 2 — нетипируемыми. Семнадцать полос в пределах от 100 до 3100 п. н. были амплифицированы в различных профилях (см. рисунок). Анализ дендрограммы показал, что изоляты разделяются путем REP-ПЦР на 7 REP-групп (R1–R7) с идентичностью в 70%. Из 100 пациентов с ИМП в данном исследовании 79 были женщины и 21 — мужчины, и подобное преобладание отмечалось в различных возрастных группах. Следует отметить, что анализ процентного соотношения женщин и среднего возраста пациентов с точки зрения выделения штаммов показал, что самый высокий процент женщин и самое низкое значение среднего возраста были в REP-группе R5 (табл. 1).
|
Профиль продуктов ПЦР некоторых образцов, колонка L — размер маркера |
|
Таблица 1. Средний возраст и процент женщин в каждой REP-группе |
Обсуждение. Уропатогенные E. Coli являются преобладающими бактериями, вызывающими ИМП, особенно у женщин. ИМП — одно из инфекционных заболеваний человека, на распространение которого влияют пол и возраст [2, 21]. REP-ПЦР выявляет структуры ДНК и фактически позволяет дифференцировать разновидности бактерий [22–23], делая данный метод актуальным для типирования различных микрооганизмов [23]. Некодирующие рассеянные повторяющиеся последовательности преобладают среди грамотрицательных бактерий [24]. Предыдущие исследования с применением REP-ПЦР показали наличие повторяющихся элементов ДНК в E. coli. Четыре случая ИМП из 100 изученных образцов в нашем исследовании отмечались у новорожденных девочек. Фактически ИМП среди новорожденных встречается в 0,1 случая. На протяжении первых двух месяцев жизни ИМП чаще отмечается среди мальчиков, но начиная со 2-го месяца жизни и во взрослом возрасте ИМП более распространены среди женщин. Однако из 100 изученных образцов ни один не принадлежал младенцу с ИМП мужского пола. Пять случаев инфекции были замечены среди девочек возрастом от одного до десяти лет, причина заболевания — короткая уретра, несоблюдение режима личной гигиены и несвоевременное опорожнение мочевого пузыря. У мальчиков обрезание снижает риск ИМП. Риск данного заболевания также снижается в пубертатном периоде. В нашем исследовании только два случая инфекции наблюдались среди девочек-подростков. Частота возникновения ИМП существенно возрастает среди молодых женщин из-за сексуальных отношений, беременности или применения противозачаточных средств. В данном исследовании зарегистрировано 22 случая ИМП в возрастном диапазоне 20–25 лет. После менопаузы число ИМП может возрасти из-за дефицита эстрогенов.
С учетом информации о полиморфизме ДНК мы изучили полиморфизм штаммов E. coli с использованием праймера REP1R, который обеспечивает достаточную точность дифференциации полиморфизмов разновидностей с высокой степенью сходства. Вследствие высокой точности дифференциации согласно дендрограмме изоляты были распределены по 7 группам со сходством структуры генома на 70% (табл. 2). В соответствии с выполненным распределением по кластерам наибольшее количество штаммов было обнаружено в группе R4 (22 штамма), а наименьшее — в группе R3 (7 штаммов). Группа R4 состояла из 22 штаммов и была самой большой группой изолятов, а штаммы 65 и 95, 57 и 60, 58 и 59 обладали сходством структуры генома более чем на 70%. Штаммы 65 и 95 в группе R4 обладали идентичной структурой генома, принадлежали одному и тому же человеку и содержались в пробах, взятых в разное время, указывая на рецидивирующую инфекцию, вызванную штаммом. Данные результаты демонстрируют точность метода. В группе R5 (21 штамм) штаммы 73 и 74 обладали сходством структуры генома более чем на 70%, и между штаммами 41, 43, 44, 45 и 46 в группе R7 (17 штаммов) также отмечалось сходство более чем на 70%. В группах R1 (12 штаммов), R2 (8 штаммов), R3 (7 штаммов) — группы с наименьшей популяцией и в группе R6 (11 штаммов) не отмечалось сходства структуры генома.
|
Таблица 2. Число типируемых штаммов в каждой REP-группе |
Полоса 100 п. н. была самой частой полосой и наблюдалась в 90% штаммов, а полосы 700 и 800 п. н. отмечались поочередно среди изолятов. Примечательно, что анализ процентного соотношения женщин и среднего возраста пациентов с точки зрения штаммов показал, что из всех групп самый высокий процент женщин и самое низкое значение среднего возраста было в группе R5. Сравнение данных антибиограммы с данными дендрограммы позволило получить примечательные результаты. Все образцы в группе R2 были стойкими к ампициллину и чувствительными к нитрофурантоину, все образцы в группе R3 — чувствительны к нитрофурантоину, большинство образцов в группе R5 — чувствительны или получувствительны к амикацину и все образцы в группе R6 — чувствительны к нитрофурантоину.
Высокая частота возникновения ИМП обусловливает необходимость определения в данном исследовании чувствительности и относительной резистентности болезнетворных бактерий к антибиотикам. Правильное использование антибиотиков и идентификация устойчивости бактерий, выделенных при ИМП, могут играть важную роль в лечении заболевания и его опасных последствий. Метод REP-ПЦР уже используется для оценки резистентности E. coli к антибиотикам. Например, M. Rashid и соавт. [25] применили этот метод для изучения резистентности бета-лактамаз расширенного спектра к бета-лактамным антибиотикам и определения их продуцентов на уровне генотипа. Ранее метод нашел широкое применение в диагностических целях. Так, S.L. McLellan и соавт. [26] с использованием молекулярного метода REP-ПЦР изучили E. coli, выделенные из проб, взятых в источниках фекального загрязнения, и определили генетические отношения между штаммами в каждой группе носителей. Исследование показало, что молекулярный метод REP-ПЦР более точен и эффективен, чем ДНК-фингерпринтинг (метод генетических «отпечатков пальцев») E. coli фекалий животного или человека. Многие другие зарубежные исследования различных штаммов E. coli также проводились с применением данного метода. В Иране число подобных исследований пока ограничено. ИМП — типичная проблема среди женского населения, и потребуются дальнейшие исследования с большим объемом выборки для ее эффективного решения, при этом следует принять во внимание роль других факторов, влияющих на развитие данного заболевания.
Заключение. Результаты настоящего исследования показали, что REP-ПЦР — надежный метод классификации, молекулярного генотипирования и определения филогенетических взаимоотношений между близкородственными разновидностями микроорганизмов и даже между отдельными (не смешивающимися с другими видами) бактериальными разновидностями. Использование этого метода с высокой точностью позволило определить, что бактерии E. coli, изученные в данном исследовании, состоят из различных отдельных клонов, и тем самым выявить разнообразие бактерий у обследованных пациентов.
Научный вклад авторов в исследование. Все авторы в равной мере принимали участие в данной работе. Все авторы перечитали и утвердили окончательный вариант рукописи.
Конфликт интересов. Конфликты интересов, связанные с данным исследованием, отсутствуют.
Литература
- Lane D.R., Takhar S.S. Diagnosis and management of urinary tract infection and pyelonephritis. Emerg Med Clin North Am 2011; 29(3): 539–552, https://doi.org/10.1016/j.emc.2011.04.001.
- Tajbakhsh E., Tajbakhsh S., Khamesipour F. Isolation and molecular detection of gram negative bacteria causing urinary tract infection in patients referred to Shahrekord Hospitals of Iran. Iran Red Crescent Med J 2015; 17(5): 17(5): e24779, https://doi.org/10.5812/ircmj.17(5)2015.24779.
- Mead P.S., Slutsker L., Dietz V., McCaig L.F., Bresee J.S., Shapiro C., Griffin P.M., Tauxe R.V. Food-related illness and death in the United States. Emerg Infect Dis 1999; 5(5): 607–625, https://doi.org/10.3201/eid0505.990502.
- Tajbakhsh E., Khamesipour F., Ranjbar R., Ugwu I.C. Prevalence of class 1 and 2 integrons in multi-drug resistant Escherichia coli isolated from aquaculture water in Chaharmahal Va Bakhtiari province, Iran. Ann Clin Microbiol Antimicrob 2015; 14(1): 37, https://doi.org/10.1186/s12941-015-0096-y.
- Johnson J.R., Russo T.A. Extraintestinal pathogenic Escherichia coli: “the other bad E. coli”. J Lab Clin Med 2002; 139(3): 155–162, https://doi.org/10.1067/mlc.2002.121550.
- Ranjbar R., Pezeshknejad P., Khamesipour F., Amini K., Kheiri R. Genomic fingerprints of Escherichia coli strains isolated from surface water in Alborz province, Iran. BMC Research Notes 2017; 10(1): 295, https://doi.org/10.1186/s13104-017-2575-z.
- Snyder J.A., Haugen B.J., Lockatell C.V., Maroncle N., Hagan E.C., Johnson D.E., Welch R.A., Mobley H.L. Coordinate expression of fimbriae in uropathogenic Escherichia coli. Infect Immun 2005; 73(11): 7588–7596, https://doi.org/10.1128/iai.73.11.7588-7596.2005.
- Svanborg C., Godaly G. Bacterial virulence in urinary tract infection. Infect Dis Clin North Am 1997; 11(3): 513–529, https://doi.org/10.1016/s0891-5520(05)70371-8.
- Donnenberg M.S., Welch R.A. Virulence determinants of uropathogenic Escherichia coli. In: Mobley H.L.T., Warren J.W. (editors). Urinary tract infections: molecular pathogenesis and clinical management. Washington, DC, USA: ASM Press; 1996; p. 135–174.
- Foxman B., Zhang L., Palin K., Tallman P., Marrs C.F. Bacterial virulence characteristics of Escherichia coli isolates from first-time urinary tract infection. J Infect Dis 1995; 171(6): 1514–1521, https://doi.org/10.1093/infdis/171.6.1514.
- Dodson K.W., Pinkner J.S., Rose T., Magnusson G., Hultgren S.J., Waksman G. Structural basis of the interaction of the pyelonephritic E. coli adhesin to its human kidney receptor. Cell 2001; 105(6): 733–743, https://doi.org/10.1016/s0092-8674(01)00388-9.
- Li W., Raoult D., Fournier P.-E. Bacterial strain typing in the genomic era. FEMS Microbiol Rev 2009; 33(5): 892–916, https://doi.org/10.1111/j.1574-6976.2009.00182.x.
- Rahimi E., Khamesipour F., Yazdi F., Momtaz H. Isolation and characterization of enterohaemorragic Escherichia coli O157:H7 and EHEC O157:NM from raw bovine, camel, water buffalo, caprine and ovine milk in Iran. Kafkas Univ Vet Fak Derg 2012; 18: 559–564, https://doi.org/10.9775/kvfd.2011.5738.
- Hemmatinezhad B., Khamesipour F., Mohammadi M., Safarpoor Dehkordi F., Mashak Z. Microbiological investigation of O-serogroups, virulence factors and antimicrobial resistance properties of shiga toxin-producing Escherichia coli isolated from ostrich, turkey and quail meats. J Food Saf 2015; 35(4): 491–500, https://doi.org/10.1111/jfs.12199.
- Ranjbar R., Hosseini S., Zahraei-Salehi T., Kheiri R., Khamesipour F. Investigation on prevalence of Escherichia coli strains carrying virulence genes ipaH, estA, eaeA and bfpA isolated from different water sources. Asian Pac J Trop Dis 2016; 6(4): 278–283, https://doi.org/10.1016/s2222-1808(15)61031-3.
- Versalovic J., Lupski J.R. Interspersed repetitive sequences in bacterial genomes. In: de Bruijn F.J., Lupski J.R., Weinstock G.M. (editors). Bacterial genomes. Springer US; 1998; p. 38–48, https://doi.org/10.1007/978-1-4615-6369-3_5.
- Molecular typing in bacterial infections. de Filippis I., McKee M.L. (editors). Humana Press; 2013, https://doi.org/10.1007/978-1-62703-185-1.
- Pitout J.D., Campbell L., Church D.L., Wang P.W., Guttman D.S., Gregson D.B. Using a commercial diversilab semiautomated repetitive sequence-based PCR typing technique for identification of Escherichia coli clone ST131 producing CTX-M-15. J Clin Microbiol 2009; 47(4): 1212–1215, https://doi.org/10.1128/jcm.02265-08.
- Rademaker J.L.W., Louws F.J., de Bruijn F.J. Characterization of the diversity of ecologically important microbes by rep-PCR genomic fingerprinting. In: Akkermans A.D.L., van Elsas J.D., de Bruijn F.J. (editors). Molecular microbial ecology manual. Suppl. 3, Chap. 343. Dordrecht: Kluwer Academic Publishers; 1998; p. 1–26.
- Tafvizi F., Tajabadi Ebrahimi M. Application of repetitive extragenic palindromic elements based on PCR in detection of genetic relationship of lactic acid bacteria species isolated from traditional fermented food products. J Agr Sci Tech 2015; 17: 87–98.
- Rosen D.A., Hooton T.M., Stamm W.E., Humphrey P.A., Hultgren S.J. Detection of intracellular bacterial communities in human urinary tract infection. PLoS Med 2007; 4(12): e329, https://doi.org/10.1371/journal.pmed.0040329.
- Olive D.M., Bean P. Principles and applications of methods for DNA-based typing of microbial organisms. J Clin Microbiol 1999; 37(6): 1661–1669.
- Elias W.P., Uber A.P., Tomita S.K., Trabulsi L.R., Gomes T.A. Combinations of putative virulence markers in typical and variant enteroaggregative Escherichia coli strains from children with and without diarrhoea. Epidemiol Infect 2002; 129(1): 49–55, https://doi.org/10.1017/s0950268802007136.
- Woods C.R., Versalovic J., Koeuth T., Lupski J.R. Whole-cell repetitive element sequence-based polymerase chain reaction allows rapid assessment of clonal relationships of bacterial isolates. J Clin Microbiol 1993; 31(7): 1927–1931.
- Rashid M., Rakib M.M., Hasan B. Antimicrobial-resistant and ESBL-producing Escherichia coli in different ecological niches in Bangladesh. Infect Ecol Epidemiol 2015; 5: 26712, https://doi.org/10.3402/iee.v5.26712.
- McLellan S.L., Daniels A.D., Salmore A.K. Genetic characterization of Escherichia coli populations from host sources of fecal pollution by using DNA Fingerprinting. Appl Environ Microbiol 2003; 69(5): 2587–2594, https://doi.org/10.1128/aem.69.5.2587-2594.2003.










