Метод ДНК-комет в оценке уровня повреждения ДНК лейкоцитов крови после фотодинамической терапии
Цель исследования — изучить методом ДНК-комет спонтанный уровень повреждений ДНК в лейкоцитах цельной крови животных-опухоленосителей после фотодинамической терапии (ФДТ) при локальном введении фотосенсибилизатора.
Материалы и методы. Эксперименты проведены на 30 белых нелинейных крысах-самцах. В качестве модели неоплазии выбран штамм — карцинома почки крыс РА. Животные были разделены на три группы: интактные (n=10), без воздействия (n=10) и ФДТ (n=10), при этом в каждой группе выделены две подгруппы в зависимости от исходных объемов опухоли: А — менее 0,3 см3 и Б — более 0,5 см3.
При ФДТ интратуморально вводили 0,3% раствор препарата «Фотосенс» (ГНЦ «НИОПИК», Россия). Затем через 6–12 ч после инъекции в течение 10 мин воздействовали светодиодным лазером (λ=660±10 нм, P=100 мВт/см2). Всего было проведено 2 сеанса ФДТ на 15-е и 19-е сутки после перевивки.
Противоопухолевый эффект воздействия оценивали по коэффициенту абсолютного прироста опухоли.
Уровень повреждений ДНК определяли методом ДНК-комет в авторской модификации. Для оценки использовали параметр %ТДНК — содержание ДНК в «хвосте» кометы в процентах.
Результаты. Установлена прямая корреляционная зависимость между уровнем спонтанного повреждения ДНК и абсолютным коэффициентом прироста опухоли (коэффициент ранговой корреляции Спирменаrs=0,85; p=0,006). После сеансов ФДТ методом ДНК-комет установлен повышенный спонтанный уровень повреждений ДНК в лейкоцитах цельной крови животных-опухоленосителей в подгруппе с исходными объемами карциномы почки до 0,3 см3 и не обнаружено таких изменений в подгруппе с исходными объемами более 0,5 см3. ФДТ при локальном введении препарата «Фотосенс» в 50% случаев приводила к регрессии карциномы почки при исходных объемах опухоли как менее 0,3 см3, так и более 0,5 см3. У резистентных к терапии крыс наблюдалась стимуляция опухолевого роста при исходных объемах опухоли до 0,3 см3.
Заключение. Спонтанный уровень повреждений ДНК в лейкоцитах крови, регистрируемый щелочной версией метода ДНК-комет в авторской модификации, можно использовать для косвенной оценки интенсивности роста злокачественного новообразования и прогноза ответа опухоли на фотодинамическую терапию с локальным введением фотосенсибилизатора.
Фотодинамическая терапия (ФДТ) используется при лечении онкологических заболеваний кожи [1–3], пищевода [4, 5], легкого [6–8], нервной системы [9, 10], женских половых органов [11–13], билиарного тракта [14],опухолей головы и шеи [15–17]как самостоятельный метод и в качестве элемента комбинированного лечения, а также при паллиативной помощи. Однако существует целый ряд ограничений, таких как низкая генерация синглетного кислорода [18], небольшая глубина терапевтического воздействия на биоткань [19], кожная фототоксичность [20], которые сдерживают распространение ФДТ в клинической практике. Использование локального (внутритканевого) способа введения фотосенсибилизатора (ФС) в опухолевую ткань позволяет решить проблему фотодерматозов, а также исключает возможность накопления препарата в органах с высокой метаболической активностью, позволяет увеличить концентрацию ФС в опухоли без усиления кожной фототоксичности, снижает расход препарата и, соответственно, стоимость лечения. Разработки методики ФДТ с локальным введением отечественных ФС в опухоль ведутся в Медицинском радиологическом научном центре РАМН с 2000 г. [21–23].
Известно, что генерируемыми продуктами действия ФДТ с ФС являются активные формы кислорода, в частности синглетный кислород, который обладает цитотоксическим и мутагенным действием, повреждая органеллы клетки и ДНК [24–26].
Еще в 1997 г. на культурах опухолевых клеток различного генеза F.I. McNair с соавт. [27] было показано, что щелочная версия метода ДНК-комет может применяться в качестве эффективного скрининга для оценки повреждений ДНК, вызванных лазерной терапией различных длин волн, в частности ФДТ. Однако данный подход в клинической практике использовали лишь A.K. Haylett с соавт. [28] и M. Mozaffarieh [29].
В данной работе с помощью метода ДНК-комет предлагается оценить базовый уровень повреждения ДНК лейкоцитов цельной крови в условиях экспериментальной неоплазии после сеансов ФДТ с локальным введением ФС.
Цель исследования — изучить методом ДНК-комет спонтанный уровень повреждений ДНК в лейкоцитах цельной крови животных-опухоленосителей после фотодинамической терапии при локальном введении фотосенсибилизатора.
В процессе работы решали следующие задачи:
оценить спонтанный уровень повреждений ДНК в лейкоцитах цельной крови крыс в процессе роста опухолевого штамма — карциномы почки РА;
оценить уровень повреждений ДНК в лейкоцитах цельной крови организма-опухоленосителя после фотодинамической терапии при локальном введении ФС.
Материалы и методы. Эксперименты проведены на 30 аутбредных крысах-самцах SD (Sprague Dawley) массой 250±25 г на базе кафедры биологии Нижегородской государственной медицинской академии. Животные приобретены в питомнике «Пущино» и содержались в стандартных условиях вивария, получали полнорационный комбикорм производства компании «Лабораторкорм» (Москва) и водопроводную питьевую воду без ограничений.
Крыс выводили из эксперимента декапитацией под наркозом, все манипуляции проводили в полном соответствии с этическими принципами Европейской конвенции по защите позвоночных животных, используемых для экспериментальных и других научных целей (принятой в Страсбурге 18.03.1986 г. и подтвержденной в Страсбурге 15.06.2006 г.), а также в соответствии с нормативами, указанными в руководстве «Guide for the Care and Use of Laboratory Animals (ILAR publication, 1996, The National Academies Press)». Работа одобрена Этическим комитетом НижГМА.
Так как фотодинамическое воздействие наиболее эффективно при поверхностной локализации опухолевого очага, а в современных банках экспериментальных опухолей нет перевиваемого штамма опухолевого роста крысиной меланомы, в качестве модели неоплазии выбрана карцинома почки крыс (РА), создаваемая путем подкожной перевивки беспородным крысам. Эта солидная опухоль была получена путем введения 6-метилтиоурацила кастрированной крысе и находится в Банке опухолевых штаммов Национального медицинского исследовательского центра онкологии им. Н.Н. Блохина. Она относится к числу быстрорастущих с достаточно коротким инкубационным периодом, не превышающим 7–10 дней, — развитие опухоли полностью завершается к 26-му дню от момента перевивки. Карцинома РА характеризуется достаточно большой биомассой и высокой степенью перевиваемости [30].
На 9-е сутки после перевивки, когда карцинома почки крыс достигла контролируемых размеров (0,07–4,20 см3), животные были разделены на три экспериментальные группы: 1) интактные — здоровые животные (n=10); 2) без воздействия — животные-опухоленосители без лечения (n=10); 3) ФДТ — животные-опухоленосители, которым проводили фотодинамическое воздействие (n=10). При распределении на группы учитывали размеры сформировавшегося опухолевого очага, а также, для большей однородности, и поведенческие особенности животных с помощью теста «открытое поле» [31]. После разделения животных на группы в течение 5 сут контролировали рост опухоли.
В исследованиях по ФДТ [20] показана возможность различного ответа опухолевой ткани на фотодинамическое воздействие в зависимости от ее исходного размера. С учетом этого в каждой группе были выделены две подгруппы животных: подгруппа А с исходными объемами опухоли до 0,3 см3 и подгруппа Б с исходными объемами опухоли более 0,5 см3.
Для проведения фотодинамического воздействия использовали синтетический ФС второго поколения — гидроксиалюминия трисульфофталоцианин (препарат «Фотосенс»; ГНЦ «НИОПИК», Россия), который имеет максимум поглощения (676 нм) в спектральной области прозрачности биоткани, что позволяет воздействовать на более глубокие слои опухолевой ткани. Для введения ФС в опухолевую ткань применили локальный (внутритканевый) способ [21–23]: 0,3% раствор препарата вводили в три точки опухоли. Затем через 6–12 ч после инъекций препарата «Фотосенс» на каждую точку в течение 10 мин воздействовали светодиодным лазером с длиной волны 660±10 нм и плотностью мощности излучения 100 мВт/см2 (плотность энергии 60 Дж/см2). Параметры излучения соответствовали требованиям, предъявляемым в инструкции используемого ФС. В качестве светового источника применяли аппарат физиотерапевтический светодиодный АФС (ООО «Полироник», Россия). Всего провели 2 сеанса ФДТ — на 15-е и 19-е сутки после перевивки, что соответствовало периоду активного роста карциномы почки крыс РА. Объем опухоли измеряли на 10-е и 20-е сутки после перевивки, т.е. за 5 сут до первого сеанса ФДТ и через сутки после второго сеанса ФДТ соответственно. Наркотизированных эфиром животных выводили из эксперимента на 20-е сутки декапитацией.
Противоопухолевый эффект проводимой терапии оценивали по коэффициенту К абсолютного прироста объема V опухоли, который рассчитывали по формуле:
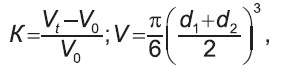
где: d1 и d2 — два взаимно перпендикулярных поперечных сечения опухоли, см; Vo — объем опухоли до воздействия, см3; Vt — объем опухоли на срок наблюдения, см3 [22].
Значения К>0 оценивали как продолженный рост опухоли, –1<К<0 — как торможение роста, К=–1 — как полную регрессию опухоли. Заключение о полной регрессии неоплазии делали при отсутствии видимого и пальпируемого очага [22].
Определение спонтанного уровня повреждений ДНК лейкоцитов цельной крови лабораторных животных проводили согласно протоколу метода ДНК-комет [32].
Изображения ДНК-комет фотографировали главным образом в центральной части слайдов, где кометы располагались в одной плоскости.
Фотографирование выполняли цифровой камерой серии DS, модель DS-Fi2 (Nikon Corporation, Япония), соединенной с прямым микроскопом Nikon Eclipse Ni-U (Nikon Corporation, Япония). Полученные изображения обрабатывали с помощью специализированного программного обеспечения Comet.exe, разработанного для регистрации и анализа отображений В.Н. Степановым [33]. Анализировали по 100 комет на стекло и из полученных данных с каждого слайда рассчитывали среднее значение для каждой экспериментальной точки. Для количественной оценки уровня повреждений ДНК использовали параметр %ТДНК — содержание ДНК в «хвосте» кометы, измеряемое отношением интенсивности флюоресценции в «хвосте» кометы к общей интенсивности флюоресценции кометы, выраженное в процентах [34]. Всего в эксперименте было приготовлено 60 слайдов на 30 стеклах.
Так как полученные данные не подчинялись нормальному распределению, для их описания использовали медиану (Ме) и интерпроцентильный размах (Ме [25%; 75%]), а обработку осуществляли методами непараметрической статистики. При статистической обработке результатов использовали U-критерий Манна–Уитни и коэффициент ранговой корреляции Спирмена. Данные обрабатывали с помощью пакетов программ Microsoft Office Excel, Statistica 8.0 и AtteStat.
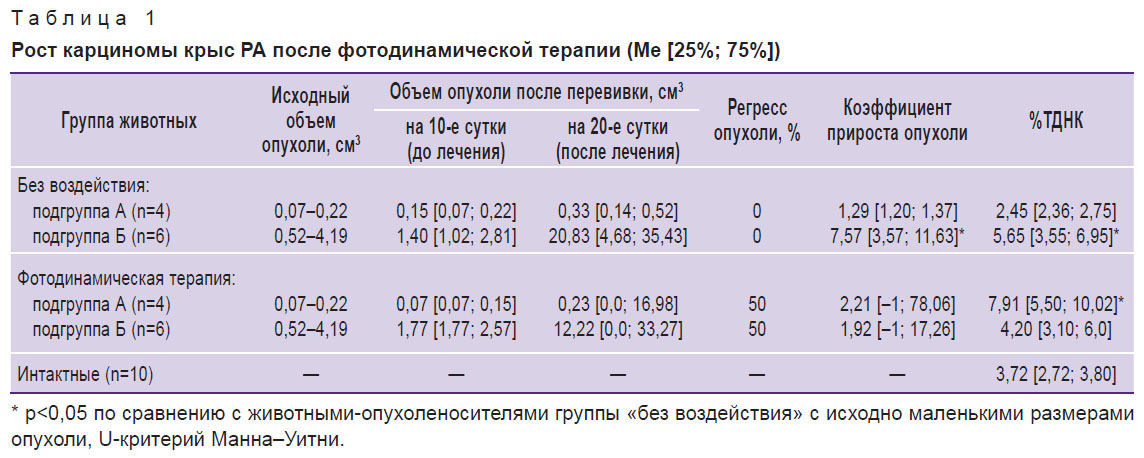
Результаты и обсуждение. Состояние модельной опухоли после проведенной терапии представлено в табл. 1.
|
Таблица 1. Рост карциномы крыс РА после фотодинамической терапии (Ме [25%; 75%]) |
У животных-опухоленосителей опытной группы «без воздействия» спонтанная регрессия карциномы не установлена. Коэффициент абсолютного прироста опухоли в подгруппе Б с исходно большими объемами неоплазии был статистически значимо выше, чем в подгруппе А с исходно меньшими объемами опухоли — 7,57 [3,57; 11,63] и 1,29 [1,20; 1,37] (р=0,011). При этом уровень спонтанных повреждений ДНК в лейкоцитах цельной крови крыс из подгруппы Б (%ТДНК) в 2 раза превышал их уровень у крыс подгруппы А (5,65 [3,55; 6,95] и 2,45 [2,36; 2,75]) соответственно (p=0,044). Взаимосвязь интенсивности роста карциномы и уровня повреждения ДНК в ядросодержащих клетках крови была подтверждена корреляционным анализом, а именно: установлена прямая зависимость между коэффициентом прироста опухоли и уровнем спонтанного повреждения ДНК (rs=0,85; p=0,006).
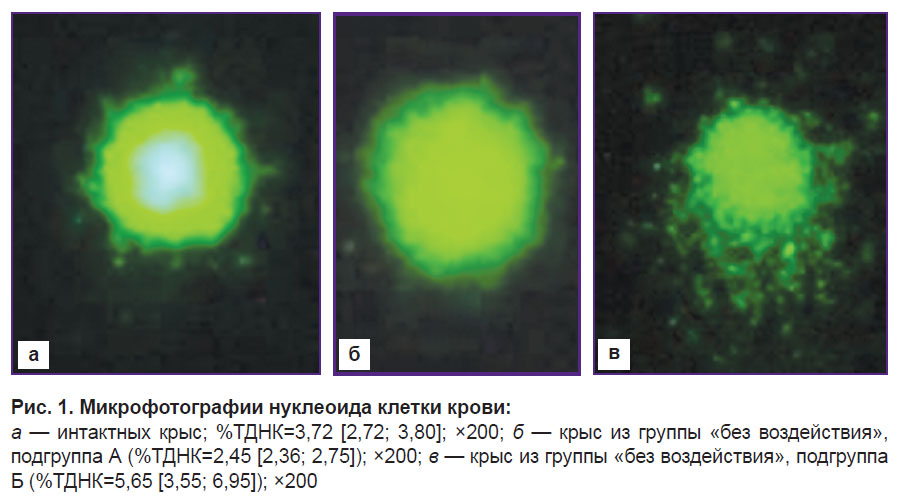
Нам удалось выявить особенности морфологии ДНК-комет крови интактных крыс и крыс-опухоленосителей (рис. 1).
Нуклеоиды клеток крови интактных животных и крыс с исходно меньшими объемами карциномы почки (подгруппа А) представляли собой яркие симметричные ДНК-сферы (рис. 1, а, б). Асимметрия в виде короткого хвоста из поврежденных участков ДНК в агарозном геле наблюдалась у нуклеоидов клеток цельной крови крыс с исходно большими объемами опухоли (подгруппа Б) (рис. 1, в).
После проведения ФДТ при локальном введении препарата «Фотосенс» полная регрессия трансплантированной неоплазии (К=–1) наблюдалась только в 50% случаев при всех исходных объемах опухоли: как менее 0,3 см3, так и более 0,5 см3 (см. табл. 1). Полученные нами результаты сопоставимы с данными регрессирования экспериментальной саркомы М-1 после ФДТ при локальном введении ФС «Фотодитазин» [22].
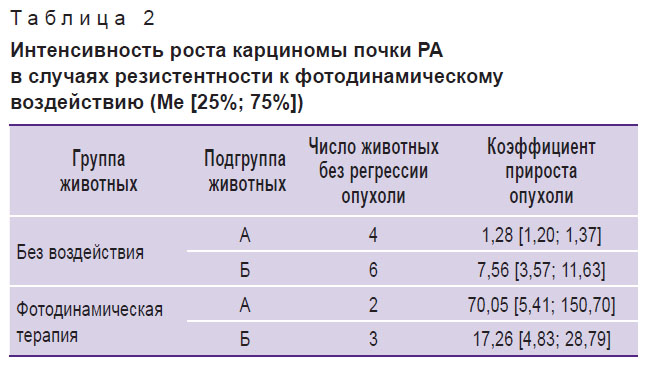
Однако при сравнении коэффициентов прироста опухоли у животных без терапии и после фотодинамического воздействия не выявлено статистически значимых различий как у крыс с исходно большими, так и с исходно маленькими размерами опухолевого очага. Это можно объяснить тем, что у животных, оставшихся резистентными к фотодинамическому воздействию (2 случая из 4 в подгруппе А и 3 из 6 — в подгруппе Б), наблюдалось более интенсивное увеличение объемов карциномы при исходно малых (в 54 раза по коэффициенту прироста опухоли) и незначительное увеличение при исходно больших размерах опухоли (в 2 раза по коэффициенту прироста опухоли) по сравнению с животными-опухоленосителями без воздействия (табл. 2).
|
Таблица 2. Интенсивность роста карциномы почки РА в случаях резистентности к фотодинамическому воздействию (Ме [25%; 75%]) |
Таким образом, для крыс с трансплантированной карциномой почки РА выявлен индивидуальный ответ на ФДТ (регрессия неоплазии или стимулирование ее роста), который не зависит от исходных размеров опухолевого очага.
После фотодинамического воздействия уровень спонтанного повреждения ДНК в лейкоцитах крови крыс с исходно малыми размерами опухолевого узла возрастает в 3 раза по сравнению с животными без терапии (p=0,021) и не изменяется у животных с исходно большими объемами опухоли (см. табл. 1).
Оценка морфологии нуклеоидов лейкоцитов цельной крови животных-опухоленосителей после сеансов ФДТ показала заметный полиморфизм сформировавшихся ДНК-комет (рис. 2).

|
Рис. 2. Микрофотография нуклеоида клетки крови крыс после фотодинамической терапии:
а — в подгруппе А; %ТДНК=7,91 [5,50; 10,02]; ×200; б — в подгруппе Б; %ТДНК= 4,20 [3,10; 6,00]; ×200 |
После проведения сеансов ФДТ нуклеоиды клеток крови крыс подгруппы А отличались наличием отчетливо выраженного «хвоста», состоящего из флюоресцентных фрагментов поврежденной ДНК (рис. 2, а). Однако в подгруппе Б таких флюоресцентных «хвостов» не наблюдалось, отмечалось только гало из поврежденной ДНК вокруг ядра (рис. 2, б).
Таким образом, с помощью метода ДНК-комет получены следующие результаты.
1. Выявлена прямая корреляционная зависимость между уровнем спонтанного повреждения ДНК и абсолютным коэффициентом прироста опухоли (rs=0,85; p=0,006).
2. После сеансов ФДТ установлен повышенный спонтанный уровень повреждений ДНК в лейкоцитах цельной крови животных-опухоленосителей с исходными объемами карциномы почки до 0,3 см3 и не обнаружено изменений в группе с исходными объемами более 0,5 см3. Очевидно, что повышенный уровень базального повреждения ДНК может служить прогностическим признаком неблагоприятного ответа на фотодинамическое воздействие.
3. Установлено, что фотодинамическая терапия при локальном введении препарата «Фотосенс» в 50% случаев приводит к регрессии карциномы почки при исходных объемах опухоли как менее 0,3 см3, так и более 0,5 см3.
4. У резистентных к терапии крыс наблюдается стимуляция опухолевого роста при исходных объемах опухоли до 0,3 см3.
Заключение. Спонтанный уровень повреждений ДНК в лейкоцитах крови, регистрируемый щелочной версией метода ДНК-комет в авторской модификации, можно использовать для косвенной оценки интенсивности роста злокачественного новообразования и прогноза ответа опухоли на фотодинамическую терапию с локальным введением фотосенсибилизатора.
Благодарности. Авторы выражают благодарность за сотрудничество д.б.н., профессору Г.С. Терентюку и к.б.н. А.Б. Бучарской.
Финансирование исследования и конфликт интересов. Исследование не финансировалось какими-либо источниками, и конфликты интересов, связанные с данным исследованием, отсутствуют.
Литература
- Каплан М.А., Капинус В.Н., Попучиев В.В., Романко Ю.С., Ярославцева-Исаева Е.В., Спиченкова И.С., Шубина А.М., Боргуль О.В., Горанская Е.В. Фотодинамическая терапия: результаты и перспективы. Радиация и риск (Бюллетень НРЭР) 2013; 22(3): 115–123.
- Gamayunov S.V., Grebenkina Е.V., Ermilina А.А., Karov V.А., König K., Korchagina К.S., Skrebtsova R.R., Terekhov V.M., Terentiev I.G., Turchin I.V., Shakhova N.М. Fluorescent monitoring of photodynamic therapy for skin cancer in clinical practice. Sovremennye tehnologii v medicine 2015; 7(2): 75–83, https://doi.org/10.17691/stm2015.7.2.10.
- Fargnoli M.C., Peris K. Photodynamic therapy for basal cell carcinoma. Future Oncol 2015; 11(22): 2991–2996, https://doi.org/10.2217/fon.15.208.
- Дуванский В.А., Князев М.В., Праведников П.В. Современные аспекты фотодинамической терапии заболеваний пищевода. Экспериментальная и клиническая гастроэнтерология 2011; 10: 111–116.
- Yi E., Yang C.K., Leem C., Park Y., Chang J.E., Cho S., Jheon S. Clinical outcome of photodynamic therapy in esophageal squamous cell carcinoma. J Photochem Photobiol B 2014; 141: 20–25, https://doi.org/10.1016/j.jphotobiol.2014.09.001.
- Яицкий Н.А., Герасин В.А., Орлов С.В., Бутенко А.Б., Молодцова В.П., Деревянко А.В., Стельмах Л.В., Уртенова М.А., Герасин А.В. Фотодинамическая терапия в лечении рака легкого. Вестник хирургии им. И.И. Грекова 2010; 169(5): 31–34.
- Simone C.B. 2nd, Cengel K.A. Photodynamic therapy for lung cancer and malignant pleural mesothelioma. Semin Oncol 2014; 41(6): 820–830, https://doi.org/10.1053/j.seminoncol.2014.09.017.
- Chen K.C., Hsieh Y.S., Tseng Y.F., Shieh M.J., Chen J.S., Lai H.S., Lee J.M. Pleural photodynamic therapy and surgery in lung cancer and thymoma patients with pleural spread. PLoS One 2015; 10(7): e0133230, https://doi.org/10.1371/journal.pone.0133230.
- Кубасова И.Ю., Вакуловская Е.Г., Ермакова К.В., Смирнова З.С. Флюоресцентная диагностика и фотодинамическая терапия при лечении злокачественных опухолей головного мозга. Российский биотерапевтический журнал 2006; 5(4): 54–63.
- Uzdensky A.B., Berezhnaya E., Kovaleva V., Neginskaya M., Rudkovskii M., Sharifulina S. Photodynamic therapy: a review of applications in neurooncology and neuropathology. J Biomed Opt 2015; 20(6): 61108, https://doi.org/10.1117/1.jbo.20.6.061108.
- Трушина О.И., Чиссов В.И., Соколов В.В., Новикова Е.Г., Филоненко Е.В., Франк Г.А., Волченко Н.Н. Противовирусная и противоопухолевая эффективность фотодинамической терапии при предраке и раннем раке шейки матки. Российский онкологический журнал 2009; 4: 15–18.
- Hillemanns P., Garcia F., Petry K.U., Dvorak V., Sadovsky O., Iversen O.E., Einstein M.H. A randomized study of hexaminolevulinate photodynamic therapy in patients with cervical intraepithelial neoplasia 1/2. Am J Obstet Gynecol 2015; 212(4): 465.e1–465.e7, https://doi.org/10.1016/j.ajog.2014.10.1107.
- Крикунова Л.И., Мкртчян Л.С., Каплан М.А., Рыкова Е.В., Капинус В.Н. Возможности фотодинамической терапии рака вульвы. Радиация и риск (Бюллетень НРЭР) 2015; 24(2): 107–115.
- Patel J., Rizk N., Kahaleh M. Role of photodynamic therapy and intraductal radiofrequency ablation in cholangiocarcinoma. Best Pract Res Clin Gastroenterol 2015; 29(2): 309–318, https://doi.org/10.1016/j.bpg.2015.02.008.
- Странадко Е.Ф., Титова В.А., Рябов М.В., Петровский В.Ю. Фотодинамическая терапия как компонент комбинированного и комплексного лечения злокачественных опухолей головы и шеи. Альманах клинической медицины 2006; 12: 37.
- Улупов М.Ю. Способ интерстициальной фотодинамической терапии злокачественных опухолей головы и шеи. Российская оториноларингология 2010; 1(44): 137–140.
- Полькин В.В., Каплан М.А., Медведев В.С., Cемин Д.Ю., Капинус В.Н., Спиченкова И.С., Исаев П.А., Дербугов Д.Н., Шубина А.М. Место фотодинамической терапии в программах органосохраняющего лечения плоскоклеточного рака слизистой оболочки полости рта. Опухоли головы и шеи 2012; 1: 23–28.
- Миронов А.Ф. Фотодинамическая терапия рака — новый эффективный метод диагностики и лечения злокачественных опухолей. Соросовский образовательный журнал 1996; 8: 32–40.
- Меерович И.Г., Меерович Г.А., Оборотова Н.А., Барышников А.Ю. Распределение света по глубине опухолевого очага и эффективность использования терапевтического излучения при фотодинамической терапии. Российский биотерапевтический журнал 2006; 5(3): 93–97.
- Цыб А.Ф., Каплан М.А., Романко Ю.С., Попучиев В.В. Фотодинамическая терапия. М.: Медицинское информационное агентство; 2009; 212 с.
- Лагода Т.С., Каплан М.А., Кривошеев Я.В., Жаворонков Л.П., Бокова М.Б. Оптимизация схемы фотодинамической терапии саркомы М1 с применением Фотосенса. Вопросы онкологии 2000; 46(3): 327–331.
- Ярославцева-Исаева Е.В., Каплан М.А., Романко Ю.С., Сокол Н.И. Разработка методики фотодинамической терапии экспериментальной опухоли (саркома М1) при локальном введении фотосенсибилизатора. Российский биотерапевтический журнал 2003; 2(4): 19–22.
- Лагода Т.С., Каплан М.А., Бондарь А.М., Бокова М.Б., Иванов Э.А., Бровин А.И., Спиченкова О.Н. Оптимизация фотодинамической терапии солидной саркомы М1 у крыс Вистар на примере применения препарата «Фотосенс». Вопросы онкологии 2005; 51(1): 103–107.
- Bonnet R., Berenbaum M. Porphyrins as photosensitizers. In: Photosensitising compounds: their chemistry, biology and clinical use. Bock G., Harnett S. (editors). John Wiley & Sons, Chichester; 1989; p. 40–49.
- Moan J., Berg K., Kvam E., Western A., Malik Z., Rock A., Schneckenburger H. Intracellular localization of photosensitizers. In: Ciba Foundation Symposium 146. Wiley, Chichester; 1989; p. 95–111.
- Moan J. On the diffusion length of singlet oxygen in cells and tissues. J Photochem Photobiol B Biol 1990; 6: 343–347, https://doi.org/10.1016/1011-1344(90)85104-5.
- McNair F.I., Marples B., West C.M., Moore J.V. A comet assay of DNA damage and repair in K562 cells after photodynamic therapy using haematoporphyrin derivative, methylene blue and meso-tetrahydroxyphenylchlorin. Br J Cancer 1997; 75(12): 1721–1729, https://doi.org/10.1038/bjc.1997.295.
- Haylett A.K., Ward T.H., Moore J.V. DNA damage and repair in Gorlin syndrome and normal fibroblasts after aminolevulinic acid photodynamic therapy: a comet assay study. Photochem Photobiol 2003; 78(4): 337–341, https://doi.org/10.1562/0031-8655(2003)0780337:ddarig2.0.co;2.
- Mozaffarieh M., Schötzau A., Josifova T., Flammer J. The effect of ranibizumab versus photodynamic therapy on DNA damage in patients with exudative macular degeneration. Mol Vis 2009; 15: 1194–1199.
- Экспериментальная оценка противоопухолевых препаратов в СССР и США. Под ред. Софьиной З.П., Сыркина А.Б., Голдина А., Кляйна А. М: Медицина; 1980; 295 с.
- Буреш Я., Бурешова О., Хьюстон Д.П. Методики и основные эксперименты по изучению мозга и поведения. М: Высшая школа; 1991; 399 с.
- Chernigina I.A., Shcherbatyuk T.G. A new version of comet assay. Sovremennye tehnologii v medicine 2016; 8(1): 20–27, https://doi.org/10.17691/stm2016.8.1.03.
- Степанов B.H. Методы и программные средства автоматизации анализа изображений медико-биологических микрообъектов. Автореф. дис. … канд. техн. наук. М; 2005.
- Сирота Н.П., Кузнецова Е.А. Применение метода «комета тест» в радиобиологических исследованиях. Радиационная биология. Радиоэкология 2010; 50(3): 329–339.