Динамика стресс-активации при повторении стрессогенного воздействия в эксперименте
Цель исследования — анализ динамики стресс-специфичных показателей функционального состояния организма, а именно уровня катехоламинов в плазме крови и спектральных показателей вариабельности сердечного ритма (ВСР), при повторяющемся иммобилизационном стрессе для определения эффектов габитуации.
Материалы и методы. Перед началом эксперимента крыс (Long-Evans, n=6) катетеризировали в яремную вену. Для иммобилизации животных мягко фиксировали в специальном гамаке по 30 мин ежедневно в течение пяти дней. В процессе иммобилизации, а также в течение 30 мин до и 60 мин после иммобилизации в условиях свободного поведения в домашней клетке у крыс проводили неинвазивную регистрацию ЭКГ для последующего анализа ВСР на основе спектральных показателей ритмограмм. В первый, третий и пятый экспериментальные дни у крыс брали пробы крови за 30 мин до (1-й этап), через 5 мин после начала иммобилизации (2-й этап), в конце иммобилизации (3-й этап) и через 30 мин после окончания иммобилизационного периода (4-й этап) для последующего анализа концентрации катехоламинов в плазме крови.
Результаты. Эффекты габитуации к иммобилизации выявлены в динамике уровня катехоламинов в плазме крови, ЧСС и ВСР. Концентрация адреналина и норадреналина увеличивалась статистически значимо в период иммобилизации в первый экспериментальный день и не имела достоверных изменений в последующие дни. ЧСС статистически значимо снижалась на 3-м и 4-м этапах эксперимента (свободное поведение в домашней клетке после иммобилизации) в пятый день и оставалась на исходно высоком уровне в первый и третий дни эксперимента. Общая мощность спектра ВСР статистически значимо уменьшалась в период иммобилизации во все экспериментальные дни. В первый день ВСР оставалась редуцированной до 4-го этапа эксперимента. В третий и пятый дни общая мощность спектра ВСР восстанавливалась после иммобилизации до исходного уровня к 4-му этапу эксперимента.
Заключение. Пятидневное повторение иммобилизационного стресса животных в специальном гамаке, разработанном для их фиксации в электрофизиологических экспериментах, сопровождается габитуацией, что демонстрируют данные динамики уровня катехоламинов в крови и ВСР. Полученные данные показывают, что эффекты габитуации проявляются не только в снижении выраженности стресс-активации, но и в сокращении ее по времени.
Введение
Интерес к хроническому стрессу обусловлен увеличением количества заболеваний (особенно сердечно-сосудистых), являющихся его следствием [1]. Исследования хронического стресса в основном акцентируются на аспектах динамики состояния индивида и выяснении его маркеров для повышения эффективности диагностики [2]. Для этого разрабатываются экспериментальные процедуры формирования хронического стресса у индивидов [1]. В таких экспериментальных процедурах (например, модель непредсказуемого хронического неострого стресса [3]) большое внимание уделяется избеганию эффектов габитуации — привыкания индивида к первоначально стрессогенному воздействию. Однако феноменология габитуации и ее динамики мало исследованы, как и в целом факторы, определяющие процессы, разворачивающиеся при повторяющемся стрессе [4].
Эффекты габитуации (или, наоборот, сенситизации) при повторении стресса обычно исследуются для тестирования моделей стрессогенных воздействий на возможность их неоднократного использования в экспериментах [5]. На уровне биохимических показателей не выявлено согласованности эффектов в отношении габитуации к повторяющемуся стресс-фактору [4]. Так, при повторении распространенной модели социального стресса (trier social stress test) показано, что эффекты габитуации проявляются в динамике концентрации кортизола (показатель активации гипоталамо-гипофизарной оси) и альфа-амилазы (показатель активации α-адренорецепторов) в слюне и не наблюдаются в динамике концентрации интерлейкина-6 (показатель выраженности воспалительных процессов). На физиологическом уровне некоторые характеристики вариабельности сердечного ритма (ВСР) — среднее значение и дисперсия R–R-интервалов — предлагаются как возможный способ оценки эффектов габитуации при повторяющемся когнитивном стрессе [6]. Кроме того, динамика этих показателей была согласована с поведенческими эффектами габитуации. Выраженность эффектов габитуации, оцениваемая по изменениям частоты сердечных сокращений (ЧСС), систолическому и диастолическому давлению, прямо коррелировала с показателями открытости новому опыту, оцениваемыми на основе опросника [7].
Имеющиеся данные обусловливают дальнейшее исследование динамики и механизмов габитуации к повторяющимся стрессогенным воздействиям как простейшей формы научения, выражающейся в снижении проявления симптомов, специфичных стрессу.
Кроме прикладного аспекта исследования габитуации при повторении стресса имеют и методическую актуальность. Как правило, экспериментальные протоколы с животными включают первоначальный этап привыкания (к обстановке или необходимому, но не исследуемому воздействию) для устранения эффектов новизны и стресса в динамике интересующих переменных. Более контактные процедуры (например, фиксация животного в установке) требуют более длительного периода привыкания. Дополнительное использование в эксперименте способов контроля состояния животного позволит надежно исключить возможность стрессогенного воздействия выбранной процедуры. Отсутствие такой возможности требует проведения предварительной пилотажной серии экспериментов с целью определения этапа, на котором у большинства или всех животных отсутствует стресс при реализации экспериментального протокола. В этом направлении наиболее интересным является исследование габитуации при повторяющемся иммобилизационном стрессе, так как многие эксперименты электрофизиологических исследований включают разной степени ограничения подвижности животного нефармакологическими способами.
Цель исследования — определение динамики функционального состояния индивида (по показателям, специфичным для состояния стресса) при повторении стрессогенного воздействия в модели иммобилизационного стресса.
Материалы и методы
Исследование проводилось на половозрелых самцах крыс линии Long-Evans (средняя масса животных составляла 300 г, средний возраст — 19 мес (мин=6, макс=24)). Катетеризировали яремную вену у 39 крыс, однако в связи с техническими проблемами (непроходимость катетера) полную экспериментальную серию удалось выполнить только на 6 животных.
Крысы содержались в стандартных условиях вивария в одиночных клетках и имели свободный доступ к воде и пище. Все манипуляции с ними выполняли в соответствии с Приказом №199н «Об утверждении Правил надлежащей лабораторной практики» (Россия, 2016) и «Международными рекомендациями (этический кодекс) по проведению медико-биологических исследований с использованием животных» (CIOMS и ICLAS, 2012), при этом неукоснительно соблюдались этические принципы, установленные Европейской конвенцией по защите позвоночных животных, используемых для экспериментальных и других научных целей (Страсбург, 2006). На проведение экспериментальных исследований на животных получено разрешение этического комитета Института психологии РАН.
Операция по установке катетера в яремную вену. Катетеры состояли из силиконовой трубки (короткой, 2,5 см) и полиэтиленовой трубки (длинной, 6 см). Стерильные катетеры промывались раствором медицинского спирта 96%. Для наркоза животным вводили раствор Рометара (10 мг/кг) и Золетила (25 мг/кг) внутримышечно. В операционном поле выстригали волосяной покров, брили и обрабатывали антисептиком. Разрез кожных покровов производили по косой линии, соединяющей верхнюю треть грудины и внутреннюю треть левой или правой ключицы таким образом, чтобы 2/3 разреза находились ниже ключицы. Длина разреза составляла 1–1,5 см. Далее рассекали поверхностную фасцию и яремную вену отпрепаровывали тупым способом. Затем на яремную вену ставили лигатуры: ростральнее — постоянную, каудальнее — временную. Между ними выполняли надрез внешней стенки яремной вены. Полученное отверстие расширяли браншами микрохирургического пинцета и вводили силиконовую часть катетера в каудальном направлении, ослабляя каудальную лигатуру, на глубину 2–3 см. Введенный катетер проверяли на возможность забора крови, заполняли гепаринизированным физиологическим раствором (500 ЕД/мл, 80 мкл), закрывали пробкой и фиксировали лигатурами на вене. Затем подкожно выводили его через надрез (3–4 мм) между лопатками, после чего ушивали раны.
Контроль проходимости катетера проводили ежедневно в течение недели взятием пробы крови.
Протокол эксперимента. Через неделю после операции по установке катетера выполняли пятидневную экспериментальную серию с ежедневными сессиями, каждая из которых включала 4 этапа (рис. 1). На 1-м этапе (30 мин) крыса находилась в домашней клетке в условиях свободного поведения. На 2-м этапе (30 мин) крыса фиксировалась в специальном гамаке для иммобилизации. На 3-м и 4-м этапах (по 30 мин) крыса снова находилась в домашней клетке в условиях свободного поведения.
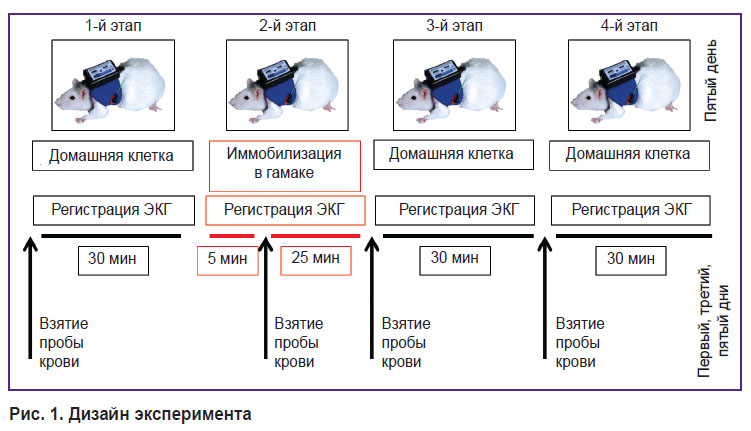 |
Рис. 1. Дизайн эксперимента |
На каждом этапе проводили неинвазивную регистрацию ЭКГ.
В первый, третий и пятый дни эксперимента перед 1, 3, 4-м этапами и на 5-й минуте 2-го этапа производили забор крови через катетер (1 мл). Взятую пробу крови центрифугировали для отделения фракции плазмы и хранили при t=18°C.
Регистрация сердечного ритма. Для неинвазивной биполярной регистрации ЭКГ у крыс использовали систему «Физиобелт» (МПК «Открытая наука», Россия), которая включает манжетку для постановки электродов на тело животного и крепления прибора со встроенными усилителем, аналого-цифровым преобразователем и передатчиком. Прибор имеет размеры 35×55×15 мм и массу 40 г. Частота опроса — 500 Гц. При регистрации использовали программное обеспечение Physiobelt (ООО «Нейроботикс», Россия).
Определение концентрации катехоламинов в плазме крови. Оценку уровня катехоламинов в плазме крови проводили на изократическом хроматографе Gilson 407 (Gilson, Франция) с использованием электрохимического детектора LC-4C (BAS, США) по протоколу М.Х. Каримовой и соавт. [8]. Все реактивы были степени Х.Ч., analytical grade.
В образцах плазмы крови определяли концентрацию адреналина и норадреналина. Эти вещества были выбраны для анализа, поскольку возрастание их концентрации является маркером I стадии острого стресса (стадии активации симпатоадреналовой системы [9]).
Анализ вариабельности сердечного ритма. В ЭКГ крыс выделяли последовательности R–R-интервалов (временных интервалов между R-зубцами в соседних QRST-комплексах кардиограммы) пороговым методом в программе Spike 2.5. Для выделения ритмограмм выбирались 100-секундные интервалы ЭКГ без артефактов. Полученные ритмограммы анализировали с построением спектров периодограммой Уэлча, предварительно интерполировав их с шагом 50 мс. Для этого использовали программу Rhythm Service 1.2 (ООО «Фотон-тест», Россия). В результате для каждой последовательности R–R-интервалов вычисляли ЧСС (в минуту) — среднюю частоту сердечных сокращений; TP (мс2) — суммарную мощность спектра ВСР; LF (мс2) — мощность спектра в области низких частот (0,04–0,15 Гц); HF (мс2) — мощность спектра в области высоких частот (0,15–0,60 Гц); LF/HF — отношение мощностей спектра в области низких и высоких частот (индекс вегетативного баланса). Все описанные показатели рассчитывались для каждого этапа эксперимента как средние значений для всех выделенных ритмограмм длительностью 100 с в этот период.
Спектральные показатели были выбраны для характеристики ВСР, так как предыдущие работы [10, 11] показали, что снижение общей мощности спектра ВСР и возрастание индекса вегетативного баланса специфичны для начала острого стресса.
Статистические процедуры. Для первого, третьего и пятого экспериментальных дней динамику показателей уровня катехоламинов в плазме крови и спектральных показателей ВСР в течение эксперимента (от 1-го до 4-го этапа) проверяли на наличие достоверных изменений, используя критерий Фридмана [12]. Парные сравнения переменных между этапами эксперимента и между экспериментальными днями проводили с использованием критерия Вилкоксона [13]. Изменения считались статистически значимыми при р≤0,05.
Результаты и обсуждение
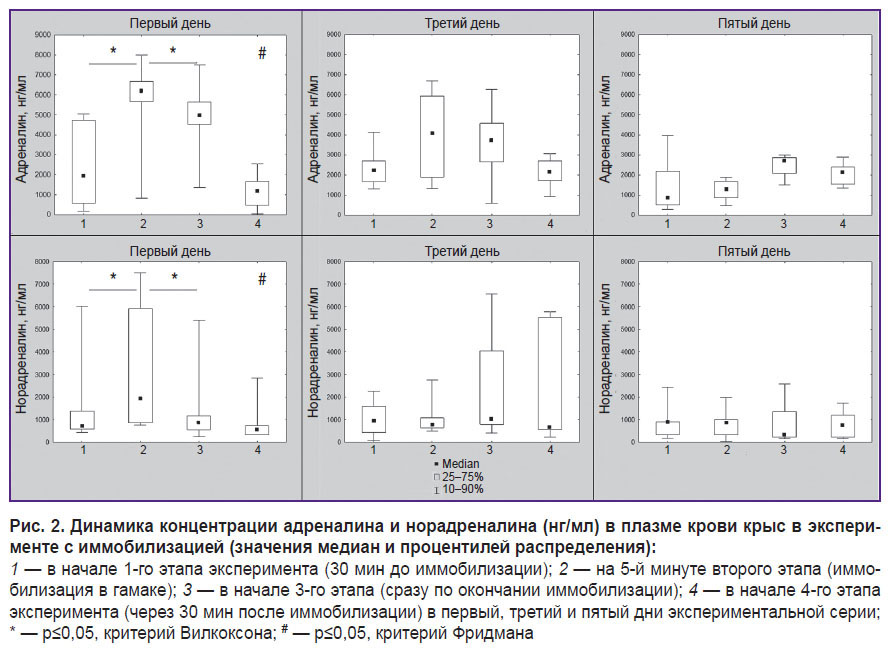
Анализ динамики концентрации адреналина показал наличие статистически значимых изменений (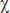 2 (n=6; df=3)=14,8; p=0,002, критерий Фридмана) в первый день экспериментальной серии. Отмечено статистически значимое возрастание адреналина на 2-м этапе эксперимента (при иммобилизации животного) и последующее снижение к 3-му, а затем — к 4-му этапу (свободное поведение в домашней клетке) (р≤0,05, критерий Вилкоксона). Аналогичные изменения наблюдались и в динамике норадреналина (
2 (n=6; df=3)=14,8; p=0,002, критерий Фридмана) в первый день экспериментальной серии. Отмечено статистически значимое возрастание адреналина на 2-м этапе эксперимента (при иммобилизации животного) и последующее снижение к 3-му, а затем — к 4-му этапу (свободное поведение в домашней клетке) (р≤0,05, критерий Вилкоксона). Аналогичные изменения наблюдались и в динамике норадреналина (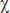 2 (n=6; df=3)=8,8; p=0,03, критерий Фридмана).
2 (n=6; df=3)=8,8; p=0,03, критерий Фридмана).
На третий день эксперимента статистически значимые изменения отсутствовали в динамике как адреналина (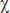 2=3,8; p=0,28, критерий Фридмана), так и норадреналина (
2=3,8; p=0,28, критерий Фридмана), так и норадреналина (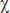 2=1,0; p=0,80, критерий Фридмана). Аналогично и в пятый день эксперимента отсутствовали достоверные изменения в динамике адреналина (
2=1,0; p=0,80, критерий Фридмана). Аналогично и в пятый день эксперимента отсутствовали достоверные изменения в динамике адреналина (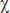 2 =6,0; p=0,11, критерий Фридмана) и норадреналина (
2 =6,0; p=0,11, критерий Фридмана) и норадреналина (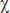 2=2,4; p=0,49, критерий Фридмана).
2=2,4; p=0,49, критерий Фридмана).
Значения адреналина и ноадреналина были статистически значимо выше на 2-м этапе эксперимента в первый день, чем на 2-м этапе в третий и пятый дни (р≤0,05, критерий Вилкоксона — для обеих переменных). На 1, 3 и 4-м этапах значения адреналина и норадреналина не отличались статистически значимо в первый, третий и пятый экспериментальные дни.
Подробнее динамика адреналина и норадреналина в течение всех дней эксперимента показана на рис. 2.
Таким образом, по данным концентрации катехоламинов в плазме крови, в первый день у животных при иммобилизации в экспериментальном гамаке наблюдается стресс-активация, которая проявляется в статистически значимом возрастании уровня адреналина и норадреналина и возвращении к исходному уровню через 30 мин после окончания иммобилизации. На третий и пятый дни в динамике концентрации катехоламинов зафиксированы эффекты габитуации к иммобилизации, так как отсутствуют достоверные изменения адреналина и норадреналина между этапами эксперимента, а также установлено их статистически значимое снижение при иммобилизации по сравнению с первым экспериментальным днем. Можно предположить, что габитуация к иммобилизации в данном случае проявляется не в форме редукции стресс-активации, а в сокращении временного периода, в который она разворачивается. В таком случае, если стресс-активация запускается и заканчивается в течение первых 5 мин иммобилизации, во второй пробе плазмы крови (которая проводилась через 5 мин после начала 2-го этапа эксперимента) фиксируется только исходный уровень адреналина и норадреналина.
В динамике ЧСС статистически значимых изменений не наблюдалось в первый (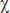 2=4,00; p=0,261, критерий Фридмана) и третий (
2=4,00; p=0,261, критерий Фридмана) и третий (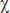 2=3,4; p=0,334, критерий Фридмана) дни эксперимента. При этом были выявлены достоверные изменения в пятый день (
2=3,4; p=0,334, критерий Фридмана) дни эксперимента. При этом были выявлены достоверные изменения в пятый день (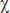 2=11,6; p=0,009, критерий Фридмана): наблюдалось статистически значимое снижение ЧСС от 2-го этапа эксперимента (период иммобилизации) к 3-му и 4-му этапам (свободное поведение в домашней клетке). Подробнее динамика ЧСС в течение всех дней эксперимента показана на рис. 3.
2=11,6; p=0,009, критерий Фридмана): наблюдалось статистически значимое снижение ЧСС от 2-го этапа эксперимента (период иммобилизации) к 3-му и 4-му этапам (свободное поведение в домашней клетке). Подробнее динамика ЧСС в течение всех дней эксперимента показана на рис. 3.
Уровень ЧСС в период иммобилизации не отличался во все экспериментальные дни и составлял примерно 460 ударов в минуту. Отличия между экспериментальными днями наблюдались на 3-м и 4-м этапах эксперимента и заключались в том, что в пятый экспериментальный день ЧСС на этих этапах была статистически значимо ниже, чем в первый и третий экспериментальные дни (для обоих этапов p≤0,05, критерий Вилкоксона).
Таким образом, эффекты габитуации к стрессогенному воздействию наблюдаются в динамике ЧСС на пятый экспериментальный день и заключаются в снижении ЧСС по окончании иммобилизации. Отсутствие возрастания ЧСС на этапе иммобилизации может быть связано с изначально высоким ее уровнем на 1-м этапе во все дни эксперимента, что еще раз подчеркивает слабую специфичность этого показателя непосредственно к стрессу.
В динамике общей мощности спектра ВСР статистически значимые изменения наблюдались в первый (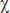 2=11,4; p =0,01, критерий Фридмана), третий (
2=11,4; p =0,01, критерий Фридмана), третий (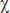 2=9,0; p=0,03, критерий Фридмана) и пятый (
2=9,0; p=0,03, критерий Фридмана) и пятый (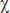 2=10,6; p=0,02, критерий Фридмана) экспериментальные дни. Во все экспериментальные дни ее значение статистически значимо снижалось на 2-м этапе эксперимента (период иммобилизации) по сравнению с 1-м этапом (свободное поведение в домашней клетке) — во всех случаях p≤0,05, критерий Вилкоксона. В первый и пятый экспериментальные дни общая мощность спектра ВСР статистически значимо увеличивалась на 3-м этапе эксперимента (свободное поведение в домашней клетке) по сравнению со 2-м этапом — иммобилизацией (p≤0,05, критерий Вилкоксона). Однако в первый день она статистически значимо снижается на 4-м этапе по сравнению с 3-м (p<0,05, критерий Вилкоксона), в то время как в пятый день на 4-м этапе продолжает увеличиваться, достигая исходного уровня. Сравнение значений ВСР между днями эксперимента показало, что они не отличаются на 1, 2 и 3-м этапах. При этом на 4-м этапе значения ВСР статистически значимо выше в третий день эксперимента, чем в первый, и в пятый день, чем в третий (см. рис. 3).
2=10,6; p=0,02, критерий Фридмана) экспериментальные дни. Во все экспериментальные дни ее значение статистически значимо снижалось на 2-м этапе эксперимента (период иммобилизации) по сравнению с 1-м этапом (свободное поведение в домашней клетке) — во всех случаях p≤0,05, критерий Вилкоксона. В первый и пятый экспериментальные дни общая мощность спектра ВСР статистически значимо увеличивалась на 3-м этапе эксперимента (свободное поведение в домашней клетке) по сравнению со 2-м этапом — иммобилизацией (p≤0,05, критерий Вилкоксона). Однако в первый день она статистически значимо снижается на 4-м этапе по сравнению с 3-м (p<0,05, критерий Вилкоксона), в то время как в пятый день на 4-м этапе продолжает увеличиваться, достигая исходного уровня. Сравнение значений ВСР между днями эксперимента показало, что они не отличаются на 1, 2 и 3-м этапах. При этом на 4-м этапе значения ВСР статистически значимо выше в третий день эксперимента, чем в первый, и в пятый день, чем в третий (см. рис. 3).
Таким образом, во все дни эксперимента ВСР, оцениваемая по общей спектральной мощности колебаний R–R-интервалов, статистически значимо уменьшается в период иммобилизации, что характерно для стресс-активации. Однако стоит отметить, что в третий и пятый экспериментальные дни в отличие от первого дня ВСР восстанавливается до изначального уровня к 4-му этапу эксперимента. Иными словами, с повторением одного и того же стресс-фактора активация, не меняясь по степени выраженности, разворачивается быстрее, что также может являться эффектом габитуации как более быстрое восстановление после стрессового воздействия.
В динамике индекса вегетативного баланса (LF/HF) не наблюдалось статистически значимых изменений в первый (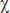 2=4,6; p=0,203, критерий Фридмана), третий (
2=4,6; p=0,203, критерий Фридмана), третий (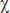 2=1,8; p=0,615, критерий Фридмана) и пятый (
2=1,8; p=0,615, критерий Фридмана) и пятый ( 2=0,6; p=0,896, критерий Фридмана) экспериментальные дни. В первый экспериментальный день наблюдалось статистически значимое снижение этого индекса на 2-м этапе (иммобилизация) по сравнению с 1-м этапом эксперимента (p≤0,05, критерий Вилкоксона). Подробнее динамику данного показателя в течение всех дней эксперимента см. на рисунке 3.
2=0,6; p=0,896, критерий Фридмана) экспериментальные дни. В первый экспериментальный день наблюдалось статистически значимое снижение этого индекса на 2-м этапе (иммобилизация) по сравнению с 1-м этапом эксперимента (p≤0,05, критерий Вилкоксона). Подробнее динамику данного показателя в течение всех дней эксперимента см. на рисунке 3.
В наблюдаемой динамике индекса вегетативного баланса отсутствует типичное для стресс-активации увеличение [10, 11]. Это может быть объяснено особенностями выбора границ частотных диапазонов при расчете значений LF и HF. В данном случае расчеты проводились по стандартным границам диапазонов (см. раздел «Анализ вариабельности сердечного ритма»), которые приняты и используются в исследованиях с участием людей. При этом существуют данные о видоспецифичности этих показателей [14], в частности у крыс диапазоны LF и HF могут быть сдвинуты в более высокочастотную область: LF — 0,04–1,0 Гц, HF — 1,0–3,0 Гц [15]. Можно ожидать, что при пересчете отношений мощности спектра согласно этим диапазонам динамика индекса примет иную структуру.
Таким образом, полученные результаты показали, что к пятому дню ежедневного повторения 30-минутной иммобилизации у крыс происходит габитуация к стрессогенному воздействию. Эффекты габитуации проявляются как на гормональном уровне (в динамике концентрации катехоламинов), так и на общеорганизменном — в показателях ВСР.
Совместное использование в эксперименте анализа биохимических и электрофизиологических данных позволило выявить важный аспект динамики габитуации: она проявляется не столько в снижении выраженности стресс-активации, сколько в сокращении времени, в которое она разворачивается, и, как следствие, в ускорении восстановления параметров к исходному, фоновому уровню. На это указывают данные ВСР, а именно тот результат, что редукция ВСР, характерная для стресса, проявляется в период иммобилизации даже в пятый день, а значения общей мощности спектра ВСР в период иммобилизации не отличаются в первый, третий и пятый дни эксперимента.
Такая динамика характеристик сердечного ритма дает основания полагать, что при уменьшении интервала времени между началом стрессогенного воздействия и взятием пробы крови для биохимического анализа с 5 до 3 мин и 1 мин габитуация по динамике катехоламинов начнет проявляться позднее, т.е. после большего числа повторений стресс-фактора. Возможно, что именно методические ограничения на частоту взятия проб для биохимического анализа (невозможность увеличить дескритизацию по времени для получаемых оценок) приводят к наблюдению несогласованных эффектов габитуации в разных биохимических маркерах стресса [4, 16].
Стоит также подчеркнуть, что более детальную информацию о динамике габитуации позволит получить непрерывный мониторинг сердечного ритма — от начала стресс-активации до полного восстановления к исходному уровню. В этом случае станет возможной точная оценка изменений продолжительности стресс-активации при повторении стресса. Это, в свою очередь, позволит проверить гипотезу о том, что развитие габитуации есть процесс уменьшения времени разворачивания активности стресс-реализующих систем организма.
Заключение
Анализ динамики стресс-специфичных показателей функционального состояния организма, а именно уровня катехоламинов в плазме крови и спектральных показателей вариабельности сердечного ритма, при повторении иммобилизационного стресса позволил выявить, что эффекты габитуации проявляются не только в снижении выраженности стресс-активации, но и в сокращении ее по времени.
Благодарность. Авторы признательны О.В. Курской за обучение катетеризации яремной вены крыс.
Финансирование исследования. Работа выполнена при поддержке грантов Российского фонда фундаментальных исследований №18-313-20003 «Исследование динамики адаптационных процессов при рассогласовании в решении социально значимых задач» (электрофизиологическая часть), №18-413-520006_р_а «Развитие Интернет-ориентированной технологии событийно-связанной телеметрии для скрининга, мониторинга и коррекции стресс-индуцированных расстройств у школьников города Нижнего Новгорода» и в рамках темы НИР на 2019 г. №0159-2019-0001 «Закономерности системогенеза и актуализации ранее сформированной памяти в индивидуальном и коллективном поведении» (биохимическая часть).
Конфликт интересов не заявляется.
Литература
- Golbidi S., Frisbee J.C., Laher I. Chronic stress impacts the cardiovascular system: animal models and clinical outcomes. Am J Physiol Heart Circ Physiol 2015; 308(12): H1476–H1498, https://doi.org/10.1152/ajpheart.00859.2014.
- McEwen B.S. Neurobiological and systemic effects of chronic stress. Chronic Stress 2017; 1: 247054701769232, https://doi.org/10.1177/2470547017692328.
- Lucca G., Comim C.M., Valvassori S.S., Pereira J.G., Stertz L., Gavioli E.C., Kapczinski F., Quevedo J. Chronic mild stress paradigm reduces sweet food intake in rats without affecting brain derived neurotrophic factor protein levels. Curr Neurovasc Res 2008; 5(4): 207–213, https://doi.org/10.2174/156720208786413406.
- Rohleder N., Janson J., Sturmbauer S. Mechanisms of habituation versus sensitization of inflammatory responses to repeated acute stress. Psychoneuroendocrinology 2017; 83: 74–75, https://doi.org/10.1016/j.psyneuen.2017.07.439.
- Quaedflieg C.W.E.M., Meyer T., van Ruitenbeek P., Smeets T. Examining habituation and sensitization across repetitive laboratory stress inductions using the MAST. Psychoneuroendocrinology 2017; 77: 175–181, https://doi.org/10.1016/j.psyneuen.2016.12.009.
- Feda D.M., Roemmich J.N. Effect of interpersonal and cognitive stressors on habituation and the utility of heart rate variability to measure habituation. Stress Health 2016; 32(4): 320–327, https://doi.org/10.1002/smi.2618.
- Súilleabháin P.S.Ó., Howard S., Hughes B.M. Openness to experience and adapting to change: cardiovascular stress habituation to change in acute stress exposure. Psychophysiology 2018; 55(5): e13023, https://doi.org/10.1111/psyp.13023.
- Каримова М.Х., Кудрин В.С., Гайнетдинов Р.Р. Оценка содержания катехоламинов в крови у практически здоровых людей. Клиническая лабораторная диагностика 1993; 9(2): 33–35.
- Парин С.Б. Люди и животные в экстремальных ситуациях. Вестник Новосибирского государственного университета. Серия: Психология 2008; 2(2): 118–135.
- Polevaya S.А., Runova Е.V., Nekrasova М.М., Fedotova I.V., Bakhchina А.V., Kovalchuk А.V., Shishalov I.S., Parin S.B. Telemetry and information technologies in diagnosis of sportsmen functional state. Sovremennye tehnologii v medicine 2012; (4): 94.
- Бахчина А.В. Динамика вегетативной регуляции кардиоритма при когнитивных, эмоциональных и физических нагрузках. Автореф. дис. … канд. психол. наук. М; 2014.
- Hollander M., Wolfe D.A., Chicken E. Nonparametric statistical methods. John Wiley & Sons, Inc.; 2015, https://doi.org/10.1002/9781119196037.
- Wilcoxon F. Individual comparisons by ranking methods. Biometrics 1945; 1(6): 80–83, https://doi.org/10.2307/3001968.
- von Borell E., Langbein J., Després G., Hansen S., Leterrier C., Marchant-Forde J., Marchant-Forde R., Minero M., Mohr E., Prunier A., Valance D., Veissier I. Heart rate variability as a measure of autonomic regulation of cardiac activity for assessing stress and welfare in farm animals — a review. Physiol Behav 2007; 92(3): 293–316, https://doi.org/10.1016/j.physbeh.2007.01.007.
- Kuwahara M., Yayou K., Ishii K., Hashimoto S., Tsubone H., Sugano S. Power spectral analysis of heart rate variability as a new method for assessing autonomic activity in the rat. J Electrocardiol 1994; 27(4): 333–337, https://doi.org/10.1016/s0022-0736(05)80272-9.
- Pulopulos M.M., Vanderhasselt M.-A., De Raedt R. Association between changes in heart rate variability during the anticipation of a stressful situation and the stress-induced cortisol response. Psychoneuroendocrinology 2018; 94: 63–71, https://doi.org/10.1016/j.psyneuen.2018.05.004.