Применение феноменологической математической модели для воспроизведения эффекта взаимодействия эндогенных и экзогенных осцилляций при нейробиоуправлении
Цель исследования — оценить возможность применения феноменологической математической модели элементарной таламокортикальной ячейки для описания частотно-временных откликов реальной таламокортикальной системы, а именно различных модуляций альфа-ритма, с воспроизведением на модели динамики сигнала в ходе нейробиоуправления.
Материалы и методы. Экспериментальная часть работы — резонансное нейробиоуправление с двойной обратной связью на базе программно-аппаратного комплекса BioFeedBack2 — проводилась по гибридному протоколу: фон — до/после: 2-минутная запись фоновой вертексной ЭЭГ (активный электрод — Сz, заземляющий и референтный электроды на мочках ушей); cканирование по частоте — 210 с: воздействие импульсным инфракрасным излучением с сальтаторно нарастающей частотой от 8 до 14 Гц (шаг по частоте — 0,1 Гц, шаг по времени — 3 с) и музыкоподобным звуковым сигналом, тональность и громкость которого определяются пиковой амплитудой в спектре текущей ЭЭГ в диапазоне 8–14 Гц. Характеристическое время обратной связи — 10 мс, точность по частоте — 0,2–0,4 Гц. В звуковой сигнал добавлены периодические шумовые импульсы, предъявляемые с частотой, соответствующей фоновой ЧСС.
Для расчетов использована ранее разработанная феноменологическая модель элементарной таламокортикальной ячейки, включающая в себя взаимодействующие модули, соответствующие таким нейронным модулям мозга, как таламус, кора и ретикулярные ядра таламуса.
Результаты и обсуждение. На феноменологической математической модели элементарной таламокортикальной ячейки получены частотно-временные отклики модельного сигнала, повторяющего частотное поведение реального сигнала ЭЭГ. Модель воспроизводит эффект изменения базового альфа-ритма внешним воздействием, для которого известны параметры таламокортикальной системы. В дальнейшем эта информация позволит усовершенствовать существующие процедуры биоуправления с обратной связью, способствующие активизации познавательной деятельности человека, так как известно, что путем проведения комплекса тренировок удается управлять частотой альфа-ритма (нейробиоуправление) таким образом, что у испытуемых по объективным показателям психофизической диагностики происходит усиление когнитивной деятельности, а по их субъективным оценкам — улучшается самочувствие в целом.
Заключение. В работе продемонстрирован нейроинформационный подход к персонализированному управлению ритмами мозга: на феноменологической модели таламокортикальной ячейки удается воспроизводить индивидуальные особенности сложной системы обработки информации.
Введение
Задачей сегодняшнего дня является персонализированный подход к медицинской диагностике, исследованиям и оказанию медицинской помощи [1, 2]. Для развития этого актуального направления необходимо совершенствование симуляторов сложных систем, позволяющих наглядно продемонстрировать наличие взаимных связей, прямых и обратных, между диагностической информацией (например, между сигналами ЭЭГ или ЭКГ) и информационными маркерами психофизического состояния обследуемого человека (объективными, полученными в результате измерений, и субъективными, полученными путем опроса). Технологии «интерфейс мозг–компьютер» [3] и «нейробиоуправление» направлены на достижение именно этой цели. В основе технологий лежат методы модуляции активности мозга с помощью сигналов обратной связи от биопотенциалов мозга, в частности от собственных ритмических процессов человека, а именно его ЭЭГ, что и является нейробиоуправлением [4, 5]. Феноменологическая модель служит примером симулятора сложной системы преобразования сигналов человеком.
Цель исследования — оценить возможность применения феноменологической математической модели элементарной таламокортикальной ячейки для описания частотно-временных откликов реальной таламокортикальной системы, а именно различных модуляций альфа-ритма, с воспроизведением на модели динамики сигнала в ходе нейробиоуправления.
В задачи входило выявить, как преобразуется сигнал в обрабатывающей информацию таламокортикальной системе; что произойдет, если в систему подать частотно-модулированный сигнал с линейно увеличивающейся частотой.
Материалы и методы
Описание нейронных модулей феноменологической модели таламокортикальной системы. В экспериментальных нейрофизиологических исследованиях выявлено, что взаимосвязанные нейрональные модули: кора, ретикулярные ядра таламуса, специфический таламус — играют важную роль в процессах обработки информации. Взаимодействующие звенья таламокортикальной цепи определяют архитектуру феноменологической модели таламокортикальной ячейки.
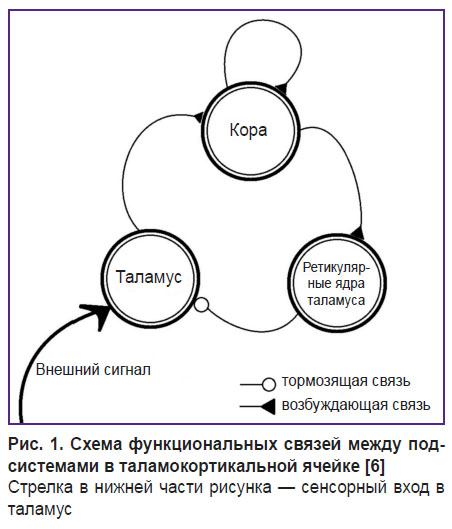
В реальности структура одного нейронного модуля состоит из ансамблей пирамидных нейронов и тормозных интернейронов коры, нейронов специфических таламических ядер и тормозных нейронов ретикулярного ядра таламуса, связанных между собой. Схема межмодульного взаимодействия показана на рис. 1 [6]. Таламус — сложное полифункциональное образование, включающее релейные ядра, где переключается афферентация от органов чувств в соответствующие области коры больших полушарий. Другими словами, в специфических (сенсорных, или релейных) ядрах таламуса происходит синаптическое переключение сенсорной информации с аксонов восходящих афферентных путей на следующие, конечные, нейроны, отростки которых идут в соответствующие сенсорные проекционные области коры больших полушарий. Например, специфическим ядром зрительной сенсорной системы является латеральное коленчатое тело, имеющее прямые связи с затылочными (зрительными) проекционными областями коры больших полушарий [6].
|
Рис. 1. Схема функциональных связей между подсистемами в таламокортикальной ячейке [6]
Стрелка в нижней части рисунка — сенсорный вход в таламус |
В нормальных условиях функционирования в таламокортикальной системе происходит следующее: 1) внешний сигнал активирует вначале нейроны специфического (релейного) ядра таламуса; 2) по таламокортикальному пути возбуждение поступает в кору, причем корковые пирамидные нейроны связаны с тормозными интернейронами, которые могут определенным образом модулировать их активность; 3) дальнейшее распространение возбуждения происходит по нисходящим корково-таламическим путям к специфическому и ретикулярному ядрам таламуса; 4) последнее связано с релейным ядром таламуса тормозными связями и может прерывать поступление возбуждения из специфического таламического ядра в кору.
Ретикулярное ядро таламуса является своеобразными воротами для сенсорной информации, поступающей в кору. Оно не имеет прямого выхода на кору, но вместе с тем получает входные сигналы от коры и других ядер таламуса и, по-видимому, выполняет функцию внутриталамического регулятора.
Тормозное действие ретикулярных ядер таламуса пресекает «строб» активности, во время которого, например, происходит выделение признака исходного сенсорного сигнала в коре головного мозга человека и животных; за ним следует период неактивности. В результате после прохождения входного сигнала через таламокортикальную систему на коре формируется прерывистое, стробированное представление исходного сенсорного сигнала.
В работе рассматривается сосредоточенная модель функционирования таламокортикальной системы без учета строения внутренних структурных модулей системы: таламическое специфическое ядро; тормозное ретикулярное неспецифическое ядро таламуса; кора, связанная с ядрами таламуса [7].
Для расчетов использована ранее разработанная феноменологическая модель элементарной таламокортикальной ячейки [7], включающая в себя взаимодействующие модули, соответствующие таким нейронным модулям мозга, как таламус, кора и ретикулярные ядра таламуса. Данная феноменологическая модель, которая соответствует схеме на рис. 1, описывается системой дифференциальных уравнений для моделирования обработки внешнего сигнала между таламусом, корой и ретикулярными ядрами таламуса:
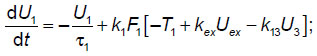
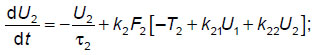
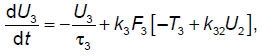
где U1, U2, U3 — усредненная активность нейронов выбранных участков таламуса, коры и ретикулярных ядер таламуса соответственно;  i — характерное время затухания активности в соответствующих нейронных ансамблях; ki — амплитуда генерации импульсной активности соответствующими нейронными ансамблями; Ti — усредненные значения для порогов возбуждения соответствующих нейронных ансамблей; Uex — входной сигнал, поступающий на таламус; kij — коэффициенты взаимной связи между подсистемами в таламокортикальной ячейке; Fi[ ] — ступенчато-образные функции, крутизна которых характеризует разброс величин порогов около усредненных значений в рассматриваемом ансамбле (другое название: функции энергообеспечения); в квадратных скобках — аналог постсинаптического потенциала на мембранах соответствующих ансамблей нейронов; i=1, 2, 3.
i — характерное время затухания активности в соответствующих нейронных ансамблях; ki — амплитуда генерации импульсной активности соответствующими нейронными ансамблями; Ti — усредненные значения для порогов возбуждения соответствующих нейронных ансамблей; Uex — входной сигнал, поступающий на таламус; kij — коэффициенты взаимной связи между подсистемами в таламокортикальной ячейке; Fi[ ] — ступенчато-образные функции, крутизна которых характеризует разброс величин порогов около усредненных значений в рассматриваемом ансамбле (другое название: функции энергообеспечения); в квадратных скобках — аналог постсинаптического потенциала на мембранах соответствующих ансамблей нейронов; i=1, 2, 3.
Так как все внешние входы коры связаны с таламическими структурами, на модели проведены расчеты сигналов и их спектров в случае частотной модуляции таламического сигнала внешним сигналом с линейно возрастающей частотой.
Входной сенсорный сигнал является частотно-модулированным (в психофизическом эксперименте он аналогичен инфракрасному высокочастотному модулированному сигналу по отношению к собственной частоте сигнала ЭЭГ). Сигнал от переменной коры аналогичен интегральному биоэлектрическому сигналу ЭЭГ.
Протокол нейробиоуправления. Резонансное нейробиоуправление с двойной обратной связью на базе программно-аппаратного комплекса BioFeedBack2 проводится по гибридному протоколу: фон — до/после: 2-минутная запись фоновой вертексной ЭЭГ (активный электрод — Сz, заземляющий и референтный электроды на мочках ушей); cканирование по частоте — 210 с: воздействие импульсным инфракрасным излучением с сальтаторно нарастающей частотой от 8 до 14 Гц (шаг по частоте — 0,1 Гц, шаг по времени — 3 с) и музыкоподобным звуковым сигналом, тональность и громкость которого определяются пиковой амплитудой в спектре текущей ЭЭГ в диапазоне 8–14 Гц. Характеристическое время обратной связи — 10 мс, точность по частоте — 0,2–0,4 Гц. В звуковой сигнал добавлены периодические шумовые импульсы, предъявляемые с частотой, соответствующей фоновой ЧСС [1, 5].
В ходе эксперимента мерцающая (с линейно увеличивающейся частотой) инфракрасная лампа направлена на закрытые глаза испытуемого. ЭЭГ снимается до воздействия на него импульсным инфракрасным излучением, в процессе воздействия и после воздействия. Далее выполняется построение динамического спектра сигнала.
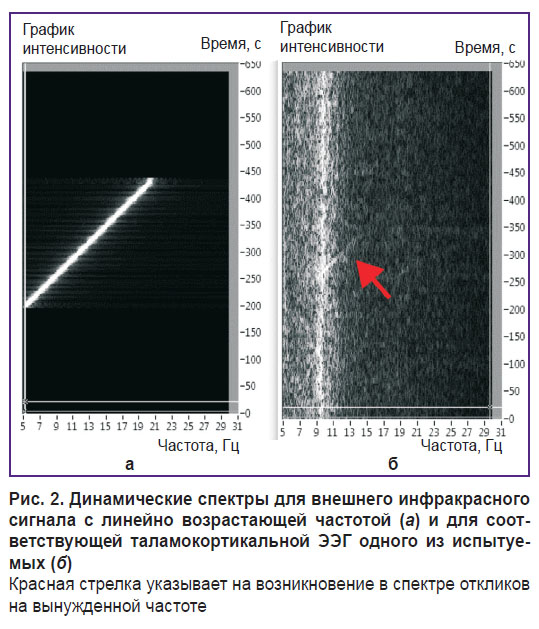
В норме динамический спектр сигналов ЭЭГ от человека имеет вид, показанный на рис. 2, б. Различиями для каждого отдельного испытуемого являются лишь основная собственная частота альфа-ритма в диапазоне от 8 до 12 Гц и ширина спектрального размытия вокруг нее.
Установлено, что, находясь под внешним воздействием, таламокортикальная система испытуемого работает в режиме вынужденных колебаний в течение определенного интервала времени (см. рис. 2). Этот интервал появляется в момент, когда частота внешнего сигнала выше собственной частоты таламокортикальной системы, и существует до тех пор, пока частота внешнего сигнала не станет настолько большой, что испытуемый будет воспринимать его как постоянный, с амплитудой, равной средней величине периодического сигнала. Этот динамический режим соответствует вынужденным колебаниям заполнения с автоколебательной огибающей и очень хорошо виден на ЭЭГ при наложении на нее формы внешнего сигнала.
Результаты и обсуждение
В данной работе из всех параметров менялась только величина внешнего сигнала Uex. Численные значения параметров: ki=1, i=1, 2, 3;  i=1, i=1, 2, 3; T1=0; T2=0,5; T3=0,5; kex=1; k13=1; k21=1; k22=0; k32=1. Использовалась плавно меняющаяся функция энергообеспечения Fi[]=0,5+0,5·tanh(20[]).
i=1, i=1, 2, 3; T1=0; T2=0,5; T3=0,5; kex=1; k13=1; k21=1; k22=0; k32=1. Использовалась плавно меняющаяся функция энергообеспечения Fi[]=0,5+0,5·tanh(20[]).
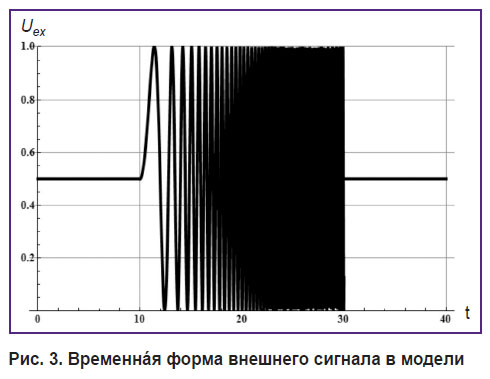
Для Uex был взят сигнал, представленный на рис. 3, который аналогичен экспериментальному: частота осциллирующей части линейно возрастает.
|
Рис. 3. Временнáя форма внешнего сигнала в модели |
Отклик таламуса (U1) для такого типа внешнего сигнала показан на рис. 4.
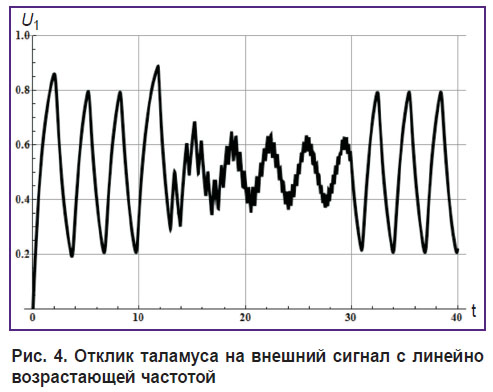 |
Рис. 4. Отклик таламуса на внешний сигнал с линейно возрастающей частотой |
Рис. 3. и 4 демонстрируют три состояния системы: перед внешним воздействием, в процессе внешнего высокочастотного воздействия и после него. Все состояния характеризуются собственной частотой таламокортикальной системы, которая зависит от средней величины внешнего сигнала [7].
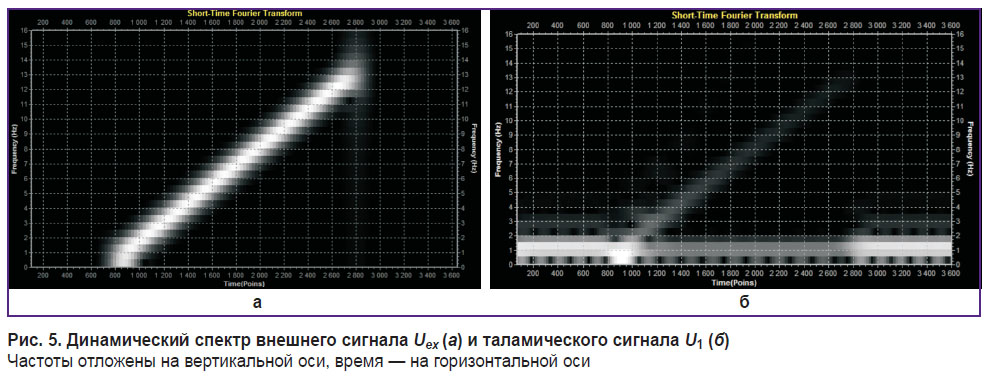
«Высокочастотное воздействие» означает, что частота внешнего сигнала существенно больше собственной частоты таламокортикальной ячейки. Динамические спектры для обоих (внешнего и таламического) сигналов изображены на рис. 5.
|
Рис. 5. Динамический спектр внешнего сигнала Uex (а) и таламического сигнала U1 (б) Частоты отложены на вертикальной оси, время — на горизонтальной оси |
Таким образом, с помощью феноменологической математической модели элементарной таламокортикальной ячейки получены частотно-временные отклики модельного сигнала, повторяющего частотное поведение реального сигнала ЭЭГ [8, 9]. Модель воспроизводит эффект изменения базового альфа-ритма под внешним воздействием, для которого известны параметры таламокортикальной системы. Эта информация даст возможность усовершенствовать существующие процедуры биоуправления с обратной связью, способствующие активизации когнитивной деятельности человека. Проведение комплекса тренировок позволит управлять частотой альфа-ритма (нейробиоуправление) таким образом, что у испытуемых по объективным показателям психофизической диагностики будет происходить усиление когнитивной деятельности, а по их субъективным оценкам — улучшаться самочувствие в целом.
Заключение
Продемонстрирован нейроинформационный подход к персонализированному управлению ритмами мозга: на феноменологической модели таламокортикальной ячейки удается воспроизводить индивидуальные особенности сложной системы обработки информации.
Благодарность. Авторы выражают благодарность А.А. Тельных (ИПФ РАН, Н. Новгород) за программное обеспечение Signal-Spectrum View, которое было использовано для построения динамических спектров сигналов.
Финансирование исследования. Работа выполнена при поддержке Российского фонда фундаментальных исследований (гранты №18-013-01225 A, №19-015-00195 А) Министерства образования и науки РФ (проект №14.Y26.31.0022).
Конфликт интересов. Авторы подтверждают отсутствие конфликтов интересов.
Литература
- Федотчев А.И., О Сан Чжун, Бондарь А.Т., Семенов В.С. Современные возможности и подходы к активизации когнитивной деятельности и процессов обучения у человека. Пущино: ИБК РАН; 2017.
- Hammond D.C. What is neurofeedback: an update. J Neurother 2011; 15(4): 305–336, https://doi.org/10.1080/10874208.2011.623090.
- Miranda R.A., Casebeer W.D., Hein A.M., Judy J.W., Krotkov E.P., Laabs T.L., Manzo J.E., Pankratz K.G., Pratt G.A., Sanchez J.C., Weber D.J., Wheeler T.L., Ling G.S. DARPA-funded efforts in the development of novel brain–computer interface technologies. J Neurosci Methods 2015; 244: 52–67, https://doi.org/10.1016/j.jneumeth.2014.07.019.
- Fedotchev А.I., Parin S.B., Polevaya S.A., Velikova S.D. Brain-computer interface and neurofeedback technologies: current state, problems and clinical prospects (review). Sovremennye tehnologii v medicine 2017; 9(1): 175, https://doi.org/10.17691/stm2017.9.1.22.
- Федотчев А.И., Бондарь А.Т., Бахчина А.В., Парин С.Б., Полевая С.А., Радченко Г.С.. Музыкально-акустические воздействия, управляемые биопотенциалами мозга, в коррекции неблагоприятных функциональных состояний. Успехи физиологических наук 2016; 47(1): 69–79.
- Coulter D.A. Thalamocortical anatomy and physiology. In: Engel J. Jr., Pedley T.A. (editors). Epilepsy: a comprehensive textbook. Philadelphia: Lippincott Williams & Wilkins; 2007; p. 353–366.
- Колосов А.В., Нуйдель И.В., Яхно В.Г. Исследование динамических режимов в математической модели элементарной таламокортикальной ячейки. Известия высших учебных заведений. Прикладная нелинейная динамика 2016; 24(5): 72–83, https://doi.org/10.18500/0869-6632-2016-24-5-72-83.
- Bondar A., Shubina L. Nonlinear reactions of limbic structure electrical activity in response to rhythmical photostimulation in guinea pigs. Brain Res Bull 2018; 143: 73–82, https://doi.org/10.1016/j.brainresbull.2018.10.002.
- Fedotchev A.I., Bondar A.T., Bakhchina A.V., Grigorieva V.N., Katayev A.A., Parin S.B., Radchenko G.S., Polevaya S.A. Transformation of patient’s EEG oscillators into music-like signals for correction of stress-induced functional states. Sovremennye tehnologii v medicine 2016; 8(1): 93–98, https://doi.org/10.17691/stm2016.8.1.12.