Метаболизм лекарственного средства стероидной структуры Гестобутаноила, обладающего гестагенной активностью
Цель исследования — изучение метаболизма средства стероидной структуры с гестагенной активностью Гестобутаноила в эксперименте с введением готовой лекарственной формы — таблеток Гестобутаноила 2 мг — экспериментальным животным (крысы и кролики).
Материалы и методы. Проводился анализ биопроб, полученных от разных видов животных: крыс-самок массой 200,0±60,0 г и кроликов-самок массой 3,0±0,2 кг, которым однократно или многократно вводили разные дозы препарата. Метаболиты идентифицировались методом высокоэффективной жидкостно-хроматографической масс-спектрометрии (ВЭЖХ-МС).
Результаты. Анализ показал, что Гестобутаноил быстро метаболизируется с образованием метаболитов 17α-ацетокси-3β-гидрокси-6-метилпрегна-4,6-диен-20-он (АМП-17) и 17-гидрокси-6-метилпрегна-1,4-диен-3,20-дион в виде ацетата (МА), что, по всей вероятности, связано в первую очередь с наличием в его молекуле радикала масляной кислоты в положении 3β, отщепляющегося в ходе биотрансформации. Полученные фармакокинетические параметры метаболитов указывают, что метаболизм Гестобутаноила носит ступенчатый характер: время достижения максимальной концентрации АМП-17 составило 1,5 ч, МА — 3 ч. Метаболит АМП-17 лучше проникает в периферические ткани, чем МА.
Заключение. Полученные данные указывают на уникальный, отличающийся от других гестагенов метаболизм вещества Гестобутаноила. Если для известного гестагена медроксипрогестерона ацетата основной путь превращения — гидроксилирование стероидного ядра молекулы при его достаточно высокой биодоступности в неизменном состоянии, то для Гестобутаноила — это быстрая биотрансформация в метаболиты АМП-17 и МА, обладающие собственной гестагенной активностью, c высвобождением масляной кислоты, которая, в свою очередь, может обусловливать успокаивающее действие на ЦНС.
Введение
Объектом исследования являлось инновационное лекарственное средство в форме таблеток на основе стероидного соединения 17α-ацетокси-3β-окси-6-метилпрегна-4,6-диен-20-он (в форме бутаноата) — Гестобутаноил — для гормональной заместительной терапии гестагенной недостаточности, в частности его метаболизм на экспериментальных животных — крысах и кроликах.
Лекарственное средство и его активная субстанция были разработаны в Российском национальном исследовательском медицинском университете им. Н.И. Пирогова для коррекции состояний гестагенной недостаточности у женщин. Ранее была показана высокая специфическая фармакологическая активность субстанции Гестобутаноила, превосходящая препараты сравнения — прогестерон и левоноргестрел — в 102 и 20 раз соответственно [1, 2]. Исследована острая, хроническая и специфическая токсичность таблеток Гестобутаноил 2 мг, позволяющая отнести разработанное лекарственное средство к малотоксичным веществам четвертого класса токсичности [3].
Обязательным компонентом доклинического исследования новых лекарственных средств является также изучение их метаболизма: качественный и количественный анализ продуктов биотрансформации фармакологического средства, изучение межвидовых различий метаболизма [4].
Цель исследования — изучение метаболизма готовой лекарственной формы средства стероидной структуры с гестагенной активностью Гестобутаноила в биологических жидкостях крыс и кроликов после перорального введения таблеток Гестобутаноила 2 мг.
Материалы и методы
В работе использованы таблетки Гестобутаноил, содержащие 2 мг бутилового эфира 17α-ацетокси-3β-окси-6-метилпрегна-4,6-диен-20-он в качестве активной фармацевтической субстанции, поливиниловый спирт (4 мг) и PROSOLV® EASYTab SP (94 мг) в качестве вспомогательных веществ, наработанные в Российском национальном исследовательском медицинском университете им. Н.И. Пирогова (проект ФСП, номер госрегистрации: AAAA-A17-117052950002-8). Субстанция 17α-ацетокси-3β-гидрокси-6-метилпрегна-4,6-диен-20-он (АМП-17) была синтезирована в Федеральном исследовательском центре «Биоинженерия» РАН, субстанция 17-гидрокси-6-метилпрегна-1,4-диен-3,20-дион в виде ацетата (МА) произведена фирмой Sigma (США).
Животным вводили измельченные таблетки в виде суспензии в 0,5% растворе карбоксиметилцеллюлозы (КМЦ). В стеклянный стакан отвешивали 2 г КМЦ (Merck, Германия), добавляли 400 мл горячей (60–70ºС) дистиллированной воды и при длительном перемешивании на магнитной мешалке RH basic (IKA, Германия) получали однородный 0,5% гель КМЦ. Суспензию таблеток готовили в фарфоровой ступке, растирая таблетки с небольшим количеством геля КМЦ и 1 мл полисорбата Твин-80. Объем суспензии доводили до необходимого, смешивая содержимое ступки и гель КМЦ в стеклянном стакане при помощи магнитной мешалки.
Идентификацию и количественное определение метаболитов выполняли на высокоэффективном жидкостном хроматографе Ultimate 3000 (Dionex, Германия) с масс-детектором MicrOTOF-Q II (Bruker, Германия) методом, описанным в работе [5].
Сыворотку крови получали от двух видов экспериментальных животных: крыс-самок массой 200,0±60,0 г и кроликов-самок массой 3,0±0,2 кг (питомник «Столбовая», Чехов, Московская область). Основные условия содержания и ухода соответствовали СП 2.2.1.3218-14 от 29.08.2014 г. N 51, ГОСТ 33044-2014 и Приказу МЗ СР РФ №199н от 01.04.2016 г.
Крысы и кролики лишались корма накануне введения препарата (18 ч до начала эксперимента). Отбор крови у крыс осуществляли при декапитации, у кроликов — катетером из ушной вены. Сыворотку получали центрифугированием крови при 3000 об./мин в течение 5 мин в центрифуге MiniSpin (Eppendorf, Германия).
На основании данных о фармакокинетике препарата сравнения медроксипрогестерона ацетата, близкого по химической структуре и механическим свойствам [6, 7], было решено принять за основную рабочую дозу 25 мг/кг Гестобутаноила. В предварительных экспериментах при дозе 25 мг/кг были обнаружены только его метаболиты: АМП-17 и МА. Аналитическая методика с пределом количественного определения Гестобутаноила 10 нг/мл не позволяла обнаружить препарат в сыворотке крови крыс. Для уточнения метаболизма, а также возможности получить кинетику самого Гестобутаноила было принято решение об увеличении доз: крысам вводили 50, 100 и 250 мг/кг, кроликам — 50 мг/кг. Выбранные рабочие дозы не превышали LD50 Гестобутаноила, определенную ранее как >5 г/кг [3].
Результаты и обсуждение
Анализ биопроб, полученных от разных видов животных, показал, что Гестобутаноил подвергается быстрой биотрансформации с образованием метаболитов АМП-17 и МА, что, по всей вероятности, связано в первую очередь с наличием в его молекуле радикала масляной кислоты в положении 3β, отщепляющегося в ходе биотрансформации. В сыворотке крови крыс и кроликов Гестобутаноил не определялся даже на первых временных точках (0,25 ч; 0,75 ч) после введения. Изучение фармакокинетики препарата проводили косвенно по его метаболитам. На рис. 1 представлены структурные формулы Гестобутаноила и его метаболитов АМП-17 и МА.
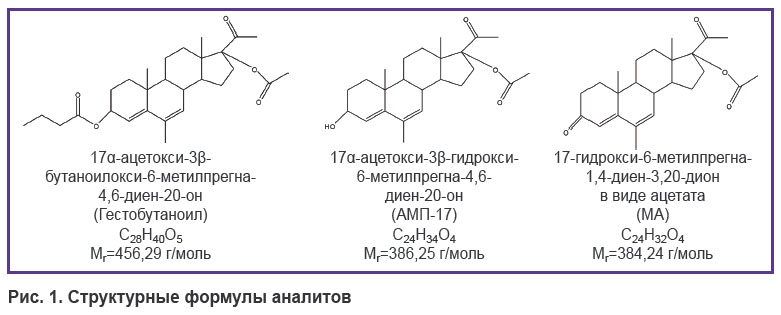
|
Рис. 1. Структурные формулы аналитов |
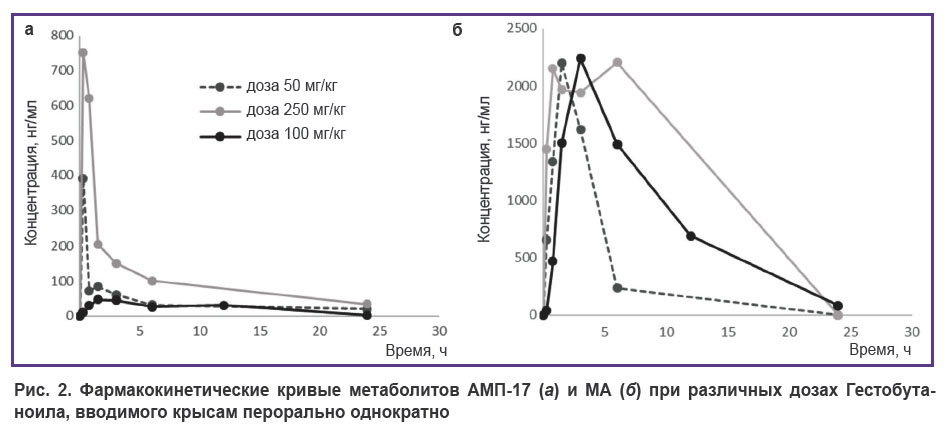
Фармакокинетика Гестобутаноила в сыворотке крови при однократном введении крысам. На рис. 2 представлены фармакокинетические кривые метаболитов АМП-17 и МА в сыворотке крови крыс, полученные при однократном пероральном введении Гестобутаноила в дозах 50, 100 и 250 мг/кг.
|
Рис. 2. Фармакокинетические кривые метаболитов АМП-17 (а) и МА (б) при различных дозах Гестобутаноила, вводимого крысам перорально однократно |
Эти кривые убедительно свидетельствуют, что достижение максимальной концентрации метаболита АМП-17 (Tmax=0,25–1,5 ч) в сыворотке крови происходит быстрее, чем МА, для которого Tmax=1,5–6 ч после введения Гестобутаноила. Исследования линейности фармакокинетики показали, что максимальная концентрация (Cmax) метаболитов не зависит от дозы Гестобутаноила. Значения Cmax для АМП-17 составили 390,4; 47,0 и 750,9 нг/мл для доз 50, 100 и 250 мг/кг соответственно. Максимальные концентрации МА при разных дозах были практически одинаковыми: 2196,0; 2238,2 и 2205,0 нг/мл для доз 50, 100 и 250 мг/кг соответственно. Доза препарата 250 мг/кг дает плато высокой концентрации МА в сыворотке крови животных — с 0,75 до 6 ч, что указывает на проявление эффекта насыщения ферментов субстратом, при котором достигается максимальная скорость реакции биотрансформации.
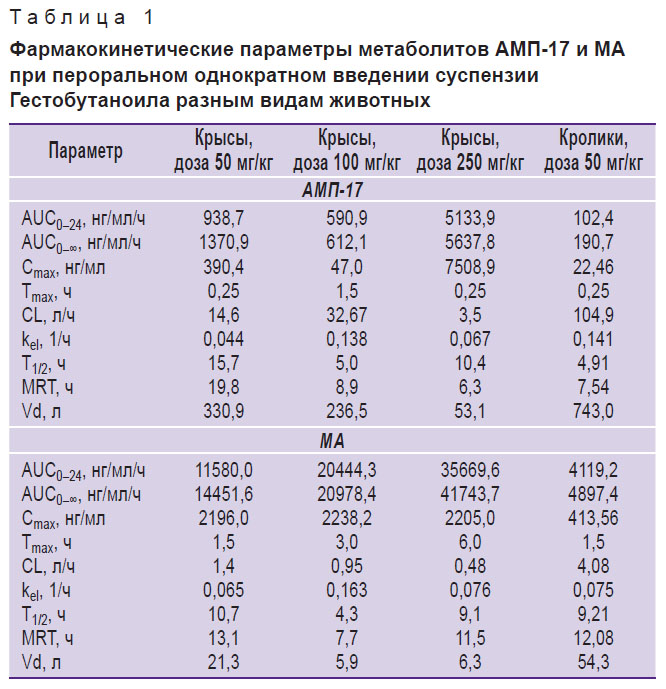
В табл. 1 приведены рассчитанные фармакокинетические параметры метаболитов АМП-17 и МА у крыс для трех доз. Площадь под фармакокинетической кривой (AUC), характеризующая биодоступность, рассчитанная для МА, имеет линейный характер зависимости от дозы введенного Гестобутаноила в диапазоне доз 50–250 мг/кг. Биодоступность АМП-17, как и Cmax, не зависит от дозы, что указывает на сильное влияние внешних факторов на этот путь биотрансформации Гестобутаноила.
|
Таблица 1. Фармакокинетические параметры метаболитов АМП-17 и МА при пероральном однократном введении суспензии Гестобутаноила разным видам животных |
Метаболит АМП-17 сравнительно с МА отличается бóльшим объемом распределения, что свидетельствует, по всей вероятности, о его более активном поступлении в периферические ткани и интенсивном метаболизме молекулы АМП-17. Периоды полуэлиминации двух метаболитов из крови практически одинаковы и изменяются в пределах 5,0–15,7 ч для АМП-17 и 4,3–10,7 ч — для МА. Константы элиминации (kel) для метаболитов составляют 0,044–0,138 ч–1 для АМП-17 и 0,065–0,163 ч–1 — для МА. Клиренс (CL) АМП-17 имеет большие разбросы и составляет 14,6; 32,67 и 3,5 л/ч для доз 50, 100 и 250 мг/кг соответственно. У метаболита МА клиренс равен 1,4; 0,95 и 0,48 л/ч для доз 50, 100 и 250 мг/кг соответственно. Показатель MRT (среднее резидентное время, англ. mean residence time) составляет 6,3–19,8 ч для АМП-17 и 7,7–13,1 ч — для МА.
Непропорциональное увеличение значений Cmax при повышении дозы Гестобутаноила и зависимость таких фармакокинетических параметров, как объем распределения Vd, константа элиминации метаболитов kel, CL, период полувыведения Т1/2 и MRT от дозы, указывают на нелинейный характер фармакокинетики метаболитов Гестобутаноила.
Фармакокинетика Гестобутаноила при однократном введении кроликам. Согласно Руководству по экспертизе лекарственных средств [4], сравнение фармакокинетики на разных видах животных можно проводить на одной дозе. Выбранная доза для кроликов 50 мг/кг была достаточной с точки зрения чувствительности аналитического метода для исследования различий в фармакокинетике у крыс и кроликов. Поскольку на крысах фармакокинетика при дозе 50 мг/кг описана (табл. 1), то для кроликов выбрали эту же дозу.
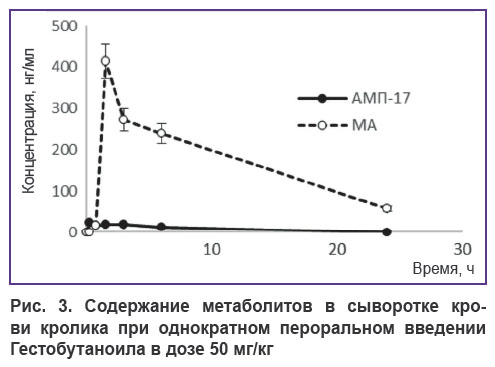
На рис. 3 представлены фармакокинетические кривые метаболитов АМП-17 и МА, обнаруженных в сыворотке крови кроликов, получавших при однократном пероральном введении Гестобутаноил в дозе 50 мг/кг.
|
Рис. 3. Содержание метаболитов в сыворотке крови кролика при однократном пероральном введении Гестобутаноила в дозе 50 мг/кг |
Из рис. 3 видно, что в сыворотке крови кроликов Cmax АМП-17 составляет 22,5 нг/мл, Cmax МА — 413,6 нг/мл. В табл. 1 представлены рассчитанные фармакокинетические параметры метаболитов АМП-17 и МА. АМП-17 имеет большой объем распределения (Vd=743,0 л) по сравнению с МА, у которого Vd=54,3 л. У кроликов kel равны 0,141 и 0,075 ч–1 для АМП-17 и МА соответственно. Клиренс АМП-17 составляет 104,9 л/ч, МА — 4,08 л/ч. Т1/2 АМП-17 — 4,91; МА — 9,21; MRT — 7,54 и 12,08 для АМП-17 и МА соответственно.
Представленные данные позволяют сделать вывод о наличии общих закономерностей в метаболизме Гестобутаноила у крыс и кроликов. Различия в фармакокинетике у сравниваемых видов животных присутствуют на уровне биодоступности определяемых метаболитов. С увеличением массы тела животных от вида к виду наблюдалось уменьшение AUC и Cmax. Впрочем, говорить однозначно о снижении биодоступности Гестобутаноила по его метаболитам невозможно. Стоит также принимать во внимание, что снижение биодоступности не обязательно ведет к снижению эффективности препарата, поскольку уменьшение общего количества циркулирующего вещества в крови не доказывает уменьшения количества вещества в месте действия или органе-мишени.
Время достижения максимальной концентрации у крыс и кроликов коррелировало между собой только для одной дозы — 50 мг/кг. При этом Tmax АМП-17 всегда было меньше, чем Tmax МА, и у крыс, и у кроликов. Увеличение CL и Vd, по всей видимости, связано лишь с увеличением массы тела животного.
Параметры, характеризующие элиминацию АМП-17 из организма, не воспроизводятся у разных видов при разных дозах, что указывает на нелинейный характер фармакокинетики метаболита.
В случае МА фармакокинетические параметры для дозы 50 мг/кг показывают, что элиминация и у крыс, и у кроликов происходит одинаково. Межвидовые различия в фармакокинетике МА практически отсутствуют.
Фармакокинетика Гестобутаноила при многократном введении крысам. При многократном введении нет необходимости проводить исследования в различных дозах. Поэтому фармакокинетику Гестобутаноила при многократном введении изучали на крысах. Для многократного введения была выбрана минимальная из изученных при однократном введении доз — 50 мг/кг, чтобы избежать проявления возможных токсических эффектов (имеется в виду возможное накопление в организме самого вещества и его метаболитов).
Фармакокинетические кривые метаболитов АМП-17 и МА, представленные по средним концентрациям, обнаруженным в сыворотке крови крыс, которым вводили Гестобутаноил многократно в течение 5 дней в дозе 50 мг/кг, отображают кинетические зависимости, полученные на 5-е сутки эксперимента (рис. 4).
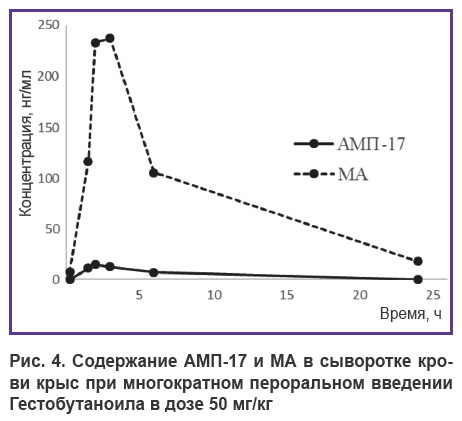 |
Рис. 4. Содержание АМП-17 и МА в сыворотке крови крыс при многократном пероральном введении Гестобутаноила в дозе 50 мг/кг |
Кинетические кривые метаболитов при многократном введении имеют схожую форму с кривыми, полученными при однократном введении (см. рис. 2). На основании этого можно сделать предположение, что эффект накопления вещества Гестобутаноила и его метаболитов отсутствует. Время достижения максимальных концентраций составляет 2 и 3 ч для АМП-17 и МА после введения Гестобутаноила. Максимальные концентрации АМП-17 и МА — 15,1 и 237,2 нг/мл соответственно, что значительно меньше, чем в эксперименте с однократным введением той же дозы.
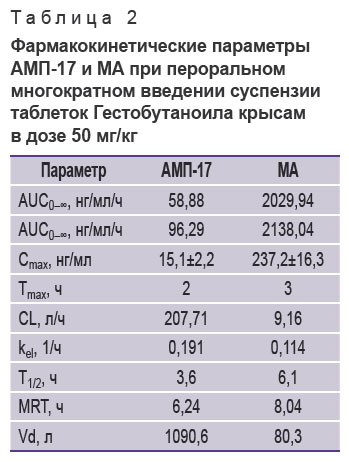
Сравнение AUC метаболитов (табл. 2) также показало их уменьшение по сравнению с данными табл. 1. Это, по-видимому, указывает на насыщение ферментных систем, осуществляющих биотрансформацию Гестобутаноила, вводимого многократно, по сравнению с таковым при однократном введении. При этом значения Vd у каждого метаболита в эксперименте с многократным введением Гестобутаноила, напротив, увеличились: они составили 1090,6 и 80,3 л для АМП-17 и МА соответственно. С повышением объема распределения увеличился CL. При многократном введении Гестобутаноила у АМП-17 он составил 207,71 л/ч, у МА — 9,16 л/ч.
|
Таблица 2. Фармакокинетические параметры АМП-17 и МА при пероральном многократном введении суспензии таблеток Гестобутаноила крысам в дозе 50 мг/кг |
Изменение кинетических параметров, описывающих выведение метаболитов из организма при смене однократного режима дозирования на многократное, практически отсутствует. Период полуэлиминации для АМП-17 составил 3,6 ч, для МА — 6,1 ч. Константы элиминации kel в эксперименте с многократным введением — 0,191 ч–1 для АМП-17 и 0,114 ч–1 для МА.
Заключение
Изучение метаболизма инновационного лекарственного средства стероидной структуры с гестагенной активностью — таблеток Гестобутаноил 2 мг in vivo на кроликах и крысах с использованием метода
высокоэффективной жидкостно-хроматографической масс-спектрометрии показало, что Гестобутаноил быстро метаболизируется с образованием метаболитов АМП-17 и МА. Полученные фармакокинетические параметры для метаболитов указывают, что метаболизм Гестобутаноила носит ступенчатый характер: время достижения максимальной концентрации АМП-17 составило 1,5 ч, МА — 3 ч. В сравнении с МА метаболит АМП-17 лучше проникает в периферические ткани. Установлено, что фармакокинетика метаболитов нелинейна. При введении больших доз Гестобутаноила эффект насыщения ферментов приводит к образованию плато на фармакокинетической кривой МА.
Сравнительные исследования фармакокинетики у крыс и кроликов показали, что в целом межвидовые различия в метаболизме Гестобутаноила отсутствуют. По сравнению с крысами у кроликов наблюдалось снижение показателей Cmax и AUC.
Фармакокинетические параметры при многократном введении Гестобутаноила крысам в течение 5 дней показали отсутствие эффекта накопления и депонирования метаболитов. Однако наблюдаемые изменения в фармакокинетике указывали на замедление метаболизма, что означало присутствие эффекта насыщения ферментных систем.
Полученные данные указывают на уникальный, кардинально отличающийся от других гестагенов метаболизм вещества Гестобутаноила. Если для известного медроксипрогестерона ацетата основной путь превращения — гидроксилирование стероидного ядра молекулы [8, 9] при его достаточно высокой биодоступности в неизменном состоянии [6], то для Гестобутаноила — это быстрая биотрансформация в метаболиты АМП-17 и МА, обладающие собственной гестагенной активностью [10], c высвобождением масляной кислоты, которая может обусловливать успокаивающее действие на ЦНС крыс [3].
Финансирование исследования. Работа поддержана грантом Российского фонда фундаментальных исследований №19-015-00195\19.
Конфликт интересов. Авторы декларируют отсутствие конфликтов интересов, о которых необходимо сообщить.
Литература
- Сергеев П.В., Федотчева Т.А., Ржезников В.М., Гриненко Г.С., Семейкин А.В., Ветчинкина В.Б., Атрошкин К.А., Шимановский Н.Л. Новый отечественный гестаген с противоопухолевой активностью. Вестник Российской академии медицинских наук 2007; 5: 27–32.
- Сергеев П.В., Ржезников В.М., Корхов В.В., Гриненко Г.С., Семейкин А.В., Маяцкая Е.Е., Самойликов Р.В., Шимановский Н.Л. Исследование гестагенной активности 17α-ацетокси-3β-бутаноилокси-6-метил-прегна-4,6-диен-20-она. Химико-фармацевтический журнал 2005; 39(7): 20–22.
- Шеина Н.И., Паршин В.А., Рыбаков Ю.Л., Гукасов В.М., Костяева М.Г., Семейкин А.В., Самойликов Р.В., Федотчева Т.А., Шимановский Н.Л. Оценка токсичности нового гестагена гестобутаноила в эксперименте на крысах и мышах. Экспериментальная и клиническая фармакология 2018; 81(11): 18–25.
- Руководство по экспертизе лекарственных средств. Т. I. М: Гриф и К; 2013.
- Степанова Е.С., Макаренкова Л.М., Чистяков В.В., Рыбаков Ю.Л., Гукасов В.М., Федотчева Т.А., Паршин В.А., Вотяков В.А., Шимановский Н.Л. ВЭЖХ-МС методика одновременного количественного определения инновационного отечественного гестагена и его метаболитов в сыворотке крови крыс и кроликов. Химико-фармацевтический журнал 2018; 52(12): 75–79, https://doi.org/10.30906/0023-1134-2018-52-12-55-59.
- Jordan A. Toxicology of depot medroxyprogesterone acetate. Contraception 1994; 49(3): 189–201, https://doi.org/10.1016/0010-7824(94)90037-x.
- Schindler A.E., Campagnoli C., Druckmann R., Huber J., Pasqualini J.R., Schweppe K.W., Thijssen J.H. Classification and pharmacology of progestins. Maturitas 2003; 46(Suppl 1): S7–S16, https://doi.org/10.1016/j.maturitas.2003.09.014.
- Chen J., Zhang J.-W., Yang L., Li W. Structure elucidation of major metabolites from medroxyprogesterone acetate by P450. Chem Pharm Bull 2009; 57(8): 835–839, https://doi.org/10.1248/cpb.57.835.
- Sturm G., Häberlein H., Bauer T., Plaum T., Stalker D.J. Mass spectrometric and high-performance liquid chromatographic studies of medroxyprogesterone acetate metabolites in human plasma. J Chromatogr 1991; 562(1–2): 351–362, https://doi.org/10.1016/0378-4347(91)80590-9.
- Зейналов О.А., Ядерец В.В., Стыценко Т.С., Петросян М.А., Андрюшина В.А. Синтез и биологическая активность синтетических производных 17α-гидроксипрогестерона. Химико-фармацевтический журнал 2012; 46(4): 7–10.










