Двухфотонная микроскопия стромы молочной железы ex vivo для использования в экспресс-диагностике рака
Цель исследования — оценка возможности экспресс-анализа ex vivo биопсийных образцов тканей молочной железы с помощью двухфотонной микроскопии (ДФМ).
Материалы и методы. Объектами исследования послужили образцы тканей молочной железы, полученные в ходе плановой трепан-биопсии. Проведено сравнение ДФМ-изображений стромы молочной железы в биопсийных ex vivo образцах и в неокрашенных депарафинированных срезах толщиной 10 мкм. В исследование включены образцы от пациенток с фиброаденомой (2 случая), карциномой in situ (1 случай) и инвазивной карциномой неспецифического типа I–II степени (4 случая). В рамках численной обработки ДФМ-изображений выполнено построение карт фактора дезорганизации коллагена, основанного на пространственном Фурье-анализе.
Результаты. Продемонстрирована возможность применения метода ДФМ для выявления ремоделирования стромы тканей молочной железы при доброкачественных и злокачественных изменениях с использованием биопсийных образцов. Получены характерные изображения биопсийных образцов и срезов стромы молочной железы в норме, при фиброаденоме и при различных вариантах карциномы, выявлены качественные отличия между типичными изображениями доброкачественных и злокачественных новообразований молочной железы. Изучены изменения структуры коллагеновых волокон и наличие/отсутствие эластиновых волокон при рассмотренных патологических состояниях молочной железы. Показаны различия ДФМ-изображений биопсийных ex vivo образцов и депарафинированных срезов, что может быть результатом искажения формы волокон в процессе обработки образцов. Предложенный алгоритм количественной обработки изображений позволяет объективизировать результаты визуализации, что является существенным шагом на пути к автоматизированной экспресс-диагностике.
Заключение. Двухфотонная микроскопия обладает высоким потенциалом в качестве метода экспресс-биопсии при первичной диагностике тканей молочной железы, а также при интраоперационном применении.
Введение
Рак молочной железы (РМЖ) в настоящее время является наиболее распространенным типом рака среди женщин во всем мире, демографические тенденции указывают на постоянное увеличение заболеваемости. По прогнозам, только на территории Европейского Союза к 2020 г. будет регистрироваться около 394 000 новых случаев РМЖ и 100 000 смертельных исходов среди пациентов с РМЖ ежегодно [1]. За последние десятилетия подходы к лечению РМЖ претерпели существенные изменения, в настоящее время основной тенденцией является проведение органосохраняющих операций [2–4], требующих интраоперационной оценки адекватности резекции опухоли. При этом известно, что злокачественные опухоли характеризуются существенной гетерогенностью. Метод срочной экспресс-биопсии, к сожалению, имеет ряд ограничений, связанных как с гетерогенностью опухолей, так и с холодовой деформацией материала во время приготовления препарата, что ухудшает качество диагностики. В связи с этим актуальным является развитие методов, позволяющих провести быструю морфологическую диагностику больших объемов тканей без их дополнительной обработки.
В последние годы активно развиваются методы оптической экспресс-биопсии для диагностики рака, в том числе РМЖ [5–8]. Они основаны на принципах оптической мультиспектральной визуализации клеточной структуры биотканей и позволяют ответить на ряд вопросов, от которых зависит выбор тактики лечения злокачественных опухолей: морфологический тип опухоли, наличие злокачественных клеток в линии резекции при органосохраняющих операциях, наличие специфических молекулярных маркеров [9]. Методы оптической экспресс-биопсии позволяют осуществлять визуализацию как in vivo, так и ex vivo для постоперационных образцов (так называемых fresh tissue samples).
Одной из технологий для оптической биопсии нативных образцов биоткани является двухфотонная микроскопия (ДФМ) [10], которая применяется при анализе опухолей различных локализаций [11–15]. В ее основе лежит принцип лазерной сканирующей микроскопии (ЛСМ) [16], в качестве источника используется импульсный фемтосекундный лазер ИК-диапазона, а изображение формируется путем одновременной регистрации сигналов генерации второй гармоники (ГВГ) от коллагена и двухфотонно-возбуждаемой автофлюоресценции (ДВАФ) от эластина и компонентов цитоплазмы клеток в видимом спектральном диапазоне. Визуализация структуры биотканей методом ДФМ выполняется с микронным пространственным разрешением и не требует дополнительного окрашивания, что позволяет удовлетворять требованиям интраоперационного применения.
Целью настоящей работы явилась разработка подходов к экспресс-анализу ex vivo биопсийных образцов тканей молочной железы с помощью двухфотонной микроскопии.
Исследована возможность отслеживания методом ДФМ трансформации структуры стромы тканей молочной железы при доброкачественных и злокачественных изменениях с использованием образцов, полученных при биопсийном диагностическом исследовании опухолей (фиброаденомы и различных вариантов карциномы), а также возможность выявления качественных отличий между типичными изображениями доброкачественных и злокачественных новообразований.
Материалы и методы
Двухфотонная микроскопия. Объектами исследования являлись биопсийные образцы тканей молочной железы, полученные от 7 пациенток, у которых по результатам гистологического исследования были диагностированы фиброаденома (2 случая), карцинома in situ (1 случай) и инвазивная карцинома неспецифического типа I–II степени злокачественности (4 случая). Биопсийный материал в виде столбика тканей молочной железы был получен в ходе плановой трепан-биопсии под УЗ-контролем. В течение 60 мин после биопсии неокрашенные образцы визуализировали на установке лазерной сканирующей микроскопии LSM 510 META (Carl Zeiss, Германия), оснащенной инвертированным микроскопом. В качестве возбуждающего излучения использовали импульсный фемтосекундный лазер Mai Tai HP (Spectra Physics, США) с частотой следования импульсов 80 МГц и их длительностью 100 фс. Образцы размещали на покровном стекле толщиной 170 мкм. Визуализацию осуществляли в отражательном режиме с помощью масляно-иммерсионного объектива EC Plan-Neofluar 40×/1.3 NA (Carl Zeiss, Германия). Изображения размером 1024×1024 пикселя строили путем сканирования остро сфокусированным лазерным пучком, поле зрения — 318×318 мкм. Средняя мощность лазерного излучения на образце составляла менее 2 Вт. ДФМ-визуализацию выполняли при возбуждении на длине волны 800 нм, регистрацию сигнала ГВГ от коллагена осуществляли в спектральном интервале 385–415 нм, а сигнала ДВАФ от эластина и клеток — в интервале 460–600 нм. При визуализации ГВГ-изображение кодировали зеленым цветом, а ДВАФ-изображение — красным. Полное ДФМ-изображение формировали путем наложения двух указанных выше изображений. После ДФМ-визуализации образцы были подвергнуты стандартному гистологическому исследованию для постановки диагноза.
Гистологическое исследование. Биопсийный материал, зафиксированный в растворе нейтрального 10% формалина, подвергали стандартной гистологической проводке на аппарате Excelsior ES (Thermo Scientific, США). После проводки изготовляли парафиновые блоки с использованием заливочной станции HistoStar (Thermo Scientific, США). Серийные срезы толщиной 4–6 мкм получали на микротоме Microm HM 325 (Thermo Scientific, США). Срезы окрашивали гематоксилином и эозином при помощи станции для окраски Gemini AS (Thermo Scientific, США), после чего выполняли рутинное гистологическое исследование на микроскопе Leica 2500 (Leica Microsystems, Германия). Срезы толщиной 10 мкм, полученные с тех же блоков, депарафинировали и исследовали методом ДФМ без дополнительного окрашивания.
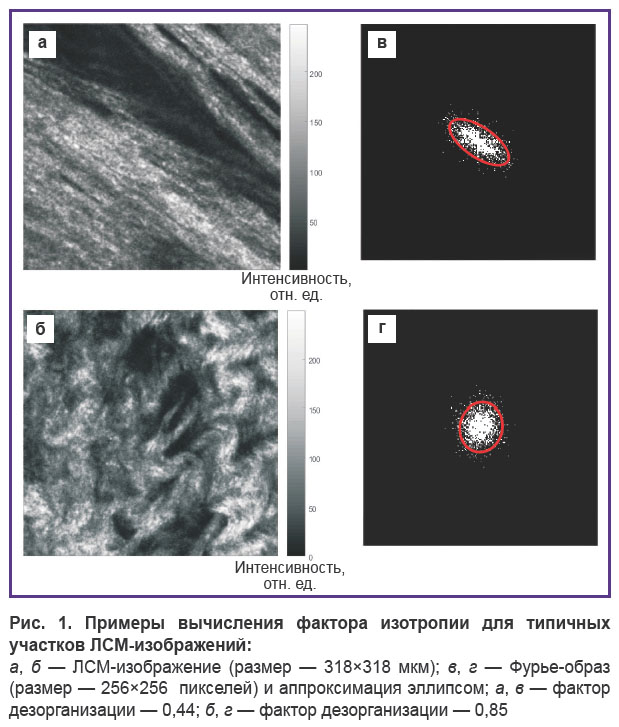
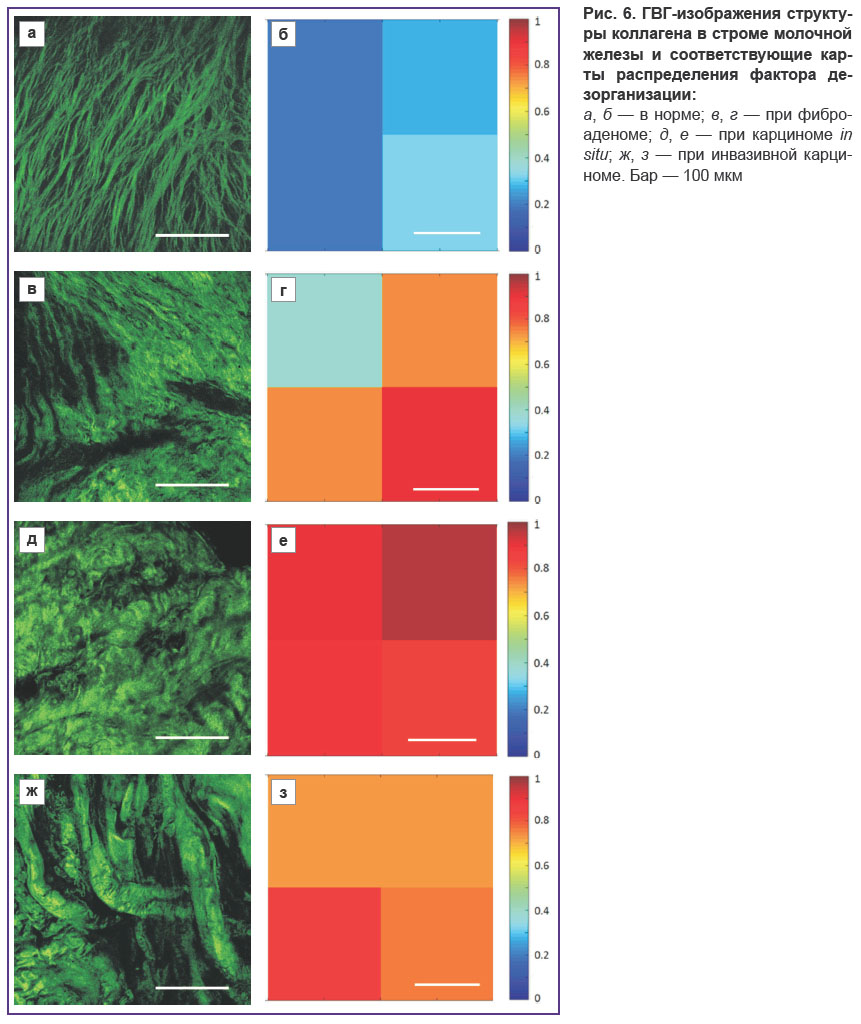
Численная обработка. Для численной характеризации степени упорядоченности коллагена использовали метод пространственного Фурье-анализа изображений. Принципы такого анализа были ранее предложены в работе [17] и позднее применены для оценки структуры стенок артерий [18, 19] и возрастных изменений кожи [20, 21]. Численному анализу подвергались ГВГ-изображения биопсийных образцов тканей молочной железы, формируемые с помощью регистрации нелинейно-оптического отклика коллагена. Двухмерный Фурье-спектр изображения упорядоченных волокон в области низких пространственных частот обычно имеет колоколообразную форму. Его сечение по определенному уровню, выбираемому эмпирически, аппроксимируется эллипсом с наименьшим среднеквадратичным отклонением, по которому вычисляется фактор дезорганизации (ФД), равный отношению короткой к длинной полуоси выбранного эллипса. Значения ФД лежат в пределах от 0 до 1. Стремление ФД к 1 означает равенство полуосей эллипса (окружность), что соответствует отсутствию выделенного направления в укладке волокон, т.е. их дезорганизации. Значения ФД, близкие к 0, означают существенную разницу в длине полуосей, что свидетельствует о наличии выделенного направления укладки волокон и их упорядоченности (рис. 1). Программа для вычисления ФД по ГВГ-изображениям реализована в среде MATLAB.
Поскольку на одном изображении могут присутствовать участки с разным характером упорядоченности коллагена, для повышения информативности исходные изображения разбивались на 4 одинаковых квадрата размером 512×512 пикселей. Для каждого из малых квадратов рассчитывался ФД, по значениям которого для полного изображения строилась карта дезорганизации коллагена. Цветовая палитра карты выбрана таким образом, что красным областям соответствуют участки с наибольшей дезорганизацией коллагена, а синим областям — участки упорядоченного коллагена на исходном изображении.
Результаты
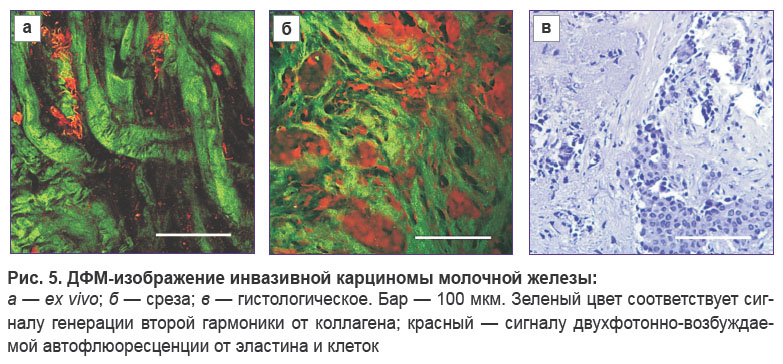
На рис. 2–5 представлены ДФМ-изображения биопсийных образцов тканей молочной железы (далее по тексту — ex vivo ДФМ-изображения) и неокрашенных тонких срезов биопсийного материала (далее — ДФМ-изображения срезов) и соответствующие изображения окрашенных гистологических препаратов. Необходимо подчеркнуть, что области на ex vivo ДФМ-изображениях и ДФМ-изображениях срезов с соответствующего образца не являются абсолютно колокализованными, в данной работе приводится качественное сравнение характерных структур, расположенных в пределах размеров биопсийного столбика.
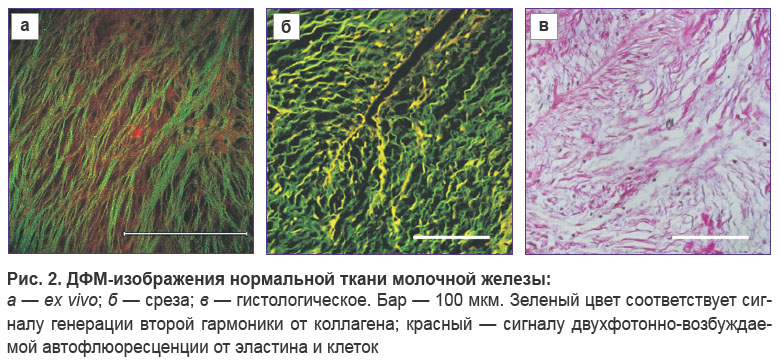
Нормальная ткань. На рис. 2 показаны изображения волокнистых тканей нормальной молочной железы, присутствовавших в пограничной области образца с фиброаденомой. Гистология (рис. 2, в) подтверждает, что визуализируемый участок соответствует нормальной строме молочной железы. Ex vivo ДФМ-изображение демонстрирует, что строма нормальной ткани неплотная, коллагеновые волокна — разрозненные, тонкие (толщиной до 5 мкм), длинные, прямые, преимущественно упорядоченные. Сигнал ГВГ от таких волокон слабый. Эластиновые волокна и эпителиальные клетки по сигналу ДВАФ не визуализируются. На ДФМ-изображении неокрашенного среза нормальной ткани коллагеновые волокна имеют волнистую структуру. Такое несоответствие ex vivo ДФМ-изображений и изображений срезов предположительно связано с обработкой образца. Эластиновые волокна на ДФМ-изображении среза также не визуализируются.
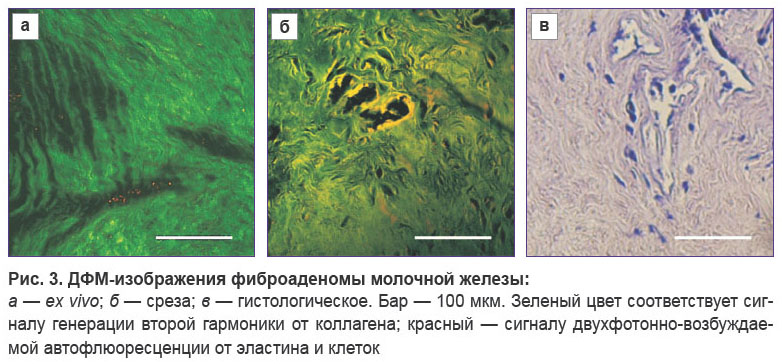
Фиброаденома. При фиброаденоме (см. рис. 3) строма молочной железы становится плотной, на ex vivo ДФМ-изображениях наблюдаются пучки коллагеновых волокон различной толщины, как длинные, так и фрагментированные, направление волокон извилистое. Фиброзная ткань занимает практически всю площадь поля зрения, выделенное направление волокон в поле зрения отсутствует, хотя присутствуют небольшие кластеры сонаправленных пучков. Толщина отдельных волокон составляет единицы микрометров, толщина пучков достигает десятков микрометров. Как и в случае нормальной ткани, на изображениях не присутствуют эластиновые волокна и эпителиальные клетки. ДФМ-изображения срезов также демонстрируют плотную строму, состоящую из хаотично ориентированных, извитых пучков коллагеновых волокон. На некоторых изображениях видны сечения протоков молочной железы с выстилающими их поверхность эпителиальными клетками, визуализируемыми по сигналу ДВАФ, а также сечения стенок кровеносных сосудов, визуализируемые по ГВГ-сигналу от коллагена.
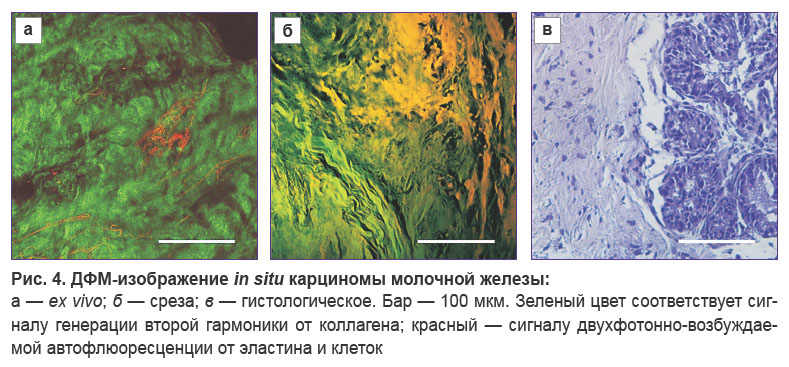
Карцинома in situ. В целом ex vivo ДФМ-изображения стромы (см. рис. 4) напоминают таковые для фиброаденомы, однако на некоторых участках среди плотных извилистых волокон коллагена визуализируются тонкие волокна эластина, скрученные в клубки или в виде перевитых нитей. При этом эпителиальные клетки не визуализируются. В то же время на неокрашенном срезе обнаружен участок, на котором визуализируется большое локализованное скопление клеток. Данный участок граничит с областью уплотненных длинных коллагеновых волокон волнистой формы, среди которых видны отдельные тонкие волокна эластина. Сопоставление с гистологией демонстрирует, что наблюдаемый участок может принадлежать к опухоли in situ.
Инвазивная карцинома неспецифического типа I–II степени злокачественности. На ex vivo ДФМ-изображениях (см. рис. 5) визуализируются протяженные толстые коллагеновые пучки, тяжи, толщина которых может достигать 20 мкм. Локальная плотность коллагеновых волокон, формирующих тяжи, высокая, но сами тяжи расположены достаточно разрозненно. Из-за начавшегося процесса гиалиноза в тяжах невозможно различить отдельные волокна коллагена. Ex vivo ДФМ-изображения отличаются выраженной гетерогенностью стромальных структур: встречаются как протяженные толстые пучки коллагеновых волокон, так и менее толстые извитые структуры, имеющие большую плотность в поле зрения. Также наблюдаются выраженные клубки волокон эластина толщиной до 5 мкм, эпителиальные клетки не визуализируются. ДФМ-изображения срезов, как и ex vivo ДФМ-изображения, демонстрируют в строме существенно измененные, утолщенные коллагеновые волокна, но, кроме того, на них визуализируются многочисленные равномерно расположенные клетки, не локализованные в пределах протоков, что хорошо соотносится с гистологическими изображениями (рис. 5, в). При этом эластиновые волокна на ДФМ-изображениях срезов практически не встречаются.
Численная обработка. Степень организации коллагеновых волокон в строме биопсийных образцов молочной железы была оценена с использованием описанного численного алгоритма для всех рассмотренных выше состояний. Карты распределения ФД продемонстрированы на рис. 6 вместе с соответствующими ГВГ-изображениями. Как и ожидалось, в нормальной строме степень сонаправленности волокон является наибольшей и величина ФД в пределах поля зрения не превышает 0,4. Для фиброаденомы степень дезорганизации коллагеновых волокон более выражена: присутствуют как участки с упорядоченным коллагеном, для которых ФД не превышает 0,4, так и участки с плотной упаковкой дезориентированных волокон, для которых значения ФД лежат в пределах 0,7–0,9. При карциноме значения ФД лежат в широком интервале 0,6–1, что говорит о высокой степени неоднородности организации коллагена: участкам с толстыми прямыми тяжами коллагена соответствуют меньшие значения ФД, а участкам с извитыми структурами — бόльшие значения ФД. В целом численная обработка позволяет дифференцировать здоровую и измененную строму молочной железы, однако для более детального распознавания различных патологических состояний стромы необходимо дополнить карты распределения ФД информацией о толщине коллагеновых волокон, а также о присутствии волокон эластина.
Обсуждение
Использование метода ДФМ для диагностики новообразований молочной железы ограничено сложностями в интерпретации получаемых данных, в частности в установлении соответствия между изображениями, формируемыми методом ДФМ, и изображениями, получаемыми традиционными методами морфологического анализа биотканей. В настоящее время микроскопия гистологических препаратов, окрашенных гематоксилином и эозином для контрастирования ядер, является «золотым стандартом» при постановке диагноза в онкологии. При этом основным диагностическим компонентом биоткани служат ядра эпителиальных клеток, а именно их локализация, количество и вид. В отличие от гистологического исследования метод ДФМ позволяет получать информацию в первую очередь о структуре стромы тканей молочной железы, в частности о коллагене и эластине, и в наименьшей степени — о характеристиках ядер эпителиальных клеток [22]. Вследствие этого не представляется возможным проводить прямое сопоставление изображений окрашенных гистологических препаратов и ДФМ-изображений и зачастую ценность информации, получаемой методом ДФМ, подвергается сомнению в рамках традиционной гистологической парадигмы. Однако, согласно данным современных исследований [23–25], внеклеточный матрикс молочной железы очень чувствителен к изменениям структуры паренхимы эпителиальных клеток, формирующих структуры долек и протоков, и в результате мутации эпителиальных клеток и их разрастания внутрь стромы меняется и паренхиматозно-стромальное взаимодействие, приводящее к изменению структуры волокон коллагена и эластина. Как было показано на опухолевых моделях лабораторных животных [26–31], ремоделирование коллагена происходит под действием секретируемых опухолью онкобелков и факторов роста, а формируемая таким образом сеть волокон обеспечивает клеткам опухоли благоприятные условия для инвазии и метастазирования. В свою очередь, доброкачественные изменения молочной железы (в частности, фиброаденоматоз) связаны с избыточным разрастанием именно соединительнотканного компонента стромы, что также отражается на состоянии коллагена и эластина [24]. Таким образом, ДФМ показывает диагностическую ценность при выявлении новообразований молочной железы, что подтверждается рядом публикаций [15, 32–35].
Высокая корреляция последовательных изменений организации коллагеновых волокон со степенью инвазии опухолей молочной железы была прослежена на лабораторных животных, а типичные признаки ремоделированной структуры коллагена были классифицированы как опухоль-ассоциированные коллагеновые маркеры [30] (tumor-associated collagen signatures, TACS). Однако подавляющее большинство работ, посвященных применению ДФМ для диагностики РМЖ человека по изменению структуры стромы, выполнено на фиксированных срезах [32–36], а в ряде случаев используются окрашенные гематоксилином и эозином гистологические препараты, приготовленные для клинического морфологического исследования [34, 36]. В результате подобной обработки организация стромы в исследуемом срезе может существенно нарушиться по сравнению с нативной биотканью, а исследование методом ДФМ окрашенных срезов может приводить к артефактам из-за выраженной флюоресценции эозина. Кроме того, изучение методом ДФМ состояния стромы молочной железы в основном ограничивается анализом структуры коллагена, в то время как другой волокнистый компонент межклеточного матрикса — эластин — остается без внимания (возможно, из-за нарушения его структуры при обработке образца или из-за спектрального наложения автофлюоресценции эластина на флюоресценцию эозина). Вместе с тем из литературы [37–39] известно, что эластоз сопутствует определенным злокачественным изменениям молочной железы, в связи с чем визуализация состояния эластиновых волокон методом ДФМ представляется перспективной задачей.
В настоящей работе продемонстрировано, что ДФМ-изображения, полученные с биопсийных ex vivo образцов тканей молочной железы, существенно отличаются от ДФМ-изображений, полученных с использованием неокрашенных срезов. В частности, отличается структура волокон коллагена в нормальной ткани: на ex vivo изображениях волокна прямые, а на изображениях срезов — волнообразные. В исследованиях, посвященных визуализации стромы молочной железы на срезах при различных патологиях, волнообразная форма тонких коллагеновых волокон ассоциирована с нормальной биотканью. На наш взгляд, имеет место искажение формы волокон в процессе обработки образцов. Отметим также, что в биопсийных образцах не визуализируются клетки, что затрудняет сопоставление с результатами стандартного гистологического исследования. С другой стороны, на ex vivo ДФМ-изображениях тканей со злокачественными изменениями отчетливо визуализируются эластиновые волокна, которые крайне редко встречаются на изображениях срезов и, возможно, по этой причине им не уделяется внимания в работах по данной тематике. Мы предполагаем, что наличие или отсутствие эластиновых волокон на ДФМ-изображениях может служить маркером злокачественных изменений и поэтому требует более тщательного анализа. Кроме того, при дальнейшей классификации ДФМ-изображений требуется также принимать во внимание такие факторы, как возраст пациенток и их рецепторный статус.
Заключение
Метод двухфотонной микроскопии, примененный для визуализации ex vivo образцов тканей молочной железы в норме и при патологиях, продемонстрировал отличительные особенности стромы при различных состояниях, не выявляемые по изображениям неокрашенных срезов биотканей и по стандартным гистологическим изображениям. Полученные данные могут быть использованы при интраоперационной диагностике новообразований молочной железы методом двухфотонной микроскопии, а в перспективе развития мультфотонных систем с выносной сканирующей головкой — для in vivo визуализации. Предложенный алгоритм количественной обработки изображений, основанной на Фурье-анализе, позволяет объективизировать результаты визуализации, что является существенным шагом на пути к автоматизированной экспресс-диагностике.
Благодарности. Авторы благодарны С.В. Гамаюнову за полезные обсуждения.
Финансирование исследования. Работа поддержана Российским фондом фундаментальных исследований, проект №16-02-00974.
Конфликт интересов отсутствует.
Литература
- International Agency for Research on Cancer. GLOBOCAN 2018. URL: https://www.iarc.fr/.
- Franceschini G., Sanchez A.M., Di Leone A., Magno S., Moschella F., Accetta C., Natale M., Di Giorgio D., Scaldaferri A., D’Archi S., Scardina L., Masetti R. Update on the surgical management of breast cancer. Ann Ital Chir 2015; 86(2): 89–99.
- Driul L., Bernardi S., Bertozzi S., Schiavon M., Londero A.P., Petri R. New surgical trends in breast cancer treatment: conservative interventions and oncoplastic breast surgery. Minerva Ginecol 2013; 65(3): 289–296.
- Franceschini G., Martin Sanchez A., Di Leone A., Magno S., Moschella F., Accetta C., Masetti R. New trends in breast cancer surgery: a therapeutic approach increasingly efficacy and respectful of the patient. G Chir 2015; 36(4): 145–152, https://doi.org/10.11138/gchir/2015.36.4.145.
- Alfano R.R. Advances in optical biopsy for cancer diagnosis. Technol Cancer Res Treat 2011; 10(2): 101, https://doi.org/10.7785/tcrt.2012.500184.
- Nie Z., An R., Hayward J.E., Farrell T.J., Fang Q. Hyperspectral fluorescence lifetime imaging for optical biopsy. J Biomed Opt 2013; 18(9): 096001, https://doi.org/10.1117/1.jbo.18.9.096001.
- Boppart S.A., Richards-Kortum R. Point-of-care and point-of-procedure optical imaging technologies for primary care and global health. Sci Transl Med 2014; 6(253): 253rv2, https://doi.org/10.1126/scitranslmed.3009725.
- Li G., Li H., Duan X., Zhou Q., Zhou J., Oldham K.R., Wang T.D. Visualizing epithelial expression in vertical and horizontal planes with dual axes confocal endomicroscope using compact distal scanner. IEEE Trans Med Imaging 2017; 36(7): 1482–1490, https://doi.org/10.1109/tmi.2017.2673022.
- Gao Z., Li G., Li X., Zhou J., Duan X., Chen J., Joshi B.P., Kuick R., Khoury B., Thomas D.G., Fields T., Sabel M.S., Appelman H.D., Zhou Q., Li H., Kozloff K., Wang T.D. In vivo near-infrared imaging of ErbB2 expressing breast tumors with dual-axes confocal endomicroscopy using a targeted peptide. Sci Rep 2017; 7(1): 14404, https://doi.org/10.1038/s41598-017-13735-z.
- Perry S.W., Burke R.M., Brown E.B. Two-photon and second harmonic microscopy in clinical and translational cancer research. Ann Biomed Eng 2012; 40(2): 277–291, https://doi.org/10.1007/s10439-012-0512-9.
- König K., Riemann I., Ehlers A., Bückle R., Dimitrow E., Kaatz M., Fluhr J., Elsner P. In vivo multiphoton tomography of skin cancer. Proc. SPIE, Multiphoton Microscopy in the Biomedical Sciences 2006; 6089: 60890R, https://doi.org/10.1117/12.646000.
- Jain M., Robinson B., Scherr D., Sterling J., Lee M., Wysock J., Rubin M., Maxfield F., Zipfel W., Webb W., Mukherjee S. Multiphoton microscopy in the evaluation of human bladder biopsies. Arch Pathol Lab Med 2012; 136(5): 517–526, https://doi.org/10.5858/arpa.2011-0147-oa.
- Yan J., Zhuo S., Chen G., Milsom J.W., Zhang H., Lu J., Zhu W., Xie S., Chen J., Ying M. Real-time optical diagnosis for surgical margin in low rectal cancer using multiphoton microscopy. Surg Endosc 2014; 28: 36–41, https://doi.org/10.1007/s00464-013-3153-7.
- Stanciu S.G., Xu S., Peng Q., Yan J., Stanciu G.A., Welsch R.E., So P.T., Csucs G., Yu H. Experimenting liver fibrosis diagnostic by two photon excitation microscopy and bag-of-features image classification. Sci Rep 2014; 4: 4636, https://doi.org/10.1038/srep04636.
- Wu Y., Fu F., Lian Y., Chen J., Wang C., Nie Y., Zheng L., Zhuo S. Monitoring morphological alterations during invasive ductal breast carcinoma progression using multiphoton microscopy. Lasers Med Sci 2015; 30(3): 1109–1115, https://doi.org/10.1007/s10103-015-1712-y.
- Denk W., Strickler J.H., Webb W.W. Two-photon laser scanning fluorescence microscopy. Science 1990; 248(4951): 73–76, https://doi.org/10.1126/science.2321027.
- Cicchi R., Kapsokalyvas D., De Giorgi V., Maio V., Van Wiechen A., Massi D., Lotti T., Pavone F.S. Scoring of collagen organization in healthy and diseased human dermis by multiphoton microscopy. J Biophotonics 2010; 3(1–2): 34–43, https://doi.org/10.1002/jbio.200910062.
- Cicchi R., Matthäus C., Meyer T., Lattermann A., Dietzek B., Brehm B.R., Popp J., Pavone F.S. Characterization of collagen and cholesterol deposition in atherosclerotic arterial tissue using nonlinear microscopy. J Biophoton 2014; 7(1–2): 135–143, https://doi.org/10.1002/jbio.201300055.
- Gubarkova E.V., Kirillin M.Y., Dudenkova V.V., Timashev P.S., Kotova S.L., Kiseleva E.B., Timofeeva L.B., Belkova G.V., Solovieva A.B., Moiseev A.A., Gelikonov G.V., Fiks I.I., Feldchtein F.I., Gladkova N.D. Quantitative evaluation of atherosclerotic plaques using cross-polarization optical coherence tomography, nonlinear, and atomic force microscopy. J Biomed Opt 2016; 21(12): 126010, https://doi.org/10.1117/1.jbo.21.12.126010.
- Wu S., Li H., Yang H., Zhang X., Li Z., Xu S. Quantitative analysis on collagen morphology in aging skin based on multiphoton microscopy. J Biomed Opt 2011; 16(4): 040502, https://doi.org/10.1117/1.3565439.
- Osman O.S., Selway J.L., Harikumar P.E., Stocker C.J., Wargent E.T., Cawthorne M.A., Jassim S., Langlands K. A novel method to assess collagen architecture in skin. BMC Bioinformatics 2013; 14(1): 260, https://doi.org/10.1186/1471-2105-14-260.
- Zipfel W.R., Williams R.M., Christie R., Nikitin A.Y., Hyman B.T., Webb W.W. Live tissue intrinsic emission microscopy using multiphoton-excited native fluorescence and second harmonic generation. Proc Natl Acad Sci U S A 2003; 100(12): 7075–7080, https://doi.org/10.1073/pnas.0832308100.
- Malandrino A., Mak M., Kamm R.D., Moeendarbary E. Complex mechanics of the heterogeneous extracellular matrix in cancer. Extreme Mechanics Letters 2018; 21: 25–34, https://doi.org/10.1016/j.eml.2018.02.003.
- Luparello C. Aspects of collagen changes in breast cancer. Journal of Carcinogenesis & Mutagenesis 2013; S13: 007, https://doi.org/10.4172/2157-2518.s13-007.
- Мнихович М.В. Межклеточные и клеточно-матриксные взаимодействия в карциномах молочной железы: современное состояние проблемы. Российский медико-биологический вестник им. академика И.П. Павлова 2014; 22(2): 152–161, https://doi.org/10.17816/pavlovj20142152-161.
- Clark A.G., Vignjevic D.M. Modes of cancer cell invasion and the role of the microenvironment Curr Opin Cell Biol 2015; 36: 13–22, https://doi.org/10.1016/j.ceb.2015.06.004.
- Iovino F., Ferraraccio F., Orditura M., Antoniol G., Morgillo F., Cascone T., Diadema M.R., Aurilio G., Santabarbara G., Ruggiero R., Belli C., Irlandese E., Fasano M., Ciardiello F., Procaccini E., Lo Schiavo F., Catalano G., De Vita F. Serum vascular endothelial growth factor (VEGF) levels correlate with tumor VEGF and p53 overexpression in endocrine positive primary breast cancer. Cancer Invest 2008; 26(3): 250–255, https://doi.org/10.1080/07357900701560612.
- Han X., Burke R.M., Zettel M.L., Tang P., Brown E.B. Second harmonic properties of tumor collagen: determining the structural relationship between reactive stroma and healthy stroma. Opt Express 2008; 16(3): 1846–1859, https://doi.org/10.1364/oe.16.001846.
- Aboussekhra A. Role of cancer-associated fibroblasts in breast cancer development and prognosis. Int J Dev Biol 2011; 55(7–9): 841–849, https://doi.org/10.1387/ijdb.113362aa.
- Provenzano P.P., Inman D.R., Eliceiri K.W., Knittel J.G., Yan L., Rueden C.T., White J.G., Keely P.J. Collagen density promotes mammary tumor initiation and progression. BMC Med 2008; 6(1): 11, https://doi.org/10.1186/1741-7015-6-11.
- Provenzano P., Eliceiri K.W., Yan L., Ada-Nguema A., Conklin M.W., Inman D.R., Keely P.J. Nonlinear optical imaging of cellular processes in breast cancer. Microsc Microanal 2008; 14(6): 532–548, https://doi.org/10.1017/s1431927608080884.
- Conklin M.W., Eickhoff J.C., Riching K.M., Pehlke C.A., Eliceiri K.W., Provenzano P.P., Friedl A., Keely P.J. Aligned collagen is a prognostic signature for survival in human breast carcinoma. Am J Pathol 2011; 178(3): 1221–1232, https://doi.org/10.1016/j.ajpath.2010.11.076.
- Burke K., Tang P., Brown E. Second harmonic generation reveals matrix alterations during breast tumor progression. J Biomed Opt 2013; 18(3): 031106, https://doi.org/10.1117/1.jbo.18.3.031106.
- Ambekar R., Lau T.Y., Walsh M., Bhargava R., Toussaint K.C. Jr. Quantifying collagen structure in breast biopsies using second-harmonic generation imaging. Biomed Opt Express 2012; 3(9): 2021–2035, https://doi.org/10.1364/boe.3.002021.
- Wu X., Chen G., Lu J., Zhu W., Qiu J., Chen J., Xie S., Zhuo S., Yan J. Label-free detection of breast masses using multiphoton microscopy. PLoS One 2013; 8(6): e65933, https://doi.org/10.1371/journal.pone.0065933.
- Natal R.A., Vassallo J., Paiva G.R., Pelegati V.B., Barbosa G.O., Mendonça G.R., Bondarik C., Derchain S.F., Carvalho H.F., Lima C.S., Cesar C.L., Sarian L.O. Collagen analysis by second-harmonic generation microscopy predicts outcome of luminal breast cancer. Tumor Biol 2018; 40(4): 1010428318770953, https://doi.org/10.1177/1010428318770953.
- Wang Y., Lu S., Xiong J., Singh K., Hui Y., Zhao C., Brodsky A.S., Yang D., Jolly G., Ouseph M., Schorl C., DeLellis R.A., Resnick M.B. ColXα1 is a stromal component that colocalizes with elastin in the breast tumor extracellular matrix. J Pathol Clin Res 2019; 5(1): 40–52, https://doi.org/10.1002/cjp2.115.
- Uchiyama S., Fukuda Y. Abnormal elastic fibers in elastosis of breast carcinoma. Ultrastructural and immunohistochemical studies. Acta Pathol Jpn 1989; 39(4): 245–253.
- Elasbali A.M., Al-Onzi Z., Hamza A., Khalafalla E., Ahmed H.G. Morphological patterns of elastic and reticulum fibers in breast lesions. Health 2018; 10(12): 1625–1633, https://doi.org/10.4236/health.2018.1012122.