Базовая когнитивная архитектура, системное воспаление и иммунная дисфункция при шизофрении
Цель исследования — оценка архитектуры нейросетей головного мозга при восприятии индивидуальных личностно-значимых по заболеванию стимулов, основных параметров иммунитета, системного воспаления для изучения их связи с маркерами повреждения мозга и паттернами когнитивно-аффективных нарушений у больных шизофренией и добровольцев контрольной группы.
Материалы и методы. В исследовании участвовали 35 больных параноидной шизофренией и 17 человек без когнитивных нарушений, сопоставимых с больными по полу и возрасту. Использована клиническая информация о больных на основе базы данных, собранной в Психиатрической клинической больнице №1 им. Н.А. Алексеева Департамента здравоохранения города Москвы. Иммунологическое обследование включало определение концентрации ключевых цитокинов, нейротрофических факторов, циркулирующих иммунных комплексов, С-реактивного белка, кортизола и иммуноглобулинов в сыворотке крови пациентов. Для регистрации функциональных изменений предложены оригинальные методы подбора стимульного материала и регистрации вегетативных показателей, которые позволяют выявить архитектуру нейросетей, участвующих в продуцировании заболевания.
Результаты. Исследование иммунологических показателей дало возможность впервые выявить у больных шизофренией достоверные изменения гуморального иммунитета, активацию системного воспаления, включая увеличение содержания цитокинов IL-6, IL-8, интерферона γ, которые наблюдались вне зависимости от длительности и характера применявшейся антипсихотической терапии, однако были связаны с фазой болезни и типом клинической динамики, что свидетельствует об их эндогенном характере и обусловленности в первую очередь патогенетическими механизмами заболевания.
Пилотные исследования в области нейровизуализации показали, что применение метода МРТ-совместимой полиграфии позволяет сформировать выборку фМРТ-сигналов для статистического анализа на основе объективной оценки реакций физиологических систем организма испытуемого на предъявление личностно-значимых стимулов. При сравнении условия восприятия личностно-значимых стимулов относительно покоя с учетом данных полиграфии наблюдается выявление активации нейросетей в области ассоциативных зон левого cuneus и precuneus, в области вентролатерального префронтального кортекса обоих полушарий, ответственных за рабочую память и процессы сознания.
Заключение. Получены новые значимые данные о связи нейрофизиологических показателей, особенностей цитокинового профиля и характера основных изменений иммунного ответа при шизофрении.
Введение
Шизофрения — полиморфное психическое расстройство с характерными нарушениями мышления, восприятия и когнитивных способностей: памяти, внимания, исполнительных функций. Социально-экономическое бремя шизофрении определяется высоким процентом инвалидизации заболевших в трудоспособном возрасте, большими расходами на лечение и содержание больных [1].
Шизофрения рассматривается как многофакторное заболевание, в развитии которого важную роль играют генетическая предрасположенность и неблагоприятные воздействия внешней среды, в том числе психосоциальные факторы [2]. Не существует единой общепринятой теории патогенеза шизофрении. Методы нейровизуализации выявляют структурные и функциональные изменения в мозге больных: уменьшение числа нейронов, изменение ответа на нейромедиаторы. Исследования методом позитронно-эмиссионной томографии позволили обнаружить дисбаланс метаболизма различных зон коры, а также повышение экспрессии и уровня дофамина в мозге больных шизофренией [3]. Также данные литературы позволяют предположить важную роль нарушений функциональной связности нейросетей в происхождении продуктивной симптоматики при шизофрении [4–7].
В настоящее время общепринятым считается участие в развитии заболевания нейровоспаления, системного воспалительного ответа и иммунных расстройств. Так, при шизофрении выявлены признаки воспаления в центральной нервной системе, что проявляется хронической избыточной активацией микроглии и астроцитов [8]. Предполагают, что нейровоспаление при шизофрении может иметь инфекционную, аутоиммунную и травматическую природу [8, 9]. Обсуждается ряд доказательств роли системного воспаления в патогенезе этого заболевания [10]. В то же время следует отметить, что большинство результатов исследования клеточных и молекулярных механизмов патогенеза шизофрении были получены на постмортальном мозге, клеточных культурах и модельных животных. Проблемы трансляции этих данных в клинику и получения достоверных результатов исследований связаны с неоднородностью факторов риска шизофрении, многообразием форм заболевания и характера их течения.
В литературе последних лет практически нет междисциплинарных исследований, в которых бы проводилось углубленное изучение иммунитета и нейроиммунных взаимодействий в ассоциации с другими системными факторами патогенеза болезни. Стала очевидной необходимость изучения иммунных расстройств и системного воспаления с детальной клинической характеристикой различных форм и вариантов шизофрении. Также, несомненно, настало время конвергенции медико-биологических исследований с современными методами нейронауки (нейрофизиологические исследования, прижизненная нейровизуализация — функциональная МРТ (фМРТ) и др.). В данной статье представлены промежуточные результаты междисциплинарного проекта, в рамках которого впервые у больных шизофренией одновременно изучали параметры иммунитета, системного воспаления, периферический уровень нейробелков и показатели фМРТ с привлечением развернутого клинического исследования и нейропсихологического тестирования.
Цель исследования — оценка архитектуры нейросетей головного мозга при восприятии индивидуальных личностно-значимых по заболеванию стимулов, основных параметров иммунитета, системного воспаления для изучения их связи с маркерами повреждения мозга и паттернами когнитивно-аффективных нарушений у больных с шизофренией и добровольцев контрольной группы.
Материалы и методы
В исследование вошли 35 больных параноидной шизофренией от 18 до 42 лет (средний возраст — 29±2 года), возраст начала продромальных явлений (инициального этапа) — 18±6 лет, манифестного приступа — 24±6 лет, начала непрерывного течения — 22±6 лет. Продолжительность поддерживающей антипсихотической терапии составляла от 6 мес до 2 лет.
В контрольную группу вошли 17 здоровых испытуемых без когнитивных и ментальных нарушений (9 мужчин, 16 женщин) от 23 до 33 лет, средний возраст — 27±4 года. Для дополнительного контроля иммунологических параметров были включены показатели 40 здоровых добровольцев (норма), среди которых 21 женщина и 19 мужчин, средний возраст — 39±5 лет, обследованных ранее в лаборатории молекулярной иммунологии и вирусологии Национального исследовательского центра «Курчатовский институт».
Критериями включения в исследование для пациентов основной группы были способность подписать и датировать форму информированного согласия, диагноз «параноидная шизофрения», возраст до 42 лет. Во всех случаях было получено добровольное информированное согласие обследуемых после разъяснения процедуры и дизайна исследования. Работа была одобрена локальным этическим комитетом Национального исследовательского центра «Курчатовский институт».
В исследовании использована полная клиническая информация о больных на основе базы данных, собранной в Психиатрической клинической больнице №1 им. Н.А. Алексеева Департамента здравоохранения города Москвы. Массив данных включает более 1000 переменных для каждого пациента. Материал отобран у лиц, обращавшихся за психиатрической помощью и проходивших лечение в стационаре. База данных содержит клинические (психопатологические), социодемографические, психометрические данные пациентов с расстройствами шизофренического спектра.
Исследовали сывороточные уровни цитокинов (IL-6, IL-8, IL-10, интерферона γ (IFN-γ), фактора некроза опухоли α (TNF-α)) и антагониста рецептора IL-1β IL-1RA, циркулирующих иммунных комплексов, С-реактивного белка, кортизола и иммуноглобулинов (IgA, IgM, IgG) с помощью иммуноферментного анализа (ИФА) (тест-системы фирм «Цитокин» и «Хема», Россия). Для определения уровня нейротрофических факторов в сыворотке крови использовали ИФА-наборы производства R&D Systems (США) для BDNF, RayBiotech (США) для фактора роста нервов (NGF-β), нейротрофина 4 (NT-4).
Статистическую обработку данных проводили с помощью стандартных пакетов прикладных программ Exel (Microsoft, 2010), Statistica 10.0 (StatSoft Inc., США, 2010). При обработке результатов пользовались стандартными статистическими методами. Для описания данных использовали средние величины (M) и среднеквадратичную ошибку средней (m). Различия считались статистически достоверными при уровне значимости (p) менее 0,05 по критерию Стьюдента.
Анализ мировых данных показал, что чувствительными параметрами при шизофрении являются структурные и функциональные изменения мозга [11]. Для регистрации этих изменений нами предложен оригинальный метод подбора личностно-значимого стимульного аудио- и видеоматериала, связанного с фабулой галлюцинаторно-бредового синдрома. Для регистрации вегетативных показателей был адаптирован метод МРT-совместимой полиграфии [12]. Эти методы (подходы) позволяют, как мы считаем, оценить степень объективного воздействия личностно-значимых стимулов на испытуемого. Таким образом, для статистического сравнения формировалось несколько выборок личностно-значимых стимулов. В первую выборку были включены все предъявляемые личностно-значимые стимулы, во вторую — все стимулы из первой, для которых существовало объективное подтверждение личностной значимости на основе анализа полиграфических данных.
Предъявление стимулов происходило попарно для групп больных и здоровых испытуемых группы контроля. Использовали блоковую парадигму предъявления стимулов. До начала предъявления при каждом исследовании фМРТ испытуемым предоставлялось 20 с покоя. Каждое исследование фМРТ включало три блока продолжительностью 64 с. Каждый блок состоял из 16 с предъявления личностно-значимых стимулов и 16 с покоя, 16 с предъявления нейтральных стимулов и 16 с покоя. Исследование проводилось на магнитно-резонансном томографе Magnetom Verio 3T (Siemens, Германия) с использованием 32-канальной головной МРТ-катушки. Для регистрации BOLD-сигнала (blood oxygen level dependent) во время просмотра визуальных стимулов использовали стандартную эхо-планарную последовательность (time repetion, TR=2000 мс; размер воксела — 2×2×2 мм). Для каждого испытуемого были также получены анатомические данные с высоким разрешением на основе Т1-взвешенной последовательности (TR=1900 мс; time echo, TE=2,21 мс; 176 срезов; размер воксела — 1×1×1 мм).
В рамках каждой из блоковых парадигм были рассчитаны попарные сравнения на основании критерия Стьюдента и получены индивидуальные статистические карты для каждого человека с помощью программы SPM12. Для каждой группы — контроля и больных — были также рассчитаны групповые статистические карты на основе one-sample T-test. Межгрупповые сравнения проводили на основе two-sample T-test. Все полученные статистические карты были нанесены на шаблонное Т1-взвешенное изображение. Была произведена повоксельная анатомическая привязка активных вокселей к атласу AAL2.
Результаты и обсуждение
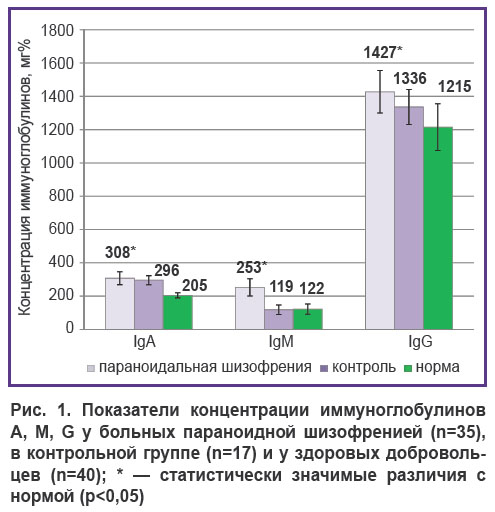
Исследование показателей иммунитета, активации системного воспаления и уровня основных цитокинов. В настоящее время считается, что психотропная терапия снижает активность иммунной системы. Анализ полученных данных показал, что, несмотря на наличие клинического улучшения под воздействием стационарного лечения, у большинства больных в среднем были повышены уровни маркеров системного воспаления и активации гуморального иммунитета. Так, оценка показателей гуморального иммунитета (уровень основных иммуноглобулинов IgA, IgM, IgG) позволила выявить, что у пациентов с параноидной формой шизофрении отмечалось повышение уровня общего IgM в сыворотке крови (рис. 1). При этом содержание IgA и IgG было повышено по сравнению с нормой, но не с показателями группы контроля. Повышенное содержание основного протективного иммуноглобулина адаптивного иммунитета IgG наблюдалось у 21 из 35 больных шизофренией.
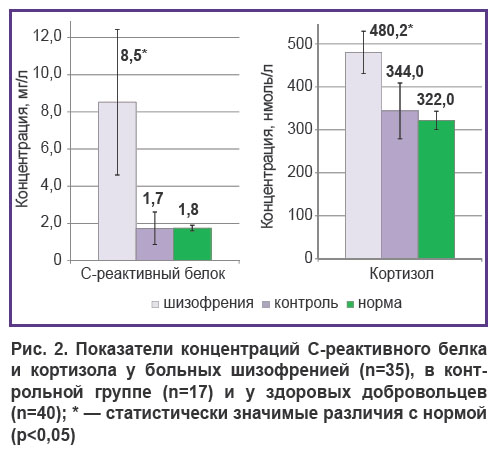
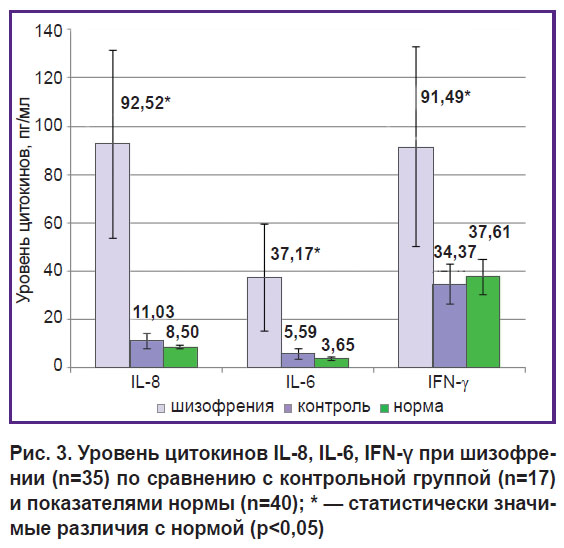
У больных параноидной шизофренией установлено повышение основных маркеров системного воспалительного ответа: уровень С-реактивного белка, кортизола, а также провоспалительных цитокинов IL-6, IL-8 и IFN-γ был существенно повышен по сравнению как с контрольной группой, так и с нормальными значениями (рис. 2, 3). Уровень IL-8 повышался в 27 из 35 случаев, IL-6 — в 26 из 35, IFN-γ — в 19 из 35 (p<0,05). Увеличение содержания гормона стресса и мощного антивоспалительного белка кортизола также было достоверным (см. рис. 2).
|
Рис. 3. Уровень цитокинов IL-8, IL-6, IFN-γ при шизофрении (n=35) по сравнению с контрольной группой (n=17) и показателями нормы (n=40); * — статистически значимые различия с нормой (р<0,05) |
Таким образом, степень изменений изученных параметров воспаления и гуморального иммунитета у больных шизофренией свидетельствует о наличии у них активного системного воспаления, несмотря на проведенную терапию и достигнутый положительный клинический эффект.
Содержание нейротрофических факторов NT-4, NGF-β и нейротропного фактора мозга (BDNF) в крови у больных шизофренией в среднем не отличалось от нормы, по-видимому, вследствие выраженной гетерогенности данных показателей. Так, уровень NT-4 был ниже нормы у 18 человек, у 8 был повышен и только у 9 человек соответствовал нормальным пределам. Повышение уровня NGF-β свыше 15 пг/мл выявлено в четверти случаев (9 человек), в остальных случаях он соответствовал норме. Меньшую вариабельность проявлял уровень BDNF, который был повышен у 6 больных, снижен — в 7 случаях и в среднем по группе не отличался от нормы. При предварительном анализе установлено, что содержание NT-4 и NGF-β ассоциировано с уровнем провоспалительного цитокина IL-6: при значительном повышении содержания IL-6 оказался увеличен и уровень данных нейротрофинов (рис. 4). Требуются дальнейшие исследования, чтобы выяснить, с каким иммунологическим и воспалительным профилем и клиническим фенотипом ассоциируется изменение содержания сывороточного уровня BDNF и других нейротрофинов у больных шизофренией и с чем это связано.
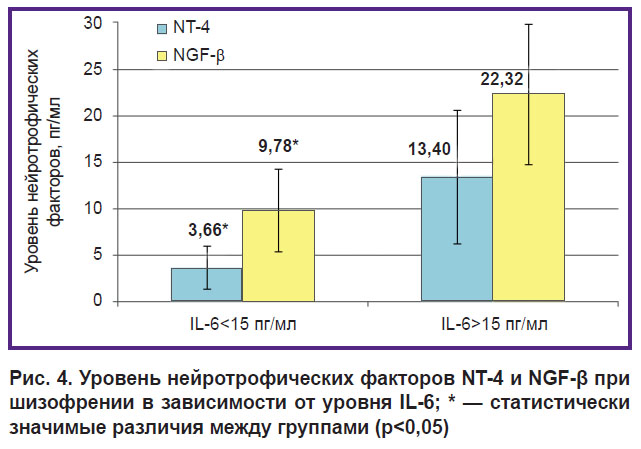
|
Рис. 4. Уровень нейротрофических факторов NT-4 и NGF-β при шизофрении в зависимости от уровня IL-6; * — статистически значимые различия между группами (р<0,05) |
Анализ мировой литературы показал, что исследования, в которых бы у больных шизофренией проводилась многофакторная оценка уровня медиаторов иммунитета в сочетании с параметрами системного воспаления, а также нейротрофическими факторами, до сих пор отсутствуют [1]. По данным работы [13], при шизофрении отмечается повышение сывороточного уровня маркеров активации нейтрофилов (лейкоцитарной эластазы, α1-протеиназного ингибитора), коррелирующее с активностью заболевания. При этом у больных с непсихотическими психическими расстройствами аналогичные изменения уровня маркеров активации нейтрофилов отмечаются лишь в половине случаев [14]. А.М. Заботиной и соавт. при изучении уровня цитокинов IL-6, IL-1β и TGF-β у больных шизофренией при первом психотическом эпизоде обнаружено повышение содержания указанных белков [15]. Уровень нейротрофических факторов BDNF, NGF-β, NT-4 при шизофрении отечественными и зарубежными авторами в последние годы комплексно не оценивался.
Следует отметить, что выявленные иммунологические изменения у пациентов отмечались вне зависимости от длительности и характера применявшейся антипсихотической терапии, однако они были связаны с фазой болезни и типом клинической динамики, что свидетельствует об ассоциации нарушений иммунитета с патогенетическими механизмами заболевания.
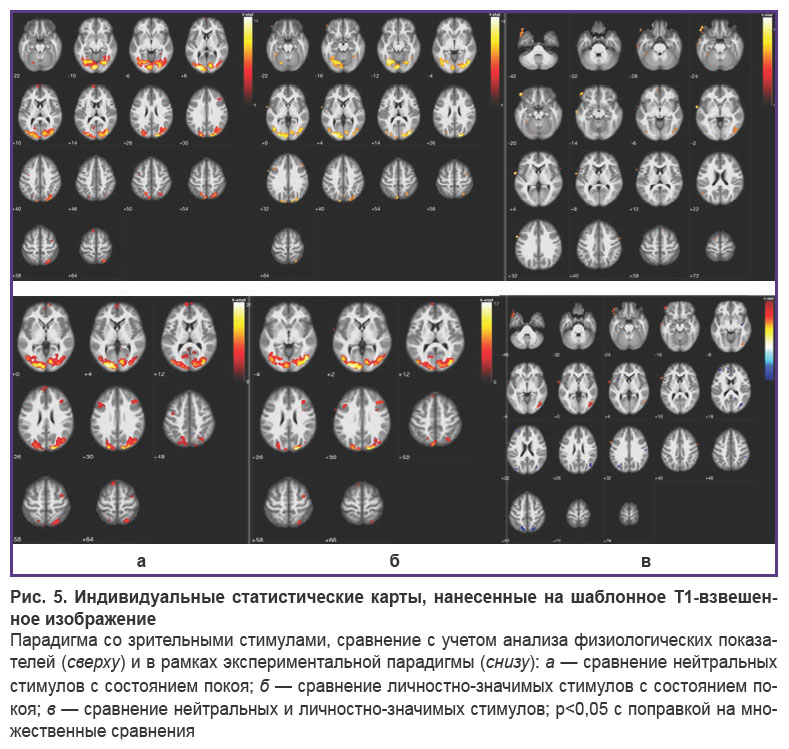
Исследование архитектуры нейросетевой активности при восприятии личностно-значимых стимулов пациентами. Экспертный анализ физиологических показателей c помощью МРТ-совместимого полиграфа позволил выявить для каждого испытуемого эмоциональную или нейтральную реакцию на предъявляемые стимуляции. На рис. 5 приведены примеры статистических карт активностей головного мозга человека, полученных в ходе анализа/отсутствия анализа этих состояний (т.е. с учетом и без учета данных томографа) в рамках используемой парадигмы. В таблице приведена анатомическая привязка полученных активностей.
Из данных таблицы следует, что учет показателей полиграфических каналов приводит к коррекции роли распределенных систем нейросетей, участвующих в восприятии нейтральных и личностно-значимых стимулов. Например, при сравнении условия восприятия личностно-значимых стимулов относительно покоя с учетом данных полиграфии наблюдается активация нейросетей в области ассоциативных зон левого cuneus и precuneus, в области вентролатерального префронтального кортекса обоих полушарий, ответственных за рабочую память и процессы сознания. При восприятии личностно-значимых стимулов по отношению к нейтральным наблюдается активация нейросетей в области l. superior frontal gyrus, ответственной за самосознание человека, и в областях правого и левого полушарий superior medial gyrus, отвечающих за исполнительные функции головного мозга (данные получены с учетом оценки личностной значимости стимулов с помощью полиграфии). Тем не менее стоит отметить, что без использования полиграфических данных при сравнении личностно-значимых стимулов по отношению к нейтральным выявляется активация в лимбических системах l. hippocampus, r. precuneus, r. putamen, а также обширные зоны активации во фронтальных районах. Таким образом, применение метода МРТ-совместимой полиграфии, с одной стороны, позволяет сформировать выборку фМРТ-сигналов для статистического анализа на основе объективной оценки реакций физиологических систем организма на предъявление личностно-значимых стимулов, с другой стороны, наличие или отсутствие физиологической реакции на личностно-значимые стимулы может говорить о разной степени поражения лимбической системы человека. Предложенный дополнительный метод МРТ-совместимой полиграфии показывает свою перспективность для оценки активации нейросетей, принимающих участие в процессах восприятия личностно-значимой (эмоциональной) информации.
Заключение
Исследования, в которых проводилась бы многофакторная оценка нейрофизиологических показателей, уровня медиаторов иммунитета в сочетании с параметрами системного воспаления, а также нейротрофическими факторами, до сих пор отсутствовали. Данная работа на ее первом этапе позволила получить новые значимые данные о нейрофизиологических изменениях, особенностях цитокинового профиля и характере основных изменений иммунного ответа при шизофрении.
Полученные первичные результаты по визуализации архитектуры коннектома при восприятии личностно-значимых стимулов с применением МРТ-совместимой полиграфии позволяют предположить перспективность данного подхода для объективной оценки восприятия личностно-значимой информации, формирования выборки фМРТ-сигналов с целью статистического анализа. На следующем этапе работы планируется комплексный анализ нейрофизиологических и иммунологических данных на индивидуальном и групповом уровнях.
Финансирование исследования. Работа выполнена при поддержке Национального исследовательского центра «Курчатовский институт» (НИР «Иммуногенетические стратегии диагностики и терапии шизофрении», приказ №1604 от 5 июля 2018 г.), при частичной поддержке Российского фонда фундаментальных исследований: грант 17-29-02518 офи_м («Нейроиммунологический статус и особенности базовых когнитивно-эффективных архитектур головного мозга в норме и у больных шизофренией») и грант 18-29-23020 мк («Исследование функциональной архитектуры нейросетей головного мозга человека в состоянии покоя как базовой модели низкоэнергетических информационных процессов сознания»).
Конфликт интересов отсутствует.
Литература
- Малашенкова И.К., Крынский С.А., Огурцов Д.П., Мамошина М.В., Захарова Н.В., Ушаков В.Л., Величковский Б.М., Дидковский Н.А. Роль иммунной системы в патогенезе шизофрении. Журнал неврологии и психиатрии им. C.C. Корсакова 2018; 118(12): 72–80.
- Howes O.D., McCutcheon R. Inflammation and the neural diathesis-stress hypothesis of schizophrenia: a reconceptualization. Transl Psychiatry 2017; 7(2): e1024–e1024, https://doi.org/10.1038/tp.2016.278.
- Jacob A., Cohen S., Alavi A. Abnormal brain circuitry and neurophysiology demonstrated by molecular imaging modalities in schizophrenia. J Alzheimers Dis Parkinsonism 2013; 3: 114, https://doi.org/10.4172/2161-0460.1000114.
- Nenadic I., Smesny S., Schlösser R.G.M., Sauer H., Gaser C. Auditory hallucinations and brain structure in schizophrenia: voxel-based morphometric study. Br J Psychiatry 2010; 196(5): 412–413, https://doi.org/10.1192/bjp.bp.109.070441.
- Modinos G., Costafreda S.G., van Tol M.-J., McGuire P.K., Aleman A., Allen P. Neuroanatomy of auditory verbal hallucinations in schizophrenia: a quantitative meta-analysis of voxel-based morphometry studies. Cortex 2013; 49(4): 1046–1055, https://doi.org/10.1016/j.cortex.2012.01.009.
- Allen P., Larøi F., McGuire P.K., Aleman A. The hallucinating brain: a review of structural and functional neuroimaging studies of hallucinations. Neurosci Biobehav Rev 2008; 32(1): 175–191, https://doi.org/10.1016/j.neubiorev.2007.07.012.
- Downar J., Crawley A.P., Mikulis D.J., Davis K.D. A multimodal cortical network for the detection of changes in the sensory environment. Neurosci Biobehav Rev 2000; 3(3): 277–283, https://doi.org/10.1038/72991.
- Bechter K. Updating the mild encephalitis hypothesis of schizophrenia. Prog Neuropsychopharmacol Biol Psychiatry 2013; 42: 71–91, https://doi.org/10.1016/j.pnpbp.2012.06.019.
- Kinney D.K., Hintz K., Shearer E.M., Barch D.H., Riffin C., Whitley K., Butler R. A unifying hypothesis of schizophrenia: abnormal immune system development may help explain roles of prenatal hazards, post-pubertal onset, stress, genes, climate, infections, and brain dysfunction. Med Hypotheses 2010; 74(3): 555–563, https://doi.org/10.1016/j.mehy.2009.09.040.
- Müller N., Weidinger E., Leitner B., Schwarz M.J. The role of inflammation in schizophrenia. Front Neurosci 2015; 9: 372, https://doi.org/10.3389/fnins.2015.00372.
- Vita A., Minelli A., Barlati S., Deste G., Giacopuzzi E., Valsecchi P., Turrina C., Gennarelli M. Treatment-resistant schizophrenia: genetic and neuroimaging correlates. Front Pharmacol 2019; 10: 402, https://doi.org/10.3389/fphar.2019.00402.
- Ushakov V.L., Malakhov D.G., Orlov V.A., Kartashov S.I., Kholodny Y.I. Research of neurocognitive mechanisms of revealing of the information concealing by the person. Advances in Intelligent Systems and Computing 2018; 310–315, https://doi.org/10.1007/978-3-319-99316-4_41.
- Зозуля С.А., Олейчик И.В., Андросова Л.В., Отман И.Н., Сарманова З.В., Столяров С.А., Бизяева А.С., Юнилайнен О.А., Клюшник Т.П. Мониторинг течения эндогенных психозов по иммунологическим показателям. Психическое здоровье 2017; 15(1): 11–18.
- Клюшник Т.П., Андросова Л.В., Зозуля С.А., Отман И.Н., Никитина В.Б., Ветлугина Т.П. Сравнительный анализ воспалительных маркеров при эндогенных и непсихотических психических расстройствах. Сибирский вестник психиатрии и наркологии 2018; 2(99): 64–69.
- Заботина А.М., Белинская М.А., Журавлев А.С., Насырова Р.Ф., Сосин Д.Н., Ершов Е.Е., Тараскина А.Е., Крупицкий Е.М. Влияние полиморфных вариантов ГЭ6311 и ГЭ6313 гена рецептора серотонина 2А (НГЕ2А) на уровень его МРНК и белка в лейкоцитах периферической крови при терапии антипсихотиками. Цитология 2018; 60(5): 381–389.