Организованная структура фибрилляции желудочков собаки при перфузии сердца в длительном эксперименте
Цель исследования — выявление организованной активности фибрилляции желудочков (ФЖ) собаки и определение ее количественных параметров при перфузии сердца в длительном эксперименте.
Материалы и методы. Выполнено четыре эксперимента на изолированном сердце собаки, перфузируемом кровью поддерживающей собаки. Регистрировали электрограмму желудочков в течение перфузии сердца при ФЖ. Проводили спектральный анализ электрограммы методом быстрого преобразования Фурье в диапазоне 0,5–15,0 Гц. Определяли частоту, спектральную мощность (амплитуду) и удельный вес (%) осцилляций 1-, 2- и 3-й по спектральной мощности частот ФЖ (частота — мода; амплитуда, удельный вес — M±SEM; n=120).
Результаты. В условиях перфузии ФЖ сердца собаки характеризуется организованной активностью, о чем свидетельствует доминантная структура частот осцилляций. Осцилляции частотой 9–10 Гц, занимающие 1/10 диапазона 0,5–15 Гц, содержат 42–44% спектральной мощности и доминируют в структуре частот осцилляций. Стабильность организованной структуры по частоте и спектральной мощности доминирующих осцилляций свидетельствует о том, что в условиях перфузии ФЖ не вызывает нарушений организованной активности.
Заключение. Эксперимент на изолированном искусственно перфузируемом сердце позволил выявить закономерности ФЖ, которые невозможно раскрыть на сердце in situ в условиях, осложняющих анализ нервных факторов и ишемии при ФЖ. По результатам работы получен патент, который можно использовать для диагностики ФЖ в имплантируемых дефибрилляторах.
Введение
В отличие от координированных сокращений сердца, поддерживающих гемодинамику, фибрилляция желудочков (ФЖ) характеризуется некоординированными сокращениями отдельных миокардиальных волокон, не способными поддержать количественные параметры гемодинамики и приводящими к смерти [1, 2]. ФЖ часто служит поводом внезапной сердечной смерти, которая является одной из основных причин смертности — 15–20% смертей во всем мире [3–5]. В силу этого ФЖ продолжает оставаться актуальной проблемой физиологии и медицины.
Фибрилляцию желудочков традиционно принято рассматривать как дезорганизованный процесс [6–9], но в последнее время при ФЖ обнаружена организованная активность [10–12]. Эта активность снижается в первые 8–10 мин ФЖ, а после 8–10-й минуты ФЖ становится дезорганизованной [13–15]. Установлено, что снижение организованности связано с угнетением электрической активности миокарда под влиянием ишемии при ФЖ [10–15], и следовательно, этого не будет происходить при перфузии, когда миокард не страдает от ишемии при ФЖ. Действительно, при оптическом картировании доминирующая частота ФЖ определялась в диапазоне 10–13 Гц, не снижаясь при часовой перфузии сердца [16]. Но картирование охватывало не более 8 см2 эпикардиальной поверхности левого желудочка, а длительность оптической регистрации составляла не более 5 с каждые 5 мин перфузии — это не более 1 мин регистрации при часовой перфузии при ФЖ. Неясно, насколько результаты картирования применимы ко всему миокарду желудочков и всему часовому интервалу перфузии при ФЖ. В работе [17] авторы указывают, что при часовой перфузии ФЖ была стабильной, но это утверждение не подкреплено ее количественными параметрами.
Таким образом, мы не нашли работ, в которых были бы представлены данные организованной активности ФЖ и ее количественные параметры при перфузии сердца, чтобы их можно было использовать для автоматической диагностики ФЖ в имплантируемых дефибрилляторах, эффективность которых пока является недостаточной: известны случаи внезапной смерти из-за отсутствия разряда при ФЖ, при этом 20% пациентов страдают от необоснованных разрядов из-за ложной диагностики ФЖ [18–21].
Цель исследования — выявление организованной активности фибрилляции желудочков и определение ее количественных параметров при перфузии сердца собаки в длительном эксперименте.
Материалы и методы
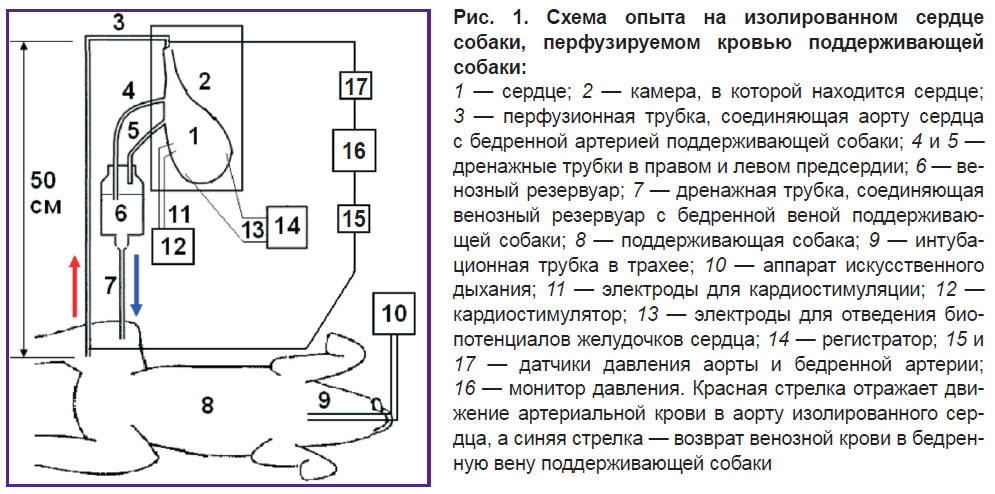
Выполнено четыре эксперимента на собаках. Содержание животных и проведение экспериментов осуществляли в соответствии с международными правилами «Guide for the Care and Use of Laboratory Animals» (National Research Council, 2011), а также с этическими принципами Европейской конвенции по защите позвоночных животных, используемых для экспериментальных и других научных целей (Страсбург, 2006). У собак массой 20–30 кг под тиопенталовым наркозом (10–15 мг/кг — начальная доза и 4–7 мг/кг — ежечасно) проводили искусственную вентиляцию легких (ИВЛ) аппаратом iVent 201 (General Electric Healthcare, Израиль). Выполняли торакотомию и выделяли, перевязывали и отсекали плечеголовные стволы аорты, легочную артерию, полые и легочные вены, непарную вену. Перед извлечением сердца из грудной клетки в бедренную вену собаки вводили 500 МЕ/кг гепарина. В правое предсердие вставляли дренажную трубку через верхнюю полую вену, а в левое предсердие — через легочную вену.
Затем канюлировали аорту и 6–8 мин перфузировали коронарные артерии кардиоплегическим раствором Custodiol (Dr. F. Köhler Chemie GmbH, Германия) температурой 5°С. После кардиоплегии осуществляли перфузию сердца кровью поддерживающей собаки (30–40 кг), которой проводили ИВЛ под тиопенталовым наркозом. Интервал от окончания кардиоплегии до подключения перфузии не превышал 10 мин, поскольку ишемия миокарда обратима без повреждения структуры и функции сердца при подключении перфузии в 10-минутном интервале кардиоплегии [22].
Из бедренной артерии поддерживающей собаки кровь поступала в аорту изолированного сердца (рис. 1). Перфузионное давление в аорте с использованием струбцины поддерживали в диапазоне 90–100 мм рт. ст., что приводило к закрытию аортального клапана и коронарной перфузии сердца по принципу Лангендорфа [23, 24]. Это давление определяли с использованием датчиков давления Combitrans (B. Braun, Польша), подключенных к монитору Datex-Ohmeda Cardiocap/5 (General Electric Healthcare, Финляндия). Венозная кровь из правого и левого предсердий стекала по дренажным трубкам в резервуар, установленный выше поддерживающей собаки, а из резервуара — в бедренную вену поддерживающей собаки. Для предотвращения тромбообразования в длительном эксперименте проводили гепаринизацию поддерживающей собаки (500 МЕ/кг — начальная доза и 150 МЕ/кг — ежечасно).
Сердце находилось в оригинальной камере из органического стекла, что обеспечивало визуальный контроль. В камере поддерживали температуру 37°С с использованием терморегулятора МН-2000 (КНР). Расхождение показаний терморегулятора с эталонным термометром ПТС-10М («ЭталонПрибор», Россия) не превышало 0,1°С в диапазоне 25–45°С. Поддерживающую собаку обогревали электрическим одеялом. Температуру собаки поддерживали на уровне 37°С с использованием терморегулятора МН-2000.
У всех четырех собак, которые составили одну изучаемую группу, определяли частотно-амплитудные параметры ФЖ в условиях перфузии сердца. Электрограмму желудочков от электродов, вколотых в правый и левый желудочки, регистрировали на кардиографе «Кардиотехника-ЭКГ-8» (ИКТ «Инкарт», Россия) при частоте оцифровки 1000 Гц. Патологические изменения на электрограммах желудочков сердца до ФЖ не определялись у всех изучаемых собак. ФЖ вызывали стимулами частотой 10 Гц и амплитудой 10 мА от кардиостимулятора. Проводили частотно-амплитудный анализ 12-секундных отрезков электрограммы методом быстрого преобразования Фурье в 30 частотах полугерцовой ширины в диапазоне 0,5–15 Гц: 0,5; 1; 1,5; …; 15 Гц.
Определяли частоту (Гц), спектральную мощность (амплитуду, мВ) и удельный вес (%) осцилляций 1-, 2- и 3-й по спектральной мощности частот в трехминутных интервалах ФЖ (здесь частота — мода; амплитуда и удельный вес — M±SEM). Методика спектрального анализа является оригинальной, разработана нами на основе предыдущих работ по изучению ФЖ [13–15] и используется впервые.
Статистическая обработка данных выполнена в программе The R Project for Statistical Computing, версия R 3.5.3 [25]. Эта программа входит в список лучших программных разработок [26]. Статистическая обработка проведена непараметрическими методами с использованием сравнения частотно-амплитудных параметров ФЖ по критерию  и корреляционной связи по Спирмену [27]. Данные представлены как среднее арифметическое ± стандартная ошибка среднего (M±SEM, n=120). Различия считали статистически значимыми при p≤0,05.
и корреляционной связи по Спирмену [27]. Данные представлены как среднее арифметическое ± стандартная ошибка среднего (M±SEM, n=120). Различия считали статистически значимыми при p≤0,05.
Результаты
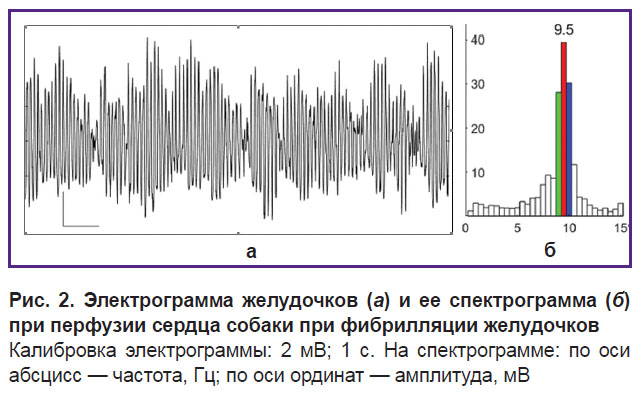
На электрограмме желудочков при перфузии сердца при ФЖ доминируют осцилляции частотой 9–10 Гц (рис. 2, а), что объективно подтверждает и спектрограмма: осцилляции частотой 9,5; 10 и 9 Гц стоят на первом, втором и третьем месте по спектральной мощности и доминируют в структуре частот осцилляций (рис. 2, б).
Доминантная частотная структура, выявленная в 12-секундном интервале ФЖ (см. рис. 2), является достоверной для 30-минутного интервала ФЖ (рис. 3). 1-я по спектральной мощности частота имеет постоянное значение 9,5 Гц, а 2-я и 3-я частоты — на 0,5 Гц больше или меньше 1-й частоты (см. рис. 3). При 30-минутной перфузии сердца при ФЖ эти три частоты образуют сплошную стабильную полосу доминирующих частот 9–10 Гц шириной 1,5 Гц, что составляет 1/10 диапазона 0,5–15 Гц.
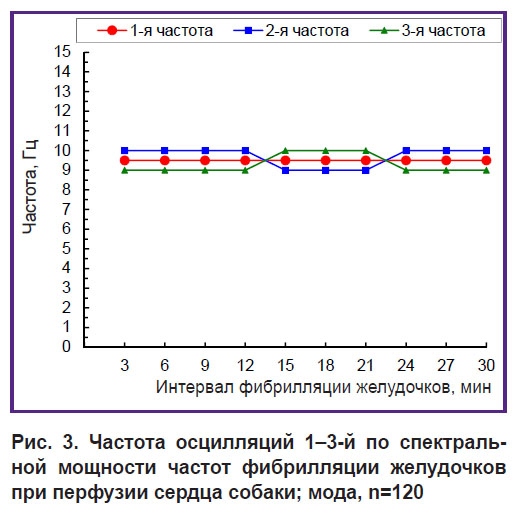
|
Рис. 3. Частота осцилляций 1–3-й по спектральной мощности частот фибрилляции желудочков при перфузии сердца собаки; мода, n=120 |
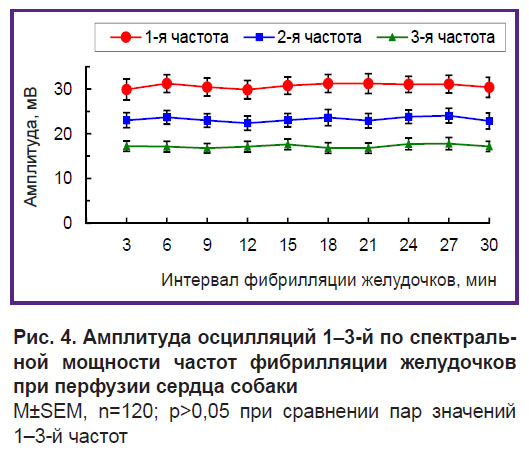
Амплитуда осцилляций 1-й частоты — 30–31 мВ, 2-й частоты — 23–24 мВ, 3-й частоты — 17–18 мВ. Амплитуда осцилляций всех трех частот является практически стабильной — различия значений в трехминутных интервалах ФЖ недостоверны (рис. 4).
|
Рис. 4. Амплитуда осцилляций 1–3-й по спектральной мощности частот фибрилляции желудочков при перфузии сердца собаки M±SEM, n=120; p>0,05 при сравнении пар значений 1–3-й частот |
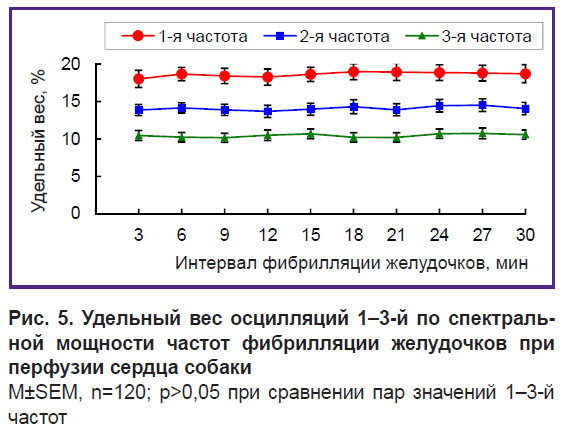
Осцилляции 1-й частоты, занимающие 1/30 диапазона 0,5–15 Гц, содержат 18–19% спектральной мощности, 2-й частоты — 13–14%, а 3-й — 10–11%; удельный вес осцилляций каждой из этих частот практически стабилен: различия значений в трехминутных интервалах ФЖ не являются достоверными (рис. 5). Удельный вес осцилляций каждой из частот связан с амплитудой осцилляций этих частот. На это указывает сильная прямая корреляционная связь между амплитудой и удельным весом осцилляций при 30-минутной перфузии сердца: у 1-й частоты — 0,79; у 2-й — 0,83 и у 3-й — 0,94.
|
Рис. 5. Удельный вес осцилляций 1–3-й по спектральной мощности частот фибрилляции желудочков при перфузии сердца собаки
M±SEM, n=120; p>0,05 при сравнении пар значений 1–3-й частот |
В сумме осцилляции 1–3-й частот, занимающие 1/10 диапазона 0,5–15 Гц, содержат 42–44% спектральной мощности и доминируют в структуре частот осцилляций. Доминантная структура является стабильной по частоте, амплитуде и удельному весу доминирующих осцилляций 1–3-й частот.
Обсуждение
В условиях перфузии ФЖ собаки характеризуется доминантной структурой частот осцилляций (см. рис. 2), что свидетельствует об организованной (синхронизированной) активности миокарда. Если бы кардиомиоциты генерировали потенциалы действия в случайном порядке и независимо друг от друга, эти потенциалы, случайно суммируясь, давали бы случайный суммарный процесс с равномерно распределенной спектральной плотностью в диапазоне 0,5–15 Гц.
Доминирование осцилляций ФЖ частотой 9–10 Гц отражает, по-видимому, синхронизированную активность кардиомиоцитов, генерирующих потенциалы действия частотой 9–10 Гц. В пользу этого мнения свидетельствует тот факт, что кардиомиоциты генерировали потенциалы действия частотой 9–10 Гц на первых секундах ФЖ [11, 12], когда миокард не страдает от ишемии, так как первые 10–20 с ФЖ могут обеспечиваться за счет резервной АТФ и кислорода в миокарде [22, 28].
Стабильность организованной структуры по частоте и спектральной мощности доминирующих осцилляций (см. рис. 3–5) свидетельствует о том, что в условиях перфузии ФЖ не вызывает нарушений организованной активности. Таким образом, результаты работы показывают, что постановка опыта на изолированном искусственно перфузируемом сердце позволяет выявлять закономерности ФЖ, которые невозможно обнаружить на сердце in situ в условиях, осложняющих анализ нервных факторов и ишемии при ФЖ. Результаты работы можно использовать для диагностики ФЖ, так как частота осцилляций ФЖ сердца собаки близка их значениям у человека [11, 12, 29–31], электрограмма желудочков сердца отражает глобальную активность желудочков по аналогии с ЭКГ [32], а метод быстрого преобразования Фурье позволяет объективно определять частотно-амплитудный состав осцилляций электрограммы желудочков при ФЖ, который сходен с частотно-амплитудным составом ЭКГ при ФЖ [8, 10, 11]. По результатам работы нами получен патент [33], результаты работы можно использовать для автоматической диагностики ФЖ в имплантируемых дефибрилляторах.
Заключение
Фибрилляция желудочков сердца собаки в условиях перфузии характеризуется организованной активностью, о чем свидетельствует доминантная структура частот осцилляций. Осцилляции частотой 9–10 Гц, занимающие 1/10 диапазона 0,5–15 Гц, содержат 42–44% спектральной мощности и доминируют в частотной структуре ФЖ. Стабильность организованной структуры по частоте и спектральной мощности доминирующих осцилляций свидетельствует о том, что в условиях перфузии ФЖ не вызывает нарушений организованной активности.
Результаты работы показывают, что постановка опыта на изолированном искусственно перфузируемом сердце позволяет выявлять закономерности ФЖ, которые невозможно увидеть на сердце in situ в условиях, осложняющих анализ нервных факторов и ишемии при ФЖ.
Финансирование исследования и конфликт интересов. Исследование не финансировалось какими-либо источниками, и конфликты интересов, связанные с данным исследованием, отсутствуют.
Литература
- Гурвич Н.Л. Основные принципы дефибрилляции сердца. М: Медицина; 1975.
- Ellenbogen K.A., Kay G.N., Wilkoff B.L. Clinical cardiac pacing and defibrillation. W.B. Saunders Company; 2000.Hayashi M., Shimizu W., Albert C.M. The spectrum of epidemiology underlying sudden cardiac death. Circ Res 2015; 116(12): 1887–1906, https://doi.org/10.1161/circresaha.116.304521.
- Востриков В.А., Кузовлев А.Н. Общедоступная дефибрилляция при внезапной остановке сердца (краткий обзор). Общая реаниматология 2018; 14(1): 58–67.
- Narayan S.M., Wang P.J., Daubert J.P. New concepts in sudden cardiac arrest to address an intractable epidemic: JACC state-of-the-art review. J Am Coll Cardiol 2019; 73(1): 70–88, https://doi.org/10.1016/j.jacc.2018.09.083.
- Jalife J. Mathematical approaches to cardiac arrhythmias. Ann N Y Acad Sci 1990; 591: 1–416.
- Karma A. Physics of cardiac arrhythmogenesis. Annu Rev Condens Matter Phys 2013; 4: 313–337, https://doi.org/10.1146/annurev-conmatphys-020911-125112.
- Pandit S.V., Jalife J. Rotors and the dynamics of cardiac fibrillation. Circ Res 2013; 112(5): 849–862, https://doi.org/10.1161/circresaha.111.300158.
- Qu Z., Weiss J.N. Mechanisms of ventricular arrhythmias: from molecular fluctuations to electrical turbulence. Annu Rev Physiol 2015; 77: 29–55, https://doi.org/10.1146/annurev-physiol-021014-071622.
- Huizar J.F., Warren M.D., Shvedko A.G., Kalifa J., Moreno J., Mironov S., Jalife J., Zaitsev A.V. Three distinct phases of VF during global ischemia in the isolated blood-perfused pig heart. Am J Physiol Heart Circ Physiol 2007; 293(3): H1617–H1628, https://doi.org/10.1152/ajpheart.00130.2007.
- Kong W., Ideker R.E., Fast V.G. Intramural optical mapping of Vm and Cai2+ during long-duration ventricular fibrillation in canine hearts. Am J Physiol Heart Circ Physiol 2012; 302(6): H1294–H1305, https://doi.org/10.1152/ajpheart.00426.2011.
- Huang J., Dosdall D.J., Cheng K.A., Li L., Rogers J.M., Ideker R.E. The importance of Purkinje activation in long duration ventricular fibrillation. J Am Heart Assoc 2014; 3(1): e000495, https://doi.org/10.1161/jaha.113.000495.
- Guryanov M.I. Dominant and non-dominant structure of ventricular fibrillation in canine heart. Bull Exp Biol Med 2016; 160(3): 291–294, https://doi.org/10.1007/s10517-016-3153-4.
- Гурьянов М.И. Организованная структура фибрилляции желудочков сердца собаки. Российский физиологический журнал им. И.М. Сеченова 2016; 102(3): 297–306.
- Guryanov M.I. Organized frequency structure of electrocardiogram during long-duration ventricular fibrillation under experimental conditions. Sovremennye tehnologii v medicine 2016; 8(3): 37–48, https://doi.org/10.17691/stm2016.8.3.04.
- Zaitsev A.V., Guha P.K., Sarmast F., Kolli A., Berenfeld O., Pertsov A.M., de Groot J.R., Coronel R., Jalife J. Wavebreak formation during ventricular fibrillation in the isolated, regionally ischemic pig heart. Circ Res 2003; 92(5): 546–553, https://doi.org/10.1161/01.res.0000061917.23107.f7.
- Koller M.L., Riccio M.L., Gilmour R.F. Jr. Dynamic restitution of action potential duration during electrical alternans and ventricular fibrillation. Am J Physiol
- 1998; 275(5): H1635–H1642, https://doi.org/10.1152/ajpheart.1998.275.5.h1635.
- Wilkoff B.L., Williamson B.D., Stern R.S., Moore S.L., Lu F., Lee S.W., Birgersdotter-Green U.M., Wathen M.S., Van Gelder I.C., Heubner B.M., Brown M.L., Holloman K.K.; PREPARE Study Investigators. Strategic programming of detection and therapy parameters in implantable cardioverter-defibrillators reduces shocks in primary prevention patients: results from the PREPARE (Primary Prevention Parameters Evaluation) study. J Am Coll Cardiol 2008; 52(7): 541–550, https://doi.org/10.1016/j.jacc.2008.05.011.
- Olde Nordkamp L.R.A., Postema P.G., Knops R.E., van Dijk N., Limpens J., Wilde A.A., de Groot J.R. Implantable cardioverter-defibrillator harm in young patients with inherited arrhythmia syndromes: a systematic review and meta-analysis of inappropriate shocks and complications. Heart Rhythm 2016; 13(2): 443–454, https://doi.org/10.1016/j.hrthm.2015.09.010.
- Thøgersen M.A., Larsen J.M., Johansen J.B., Abedin M., Swerdlow C.D. Failure to treat life-threatening ventricular tachyarrhythmias in contemporary implantable cardioverter-defibrillators: implications for strategic programming. Circ Arrhythm Electrophysiol 2017; 10(9): e005305, https://doi.org/10.1161/circep.117.005305.
- Watanabe E., Okajima K., Shimane A., Ozawa T., Manaka T., Morishima I., Asai T., Takagi M., Honda T., Kasai A., Fujii E., Yamashiro K., Kohno R., Abe H., Noda T., Kurita T., Watanabe S., Ohmori H., Nitta T., Aizawa Y., Kiyono K., Okumura K. Inappropriate implantable cardioverter defibrillator shocks — incidence, effect, and implications for driver licensing. J Interv Card Electrophysiol 2017; 49(3): 271–280, https://doi.org/10.1007/s10840-017-0272-4.
- Gebhard M.-M., Bretschneider H.J., Schnabel P.A. Cardioplegia principles and problems. In: Physiology and pathophysiology of the heart. Springer Science+Business Media; 1989; p. 655–668.
- Langendorff O. Untersuchungen am überlebenden Säugethierherzen. Pflügers Arch 1895; 61: 291–332, https://doi.org/10.1007/BF01812150.
- Janse M.J. The effect of changes in heart rate on the refractory period of the heart. PhD Thesis. Amsterdam: Mondeel-Offsetdrukkerij; 1971.
- The R Project for Statistical Computing. URL: https://www.r-project.org/.
- Хромов-Борисов Н.Н. Биостатистические программы свободного доступа. Травматология и ортопедия России 2015; 4(78): 154–159.
- Кобзарь А.И. Прикладная математическая статистика. Для инженеров и научных работников. М: Физматлит; 2006.
- Stanley W.C., Recchia F.A., Lopaschuk G.D. Myocardial substrate metabolism in the normal and failing heart. Physiol Rev 2005; 85(3): 1093–1129, https://doi.org/10.1152/physrev.00006.2004.
- Иванов Г.Г., Востриков В.А. Фибрилляция желудочков и желудочковые тахикардии — базовые положения и диагностические критерии. Вестник Российского университета дружбы народов. Серия: Медицина 2007; 4: 44–54.
- Noujaim S.F., Berenfeld O., Kalifa J., Cerrone M., Nanthakumar K., Atienza F., Moreno J., Mironov S., Jalife J. Universal scaling law of electrical turbulence in the mammalian heart. Proc Natl Acad Sci U S A 2007; 104(52): 20985–20989, https://doi.org/10.1073/pnas.0709758104.
- Venable P.W., Taylor T.G., Shibayama J., Warren M., Zaitsev A.V. Complex structure of electrophysiological gradients emerging during long-duration ventricular fibrillation in the canine heart. Am J Physiol Heart Circ Physiol 2010; 299(5): H1405–H1418, https://doi.org/10.1152/ajpheart.00419.2010.
- Barr R.C. The electrocardiogram and its relationship to excitation of the heart. In: Physiology and pathophysiology of the heart. Springer Science+Business Media; 1989; p. 175–193.
- Гурьянов М.И. Способ диагностики фибрилляции желудочков сердца. Патент РФ 2704783. 2019.