Цитокиновый профиль CCR6+ T-хелперов, выделенных из крови пациентов с язвенной болезнью, ассоциированной с H. pylori-инфекцией
Ранее мы обнаружили, что при H. pylori-ассоциированной язвенной болезни в крови увеличивается содержание CCR6+ Т-хелперов с фенотипом эффекторов/эффекторных Т-клеток памяти. Зрелый фенотип и экспрессия хемокинового рецептора CCR6, участвующего в миграции лимфоцитов в воспаленную слизистую оболочку желудочно-кишечного тракта, наводят на мысль о вовлечении этих клеток в иммунный ответ при исследуемом заболевании. Для оценки патогенетической роли данных клеток требуется исследование их функциональных свойств: в частности, продукции провоспалительных цитокинов, вовлеченных в патогенез заболевания.
Цель исследования — оценить изменения содержания в крови провоспалительных типов зрелых CCR6+ Т-хелперов при H. pylori-ассоциированной язвенной болезни.
Материалы и методы. CСR6+ Т-хелперы выделяли с помощью модифицированного для выполнения данного исследования метода иммуномагнитной сепарации. Количество Т-хелперов 1-го и 17-го типов (Тх1 и Тх17) и клеток со смешанными свойствами Тх1 и Тх17 (Тх1/Тх17) определяли с помощью метода оценки внутриклеточных цитокинов.
Результаты. Исходно мы планировали активировать неразделенные мононуклеарные клетки периферической крови ex vivo и оценить содержание продуцентов цитокинов в группе зрелых CСR6+ Т-хелперов, выделенных в гейт при анализе результатов проточной цитометрии. Однако существенные изменения фенотипа Т-хелперов не позволили надежно идентифицировать исследуемую группу клеток после активации. В дальнейшем мы использовали двухэтапную иммуномагнитную сепарацию, с помощью которой из крови выделяли функционально активные зрелые CСR6+ Т-хелперы с чистотой более 90%. Выход этих клеток из крови пациентов с H. pylori-ассоциированной язвенной болезнью в 9 раз превышал выход из крови здоровых доноров. Активация очищенных CСR6+ Т-хелперов выявила повышенное содержание Тх1, Тх17 и Тх1/Тх17 в этой группе клеток при язвенной болезни. Из 1 мл крови больных выделялось в 18,1 раза больше CСR6+ Тх1, в 19,4 раза больше CСR6+ Тх17 и в 21,1 раза больше CСR6+ Тх1/Тх17 по сравнению с кровью здоровых доноров.
Заключение. Содержание зрелых CСR6+ Т-хелперов c провоспалительной активностью значительно возрастает в крови пациентов с H. pylori-ассоциированной язвенной болезнью.
Введение
В данной работе исследовали CCR6+ Т-хелперы, содержание которых в крови увеличивается при язвенной болезни, ассоциированной с H. pylori-инфекцией [1]. H. pylori способен длительно персистировать в желудке и на участках желудочной метаплазии в двенадцатиперстной кишке человека, вызывая различные формы инфекции — от бессимптомного инфицирования до гастрита типа В и язвенной болезни, а также провоцируя развитие аденокарциномы желудка и MALT-лимфомы [2–4]. Иммунный ответ на инфицирование H. pylori развивается быстро [5, 6], однако этой реакции оказывается недостаточно для эффективной борьбы с микроорганизмом, заселяющим весьма специфические ниши [7, 8], малодоступные для эффекторов иммунитета. В частности, слабость трансэпителиального транспорта IgA в желудке [9] не позволяет создать концентрацию секреторного IgA, достаточную для устранения H. pylori из защитного слоя слизи желудка и с поверхности эпителия [10–12]. Клеточный иммунный ответ на H. pylori также обладает ограниченным защитным эффектом. Более того, эксперименты на животных позволяют предположить, что клеточный иммунный ответ, а именно активность провоспалительных Т-хелперов, вносит важный вклад в развитие симптомов гастрита [12], наряду с прямым действием токсинов H. pylori. Так, при отсутствии полноценно функционирующих Т-хелперов H. pylori вызывает массивную, но бессимптомную инфекцию у мышей, тогда как восстановление иммунитета этих мышей за счет введения им нормальных Т-хелперов ведет к уменьшению бактериальной нагрузки и одновременно к развитию выраженного воспалительного поражения слизистой оболочки желудка [13, 14]. Основными цитокинами, индуцирующими воспаление в моделях H. pylori-ассоциированного гастрита, являются ключевой цитокин Тх1 интерферон-γ (IFN-γ) и цитокин Тх17 интерлейкин-17А (IL-17А) [13], причем созревание Тх17 и продукция ими IL-17А служит обязательным условием роста продукции IFN-γ [15, 16]. Вклад иммунных механизмов в формирование язвенной болезни исследован недостаточно.
Ранее [1] мы обнаружили, что при H. pylori-ассоциированной язвенной болезни в крови в 2 раза повышается содержание зрелых Т-хелперов, экспрессирующих хемокиновый рецептор CCR6, тогда как при гастродуодените количество этих клеток увеличивается незначительно. CCR6 направляет миграцию Т-лимфоцитов из кровотока в кожу, пейеровы бляшки, а также в воспаленную слизистую оболочку желудочно-кишечного тракта [17, 18]. Экспрессия CCR6 характерна для Тх17, хотя количество CCR6+ Т-хелперов значительно превышает количество зрелых Тх17 [19]. По нашему мнению, рост содержания зрелых CCR6+ Т-хелперов происходит за счет клеток, вовлеченных в иммунный ответ на H. pylori-инфекцию. Покинув после созревания вторичные лимфоидные органы и оказавшись в кровотоке, эти клетки могут направленно мигрировать в воспаленную слизистую оболочку, где будут продуцировать цитокины в соответствии с типом цитокинопродукции, приобретенным в ходе созревания. Для оценки возможной патогенетической роли CCR6+ Т-хелперов следует определить содержание среди этих клеток зрелых Тх1, Тх17, а также клеток со смешанными свойствами Тх1 и Тх17 в норме и при изучаемой патологии.
Цель исследования — оценить изменения содержания в крови провоспалительных типов зрелых CCR6+ Т-хелперов при H. pylori-ассоциированной язвенной болезни.
Материалы и методы
Исследование проведено в соответствии с положениями Хельсинкской декларации (2013) и одобрено локальным этическим комитетом Нижегородского НИИ эпидемиологии и микробиологии им. академика И.Н. Блохиной Роспотребнадзора. Все пациенты и доноры дали информированное согласие на участие в исследовании. Обследовали взрослых больных (n=7) с язвенной болезнью желудка или двенадцатиперстной кишки, ассоциированной с H. pylori-инфекцией, при поступлении в стационар в связи с обострением основного заболевания. Наличие H. pylori подтверждали с помощью быстрого уреазного теста и обнаружения ДНК H. pylori с использованием полимеразой цепной реакции [20]. Взрослые практически здоровые доноры были привлечены для отработки методов (n=4) и формирования группы сравнения (n=15).
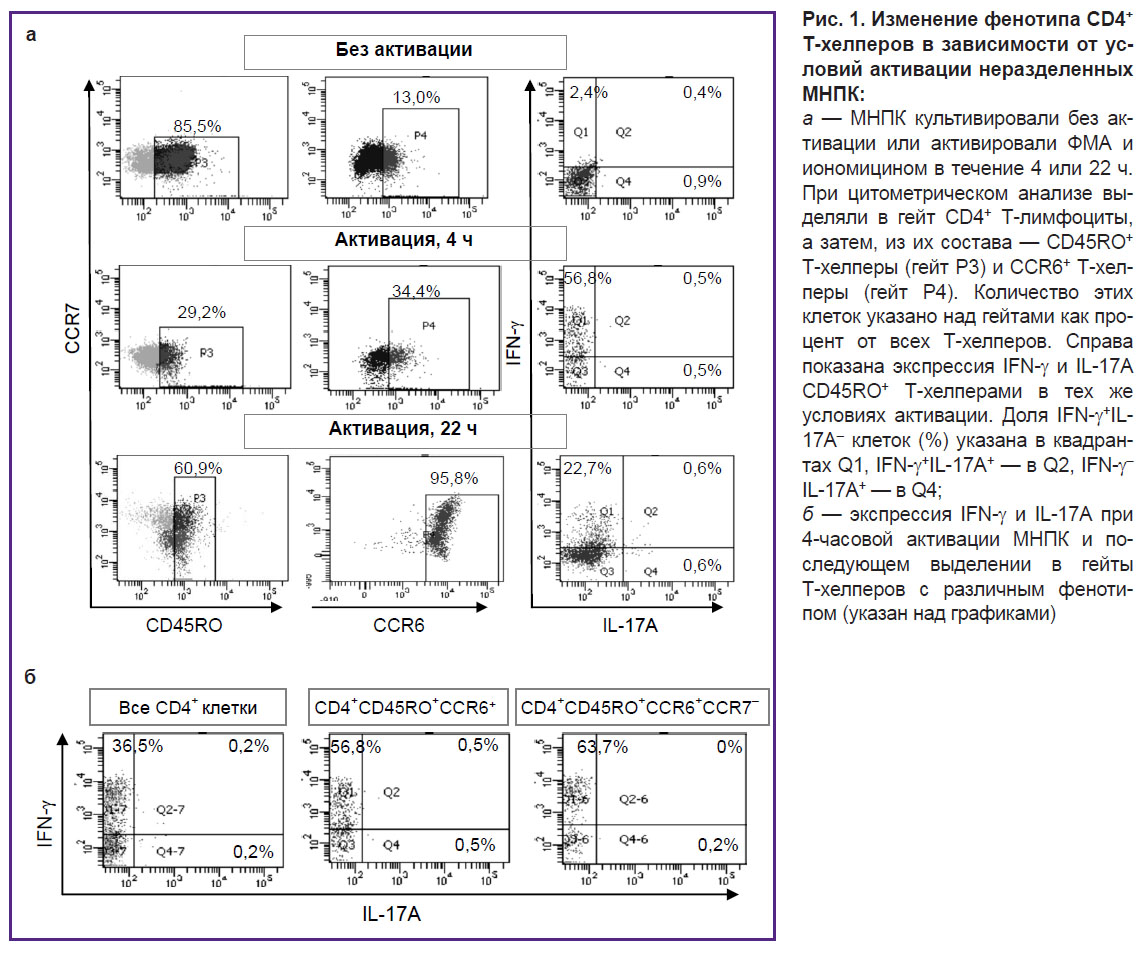
Активация неразделенных мононуклеарных клеток периферической крови. Мононуклеарные клетки периферической крови (МНПК) выделяли из гепаринизированной венозной крови традиционным способом с помощью центрифугирования над слоем Hystopaque-1077 (Sigma, США). Затем их засевали в 24-луночные планшеты (Costar, США) по 2·106 клеток на лунку в 1 мл среды RPMI-1640 (Gibco, Великобритания) c 10% эмбриональной телячьей сыворотки — ЭТС (PAA Laboratories, Австрия) и активаторами: 25 нг/мл форбол-12-миристат-13-ацетата — ФМА (Serva, Германия) и 1 мкг/мл иономицина (Sigma). Клетки культивировали 4 или 22 ч при +37°С и 5% СО2, причем в обоих случаях — с добавлением 5 мкг/мл брифелдина А (BioLegend, США) на последние 4 ч культивирования. Затем клетки окрашивали флуоресцентными конъюгатами антител к молекулам CD4 («Сорбент», Россия), CD45RO, CCR6 (BioLegend) и CCR7 (eBioscience, США), фиксировали 4% параформальдегидом, пермеабилизировали мембраны 0,1% сапонином и окрашивали цитокины конъюгатами антител к IFN-γ и IL-17А (eBioscience), как это описано ранее [21]. Пробы анализировали на проточном цитофлуориметре FacsCanto II (BD Biosciences, США), оценивая количество продуцентов IFN-γ и IL-17А в CD4+, CD4+CD45RO+ и CD4+CD45RO+CСR6+CCR7– клетках.
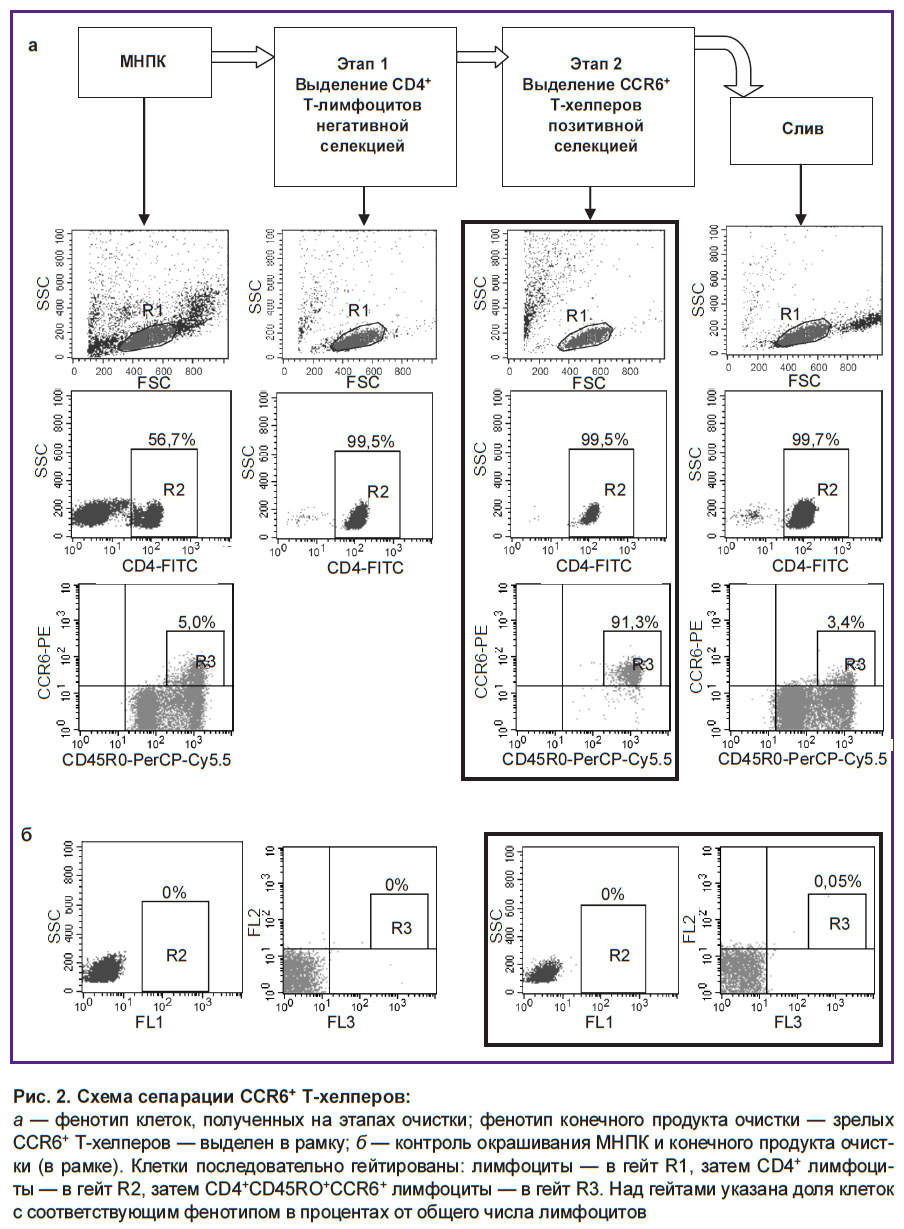
Иммуномагнитная сепарация CCR6+ Т-хелперов. На первом этапе сепарации из МНПК выделяли CD4+ Т-хелперы путем негативной селекции, используя набор EasySep Human CD4+ T Cell Isolation Kit (STEMCELL Technologies, Канада) согласно инструкции производителя. На втором этапе из состава Т-хелперов выделяли клетки CCR6+ позитивной селекцией, используя отдельные реагенты STEMCELL Technologies. Для этого Т-хелперы, выделенные из 18 мл крови, помещали в круглодонную полистироловую пробирку диаметром 12 мм и высотой 75 мм, однократно отмывали и ресуспендировали в 350 мкл среды для магнитных бус следующего состава: забуференный фосфатами физиологический раствор с 2% ЭТС и 1 мM этилендиаминтетрауксусной кислоты. Затем в пробирку добавляли 9 мкл реагента EasySep Human CCR6+ Positive Selection Cocktail II (STEMCELL Technologies), связывающего CCR6 с поверхностью бус. После 5 мин инкубации при комнатной температуре и плавном перемешивании добавляли 70 мкл суспензии магнитных бус EasySep Releasable RapidSpheres 50201 и инкубировали еще 5 мин. Доводили объем средой для бус до 2,5 мл, перемешивали и помещали в магнит EasySep. Через 5 мин сливали жидкость из пробирки, не вынимая ее из магнита. Затем пробирку извлекали из магнита, оставшиеся на стенках бусы с клетками ресуспендировали в 2,5 мл среды для бус. Пробирку вновь помещали в магнит и через 5 мин сливали жидкость, не вынимая пробирку из магнита. Затем ее доставали, добавляли 175 мкл среды для бус, обмывая стенки, добавляли 35 мкл буфера для снятия бус (EasySep Release Buffer) и инкубировали 5 мин. Далее пробирку ставили в магнит и через 5 мин сливали в стерильную пробирку жидкость, содержащую CCR6+ Т-хелперы. Чистоту конечного продукта сепарации и проб, отобранных на этапах очистки, определяли с помощью проточной цитометрии клеток, окрашенных конъюгатами антител к CD4, CD45RO и CCR6.
Активация очищенных Т-хелперов. Очищенные клетки отмывали и засевали в лунки круглодонных 96-луночных планшетов (Costar) по 2,5·104 клеток в 100 мкл среды RPMI-1640 c 10% ЭТС. Клетки культивировали от 22 до 118 ч при +37°С и 5% СО2. Активацию проводили, добавляя 25 нг/мл ФМА и 1 мкг/мл иономицина на последние 4 или 22 ч культивирования. Брифелдин А (5 мкг/мл) добавляли на последние 4 ч культивирования. После культивирования клетки собирали, окрашивали внутриклеточные цитокины, как это описано выше, и анализировали на цитофлуориметре.
Статистическая обработка данных. Результаты цитометрии обрабатывали программой Diva (BD Biosciences). Статистический анализ проводили с использованием t-теста Стьюдента.
Результаты и обсуждение
Исходно мы планировали активировать неразделенные МНПК, а затем оценить содержание продуцентов IFN-γ и IL-17А в исследуемой группе CD4+CD45RO+CСR6+CCR7– Т-хелперов, выделенных в гейт при анализе результатов цитометрии. Однако мы были вынуждены отказаться от этого подхода в связи с существенным изменением фенотипа клеток при активации. Так, при 4-часовой активации МНПК наблюдалось снижение экспрессии CD4 и CD45RO и заметный рост экспрессии CCR6 (рис. 1, а). При 22-часовой активации экспрессия CCR6 увеличивалась многократно, в результате чего эту молекулу несли практически все Т-хелперы. Эти сильные изменения фенотипа не позволили выделить объект нашего исследования, а именно содержащуюся в исходных образцах крови малочисленную группу зрелых CСR6+ Т-хелперов. Вместо этого мы выделяли в гейт большое количество Т-хелперов, исходно лишенных молекулы CCR6 и экспрессирующих ее в процессе активации. По продукции IFN-γ и IL-17А эти клетки не отличались от общей группы зрелых CD4+CD45RO+ Т-хелперов: большинство продуцентов являлись Тх1, синтезирующими IFN-γ, тогда как количество продуцентов IL-17А было ничтожным (рис. 1, б).
В результате мы отказались от этого метода и приняли решение выделять целевую группу клеток из состава МНПК с помощью магнитной сепарации и лишь затем подвергать очищенные клетки активации. Поскольку коммерческих наборов для выделения зрелых CCR6+ Т-хелперов не существует, нам пришлось модифицировать метод очистки, используя набор для выделения CD4+ Т-хелперов и отдельные реагенты из набора для обогащения Тх17.
Использованная нами схема очистки была следующей. На первом этапе сепарации из МНПК выделяли CD4+ Т-хелперы негативной селекцией. При этом все клетки, отличные от Т-хелперов, с помощью антител к линейным маркерам связывали с магнитными бусами и отделяли на магните, а свободные от бус Т-хелперы собирали для следующего этапа разделения. На втором этапе из состава Т-хелперов выделяли CCR6+-клетки, связывая их с бусами при помощи соответствующих антител. Меченные бусами клетки выделяли на магните, снимали с них бусы и получали конечный продукт — CCR6+ Т-хелперы. Фенотипический анализ показал, что данный способ эффективно позволяет выделять группу Т-хелперов с высоким уровнем экспрессии CCR6, тогда как слив содержит CCR6– Т-хелперы и остаточное количество Т-хелперов с низким уровнем экспрессии CCR6 (рис. 2). Поскольку выраженной экспрессией CCR6 обладают исключительно зрелые Т-клетки [1], конечный продукт сепарации содержал практически чистую группу зрелых клеток с фенотипом CD4+CD45RO+CСR6+. Чистота выделения CD4+ клеток уже после первого этапа сепарации превышала 99%, чистота CD4+CD45RO+CСR6+ клеток после второго этапа сепарации превышала 90% (см. рис. 2). Таким образом, клетки, выделенные с помощью данного метода, соответствуют объекту исследования — зрелым циркулирующим CСR6+ Т-хелперам.
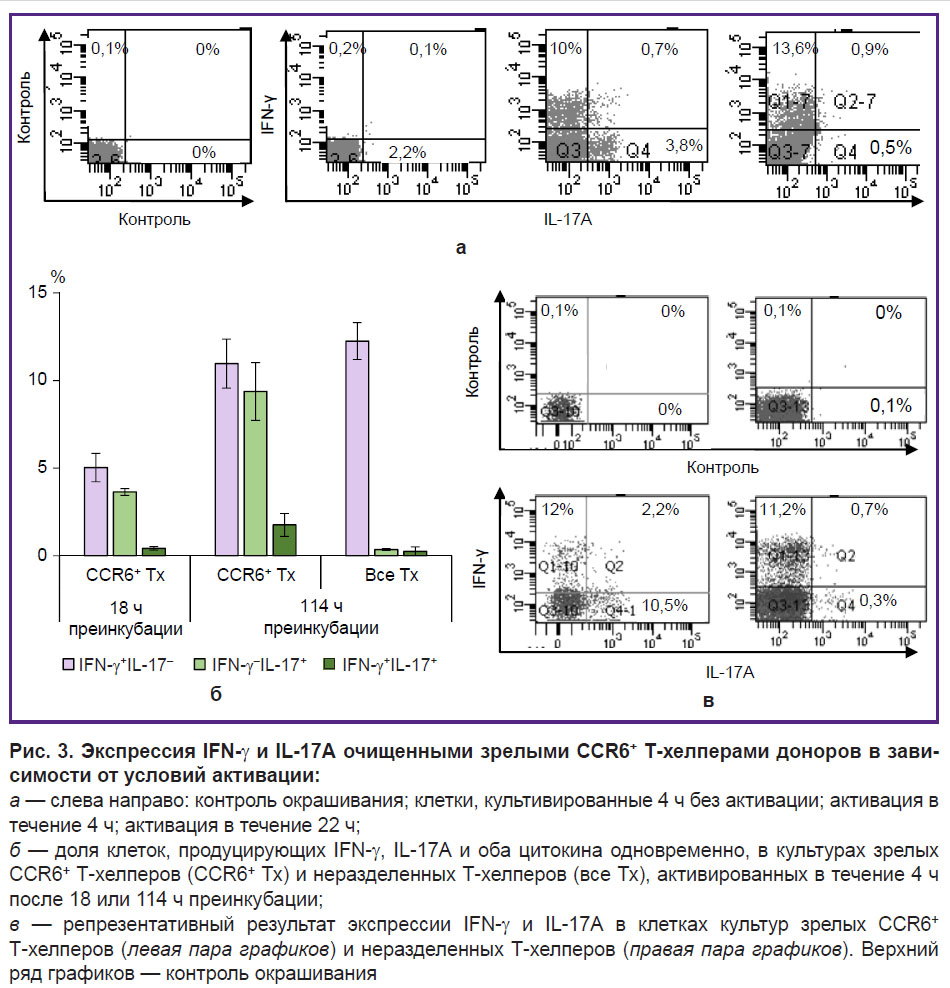
Для отработки метода оценки функциональных свойств очищенные CСR6+ Т-хелперы здоровых доноров активировали смесью ФМА и иономицина в течение 4 или 22 ч. Контролем служили клетки без активаторов. Для накопления продуцируемых цитокинов внутри клеток во все культуры добавляли ингибитор внутриклеточного транспорта брифелдин А на последние 4 ч культивирования. Окрашивание IFN-γ и IL-17А показало, что зрелые циркулирующие CСR6+ Т-хелперы не продуцируют эти цитокины без активации (рис. 3, а). Краткосрочная активация вызывала накопление IFN-γ и IL-17А в двух различных группах клеток — Тх1 и Тх17 соответственно. Также обнаружилось небольшое количество клеток со смешанными свойствами — Тх1/Тх17. При активации клеток в течение 22 ч с добавлением брифелдина А на последние 4 ч культивирования количество выявляемых Тх1 существенно не изменялось, тогда как Тх17 практически переставали обнаруживаться. Следует предположить, что Тх17, входящие в состав зрелых CСR6+ Т-хелперов крови, после активации быстро начинают продуцировать IL-17А, но полностью заканчивают продукцию к 18 ч, тогда как Тх1 сохраняют продукцию IFN-γ в течение всего срока культивирования.
Неактивированные очищенные клетки оказались способны переносить длительное культивирование без утраты своих функциональных свойств. Мы культивировали эти клетки в среде без активаторов ночь (18 ч) или 114 ч, а затем активировали их в течение 4 ч в присутствии брифелдина А. При 18-часовой преинкубации в культурах было обнаружено сходное количество Тх1 и Тх17 и незначительное количество Тх1/Тх17 (рис. 3, б). При 114-часовой преинкубации количество клеток, демонстрирующих свойства Тх1, Тх17 и Тх1/Тх17, не снижалось и даже имело тенденцию к росту. Т-хелперы, не разделенные по наличию и отсутствию CCR6 (клетки, полученные на первом этапе очистки), в аналогичных условиях активации преимущественно демонстрировали свойства Тх1 (см. рис. 3, б, рис. 3, в).
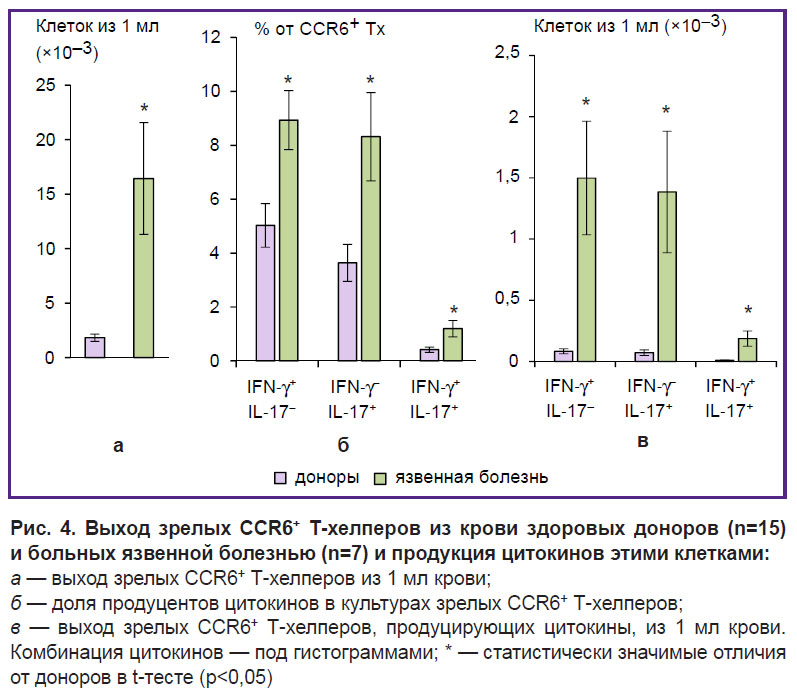
Для сравнения CСR6+ Т-хелперов крови в норме и при язвенной болезни эти клетки выделяли магнитной сепарацией, преинкубировали в течение 18 ч и активировали ФМА и иономицином в присутствии брифелдина А в течение 4 ч. Выход очищенных зрелых CСR6+ Т-хелперов у здоровых доноров составляет 0,13±0,02% от исходного количества МНПК, а у больных язвенной болезнью — 1,04±0,31% (р=0,02). Количество зрелых CCR6+ Т-хелперов, выделяемое из 1 мл крови пациентов с язвенной болезнью, было в 9 раз больше, чем у здоровых доноров (рис. 4, а). Выделенные у больных CСR6+ Т-хелперы содержали в своем составе достоверно бóльшие доли Тх1, Тх17 и Тх1/Тх17 по сравнению с аналогичными клетками здоровых доноров (рис. 4, б). Расчет выхода провоспалительных типов Т-хелперов из крови показал, что из 1 мл крови больных выделяется в 18,1 раза больше CСR6+ Тх1 (р=0,02), в 19,4 раза больше CСR6+ Тх17 (р=0,03) и в 21,1 раза больше CСR6+ Тх1/Тх17 (р=0,03) по сравнению с кровью здоровых доноров (рис. 4, в).
Заключение
С использованием иммуномагнитной сепарации получены пробы функционально активных зрелых CСR6+ Т-хелперов крови с чистотой более 90%. Выход этих клеток из крови пациентов с H. pylori-ассоциированной язвенной болезнью в 9 раз превышает их выход из крови здоровых доноров. Активация очищенных CСR6+ Т-хелперов ex vivo выявляет повышенное содержание Тх1, Тх17 и Тх1/Тх17 в этой группе клеток при язвенной болезни. Рост содержания зрелых CСR6+ Т-хелперов крови и их повышенная провоспалительная активность согласуются с предположением о патогенетическом значении этой группы клеток при H. pylori-ассоциированной язвенной болезни.
Финансирование исследования. Работа выполнена за счет средств проекта Российского фонда фундаментальных исследований №18-015-00028-а (в части модификации метода сепарации CCR6+ Т-хелперов), отраслевой научно-исследовательской программы «Научные исследования и разработки с целью обеспечения санитарно-эпидемиологического благополучия и снижения инфекционной заболеваемости в Российской Федерации» (в части исследования H. pylori-инфекции).
Конфликт интересов. Авторы декларируют отсутствие конфликта интересов.
Литература
- Талаев В.Ю., Талаева М.В., Воронина Е.В., Заиченко И.Е., Неумоина Н.В., Перфилова К.М., Бабайкина О.Н. Экспрессия хемокиновых рецепторов на Т-хелперах крови при заболеваниях, ассоциированных с Helicobacter pylori: хроническом гастродуодените и язвенной болезни. Инфекция и иммунитет 2019; 9(2): 295–303, https://doi.org/10.15789/2220-7619-2019-2-295-303.
- Danesh J. Helicobacter pylori infection and gastric cancer: systematic review of the epidemiological studies. Aliment Pharmacol Ther 1999; 13(7): 851–856, https://doi.org/10.1046/j.1365-2036.1999.00546.x.
- Amieva M., Peek R.M. Jr. Pathobiology of Helicobacter pylori-induced gastric cancer. Gastroenterology 2016; 150(1): 64–78, https://doi.org/10.1053/j.gastro.2015.09.004.
- Kusters J.G., van Vliet A.H.M., Kuipers E.J. Pathogenesis of Helicobacter pylori infection. Clin Microbiol Rev 2006; 19(3): 449–490, https://doi.org/10.1128/CMR.00054-05.
- Graham D.Y., Opekun A.R., Osato M.S., El-Zimaity H.M.T., Lee C.K., Yamaoka Y., Qureshi W.A., Cadoz M., Monath T.P. Challenge model for Helicobacter pylori infection in human volunteers. Gut 2004; 53(9): 1235–1243, https://doi.org/10.1136/gut.2003.037499.
- Nurgalieva Z.Z., Conner M.E., Opekun A.R., Zheng C.Q., Elliott S.N., Ernst P.B., Osato M., Estes M.K., Graham D.Y. B-cell and T-cell immune responses to experimental Helicobacter pylori infection in humans. Infect Immun 2005; 73(5): 2999–3006, https://doi.org/10.1128/IAI.73.5.2999-3006.2005.
- Eaton K.A., Suerbaum S., Josenhans C., Krakowka S. Colonization of gnotobiotic piglets by Helicobacter pylori deficient in two flagellin genes. Infect Immun 1996; 64(7): 2445–2448.
- Tan S., Tompkins L.S., Amieva M.R. Helicobacter pylori usurps cell polarity to turn the cell surface into a replicative niche. PLoS Pathog 2009; 5(5): e1000407, https://doi.org/10.1371/journal.ppat.1000407.
- Isaacson P. Immunoperoxidase study of the secretory immunoglobulin system and lysozyme in normal and diseased gastric mucosa. Gut 1982; 23(7): 578–588, https://doi.org/10.1136/gut.23.7.578.
- Velin D., Bachmann D., Bouzourene H., Michetti P. Reduction of Helicobacter infection in IL-10–/– mice is dependent on CD4+ T cells but not on mast cells. Helicobacter 2008; 13(5): 361–369, https://doi.org/10.1111/j.1523-5378.2008.00614.x.
- Moyat M., Velin D. Immune responses to Helicobacter pylori infection. World J Gastroenterol 2014; 20(19): 5583–5593, https://doi.org/10.3748/wjg.v20.i19.5583.
- Kronsteiner B., Bassaganya-Riera J., Philipson C., Viladomiu M., Carbo A., Abedi V., Hontecillas R. Systems-wide analyses of mucosal immune responses to Helicobacter pylori at the interface between pathogenicity and symbiosis. Gut Microbes 2016; 7(1): 3–21, https://doi.org/10.1080/19490976.2015.1116673.
- Eaton K.A., Ringler S.R., Danon S.J. Murine splenocytes induce severe gastritis and delayed-type hypersensitivity and suppress bacterial colonization in Helicobacter pylori-infected SCID mice. Infect Immun 1999; 67(9): 4594–4602.
- Gray B.M., Fontaine C.A., Poe S.A., Eaton K.A. Complex T cell interactions contribute to Helicobacter pylori gastritis in mice. Infect Immun 2013; 81(3): 740–752, https://doi.org/10.1128/IAI.01269-12.
- Caruso R., Fina D., Paoluzi O.A., Del Vecchio Blanco G., Stolfi C., Rizzo A., Caprioli F., Sarra M., Andrei F., Fantini M.C., MacDonald T.T., Pallone F., Monteleone G. IL-23-mediated regulation of IL-17 production in Helicobacter pylori-infected gastric mucosa. Eur J Immunol 2008; 38(2): 470–478, https://doi.org/10.1002/eji.200737635.
- Shi Y., Liu X.F., Zhuang Y., Zhang J.Y., Liu T., Yin Z., Wu C., Mao X.H., Jia K.R., Wang F.J., Guo H., Flavell R.A., Zhao Z., Liu K.Y., Xiao B., Guo Y., Zhang W.J., Zhou W.Y., Guo G., Zou Q.M. Helicobacter pylori induced Th17 responses modulate Th1 cell responses, benefit bacterial growth, and contribute to pathology in mice. J Immunol 2010; 184(9): 5121–5129, https://doi.org/10.4049/jimmunol.0901115.
- Wang C., Kang S.G., Lee J., Sun Z., Kim C.H. The roles of CCR6 in migration of Th17 cells and regulation of effector T-cell balance in the gut. Mucosal Immunol 2009; 2(2): 173–183, https://doi.org/10.1038/mi.2008.84.
- Villablanca E.J., Cassani B., von Andrian U.H., Mora J.R. Blocking lymphocyte localization to the gastrointestinal mucosa as a therapeutic strategy for inflammatory bowel diseases. Gastroenterology 2011; 140(6): 1776–1784, https://doi.org/10.1053/j.gastro.2011.02.015.
- Singh S.P., Zhang H.H., Tsang H., Gardina P.J., Myers T.G., Nagarajan V., Lee C.H., Farber J.M. PLZF regulates CCR6 and is critical for the acquisition and maintenance of the Th17 phenotype in human cells. J Immunol 2015; 194(9): 4350–4361, https://doi.org/10.4049/jimmunol.1401093.
- Перфилова К.М., Неумоина Н.В., Бутина Т.Ю., Кузнецова И.В., Шутова И.В., Ларионова Т.В., Ефимова Е.И. Опыт использования метода полимеразной цепной реакции для исследования маркеров Heliсobacter pylori. Медицинский альманах 2016; 2: 52–56.
- Talayev V.Yu., Zaichenko I.Ye., Babaykina O.N., Lomunova M.A., Talayeva E.B., Nikonova M.F. Ex vivo stimulation of cord blood mononuclear cells by dexamethasone and interleukin-7 results in the maturation of interferon γ-secreting effector memory T cells. Clin Exp Immunol 2005; 141(3): 440–448, https://doi.org/10.1111/j.1365-2249.2005.02863.x.