Оценка эффективности системы поддержки принятия решений в спинальной нейрохирургии для персонифицированного использования минимально-инвазивных технологий на поясничном отделе позвоночника
Цель исследования — оценить эффективность системы поддержки принятия решений (СППР) в спинальной нейрохирургии для персонифицированного использования минимально-инвазивных технологий на поясничном отделе позвоночника.
Материалы и методы. В проспективное исследование включено 59 пациентов, которые были прооперированы с применением СППР, основанной на разработанном нами ранее алгоритме персонифицированного хирургического лечения, учитывающего индивидуальные параметры поясничных сегментов. Из них тотальная артропластика (ТА) выполнена 11 пациентам, минимально-инвазивная (MI-TLIF) и открытая (O-TLIF) дорсальная ригидная стабилизация — 25 и 23 пациентам соответственно по авторской технологии. Сравнительный анализ проводили с ретроспективно собранными результатами лечения 196 пациентов, оперированных с использованием технологий ТА (n=42), MI-TLIF (n=79) и O-TLIF (n=75). Эффективность лечебных алгоритмов СППР оценивали по уровню болевого синдрома в поясничном отделе позвоночника и нижних конечностей, а также функциональному состоянию пациентов по ODI при выписке, через 3 и 6 мес после операции.
Результаты. При сравнении исследуемых групп по гендерным характеристикам и антропометрическим данным статистически значимых межгрупповых различий не выявлено (p>0,05). Межгрупповой анализ результатов функционального статуса по ODI, интенсивности боли в нижних конечностях и поясничном отделе показал лучшие клинические исходы у пациентов, оперированных с использованием СППР, по сравнению с ретроспективной группой (p<0,05): через 6 мес после ТА и O-TLIF и через 3 мес после MI-TLIF.
Заключение. По результатам исследования установлена высокая эффективность разработанной нами СППР для персонифицированного хирургического лечения пациентов с дегенеративными заболеваниями поясничного отдела позвоночника, учитывающего индивидуальные биометрические параметры поясничных сегментов.
Введение
Дегенеративные изменения в анатомических элементах поясничных сегментов позвоночника зачастую сопровождаются развитием компрессионной и/или псевдорадикулярной клинической симптоматики [1]. Морфоструктурный каскад этих изменений характеризуется постепенной дегенерацией межпозвонковых дисков (МПД) и дугоотростчатых суставов (ДС), которая не всегда идет параллельно [2]. Многообразие вариантов неврологических проявлений, функциональных нарушений позвоночно-двигательных сегментов, а также выраженности патологических изменений в переднем и заднем опорных комплексах при дегенеративных заболеваниях поясничного отдела позвоночника стимулирует разработку различных подходов в спинальной хирургии: от чрескожных пункционных до расширенных декомпрессивно-стабилизирующих методик [3].
Успех вмешательств на позвоночнике напрямую взаимосвязан с устранением причины клинической симптоматики и восстановлением нормальной биомеханики оперированных сегментов [4]. При этом отсутствие единых лечебно-диагностических алгоритмов в вертебрологии, высокая вариабельность хирургических решений, широкая гамма морфологических субстратов, обусловливающих неврологические нарушения, определяют субъективность принятия решения хирургом и, как следствие, достаточно высокий уровень неудовлетворительных послеоперационных исходов [5, 6]. Кроме того, вышеуказанные обстоятельства сопряжены со значительной финансовой нагрузкой на систему здравоохранения в виде повторных госпитализаций, реопераций, а также с развитием периоперационных осложнений, с длительной или полной утратой трудоспособности оперированным пациентом [7].
Формирование методологии, направленной на улучшение исходов оперативных вмешательств у пациентов с дегенеративными заболеваниями поясничного отдела позвоночника, основано на определении объективных клинических и анатомо-структурных параметров, необходимых для создания персонифицированных хирургических подходов, а также на разработке критериев прогнозирования развития периоперационных неблагоприятных последствий [8, 9].
Одним из методов, который способен снизить частоту ошибок лечебно-диагностической тактики в различных разделах медицины, является система поддержки принятия решений (СППР), основанная на обработке большого массива информации и результатах собственных исследований [10]. Данный инновационный подход связан с использованием машинного обучения (МО) и искусственного интеллекта (ИИ) [11]. Такие технологии успешно применяют в современном здравоохранении для поддержки принятия клинических решений и скрининга пациентов после различных оперативных вмешательств и консервативного лечения [12]. Таким образом, в настоящее время перспективным направлением в медицине, в том числе в спинальной нейрохирургии, является разработка автоматизированных систем, использующих ИИ и МО и способных прогнозировать результаты лечения на основе лечебно-диагностических алгоритмов и математических расчетов [13]. Потенциал применения этих систем заключается в лучшей объективизации и визуализации патологии, повышении диагностической точности и замене части рутинной работы врачей-специалистов [14]. Несмотря на увеличение количества публикаций о применении ИИ и МО в различных направлениях современной медицины, разработка СППР в вертебрологии в настоящее время находится в зачаточном состоянии.
В Центре нейрохирургии Клинической больницы «РЖД-Медицина» (Иркутск) с 2020 г. применяется программное обеспечение, разработанное на основе большого массива собственных результатов исследований (базы данных более 12 тыс. пациентов, оперированных за последние 15 лет) по использованию различных способов хирургического лечения пациентов с дегенеративными заболеваниями поясничного отдела позвоночника в зависимости от индивидуальных морфоструктурных характеристик позвоночно-двигательных сегментов. Поверхностные данные об использовании СППР в хирургии позвоночника явились побудительным моментом для осуществления данного научного проекта.
Цель настоящего исследования — оценка эффективности системы поддержки принятия решений в спинальной нейрохирургии для персонифицированного использования минимально-инвазивных технологий на поясничном отделе позвоночника.
Материалы и методы
Предпосылки к созданию системы поддержки принятия решений в спинальной нейрохирургии. В рамках ранее выполненных научных проектов (гранта Президента Российской Федерации «Исследование модели изменения наноструктурной организации соединительной ткани под воздействием лазерного излучения» (МД-6662.2012.7), гранта Российского научного фонда «Молекулярные сигнальные каскады и их влияние на нутритивный транспорт через межклеточный матрикс для регенерации межпозвонкового диска» (проект №15-15-30037), государственного контракта №620-НИОКТР/1800/2625-ЭА/19 от 26.06.2019 г. «Оптимизация хирургического лечения дегенеративных заболеваний поясничного отдела позвоночника в Иркутской области»), а также с использованием массива данных пациентов с дегенеративными заболеваниями поясничного отдела позвоночника (n=12 087), проходивших лечение в Центре нейрохирургии Клинической больницы «РЖД-Медицина» (Иркутск) в 2005–2020 г., проведен ретроспективный анализ результатов комплексного клинико-инструментального обследования этих пациентов (рис. 1). Из общей когорты методом случайной выборки отобраны лица, оперированные с применением поясничной тотальной артропластики (ТА, n=42), минимально-инвазивного трансфораминального межтелового спондилодеза (minimal invasive transforaminal interbody fusion, MI-TLIF, n=79) и открытого (оpen) трансфораминального межтелового спондилодеза (O-TLIF, n=75). Изучены клинико-инструментальные данные (табл. 1) для прогнозирования и предупреждения развития неблагоприятных клинических исходов.

|
Таблица 1. Клинические данные ретроспективно исследуемых групп, Me [Q1; Q3] |
При анализе значимости влияния исследуемых инструментальных параметров на отдаленный клинический результат и в ходе изучения возможности оптимизировать тактику лечения пациентов с дегенеративными заболеваниями поясничного отдела позвоночника установлено, что в группе пациентов, оперированных по методике динамической фиксации (ТА), хорошие отдаленные исходы по визуально-аналоговой шкале (ВАШ) и опроснику Освестри (Oswestry Disability Index, ODI) достигнуты при дооперационных параметрах линейного смещения позвонков не более 4 мм, сагиттального объема движений — менее 6°, при снижении высоты межтелового промежутка не более 2/3 от вышележащего, I–II степени дегенерации МПД по C. Pfirrmann, значении измеряемого коэффициента диффузии (ИКД) не менее 1240 с/мм2, I–II степени дегенерации ДС по A. Fujiwara, величине фасеточного угла менее 60°, вне зависимости от наличия тропизма. В группах пациентов, оперированных по методике ригидной стабилизации (MI-TLIF и O-TLIF), минимальные отдаленные исходы по ВАШ и ODI достигнуты при дооперационных параметрах линейного смещения позвонков более 4 мм, сагиттального объема движений — не менее 6°, при снижении высоты межтелового промежутка более 2/3 от вышележащего, величине фасеточного угла более 60°. При этом в случае III–IV степени дегенерации МПД по C. Pfirrmann, значении ИКД менее 1150 с/мм2, II–III степени дегенерации ДС по A. Fujiwara, а также отсутствии тропизма возможно проведение минимально-инвазивной ригидной стабилизации; при IV–V степени дегенерации МПД по C. Pfirrmann, при значении ИКД менее 950 с/мм2, IV степени дегенерации ДС по A. Fujiwara и наличии тропизма целесообразно выполнение открытого спондилодеза и транспедикулярной стабилизации.
Разработаны рекомендации по использованию лечебного алгоритма при выполнении минимально-инвазивных оперативных вмешательств у пациентов с дегенеративными заболеваниями поясничного отдела позвоночника на основе комплексной предоперационной клинической и инструментальной оценки [15].
Описание и применение системы поддержки принятия решений. СППР была разработана как система для определения тактики персонифицированного хирургического лечения пациентов с дегенеративными заболеваниями поясничного отдела позвоночника на основе ведущих инструментальных признаков анатомических особенностей поясничных сегментов. В качестве входных данных использовались первичные сведения о пациентах, результаты клинических и инструментальных методов обследований. Выходными реакциями являлись алгоритмы лечения.
Компьютерная автоматизированная система включает в себя электронный чек-лист, в который вносятся дооперационные инструментальные данные о поясничных сегментах пациентов с дегенеративными заболеваниями. Программное обеспечение разработано с использованием UMKB (United Medical Knowledge Base, Объединенной базы медицинских знаний) — семантической сети, структурированной на основе медицинских онтологий и принципах нечеткой логики, в рамках партнерского договора о сотрудничестве с АО «Соцмедика».
С применением СППР по предложенному алгоритму персонифицированного хирургического лечения, учитывающего индивидуальные параметры поясничных сегментов, с сентября 2020 г. прооперировано 59 пациентов, которым выполнена ТА (n=11), MI-TLIF (n=25) и O-TLIF (n=23). Для ригидной стабилизации применяли авторские хирургические технологии — MI-TLIF [16] и O-TLIF [17]. Все включенные в проспективное исследование пациенты имели минимальный катамнез наблюдения — 6 мес после операции.
Критерии включения:
неэффективная консервативная терапия, длительный или рецидивирующий болевой синдром, стойкий неврологический дефицит от явлений радикулоневралгии до радикулопатии с периферическими парезами;
сочетание радикулярной и псевдорадикулярной клинической симптоматики;
снижение высоты межтелового промежутка более 1/3 от высоты вышележащего;
по данным нейровизуализации — одноуровневое симптоматичное дегенеративное заболевание поясничного отдела позвоночника.
Критерии исключения:
центральный стеноз позвоночного канала;
спондилолистез со спондилолизом или без него;
тяжелая сопутствующая патология;
значимый остеопороз (снижение минеральной плотности костной ткани на 2,8 или более по Т-критерию (ВОЗ, 1995 г.));
потребность в значительной коррекции сагиттального баланса;
необходимость в оперативном вмешательстве на двух и более сегментах поясничного отдела позвоночника.
Сравнительный анализ результатов лечения пациентов с применением СППР и контрольной ретроспективной группы проводили при выписке, через 3 и 6 мес после операции по уровню болевого синдрома в поясничном отделе позвоночника и нижних конечностях, а также функциональному статусу по ODI.
Исследование проведено в соответствии с Хельсинкской декларацией (2013) и одобрено Этическим комитетом Иркутского государственного медицинского университета. От пациентов получено информированное согласие.
Статистическую обработку результатов исследования выполняли с использованием программы Statistica 8.0. Оценку характера распределения признаков производили по тестам на нормальность Шапиро−Уилка, Колмогорова−Смирнова и Лиллиефорса. Учитывая наличие по указанным тестам статистически значимых различий (p<0,05), распределение считали отличным от нормального, в связи с чем для оценки значимости различий выборочных совокупностей использовали критерии непараметрической статистики. Различия считали статистически значимыми при р<0,05. Полученные результаты представлены медианой, значениями 1-го и 3-го квартилей — Me [Q1; Q3]. Для сравнительного анализа полученных значений использовали U-тест Манна−Уитни и критерий Вилкоксона для непараметрических данных, критерий 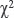 — для биноминальных знаков.
— для биноминальных знаков.
Результаты
Данные пациентов исследуемых групп представлены в табл. 2. При сравнении анализируемых групп по гендерным характеристикам и антропометрическим данным статистически значимых межгрупповых различий не выявлено (p>0,05). Наибольшая частота хирургических вмешательств была зарегистрирована в нижнепоясничных сегментах L4–L5 и L5–S1.

|
Таблица 2. Общие данные о пациентах исследуемых групп |
Тотальная артропластика. При межгрупповом сравнении клинических параметров хирургического лечения пациентов с имплантацией искусственного протеза МПД по ВАШ и ODI установлены сопоставимый уровень болевого синдрома и функциональный статус до операции, при выписке и через 3 мес (p>0,05). При этом через 6 мес после операции в проспективной группе зарегистрированы лучшие клинические исходы: уменьшение интенсивности боли в нижних конечностях (p=0,02) и в поясничном отделе (p=0,03), повышение функционального статуса по ODI (p=0,02) (рис. 2).

|
Рис. 2. Клинические параметры у пациентов исследуемых групп после выполнения поясничной тотальной артропластики |
Минимально-инвазивная ригидная стабилизация. При межгрупповом сравнении клинических параметров пациентов после проведения MI-TLIF по ВАШ и ODI установлены сопоставимый уровень болевого синдрома и функциональный статус до операции и при выписке (p>0,05). В сроки 3 и 6 мес после операции в проспективной группе отмечены лучшие клинические исходы: уменьшение интенсивности боли в нижних конечностях (p=0,01 и p=0,01 соответственно) и в поясничном отделе (p=0,03 и p=0,02 соответственно), повышение функционального статуса по ODI (p=0,01 и p=0,03 соответственно) (рис. 3).

|
Рис. 3. Клинические параметры у пациентов исследуемых групп после выполнения минимально-инвазивного трансфораминального межтелового поясничного спондилодеза |
Открытая ригидная стабилизация. При межгрупповом сравнении клинических параметров пациентов после проведения открытого трансфораминального межтелового поясничного спондилодеза по ВАШ и ODI установлены сопоставимый уровень болевого синдрома и функциональный статус до операции, при выписке и через 3 мес (p>0,05). При этом через 6 мес после операции в проспективной группе зарегистрированы лучшие клинические исходы: уменьшение интенсивности боли в нижних конечностях (p=0,04) и в поясничном отделе (p=0,03), повышение функционального статуса по ODI (p=0,01) (рис. 4).

|
Рис. 4. Клинические параметры у пациентов исследуемых групп после выполнения открытого трансфораминального межтелового поясничного спондилодеза |
Обсуждение
Система поддержки принятия решений относится к методам прогнозирования послеоперационного исхода с учетом устранения модифицируемых факторов, оказывающих влияние на формирование неудовлетворительного результата [10]. Данный подход предполагает использование МО и ИИ, активному внедрению которых в медицинскую практику способствует быстрое развитие компьютерных технологий [13]. МО и ИИ направлены на объективизацию и улучшение результатов лечения, определение вероятности развития осложнений и уменьшение числа нежелательных явлений [18, 19].
В настоящее время в специализированной литературе имеются немногочисленные сообщения, описывающие применение различных алгоритмов МО и ИИ в спинальной хирургии. Так, V.E. Staartjes с соавт. [20] при использовании метода глубокого МО разработали модель предоперационного прогнозирования вероятности уменьшения болевого синдрома в спине и ноге, а также повышения функционального статуса по ODI после поясничной дискэктомии. При этом регрессионные модели продемонстрировали худшие показатели эффективности лечения для каждого из клинических исходов. Применение технологии глубокого обучения в исследовании A. Wirries с соавт. [21] способствовало точному прогнозированию функционального статуса пациента по ODI через 6 мес как после проведения поясничной микродискэктомии, так и в случае консервативной терапии. A. Siccoli с соавт. [22], используя данные проспективного регистра (n=635), показали, что модель, основанная на нескольких алгоритмах МО, позволяет обеспечить дооперационное планирование следующих результатов: клинического улучшения ODI, уменьшения боли в ногах и в спине через 12 мес после операции — с точностью до 62, 74 и 66% соответственно; снижения общего количества реопераций — с точностью 69% и времени операции — с точностью 78%; сокращения длительности пребывания в стационаре — с точностью 77%.
Технологии МО и ИИ помогают и в решении узкоспецифичных задач. N.J. Lee с соавт. [23] отметили эффективность использования алгоритмов МО для точного прогнозирования позвоночно-тазовой компенсации после спондилодеза для снижения риска формирования проксимального кифоза. A. Campagner с соавт. [24] при исследовании результатов минимально-инвазивных хирургических методик (ALIF, XLIF) и традиционного TLIF показали возможность МО для предоперационного прогнозирования степени инвазивности вмешательства с учетом маркеров воспаления в крови пациентов. T. Raman с соавт. [25] установили, что применение технологий МО позволяет выявлять факторы риска увеличения кровопотери во время операции и периоперационного переливания эритроцитарной массы. Авторы отнесли к ним стабилизацию более 13 сегментов позвоночника, оценку по шкале ASA выше I степени, трехколонную остеотомию и тазовую фиксацию.
Внедрение МО и ИИ в спинальную хирургию позволит снизить затраты на лечение пациентов [26] и будет способствовать экономии рабочего времени целого ряда смежных специалистов, участвующих в диагностике, оперативном лечении, реабилитации наряду с оперирующим хирургом [10, 18].
Существенными проблемами использования МО и ИИ являются сложность применения математических расчетов при их реализации, этический аспект разделения ответственности между врачом и разработчиком СППР за формирование нежелательных последствий, а также возможные системные программные ошибки и индивидуальные исключительные особенности пациентов, которые потенциально могут повлиять на принятие окончательного решения и результат [27, 28].
В настоящее время при использовании моделей на основе МО и ИИ необходим баланс сил между доверием к созданному машиной алгоритму и собственным клиническим опытом.
В проведенном исследовании установлено, что применение СППР, разработанной на основе алгоритма выбора хирургической тактики в зависимости от ряда индивидуальных анатомических особенностей пояснично-двигательных сегментов, позволило снизить болевой синдром в поясничном отделе и нижних конечностях пациентов, восстановить их повседневную активность и тем самым повысить качество жизни. Использование разработанного электронного чек-листа является удобным и простым способом получения рекомендаций по персонифицированному хирургическому лечению пациентов с дегенеративными заболеваниями поясничного отдела позвоночника.
Ограничение исследования. Значимым ограничением проведенного исследования является его одноцентровой характер, небольшие когорты анализируемых пациентов в проспективной группе и непродолжительный катамнез наблюдения больных, оперированных с применением разработанной СППР.
Заключение
Результаты исследования показали высокую эффективность разработанной нами системы поддержки принятия решений, основанной на индивидуальных биометрических параметрах пояснично-двигательных сегментов, для персонифицированного хирургического лечения пациентов с дегенеративными заболеваниями поясничного отдела позвоночника.
Однако требуется проведение дальнейших мультицентровых исследований, направленных на оценку различных анатомо-морфологических, конституциональных, биомеханических, клинических и инструментальных параметров у пациентов, оперированных с использованием разработанной системы поддержки принятия решений на большем числе респондентов в продолжительном катамнезе.
Источник финансирования. Работа выполнена в рамках договора №3875ГС1/63146 на выполнение научно-исследовательских и опытно-конструкторских работ по теме «Разработка и испытание опытного образца системы поддержки принятия решений нейрохирургом при лечении пациентов с дегенеративными заболеваниями поясничного отдела позвоночника» (проект №63146, заявка С1-81654 в рамках реализации инновационного проекта «Система поддержки принятия решения для нейрохирургов “Тактика и профилактика”»), финансируемого Фондом содействия развитию малых форм предприятий в научно-технической сфере и ООО «Бывальцев Нейрософт».
Конфликт интересов. Авторы декларируют отсутствие конфликтов интересов, связанных с публикацией настоящей статьи.
Литература
- Bagley C., MacAllister M., Dosselman L., Moreno J., Aoun S.G., El Ahmadieh T.Y. Current concepts and recent advances in understanding and managing lumbar spine stenosis. F1000Res 2019; 8: 137, https://doi.org/10.12688/f1000research.16082.1.
- Кривошеин А.Е., Конев В.П., Колесов С.В., Московский С.Н., Игнатьев Ю.Т., Никитенко С.А., Ерофеев С.А. Морфологические и рентгенологические параметры фасеточных суставов в зависимости от степени дегенерации межпозвонкового диска. Гений ортопедии 2020; 26(4): 565–570.
- Бывальцев В.А., Калинин А.А., Коновалов Н.А. Минимально инвазивная хирургия позвоночника: этапы развития. Вопросы нейрохирургии имени Н.Н. Бурденко 2019; 83(5): 92–100, https://doi.org/10.17116/neiro20198305192.
- Елисеев А.С., Боков А.Е., Млявых С.Г., Мордвинов А.А. Философия некоторых проблем спинальной нейрохирургии. Вопросы нейрохирургии имени Н.Н. Бурденко 2021; 85(1): 28–35, https://doi.org/10.17116/neiro20218501128.
- Афаунов А.А., Басанкин И.В., Кузьменко А.В., Шаповалов В.К. Анализ причин ревизионных операций при хирургическом лечении больных с поясничными стенозами дегенеративной этиологии. Кубанский научный медицинский вестник 2013; 7: 173–176.
- Mohi Eldin M.M., Hassan A.S. Percutaneous transpedicular fixation: technical tips and pitfalls of sextant and pathfinder systems. Asian Spine J 2016; 10(1): 111–122, https://doi.org/10.4184/asj.2016.10.1.111.
- Baranowska A., Baranowska J., Baranowski P. Analysis of reasons for failure of surgery for degenerative disease of lumbar spine. Ortop Traumatol Rehabil 2016; 18(2): 117–129, https://doi.org/10.5604/15093492.1205004.
- Басков А.В., Евсюков А.А., Оглезнев К.Я., Сидоров Е.В. Прогнозирование результатов хирургического лечения приобретенного стеноза позвоночного канала на уровне поясничного отдела. Вопросы нейрохирургии имени Н.Н. Бурденко 2003; 2: 20–26.
- Belykh E., Kalinin A.A., Patel A.A., Miller E.J., Bohl M.A., Stepanov I.A., Bardonova L.A., Kerimbaev T., Asantsev A.O., Giers M.B., Preul M.C., Byvaltsev V.A. Apparent diffusion coefficient maps in the assessment of surgical patients with lumbar spine degeneration. PLoS One 2017; 12(8): e0183697, https://doi.org/10.1371/journal.pone.0183697.
- Ancker J.S., Edwards A., Nosal S., Hauser D., Mauer E., Kaushal R.; with the HITEC Investigators. Effects of workload, work complexity, and repeated alerts on alert fatigue in a clinical decision support system. BMC Med Inform Decis Mak 2017; 17(1): 36, https://doi.org/10.1186/s12911-017-0430-8.
- Danilov G.V., Shifrin M.A., Kotik K.V., Ishankulov T.A., Orlov Yu.N., Kulikov A.S., Potapov A.A. Artificial intelligence technologies in neurosurgery: a systematic literature review using topical modeling methods. Part I: principal areas of research (review). Sovremennye tehnologii v medicine 2020; 12(5): 106–113, https://doi.org/10.17691/stm2020.12.5.12.
- Reddy S., Fox J., Purohit M.P. Artificial intelligence-enabled healthcare delivery. J R Soc Med 2019; 112(1): 22–28, https://doi.org/10.1177/0141076818815510.
- Chang M., Canseco J.A., Nicholson K.J., Patel N., Vaccaro A.R. The role of machine learning in spine surgery: the future is now. Front Surg 2020; 7: 54, https://doi.org/10.3389/fsurg.2020.00054.
- Obermeyer Z., Emanuel E.J. Predicting the future — big data, machine learning, and clinical medicine. N Engl J Med 2016; 375(13): 1216–1219, https://doi.org/10.1056/nejmp1606181.
- Бывальцев В.А., Калинин А.А., Степанов И.А. Использование лечебного алгоритма выполнения минимально-инвазивных оперативных вмешательств при дегенеративных заболеваниях поясничного отдела позвоночника на основе комплексной предоперационной клинической и инструментальной оценки. Методические рекомендации. Иркутск: ИГМУ; 2019.
- Бывальцев В.А., Калинин А.А. Способ минимально-инвазивного хирургического лечения стеноза позвоночного канала поясничного отдела позвоночника. Патент РФ 2731809. 2018.
- Бывальцев В.А., Сороковиков В.А., Калинин А.А., Белых Е.Г. Способ реконструкции позвоночного канала при лечении стеноза пояснично-крестцового отдела позвоночника. Патент РФ 2531927. 2014.
- Triantafyllidis A.K., Tsanas A. Applications of machine learning in real-life digital health interventions: review of the literature. J Med Internet Res 2019; 21(4): e12286, https://doi.org/10.2196/12286.
- Deo R.C. Machine learning in medicine. Circulation 2015; 132(20): 1920–1930, https://doi.org/10.1161/circulationaha.115.001593.
- Staartjes V.E., de Wispelaere M.P., Vandertop W.P., Schröder M.L. Deep learning-based preoperative predictive analytics for patient-reported outcomes following lumbar discectomy: feasibility of center-specific modeling. Spine J 2019; 19(5): 853–861, https://doi.org/10.1016/j.spinee.2018.11.009.
- Wirries A., Geiger F., Hammad A., Oberkircher L., Blümcke I., Jabari S. Artificial intelligence facilitates decision-making in the treatment of lumbar disc herniations. Eur Spine J 2021; 30(8): 2176–2184, https://doi.org/10.1007/s00586-020-06613-2.
- Siccoli A., de Wispelaere M.P., Schröder M.L., Staartjes V.E. Machine learning-based preoperative predictive analytics for lumbar spinal stenosis. Neurosurg Focus 2019; 46(5): E5, https://doi.org/10.3171/2019.2.focus18723.
- Lee N.J., Sardar Z.M., Boddapati V., Mathew J., Cerpa M., Leung E., Lombardi J., Lenke L.G., Lehman R.A. Can machine learning accurately predict postoperative compensation for the uninstrumented thoracic spine and pelvis after fusion from the lower thoracic spine to the sacrum? Global Spine J 2020; 8: 2192568220956978, https://doi.org/10.1177/2192568220956978.
- Campagner A., Berjano P., Lamartina C., Langella F., Lombardi G., Cabitza F. Assessment and prediction of spine surgery invasiveness with machine learning techniques. Comput Biol Med 2020; 121: 103796, https://doi.org/10.1016/j.compbiomed.2020.103796.
- Raman T., Vasquez-Montes D., Varlotta C., Passias P.G., Errico T.J. Decision tree-based modelling for identification of predictors of blood loss and transfusion requirement after adult spinal deformity surgery. Int J Spine Surg 2020; 14(1): 87–95, https://doi.org/10.14444/7012.
- Lafage R., Pesenti S., Lafage V., Schwab F.J. Self-learning computers for surgical planning and prediction of postoperative alignment. Eur Spine J 2018; 27(Suppl 1): 123–128, https://doi.org/10.1007/s00586-018-5497-0.
- Char D.S., Shah N.H., Magnus D. Implementing machine learning in health care — addressing ethical challenges. N Engl J Med 2018; 378(11): 981–983, https://doi.org/10.1056/nejmp1714229.
- Shaw J., Rudzicz F., Jamieson T., Goldfarb A. Artificial intelligence and the implementation challenge. J Med Internet Res 2019; 21(7): e13659, https://doi.org/10.2196/13659.











