Метод SNP-однонуклеотидного хромосомного микроматричного анализа в изучении вариаций числа копий ДНК у плодов с расширенной воротниковой зоной
Цель исследования — оценка диагностической эффективности SNP-однонуклеотидного хромосомного микроматричного анализа для выявления патогенных вариаций числа копий ДНК (copy number variations, CNV) у плодов с увеличенной толщиной воротникового пространства (более 2,5 мм), выявленной в ходе выполнения УЗИ на сроке беременности от 11 нед до 13 нед 6 дней при нормальном кариотипе плода.
Материалы и методы. В исследование было включено 225 беременных женщин, которым проведена инвазивная пренатальная диагностика в связи с выявлением у плода изолированно расширенного воротникового пространства. Полученный после проведения инвазивной диагностической процедуры материал плода первоначально изучали с помощью цитогенетического исследования и при нормальном кариотипе в качестве теста второй линии проводили хромосомный микроматричный анализ.
Результаты. Различные патогенные CNV были выявлены у 22 из 225 плодов (9,8%) с нормальным кариотипом. Из них патогенные CNV, не классифицированные как синдром, были обнаружены в 14 случаях (63,6%), а ранее описанные как синдром — в 8 случаях (36,4%). У 9 плодов (41%) были определены CNV с вовлечением двух негомологичных хромосом, при наличии которых существует высокая вероятность носительства сбалансированных транслокаций у родителей. При проведении анализа кариотипа родителей у 8 из 9 пар выявлены сбалансированные транслокации у одного из супругов.
Заключение. Использование хромосомного микроматричного анализа при наличии у плода расширенного воротникового пространства позволяет повысить эффективность выявления хромосомного дисбаланса, в том числе обусловленного патологической мейотической сегрегацией родительской реципрокной транслокации.
Введение
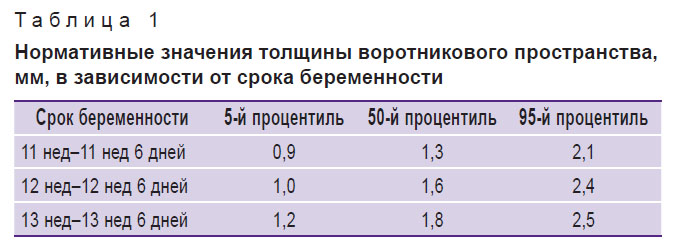
Самым важным и статистически значимым ультразвуковым маркером, который определяется в I триместре беременности для пренатальной оценки индивидуального риска хромосомной патологии, является толщина воротникового пространства (ТВП) [1]. Это область между внутренней поверхностью кожи плода и наружной поверхностью мягких тканей, покрывающих шейный отдел позвоночника [2]. Нормативные значения ТВП зависят от срока беременности и копчико-теменного размера плода (табл. 1) [2].
|
Таблица 1. Нормативные значения толщины воротникового пространства, мм, в зависимости от срока беременности |
При увеличении ТВП до значения более 2,5 мм хромосомные анеуплоидии (ХА) обнаруживаются примерно у 38% плодов, причем 61% анеуплоидий приходится на трисомию хромосомы 21 [3, 4]. Известно, что расширенное воротниковое пространство является полипотенциальным фактором, поскольку при этом у плода увеличивается не только частота ХА, но и риск врожденных пороков развития, прежде всего пороков сердца [5]. В среднем у 15% плодов с увеличенной ТВП в I триместре и нормальным кариотипом позже выявляются различные врожденные пороки развития [4, 6]. Случай же, когда ТВП увеличена, а хромосомный набор плода нормальный, может свидетельствовать о повышенном риске осложненного течения беременности в дальнейшем [7, 8], поэтому крайне важно установить причину, которая привела к появлению данного маркера.
Увеличение ТВП у плода может быть связано не только с ХА (такими, как трисомии 21, 18 и 13 и др.), но также с микроделеционными/микродупликационными синдромами [9, 10]. Эти синдромы не идентифицируются при проведении стандартного цитогенетического исследования, разрешающая способность которого — менее 8–10 млн. п.н. (пар нуклеотидов) [11]. Применение SNP-однонуклеотидного хромосомного микроматричного анализа (ХMA) для выявления геномного/хромосомного дисбаланса имеет преимущества по сравнению с другими методами не только в постнатальной [12], но и в пренатальной диагностике [4]. ХМА позволяет диагностировать патогенные вариации числа копий ДНК (copy number variations, CNV) у 5,6% плодов с изолированными пороками и у 9,1% — с множественными аномалиями развития [13].
Сравнительная оценка ХМА и анализа кариотипа при пренатальной диагностике, проведенная в нескольких масштабных исследованиях [4, 6], убедительно продемонстрировала, что для выявления хромосомного дисбаланса при наличии пороков развития плода, обнаруженных с помощью УЗИ, наиболее целесообразно использование ХМА. Многоцентровое исследование, организованное в 2012 г. Национальным институтом здоровья ребенка и развития человека (National Institute of Child Health and Human Development, NICHD), показало, что у плодов с нормальным кариотипом и установленными ультразвуковыми аномалиями при проведении ХМА клинически значимые CNV обнаруживаются в 6% случаев, а при отсутствии ультразвуковых маркеров хромосомных аномалий — у 1,7% плодов [14]. В клинических рекомендациях Американской коллегии акушеров-гинекологов (American College of Obstetricians and Gynecologists, ACOG) и Общества медицины матери и плода (Society for Maternal-Fetal Medicine, SMFM) отмечается необходимость использования ХМА в качестве теста первой линии в случаях выявления по результатам УЗИ пороков развития плода, при этом проведения традиционного анализа кариотипа не требуется (уровень доказательности 1А) [15].
Следует заметить, что выявление клинически значимых CNV возможно при выполнении NGS-тестов (next-generation sequencing). На сегодняшний день NGS является основным надежным методом выявления точечных мутаций, однако в данном случае ХМА остается более предпочтительным методом, поскольку низкая конкордантность детекции CNV при использовании NGS наблюдалась во всех алгоритмах, основанных на количестве прочтений. По сравнению с ХМА методика NGS в обнаружении клинически значимых CNV показала более низкую чувствительность и специфичность, и потому ХМА продолжает играть в этом ключевую роль [16].
Целью нашего исследования явилась оценка диагностической эффективности хромосомного микроматричного анализа для выявления патогенных CNV у плодов с нормальным кариотипом, у которых при УЗИ на сроке беременности от 11 нед до 13 нед 6 дней обнаружено увеличение толщины воротникового пространства (более 2,5 мм).
Материалы и методы
Проведено ретроспективное, когортное, описательное исследование 225 беременных женщин в возрасте 32 (20–44) лет, которым в 2013–2020 гг. была проведена инвазивная пренатальная диагностика в связи с выявлением у плодов по результатам УЗИ изолированного расширения воротникового пространства более 2,5 мм (среднее значение — 4,2 [2,5; 8,8] мм). Пренатальный скрининг выполняли в I триместре беременности: с 11 нед 0 дней до 13 нед 6 дней. Исследование проводили на базе медико-генетического центра «Геномед» (Москва). Работа одобрена Этическим комитетом Медико-генетического научного центра им. академика Н.П. Бочкова и проведена в соответствии с этическими нормами, изложенными в Хельсинкской декларации (2013). От всех пациентов было получено информированное согласие.
Первоначально осуществляли анализ плодного материала методом стандартного кариотипирования. При выявлении нормального кариотипа у плода материал направляли на ХМА для исключения субмикроскопических хромосомных перестроек.
Образцы ДНК плодов исследовали с помощью SNP-однонуклеотидного ХМА. Анализ выполняли с использованием системы «GeneChip™ 3000» (Thermo Fisher Scientific, США) согласно протоколу производителя, на микроматрице, содержащей 315 608 маркеров. Определение CNV проводили путем измерения соотношения интенсивности флуоресценции опытной и референсной ДНК. Полученные данные анализировали в соответствии с алгоритмом, приведенным в описании технологии «Использование ХМА для повышения эффективности медико-генетического консультирования» (разработана в Медико-генетическом научном центре им. академика Н.П. Бочкова в 2015 г.). Молекулярный кариотип указывали в соответствии с Международной системой цитогеномной номенклатуры (International System for Human Cytogenomic Nomenclature, ISCN 2016). Для всех CNV, соответствующих критериям верификации, определяли клиническую значимость. С этой целью такие характеристики CNV, как размер, локализация, генный контент, сравнивали с описанными в базах данных (DGV, OMIM, ORPHANET, ISCA, DECIPHER).
Методы статистической обработки. Качественные показатели представлены в абсолютных и относительных величинах (%), для оценки количественных показателей указаны медиана и интерквартильный размах. Статистическую обработку результатов исследования осуществляли с помощью программ Microsoft Excel (2016) и Statistica 10.0 (StatSoft Inc., США). Статистическую значимость различий показателей у групп пациенток с изолированным увеличением ТВП и без него оценивали с помощью критерия 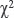 с расчетом отношения шансов (ОШ). Различия считали статистически значимыми при p<0,05.
с расчетом отношения шансов (ОШ). Различия считали статистически значимыми при p<0,05.
Результаты
Инвазивная пренатальная диагностика была выполнена пациенткам в сроки 12–17 нед беременности. Плодный материал был получен при проведении амниоцентеза у 149 из 225 пациенток (66,2%), а при выполнении хорионбиопсии или плацентоцентеза — у 76 из 225 женщин (44,0%). Перед ХМА всем плодам провели стандартное кариотипирование, которое не выявило отклонений по количеству и структуре хромосом.
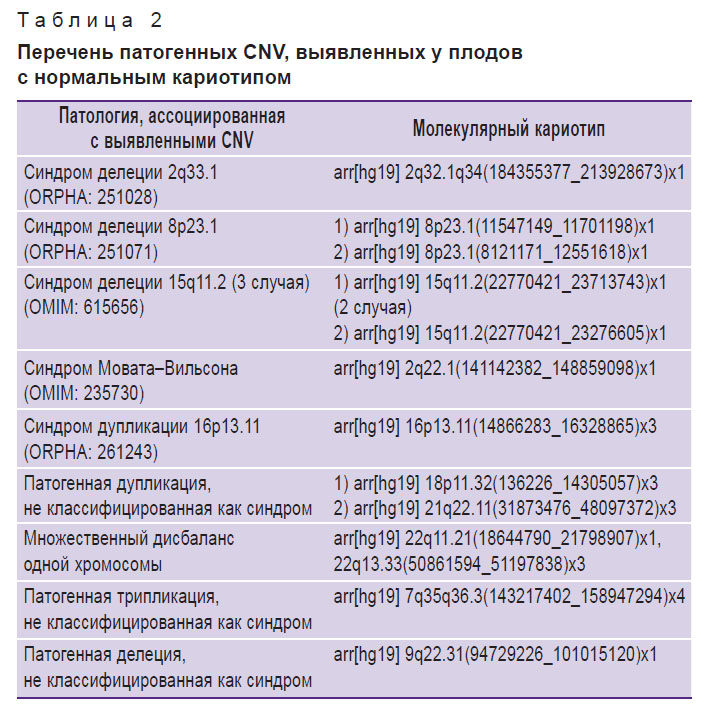
Доля патогенных СNV составила 9,8% (22/225). В 13 случаях были выявлены делеции либо дупликации одной хромосомы, спектр которых представлен в табл. 2.
|
Таблица 2. Перечень патогенных CNV, выявленных у плодов с нормальным кариотипом |
В 9 случаях были выявлены CNV двух и более негомологичных хромосом. В связи с этим для определения происхождения несбалансированной транслокации у плодов были запрошены данные о кариотипах супругов. При отсутствии таких данных цитогенетический анализ выполнялся впервые. В результате у 8 из 9 пар были выявлены сбалансированные ХА у одного из супругов (табл. 3), в одном случае данные о кариотипе родителей не получены.

|
Таблица 3. Результаты кариотипирования супружеских пар, у плодов которых был выявлен хромосомный дисбаланс |
У супружеской пары в случае 8 установлены нормальные кариотипы. Однако с учетом наличия несбалансированной транслокации у плода было принято решение провести флуоресцентную гибридизацию in situ — FISH-диагностику. По результатам FISH-теста у матери выявлена сбалансированная транслокация между 4-й и 15-й хромосомами — t(4;5)(p15;p14), которая не была определена с помощью стандартного цитогенетического исследования из-за субмикроскопического размера.
Для того чтобы оценить, насколько изолированное расширение воротникового пространства при нормальном кариотипе плода (по результатам стандартного кариотипирования) повышает риск наличия патогенных CNV, мы включили в исследование группу пациенток, клинически сопоставимую с основной группой, но в которой не было выявлено ни врожденных пороков развития, ни маркеров ХА, в том числе увеличения ТВП. В эту группу вошли 202 пациентки, которые были направлены на инвазивную пренатальную диагностику в связи с высоким риском ХА (>1:100) по результатам комбинированного пренатального скрининга и у которых при цитогенетическом исследовании был определен нормальный кариотип плода. При использовании ХМА у 2 пациенток выявлен аномальный молекулярный кариотип: в одном случае определена делеция короткого плеча 4-й хромосомы — arr4p16.3(1159060_1992826)x1, в другом — делеция длинного плеча 22-й хромосомы — arr22q11.21(18169796_21103320)x1.
Таким образом, при отсутствии мягких маркеров ХА у плода и его нормальном кариотипе по результатам цитогенетического исследования патогенные СNV с помощью ХМА были выявлены в 2 из 202 случаев (0,9%). Различия по сравнению с группой плодов, у которых зарегистрировано изолированное увеличение ТВП, статистически значимы: 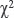 =15,49; р<0,001; ОШ=10,85 [2,52; 46,70].
=15,49; р<0,001; ОШ=10,85 [2,52; 46,70].
Обсуждение
При анализе результатов обращает на себя внимание тот факт, что в 14 из 22 случаев (63,6%) выявлены CNV, не классифицированные как синдром в базах данных, причем больше половины из них — 9 из 14 (64,2%) — составили CNV двух негомологичных хромосом, при наличии которых существует высокая вероятность носительства сбалансированных транслокаций у родителей. Выявление подобных особенностей генома крайне важно, так как сбалансированные структурные хромосомные перестройки могут приводить в будущем к повторным случаям невынашивания беременности либо к рождению детей с врожденными пороками развития.
Метод SNP-однонуклеотидного ХМА с использованием микроматриц низкой плотности можно использовать для поиска как анеуплоидий, так и патогенных CNV у плодов с увеличенной ТВП, установленной по результатам УЗИ в срок от 11 нед до 13 нед 6 дней. В нашем исследовании минимальный размер CNV, выявленных у плодов с расширенным воротниковым пространством, составил 157 тыс. п.н., что значительно меньше разрешающей способности стандартного цитогенетического исследования. Таким образом, использование ХМА в качестве исследования первой линии при наличии у плода увеличенной ТВП позволит повысить эффективность выявления хромосомного дисбаланса, в том числе обусловленного патологической мейотической сегрегацией родительской реципрокной транслокации.
Изолированное расширение воротникового пространства повышает вероятность обнаружения патогенных CNV более чем в 10 раз (ОШ=10,84) по сравнению со случаем отсутствия ультразвуковых маркеров хромосомных аномалий. Поэтому мы считаем необходимым в такой ситуации выполнять анализ материала плода с помощью ХМА, в том числе в случае, когда было проведено стандартное кариотипирование и получен нормальный результат.
Заключение
Увеличение толщины воротникового пространства является важным маркером не только анеуплоидий, но и CNV в виде микроделеций и микродупликаций, размеры которых не позволяют идентифицировать их стандартным методом кариотипирования. Одним из важных преимуществ хромосомного микроматричного анализа перед другими методами является возможность выявлять CNV негомологичных хромосом, при которых высока вероятность наличия сбалансированной хромосомной аномалии у одного из супругов и, следовательно, имеется риск аномалий кариотипа у плода при последующих беременностях.
Источник финансирования. Авторы заявляют об отсутствии финансирования настоящей работы.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Литература
- Nicolaides K.H. A model for a new pyramid of prenatal care based on the 11 to 13 weeks’ assessment. Prenat Diagn 2011; 31(1): 3–6, https://doi.org/10.1002/pd.2685.
- Медведев М.В., Алтынник Н.А. Основы ультразвукового скрининга в 11–14 недель беременности. М: Реальное время; 2014; с. 128.
- Золотухина Т.В., Юдина Е.В., Шилова Н.В., Миньженькова М.Е., Козлова Ю.О., Маркова Ж.Г. Спектр редких хромосомных аномалий, выявленных пренатально у плодов с увеличенным воротниковым пространством. Журнал акушерства и женских болезней 2013; 62(2): 88–92, https://doi.org/10.17816/jowd62288-92.
- Кудрявцева Е.В., Ковалев В.В., Канивец И.В., Киевская Ю.К., Коростелев С.А. Использование хромосомного микроматричного анализа в пренатальной диагностике в России. Уральский медицинский журнал 2017; 11: 12–15.
- Dugoff L., Norton M.E., Kuller J.A. The use of chromosomal microarray for prenatal diagnosis. Am J Obstet Gynecol 2016; 215(4): B2–B9, https://doi.org/10.1016/j.ajog.2016.07.016.
- Souka A.P., Krampl E., Bakalis S., Heath V., Nicolaides K.H. Outcome of pregnancy in chromosomally normal fetuses with increased nuchal translucency in the first trimester. Ultrasound Obstet Gynecol 2001; 18(1): 9–17, https://doi.org/10.1046/j.1469-0705.2001.00454.x.
- Srebniak M.I., Diderich K.E.M., Joosten M., Govaerts L.C.P., Knijnenburg J., de Vries F.A.T., Boter M., Lont D., Knapen M.F.C.M., de Wit M.C., Go A.T.J.I., Galjaard R.J.H., Van Opstal D. Prenatal SNP array testing in 1000 fetuses with ultrasound anomalies: causative, unexpected and susceptibility CNVs. Eur J Hum Genet 2016; 24(5): 645–651, https://doi.org/10.1038/ejhg.2015.193.
- Hillman S.C., McMullan D.J., Hall G., Togneri F.S., James N., Maher E.J., Meller C.H., Williams D., Wapner R.J., Maher E.R., Kilby M.D. Use of prenatal chromosomal microarray: prospective cohort study and systematic review and meta-analysis. Ultrasound Obstet Gynecol 2013; 41(6): 610–620, https://doi.org/10.1002/uog.12464.
- Äyräs O., Tikkanen M., Eronen M., Paavonen J., Stefanovic V. Increased nuchal translucency and pregnancy outcome: retrospective study of 1063 consecutive singleton pregnancies in a single referral institution. Prenat Diagn 2013; 33(9): 856–862, https://doi.org/10.1002/pd.4143.
- Souka A.P., von Kaisenberg C.S., Hyett J.A., Sonek J.D., Nicolaides K.H. Increased nuchal translucency with normal karyotype. Am J Obstet Gynecol 2005; 192(4): 1005–1021, https://doi.org/10.1016/j.ajog.2004.12.093.
- Шилова Н.В. Миньженкова М.Е. Интерпретация клинически значимых вариаций числа копий ДНК. Медицинская генетика 2018; 17(10): 15–19.
- Tsyvian P.B., Kovalev V.V., Kosovtsova N.V. Ultrasound markers of genetic pathology and early hemodynamic changes in human embryo. Hum Physiol 2014; 40(3): 340–343, https://doi.org/10.1134/s0362119714030189.
- Cai M., Lin N., Su L., Wu X., Xie X., Li Y., Lin Y., Xu L., Huang H. Copy number variations in ultrasonically abnormal late pregnancy fetuses with normal karyotypes. Sci Rep 2020; 10(1): 15094, https://doi.org/10.1038/s41598-020-72157-6.
- Callaway J.L., Shaffer L.G., Chitty L.S., Rosenfeld J.A., Crolla J.A. The clinical utility of microarray technologies applied to prenatal cytogenetics in the presence of a normal conventional karyotype: a review of the literature. Prenat Diagn 2013; 33(12): 1119–1123, https://doi.org/10.1002/pd.4209.
- American College of Obstetricians and Gynecologists. Prenatal diagnostic testing for genetic disorders. Practice Bulletin No.162. Obstet Gynecol 2016; 127(5): e108–e122, https://doi.org/10.1097/aog.0000000000001405.
- Yao R., Zhang C., Yu T., Li N., Hu X., Wang X., Wang J., Shen Y. Evaluation of three read-depth based CNV detection tools using whole-exome sequencing data. Mol Cytogenet 2017; 10: 30, https://doi.org/10.1186/s13039-017-0333-5.










