Нейроиммунные аспекты шизофрении с выраженными негативными симптомами: новые маркеры диагностики фенотипов болезни
Цель исследования — изучение иммуновоспалительного профиля у больных параноидной шизофренией в зависимости от выраженности негативных симптомов и их взаимосвязей с данными структурной МРТ для разработки биомаркеров неблагоприятного течения болезни, поиска новых подходов к терапии и контролю ее эффективности.
Материалы и методы. В основную группу вошел 51 больной параноидной шизофренией, в контрольную — 30 здоровых добровольцев. Больным были проведены МРТ-сканирование и иммунологические исследования, включавшие оценку основных параметров естественного и адаптивного иммунитета, системного уровня ключевых провоспалительных и противовоспалительных цитокинов, а также других маркеров воспаления.
Результаты. Впервые показаны особенности расстройств иммунитета и иммуновоспалительного профиля у больных параноидной шизофренией с выраженными негативными симптомами: при наличии выраженной негативной симптоматики (более 15 баллов по шкале NSA-4) были повышены уровни активации гуморального иммунитета, цитокинов IL-10 и IL-12p40 и нейротрофина NGF на фоне высокого содержания маркеров системного воспаления. Определены морфометрические изменения мозга, характерные для больных шизофренией, а также специфичные — для группы больных с выраженными негативными симптомами. Впервые получены данные о взаимосвязи иммунных изменений со структурными изменениями ряда зон мозга, включая лобную кору и гиппокамп. Выявлен ряд ассоциаций между уровнем противовоспалительных цитокинов IL-10, IL-12p40 и морфометрическими показателями мозга, специфичными только для больных шизофренией с выраженной негативной симптоматикой.
Заключение. Новый междисциплинарный подход, включающий морфометрию головного мозга больных шизофренией и здоровых добровольцев, а также углубленные иммунологические и клинические исследования, позволил впервые определить нейробиологические, иммунные и нейрокогнитивные маркеры, отражающие взаимосвязь иммунных и воспалительных нарушений, морфометрических показателей и клинических проявлений при параноидной шизофрении с выраженными негативными симптомами. Полученные данные важны для дальнейшей расшифровки патогенеза шизофрении и ее подтипов, а также для поиска новых подходов к терапии тяжелых форм заболевания.
Введение
Шизофрения — хроническое психическое расстройство, которое вызывается сложной палитрой генетических, эпигенетических и повреждающих факторов окружающей среды [1]. Заболевание характеризуется ошибочным восприятием окружающей действительности и уходом от реальности. Симптоматика шизофрении включает позитивные (бред, галлюцинации) и негативные симптомы (социальная изоляция, апатия, мотивационный дефицит, бедность речи, снижение эмоциональной реактивности, абулия), когнитивные изменения, неорганизованное мышление и психомоторные нарушения [2]. Надо отметить, что шизофрения приводит не только к ранней инвалидизации (пик заболеваемости приходится на 18–25 лет) [2], но и к снижению продолжительности жизни [3]: она примерно на 10–25 лет меньше, чем у обычного населения, из-за проблем со здоровьем и более высокого уровня самоубийств [4]. У 30% и более больных шизофренией наблюдается устойчивость к лечению, что еще больше увеличивает тяжелое социально-экономическое бремя болезни [5].
Патогенез заболевания и его многообразных форм до конца не расшифрован. Предполагают, что эндогенные и экзогенные (инфекционные, токсические, социальные и другие) патологические стимулы взаимодействуют с генетическими и эпигенетическими факторами как в пренатальном, так и постнатальном периодах, что приводит к нарушению морфогенеза мозга, центральной и периферической иммунной активации и развитию системного воспаления [1, 6, 7]. Большой интерес представляют данные, показывающие критическую роль иммунных нарушений и нейровоспаления в патогенезе различных форм шизофрении [6, 8, 9].
В настоящее время стала очевидной взаимосвязь между иммунной системой, периферической нервной системой и головным мозгом. Практически все нейротрансмиттеры, включая ацетилхолин и дофамин, секретируются циркулирующими лимфоцитами, а их рецепторы экспрессируются этими клетками и играют важную роль в иммунорегуляции и нейроиммунных взаимодействиях. Полагают, что макрофаги и Т-клетки являются своеобразными точками холинергической передачи сигналов через парасимпатическую нервную систему от мозга к селезенке и наоборот [4]. Таким образом, накоплено большое количество данных, показывающих, что иммунные факторы играют важную роль в функциях здорового мозга [10, 11]. При этом F.C. Bennett и A.V. Molofsky [12] подчеркивают, что, несмотря на выявленные многими авторами корреляции между показателями иммунной функции и психическими заболеваниями, их значение остается в значительной степени нерасшифрованным.
Ранее мы сообщали о наличии системного воспаления у больных с параноидной формой шизофрении, наиболее выраженного у лиц с первым эпизодом психоза [13]. В целом установлено, что на разных этапах развития и клинического течения заболевания повышаются уровни белков острой фазы, макрофагальных и лимфоцитарных провоспалительных факторов, включая цитокины и хемокины клеток естественного и адаптивного иммунитета, а также противовоспалительных белков. Описанные нарушения могут по-разному сочетаться у таких больных, создавая многочисленные иммунные паттерны, которые способны менять сигнальные и метаболические пути на периферии и в головном мозге [14]. При этом иммунные профили при шизофрении с выраженными негативными расстройствами изучены недостаточно.
Негативные симптомы характерны для шизофрении и присутствуют более чем у половины больных (от 60 до 90% по данным литературы) [15]. Описан подтип заболевания, называемый дефицитной шизофренией, который характеризуется первичными и стойкими негативными симптомами и встречается примерно у 20% больных [16]. Такие симптомы часто выявляют у людей с устойчивой к лечению шизофренией. Считается, что они определяют тяжесть заболевания и развитие когнитивного дефицита у этих больных. Важно отметить, что негативные симптомы у больных шизофренией в большей степени, чем положительные, связаны с функциональными нарушениями и плохим прогнозом. Современные нейролептики не обеспечивают адекватной терапии негативных симптомов, что остается серьезной проблемой при лечении и ведении больных шизофренией [16, 17].
Нейровизуализация вносит большой вклад в открытие клинически значимых биологических процессов при шизофрении и дает уникальную возможность исследования различных аспектов патологии мозга in vivo, включая структурные нарушения мозга, нарушения функциональной связности и изменения нейротрансмиттерных систем [18]. У многих больных шизофренией обнаруживают различной степени выраженности структурные, функциональные и метаболические нарушения в лобной доле, но механизмы, лежащие в основе этих изменений, еще не полностью изучены [18–20].
До настоящего времени не разработано общепринятых подходов к использованию данных нейровизуализации для прогнозирования психоза, постановки диагноза шизофрении, подбора терапии заболевания и его мониторинга. Одним из важных путей трансляции данных МРТ в клиническую практику является изучение нарушений нейроиммунных взаимосвязей и представленности маркеров системного воспаления (возможность их выявления, оценки) у больных шизофренией в зависимости от клинической картины, в том числе типа течения болезни и преобладающей симптоматики.
Цель исследования — изучение иммуновоспалительного профиля больных параноидной шизофренией в зависимости от выраженности негативных симптомов и их взаимосвязей с данными структурной МРТ для последующей разработки биомаркеров неблагоприятного течения болезни, поиска новых подходов к терапии и контролю ее эффективности.
Материалы и методы
В исследование иммунологических показателей вошел 51 больной параноидной шизофренией в возрасте от 18 до 40 лет (из них 32 мужчины и 19 женщин, средний возраст — 28,5±6,2 года). Больные проходили стационарное лечение в Психиатрической клинической больнице №1 им. Н.А. Алексеева (Москва) в 2017–2019 гг. На момент поступления в стационар у них наблюдался галлюцинаторно-бредовый синдром с бредом воздействия, психическим автоматизмом и вербальными псевдогаллюцинациями, что соответствовало симптомам первого ранга по критериям Курта Шнайдера и основным критериям диагностики шизофрении по МКБ-10 и DSM-5. У двух третей больных галлюцинаторно-бредовый синдром сочетался с негативными симптомами. Выраженных симптомов депрессии у обследованных не отмечалось.
Критерии исключения из исследования: наличие на момент обследования манифестных симптомов шизофрении, органических заболеваний ЦНС, соматической патологии в стадии декомпенсации, острых или находящихся в фазе обострения инфекционных, аутоиммунных, аутовоспалительных заболеваний; злоупотребление психоактивными веществами.
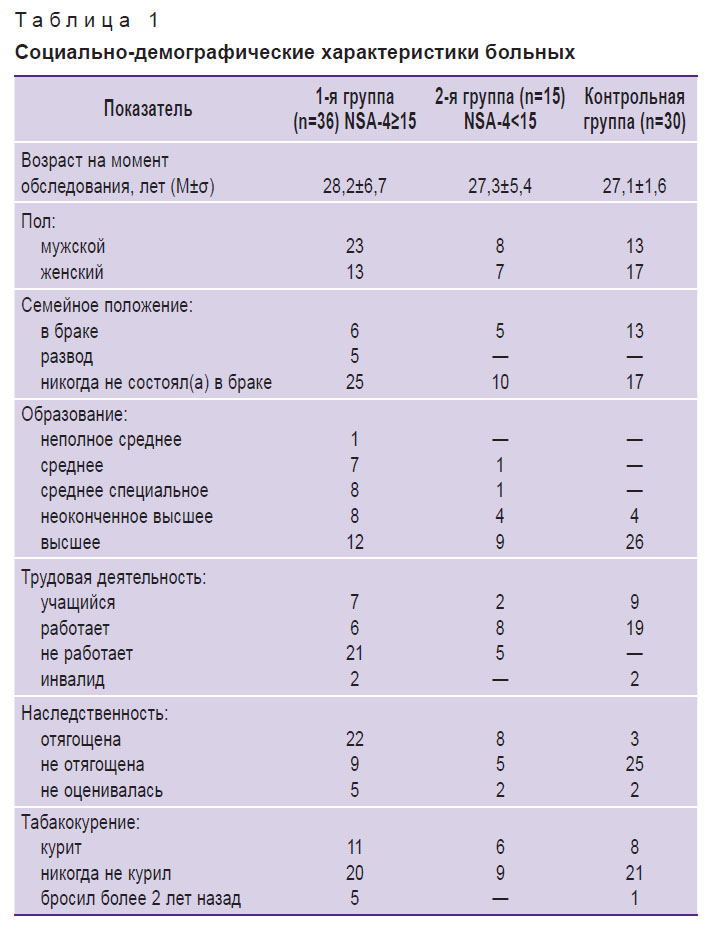
Для анализа результатов исследования больные были распределены на две группы в зависимости от выраженности негативной симптоматики по данным шкалы оценки негативных симптомов (Negative Symptom Assessment) NSA-4: 1-я (n=36) — количество баллов 15 и больше; 2-я (n=15) — количество баллов меньше 15. Социально-
демографические и клинические характеристики исследуемых представлены в табл. 1 и 2. Из всех больных шизофренией 25 человек с разными показателями тестирования по шкале NSA-4 проходили исследование в динамике. Группу контроля составили 30 здоровых добровольцев из числа сотрудников больницы, сопоставимых по возрасту и полу, без признаков психических расстройств и не состоящих в родстве с больными шизофренией или другими психическими заболеваниями.
|
Таблица 1. Социально-демографические характеристики больных |
|
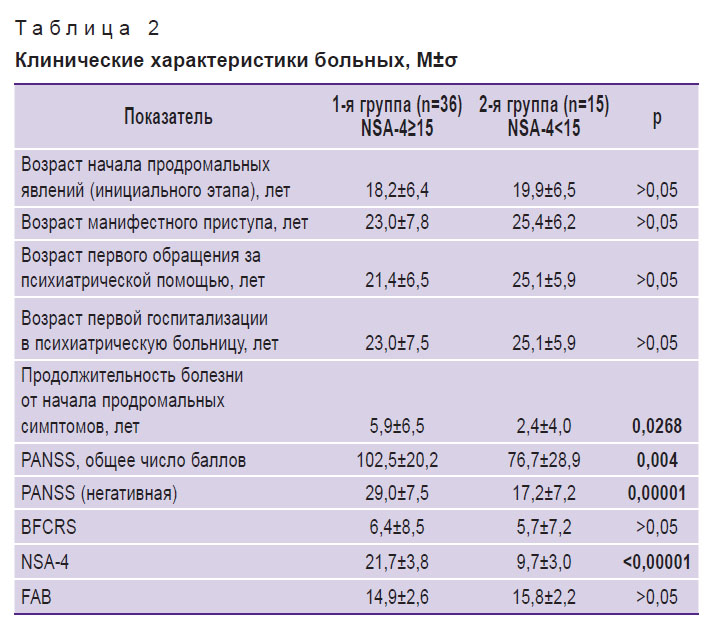
Таблица 2. Клинические характеристики больных, M±σ |
Для психометрического и нейропсихологического исследований больных и здоровых применяли следующие тесты и шкалы: шкалу оценки позитивных и негативных синдромов (Positive and Negative Syndrome Scale, PANSS), шкалу оценки кататонии Буша–Фрэнсиса (Bush–Francis Catatonia Rating Scale, BFCRS), шкалу оценки негативных симптомов NSA-4, тест-батарею лобной дисфункции (Frontal Assessment Battery, FAB).
Иммунологическое исследование и МРТ-сканирование были проведены в период становления ремиссии со значительной редукцией позитивной симптоматики и формированием критики к перенесенному психозу. Уменьшение позитивной симптоматики происходило после стандартной терапии атипичными антипсихотиками (оланзапин, рисперидон) в эквиваленте 6–8 мг рисперидона в сутки. У всех больных исследовали содержание цитокинов (IL-1β, TNF-α, IL-6, IL-2, IL-4, IL-8, IL-10, IFN-γ, IL-12р40), С-реактивного белка (СРБ), кортизола, циркулирующих иммунных комплексов (ЦИК), общих иммуноглобулинов (IgA, IgM, IgG), нейротрофина NGF в сыворотке крови методом ИФА с использованием наборов реагентов производства следующих фирм: «Цитокин» (Россия), «Вектор-Бест» (Россия), BioVendor — Laboratorni medicina a.s. (Чехия), Bender MedSystems (Австрия), «ХЕМА» (Россия).
МРТ-сканирование было выполнено 39 больным на базе Курчатовского комплекса НБИКС-природоподобных технологий (Национальный исследовательский центр «Курчатовский институт») на магнитно-резонансном томографе Magnetom Verio 3T (Siemens, Германия). Данные были получены с использованием 32-канальной катушки для головного мозга. С целью оценки гирификации, морфометрии серого и белого вещества, определения объема ликвора были получены анатомические данные каждого испытуемого на основе Т1-взвешенной последовательности (TR=1900 мс; TE=2,21 мс; 176 срезов; размер вокселя — 1×1×1 мм).
Все полученные структурные изображения в рамках данного проекта проанализированы на суперкомпьютере Национального исследовательского центра «Курчатовский институт» в программе Freesurfer. Это программный пакет с открытым исходным кодом, который позволяет провести удаление сигнала от черепа из изображений, подкорковую и корковую сегментацию, реконструкцию кортикальной поверхности, оценку кортикальной толщины и полную морфометрию головного мозга. На основе полученных после анализа в программе Freesurfer данных был также проведен расчет индекса локальной гирификации головного мозга.
Этические принципы. Проведение исследования было одобрено Этическим комитетом Национального исследовательского центра «Курчатовский институт». Все участники были ознакомлены с деталями исследования и подписывали лист добровольного информированного согласия, а также согласие на обработку персональных данных. Неукоснительно соблюдались принципы Хельсинкской декларации (2013).
Статистическая обработка. Для статистической обработки применяли программное обеспечение Excel (Microsoft, 2010), Statistica 10.0 (StatSoft, 2010). Оценку нормальности распределения проводили по критерию Шапиро–Уилка. Результаты по группам для клинических показателей представляли в виде средних со стандартным отклонением (M±σ), для иммунологических показателей — в виде медиан с 25-м и 75-м процентилями. Для оценки значимости различий по клиническим показателям использовали t-критерий Стьюдента, по иммунологическим показателям — U-критерий Манна–Уитни, считая различия между показателями статистически значимыми при р<0,05. Для оценки корреляций применяли коэффициент корреляции Пирсона. Для оценки силы выявленных связей использовали шкалу Чеддока.
Результаты
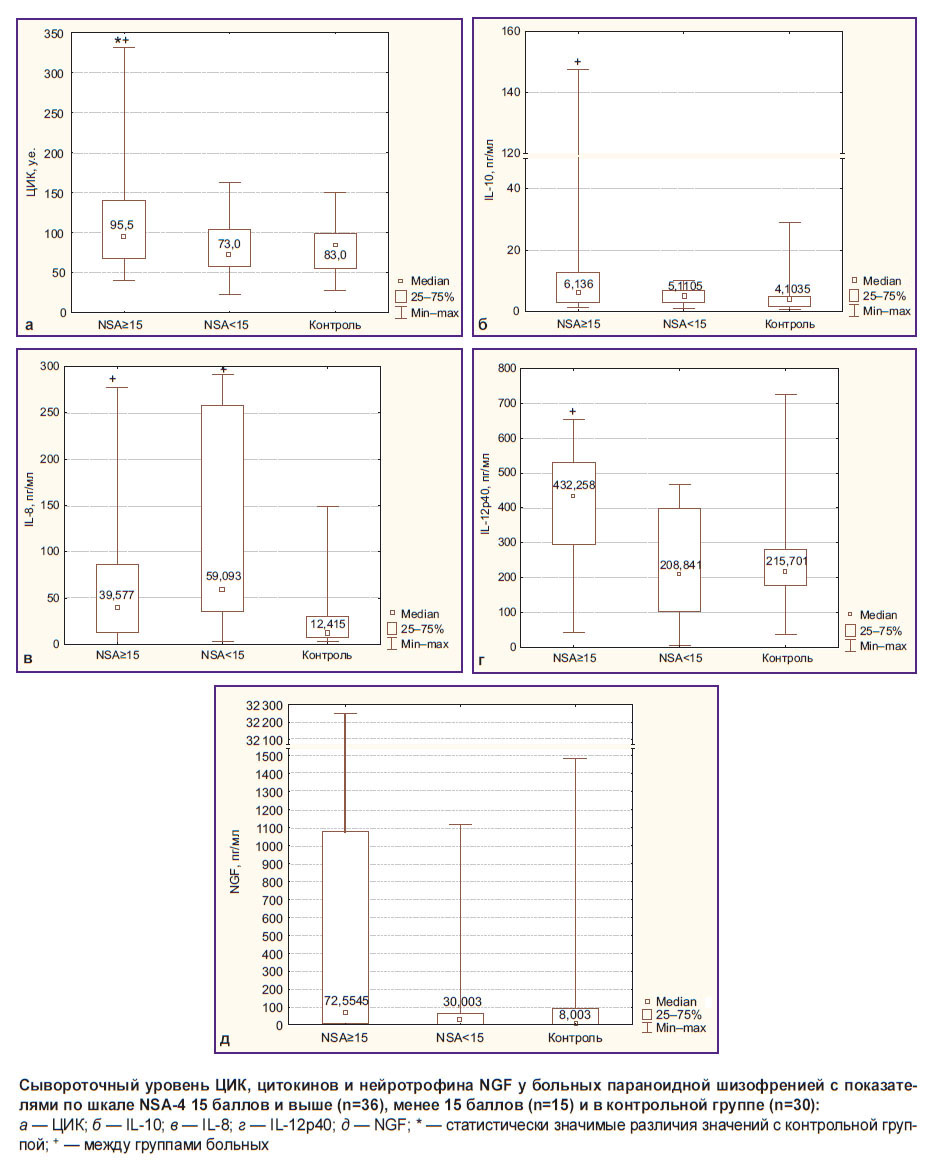
Исследование позволило выявить связи содержания ряда медиаторов иммунной системы с наличием и выраженностью негативных и позитивных симптомов при параноидной шизофрении. Так, у больных с выраженными негативными симптомами (1-я группа) были повышены уровни маркеров активации гуморального иммунитета. У них наблюдалось значимое увеличение уровня ЦИК: 95,5 [68,0; 140,0] у.е. при уровне 73 [58; 104] у.е. во 2-й группе и 83 [55; 99] у.е. — в контрольной группе (см. рисунок, а). Кроме того, у них отмечалась тенденция к более высокому содержанию общего уровня иммуноглобулинов класса G (13,53 [12,10; 15,42] г/л при уровне 11,84 [10,80; 13,86] г/л во 2-й группе и 13,04 [10,16; 14,50] г/л — в контрольной группе). При этом у части больных 1-й группы с выраженным повышением ЦИК (18 из 36 человек, медианный уровень ЦИК — 138,5 [118,0; 215,0] у.е.) чаще выявлялось увеличение уровня IL-4, СРБ и IFN-γ, что свидетельствует об активации у них адаптивного звена иммунитета. Кроме того, у этих больных был выше нейтрофильно-лимфоцитарный индекс (1,96 [1,67; 2,77] по сравнению с 1,53 [1,13; 2,59] во 2-й группе), что отражает бóльшую активацию у них нейтрофилов/фагоцитов периферической крови.
Содержание IL-10 (см. рисунок, б) и IL-12p40 (см. рисунок, г), важных участников противовоспалительной регуляции, в 1-й группе больных шизофренией было статистически значимо увеличено по сравнению с контролем и превышало аналогичные показатели у больных 2-й группы. Оказалось, что у больных 1-й группы с более высоким уровнем IL-10 (более 5,4 пг/мл, медианный уровень — 7,73 [6,14; 24,62] пг/мл) чаще выявлялось существенное увеличение содержания СРБ, ЦИК, кортизола, цитокинов естественного и адаптивного иммунитета (IL-2, IL-4, IFN-γ). В то же время более чем у 40% больных 1-й группы с увеличенным содержанием СРБ не отмечалось соответствующего повышения уровня IL-10. Также у этих больных отсутствовало увеличение содержания NGF и/или IL-12р40. При этом содержание IL-8, одного из основных медиаторов системного воспаления, было повышено у больных шизофренией независимо от выраженности негативных симптомов (см. рисунок, в).
Уровень нейротрофина NGF в сыворотке крови у большинства больных, имеющих выраженную негативную симптоматику, был увеличен в несколько раз по сравнению с контрольной группой и больными с количеством баллов по шкале NSA-4 менее 15 (см. рисунок, д), однако различия между группами не достигали достоверности в связи с большим разбросом данных.
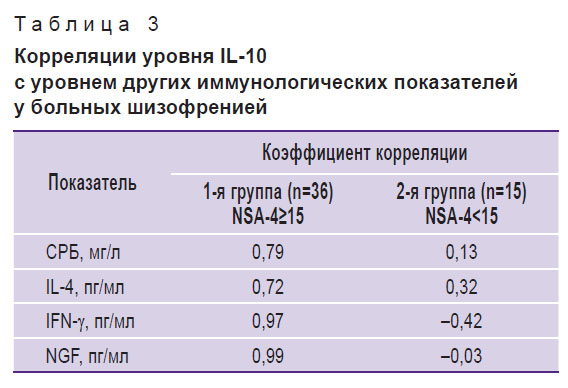
У больных шизофренией в 1-й группе была выявлена значимая положительная корреляция содержания СРБ, IL-4, IFN-γ, NGF с уровнем IL-10 (табл. 3).
|
Таблица 3. Корреляции уровня IL-10 с уровнем других иммунологических показателей у больных шизофренией |
Сравнение показателей структурной нейровизуализации у больных с различной выраженностью негативных симптомов позволило обнаружить, что снижение (p<0,005) показателя средней толщины коры в ряде областей мозга (преимущественно в лобных долях) было характерно для больных шизофренией независимо от выраженности негативных симптомов (в правой верхней лобной извилине, покрышечной части левой нижней лобной извилины, в целом по левому полушарию, в левой постцентральной извилине, в ростральной части левой средней лобной извилины и др.). Однако в ряде областей средняя толщина коры статистически значимо (p<0,005) снижалась только у больных с высокой выраженностью негативных симптомов (NSA-4≥15): в целом по правому полушарию, в триангулярной части правой нижней лобной извилины, в каудальной части левой средней лобной извилины, в каудальной части правой средней лобной извилины, в триангулярной части левой нижней лобной извилины, в ростральной части правой средней лобной извилины, в орбитальной части правой нижней лобной извилины, в правой верхней височной извилине и др. В то же время средняя толщина коры в области правой медиальной орбитофронтальной коры статистически значимо (p<0,005) снижалась только у больных параноидной шизофренией с низкой выраженностью негативных симптомов (NSA-4<15).
Эти впервые полученные результаты в совокупности указывают на изменения толщины коры ряда областей мозга как в правом, так и в левом большом полушарии, характерные только для больных с выраженными негативными симптомами.
Было важно установить, какие иммуновоспалительные изменения в системном кровотоке связаны со структурными (морфометрическими) изменениями в головном мозге, особенно у больных шизофренией с выраженными негативными симптомами. Акцент был сделан на анализе взаимосвязи уровней противовосспалительных медиаторов со структурными изменениями головного мозга при шизофрении, что еще остается практически не изученным.
У больных с выраженной негативной симптоматикой (с числом баллов по шкале NSA-4≥15) уровень противовоспалительного цитокина IL-10 отрицательно коррелировал со средней интенсивностью сигнала в области базальных ядер и гиппокампа (табл. 4). Отметим, что аналогичные корреляции для базальных ядер выявлялись и с уровнем цитокина IL-12p40, что может отражать наличие профиля заболевания, ассоциируемого с определенными морфометрическими изменениями, а также с повышением сывороточного уровня цитокинов, ассоциированных с системным воспалительным ответом.
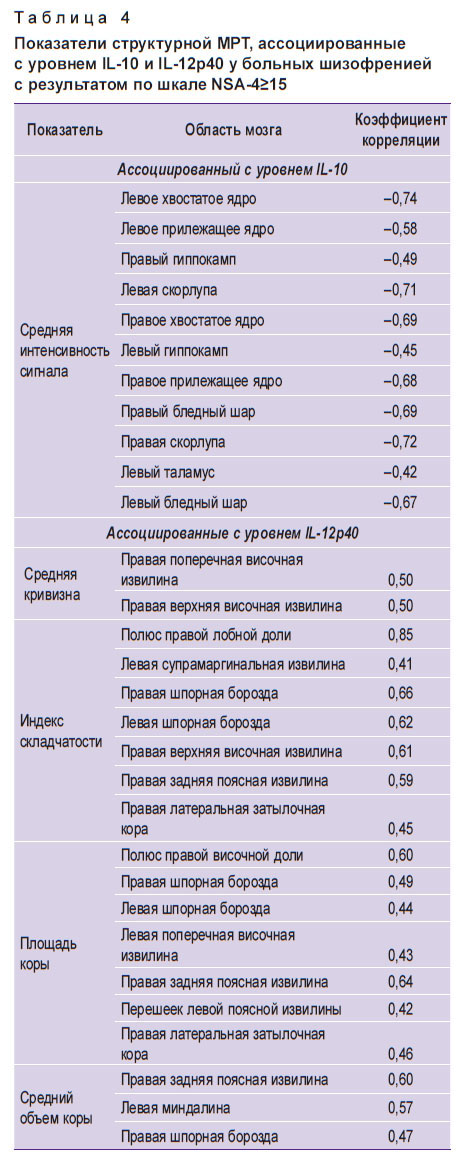
|
Таблица 4. Показатели структурной МРТ, ассоциированные с уровнем IL-10 и IL-12p40 у больных шизофренией с результатом по шкале NSA-4≥15 |
Был также выявлен ряд ассоциаций между уровнем цитокина IL-12p40 и морфометрическими показателями, специфичных только для больных шизофренией с выраженной негативной симптоматикой. Так, анализ взаимосвязи сывороточного уровня иммунных и нейробиологических факторов с результатами структурной и функциональной визуализации выявил, что у больных с результатом по шкале NSA-4≥15 отмечалась статистически значимая (p<0,05) корреляция уровня IL-12p40 с большим числом показателей структурной МРТ. Часть полученных данных представлена в табл. 4.
Обсуждение
Впервые выявлены существенные различия иммуновоспалительного профиля у больных шизофренией с выраженными негативными симптомами: активация гуморального звена и значительное увеличение уровня ЦИК на фоне сохраняющегося низкоуровневого системного воспаления. Полученные данные свидетельствуют, что у больных наблюдается антигенная стимуляция (эндотоксинами или другими инфекционными антигенами, антигенами мозговой ткани или другими аутоантигенами). Эндотоксинам кишечного происхождения придается сейчас большое значение, так как известно, что изменения микробиоты кишечника напрямую коррелируют с аффективными состояниями, тревогой и депрессией [21]. Также у больных шизофренией может быть снижен клиренс иммунных комплексов фагоцитами, несмотря на некоторые признаки их активации (увеличены нейтрофильно-лимфоцитарный индекс и уровень цитокинов естественного иммунитета). У больных шизофренией с выраженными негативными симптомами нельзя исключить снижение фагоцитарной активности клеток на фоне повышения ими продукции цитокинов. Известно, что микроглия при шизофрении имеет провоспалительный фенотип М1 и сниженную способность к фагоцитозу [22–24]. Предполагают также взаимосвязь между состоянием микроглии и периферических фагоцитов [9].
У больных с выраженными негативными симптомами были выявлены повышенные уровни цитокинов IL-10, IL-12p40 и NGF, которые обладают противовоспалительными эффектами. Причем обнаружена значимая положительная корреляция уровня IL-10 с содержанием СРБ, IL-4, IFN-γ и NGF. При высоком уровне IL-10 чаще отмечали существенное увеличение содержания ЦИК, кортизола, цитокинов естественного и адаптивного иммунитета (IL-2, IL-4, IFN-γ), что позволяет оценивать повышенный уровень IL-10 как реакцию на системное воспаление. Ключевой противовоспалительный регулятор IL-10 имеет решающее значение для защиты организма от повреждения тканей, особенно во время острой фазы иммунного ответа. Данные свидетельствуют, с одной стороны, о сохраненном регуляторном ответе, с другой — о недостаточной его эффективности, так как у больных с высоким уровнем воспаления увеличенное содержание IL-10 не обеспечивает прекращения хронического системного воспаления. Это может быть обусловлено изменениями чувствительности рецепторов к высокому уровню цитокина, недостаточностью активности других участников подавления воспаления, а также наличием полиморфизмов гена IL-10, уменьшающего его функциональную активность, — все это требует дальнейших исследований. Важно, что высокие концентрации IL-10 могут быть использованы вирусами для уклонения от иммунного надзора. В частности, это характерно для герпесвирусов, активация которых может вносить свой вклад в воспаление, а в дальнейшем — в нейродегенерацию [25]. Избыток IL-10 может иметь и свои негативные эффекты: так, в работе [26] показано, что повышенные уровни периферического IL-10 связаны с нарушением целостности микроструктуры белого вещества мозга при шизофрении.
В нашем исследовании также впервые установлено, что у больных шизофренией с выраженными негативными симптомами значительно повышен и уровень IL-12p40. Ранее в работе [27] было показано повышение уровня IL-12p40 в целом у больных шизофренией по сравнению со здоровыми добровольцами, при этом анализа связи такого повышения с симптомами и другими параметрами, кроме пола, не проводилось. Мономер 12p40 ингибирует активность IL-12 и продукцию IFN-γ, т.е. обладает противовоспалительным эффектом в отношении активности Т-хелперов 1-го типа. Имеются данные, что IL-12р40 активирует регуляторные клетки (противовоспалительные эффекты), ослабляет аутоиммунные субпопуляции хелперов Th1 и Th17 через подавление IL-12 и IL-23 (воздействуя на их рецепторы и вызывая интернализацию IL-12Rβ1) [28]. И здесь мы видим, что еще один противовоспалительный медиатор IL-12р40 может подавлять противовирусный ответ и способствовать хроническим вирусным инфекциям при шизофрении.
Как показали наши исследования, содержание нейротрофина NGF в сыворотке крови у больных, имеющих наиболее выраженную негативную симптоматику, было увеличено в несколько раз по сравнению с контрольной группой и группой больных без выраженных негативных симптомов. NGF участвует в развитии нейронов, дифференцировке и поддержании их как в процессе развития, так и на протяжении всей жизни. Этот нейротрофин оказывает влияние на структуру и функцию мозга, вызывая рост нейритов, а также увеличение сложности ветвления и длины дендритов в корковых нейронах [29, 30]. В головном мозге самая высокая экспрессия мРНК NGF обнаружена в гиппокампе [31]. Установлено, что уровень NGF в сыворотке ассоциирован с его концентрацией в ЦНС [32]. Исследования на животных показали, что NGF проникает через гематоэнцефалический барьер [33]. Более того, в нескольких исследованиях сообщалось о связи между периферическими уровнями NGF и различными аспектами патофизиологии шизофрении. Например, у больных шизофренией уровень NGF коррелировал с аномальными электрофизиологическими показателями, а именно потенциалом p300 [34], причем лечение антипсихотиками было связано с увеличением уровней NGF в сыворотке [35]. Если принять во внимание эти данные, можно утверждать, что уровни NGF в сыворотке могут быть многообещающим маркером концентрации этого нейротрофина в ЦНС. Следует подчеркнуть, что дисфункция NGF, вызванная либо патологическим изменением его концентрации, либо действием на рецептор, может способствовать нарушению нейропластичности и синаптических взаимодействий. Эти изменения могут лежать в основе структурных и функциональных изменений, наблюдаемых при шизофрении. Неоднократно сообщалось, что уровни NGF в сыворотке крови у больных шизофренией значительно снижаются по сравнению со здоровыми субъектами [36]. Показано также, что NGF участвует в регуляции и иммунных функций: стимулирует пролиферацию B- и T-клеток, выработку антител IgM, IgA и IgG4, хемотаксис, жизнеспособность и функциональные свойства нейтрофилов, выживание B-клеток памяти [30]. Установлено, что NGF оказывает тормозящее действие на агрессивное поведение самцов мышей и вызывает формирование у них подчиненного положения за счет стимуляции секреции глюкокортикоидов корой надпочечников [37]. Таким образом, повышение уровня NGF у больных параноидной шизофренией с выраженными негативными симптомами, выявленное нами впервые, может служить одной из причин их развития.
В целом можно предположить, что активация гуморального звена у больных параноидной шизофренией происходит вследствие антигенемии разного генеза, а увеличение уровня медиаторов, снижающих воспаление, поддерживает активность Т-хелперов 2-го типа и, кроме того, способствует латентной вирусной инфекции. Вследствие этого требуются дальнейшие исследования причин иммунных нарушений при шизофрении с выраженными негативными симптомами, включая генетические факторы их развития.
В данной работе мы стремились выявить изменения морфометрии мозга, которые напрямую связаны с выраженностью негативных симптомов по данным нейропсихологического тестирования, что подтверждало бы их связь не только с нарушениями функции мозга, но и со структурными изменениями, которые лежат в основе различий клинической картины у вариантов параноидной шизофрении. Мы показали, что снижение (p<0,005) показателя средней толщины коры в ряде областей мозга (преимущественно в лобных долях) характерно для больных параноидной шизофренией независимо от выраженности негативных симптомов. Это совпадает с результатами других работ, выявивших, что шизофрения сопровождается структурными и функциональными изменениями головного мозга [38, 39].
В литературе встречаются лишь единичные сообщения об исследованиях связи между негативными симптомами и структурными изменениями мозга. Так, T. Zhang и соавт. [40] обнаружили снижение объема серого вещества в мозжечке, левой нижней орбитофронтальной коре и правом таламусе у больных шизофренией с негативными симптомами. Еще одна работа [41] посвящена поиску структурных различий мозга, выявленных на МРТ, у больных шизофренией с нейрокогнитивным дефектом по сравнению со здоровыми: авторы продемонстрировали сокращение объема серого и белого вещества мозга при данной форме шизофрении. В обзоре A. Kaladjian и соавт. [42] показано выявленное путем структурной визуализации уменьшение плотности серого вещества или толщины коры в лобных и височных областях, связанное с негативными симптомами и локализованное, в частности, в медиальной лобной и орбитофронтальной коре, а также в области амигдало-гиппокампального комплекса.
В нашем исследовании мы обнаружили, что средняя толщина коры в ряде областей мозга была снижена (p<0,005) только у больных с высокой выраженностью негативных симптомов (NSA-4≥15). Отметим, что у таких больных отмечались, по данным морфометрии, статистически значимые изменения более 25 показателей по сравнению с контрольной группой (p<0,005). Эти впервые полученные результаты показали, что изменения толщины коры ряда областей мозга как в правом, так и в левом большом полушарии характерны только для больных параноидной шизофренией с выраженными негативными симптомами.
Большое место в нашем исследовании было отведено поиску взаимосвязей между иммуновоспалительным профилем больных параноидной шизофренией с выраженными негативными симптомами со структурными изменениями мозга. Подобных исследований в доступной литературе не обнаружено. У больных с выраженной негативной симптоматикой (число баллов по шкале NSA-4≥15) уровень противовоспалительного цитокина IL-10 отрицательно коррелировал со средней интенсивностью сигнала в области базальных ядер и гиппокампа (коэффициент корреляции — от –0,74 до –0,42). При этом корреляция была сильной для левого хвостатого ядра, левой и правой скорлупы; средней — для правого хвостатого ядра, левого и правого прилежащего ядра, левого и правого бледного шара. Всего у больных с высокой выраженностью негативных симптомов мы выявили корреляцию уровня IL-10 с 60 показателями морфометрии. В работе [26] показано, что повышенный уровень IL-10 связан с нарушением целостности определенных пучков белого вещества при шизофрении. Причины этих изменений пока не ясны, но, на наш взгляд, они могут быть обусловлены высоким уровнем системного нейровоспаления. Отметим, что аналогичные корреляции в областях базальных ядер нами отмечены и для цитокина IL-12p40. Выявлен ряд ассоциаций между его уровнем и морфометрическими показателями, которые характерны только для больных шизофренией с выраженной негативной симптоматикой. В целом у таких больных по данным морфометрии установлены корреляции уровня цитокина IL-12p40 и более 73 показателей. Сильная корреляция отмечалась с индексом складчатости в области полюса правой лобной доли, средняя — со средней кривизной в области правой поперечной височной извилины и правой верхней височной извилины, с индексом складчатости в области левой и правой шпорной борозды, правой верхней височной извилины, правой задней поясной извилины, с площадью коры в области правой задней поясной извилины и полюса правой височной доли, со средним объемом коры в области правой задней поясной извилины и в области левой миндалины. Надо отметить, что имеются доказательства периферического проникновения цитокинов через гематоэнцефалический барьер из-за активированных эндотелиальных клеток и повышенной проницаемости гематоэнцефалического барьера при шизофрении [43].
В результате работы была получена новая информация об иммуновоспалительном профиле и связи важнейших регуляторных цитокинов IL-10 и IL-12p40, нейротрофина NGF у больных параноидной шизофренией с выраженными негативными симптомами, а также дополнительные доказательства достоверности нейровоспалительной гипотезы шизофрении и роли нейроиммунных взаимодействий в патогенезе заболевания.
Ограничениями данной работы можно считать относительно небольшое число вошедших в исследование больных, отсутствие не получавших лечения больных, отсутствие обследования больных в динамике.
Заключение
Междисциплинарный подход, включавший морфометрию головного мозга больных шизофренией и здоровых добровольцев, углубленные иммунологические и клинические исследования, позволил выявить нейробиологические, иммунные и нейрокогнитивные маркеры (IL-10, IL-12p40, NGF), отражающие взаимосвязь иммунологических и воспалительных нарушений, иммунологических показателей и клинических проявлений при шизофрении. Определены особенности расстройств иммунитета и иммуновоспалительный профиль больных параноидной шизофренией с выраженными негативными симптомами. Получены данные о тесной взаимосвязи иммунных изменений с изменениями структуры серого вещества и желудочков мозга (включая важные зоны коры, гиппокамп и другие показатели структурной МРТ): толщины, гирификации и объема коры в ряде зон мозга.
Исследования взаимосвязей клинических проявлений с маркерами иммуновоспалительных расстройств и поиск их мозговых коррелятов крайне важны для будущего внедрения их результатов в практику. С учетом многообразия форм шизофрении и насущной потребности в поиске новых методов ее терапии подобные исследования открывают перспективу использования морфометрических и связанных с ними иммунологических параметров в качестве биомаркеров прогноза, мониторинга и поиска терапевтических воздействий.
Источники финансирования. Работа проведена за счет средств Национального исследовательского центра «Курчатовский институт» (ВНИР «Биомедицинские технологии», проводимая в соответствии с Приказом НИЦ «Курчатовский институт»), частично — за счет средств гранта Российского научного фонда №20-15-00299.
Конфликт интересов. Конфликт интересов, связанный с данным исследованием, отсутствует.
Литература
- Millan M.J., Fone K., Steckler T., Horan W.P. Negative symptoms of schizophrenia: clinical characteristics, pathophysiological substrates, experimental models and prospects for improved treatment. Eur Neuropsychopharmacol 2014; 24(5): 645–836, https://doi.org/10.1016/j.euroneuro.2014.03.008.
- Iasevoli F., Avagliano C., Altavilla B., Barone A., D’Ambrosio L., Matrone M., Notar Francesco D., Razzino E., de Bartolomeis A. Disease severity in treatment resistant schizophrenia patients is mainly affected by negative symptoms, which mediate the effects of cognitive dysfunctions and neurological soft signs. Front Psychiatry 2018; 9: 553, https://doi.org/10.3389/fpsyt.2018.00553.
- Laursen T.M., Nordentoft M., Mortensen P.B. Excess early mortality in schizophrenia. Annu Rev Clin Psychol 2014; 10: 425–448, https://doi.org/10.1146/annurev-clinpsy-032813-153657.
- Corsi-Zuelli F.M.D.G., Brognara F., Quirino G.F.D.S., Hiroki C.H., Fais R.S., Del-Ben C.M., Ulloa L., Salgado H.C., Kanashiro A., Loureiro C.M. Neuroimmune interactions in schizophrenia: focus on vagus nerve stimulation and activation of the alpha-7 nicotinic acetylcholine receptor. Front Immunol 2017; 8: 618, https://doi.org/10.3389/fimmu.2017.00618.
- Kennedy J.L., Altar C.A., Taylor D.L., Degtiar I., Hornberger J.C. The social and economic burden of treatment-resistant schizophrenia: a systematic literature review. Int Clin Psychopharmacol 2014; 29(2): 63–76, https://doi.org/10.1097/yic.0b013e32836508e6.
- Miller B.J., Goldsmith D.R. Towards an immunophenotype of schizophrenia: progress, potential mechanisms, and future directions. Neuropsychopharmacology 2017; 42(1): 299–317, https://doi.org/10.1038/npp.2016.211.
- Малашенкова И.К., Крынский С.А., Огурцов Д.П., Мамошина М.В., Захарова Н.В., Ушаков В.Л., Величковский Б.М., Дидковский Н.А. Роль иммунной системы в патогенезе шизофрении. Журнал неврологии и психиатрии им. С.С. Корсакова 2018; 118(12): 72–80, https://doi.org/10.17116/jnevro201811812172.
- Noto C., Maes M., Ota V.K., Teixeira A.L., Bressan R.A., Gadelha A., Brietzke E. High predictive value of immune-inflammatory biomarkers for schizophrenia diagnosis and association with treatment resistance. World J Biol Psychiatry 2015; 16(6): 422–429, https://doi.org/10.3109/15622975.2015.1062552.
- Kroken R.A., Sommer I.E., Steen V.M., Dieset I., Johnsen E. Constructing the immune signature of schizophrenia for clinical use and research; an integrative review translating descriptives into diagnostics. Front Psychiatry 2019; 9: 753, https://doi.org/10.3389/fpsyt.2018.00753.
- Dantzer R. Neuroimmune interactions: from the brain to the immune system and vice versa. Physiol Rev 2018; 98(1): 477–504, https://doi.org/10.1152/physrev.00039.2016.
- Malashenkova I.K., Krynskiy S.A., Khailov N.A., Kazanova G.V., Velichkovsky B.B., Didkovsky N.A. The role of cytokines in memory consolidation. Biol Bull Rev 2016; 6(2): 126–140, https://doi.org/10.1134/s2079086416020055.
- Bennett F.C., Molofsky A.V. The immune system and psychiatric disease: a basic science perspective. Clin Exp Immunol 2019; 197(3): 294–307, https://doi.org/10.1111/cei.13334.
- Ushakov V.L., Sharaev M.G., Malashenkova I.K., Krynskiy S.A., Kartashov S.I., Orlov V.A., Malakhov D.G., Hailov N.A., Ogurtsov D.P., Zakharova N.V., Didkovsky N.A., Maslennikova A.V., Arkhipov A.Yu., Strelets V.B., Arsalidou M., Velichkovsky B.M., Kostyuk G.P. Basic cognitive architectures and neuroimmune serum biomarkers in schizophrenia. Procedia Comput Sci 2018; 145: 596–603, https://doi.org/10.1016/j.procs.2018.11.097.
- Neugebauer K., Hammans C., Wensing T., Kumar V., Grodd W., Mevissen L., Sternkopf M.A., Novakovic A., Abel T., Habel U., Nickl-Jockschat T. Nerve growth factor serum levels are associated with regional gray matter volume differences in schizophrenia patients. Front Psychiatry 2019; 10: 275, https://doi.org/10.3389/fpsyt.2019.00275.
- Szkultecka-Dębek M., Walczak J., Augustyńska J., Miernik K., Stelmachowski J., Pieniążek I., Obrzut G., Pogroszewska A., Paulić G., Damir M., Antolić S., Tavčar R., Indrikson A., Aadamsoo K., Jankovic S., Pulay A.J., Rimay J., Varga M., Sulkova I., Veržun P. Epidemiology and treatment guidelines of negative symptoms in schizo-phrenia in Central and Eastern Europe: a literature review. Clin Pract Epidemiol Ment Health 2015; 11: 158–165, https://doi.org/10.2174/1745017901511010158.
- Correll C.U., Schooler N.R. Negative symptoms in schizophrenia: a review and clinical guide for recognition, assessment, and treatment. Neuropsychiatr Dis Treat 2020; 16: 519–534, https://doi.org/10.2147/ndt.s225643.
- Goldsmith D.R., Rapaport M.H. Inflammation and negative symptoms of schizophrenia: implications for reward processing and motivational deficits. Front Psychiatry 2020; 11: 46, https://doi.org/10.3389/fpsyt.2020.00046.
- Kraguljac N.V., Lahti A.C. Neuroimaging as a window into the pathophysiological mechanisms of schizophrenia. Front Psychiatry 2021; 12: 613764, https://doi.org/10.3389/fpsyt.2021.613764.
- Mubarik A., Tohid H. Frontal lobe alterations in schizophrenia: a review. Trends Psychiatry Psychother 2016; 38(4): 198–206, https://doi.org/10.1590/2237-6089-2015-0088.
- Birur B., Kraguljac N.V., Shelton R.C., Lahti A.C. Brain structure, function, and neurochemistry in schizophrenia and bipolar disorder — a systematic review of the magnetic resonance neuroimaging literature. NPJ Schizophr 2017; 3: 15, https://doi.org/10.1038/s41537-017-0013-9.
- Ewald D.R., Sumner S.C.J. Human microbiota, blood group antigens, and disease. Wiley Interdiscip Rev Syst Biol Med 2018; 10(3): e1413, https://doi.org/10.1002/wsbm.1413.
- Just D., Månberg A., Mitsios N., Stockmeier C.A., Rajkowska G., Uhlén M., Mulder J., Feuk L., Cunningham J.L., Nilsson P., Carlström E.L. Exploring autoantibody signatures in brain tissue from patients with severe mental illness. Transl Psychiatry 2020; 10(1): 401, https://doi.org/10.1038/s41398-020-01079-8.
- Almeida P.G.C., Nani J.V., Oses J.P., Brietzke E., Hayashi M.A.F. Neuroinflammation and glial cell activation in mental disorders. Brain Behav Immun Health 2020; 2: 100034, https://doi.org/10.1016/j.bbih.2019.100034.
- Laskaris L.E., Di Biase M.A., Everall I., Chana G., Christopoulos A., Skafidas E., Cropley V.L., Pantelis C. Microglial activation and progressive brain changes in schizophrenia. Br J Pharmacol 2016; 173(4): 666–680, https://doi.org/10.1111/bph.13364.
- Duarte L.F., Farías M.A., Álvarez D.M., Bueno S.M., Riedel C.A., González P.A. Herpes simplex virus type 1 infection of the central nervous system: insights into proposed interrelationships with neurodegenerative disorders. Front Cell Neurosci 2019; 13: 46, https://doi.org/10.3389/fncel.2019.00046.
- Fu G., Zhang W., Dai J., Liu J., Li F., Wu D., Xiao Y., Shah C., Sweeney J.A., Wu M., Lui S. Increased peripheral interleukin 10 relate to white matter integrity in schizophrenia. Front Neurosci 2019; 13: 52, https://doi.org/10.3389/fnins.2019.00052.
- Bedrossian N., Haidar M., Fares J., Kobeissy F.H., Fares Y. Inflammation and elevation of interleukin-12p40 in patients with schizophrenia. Front Mol Neurosci 2016; 9: 16, https://doi.org/10.3389/fnmol.2016.00016.
- Mondal S., Kundu M., Jana M., Roy A., Rangasamy S.B., Modi K.K., Wallace J., Albalawi Y.A., Balabanov R., Pahan K. IL-12 p40 monomer is different from other IL-12 family members to selectively inhibit IL-12Rβ1 internalization and suppress EAE. Proc Natl Acad Sci U S A 2020; 117(35): 21557–21567, https://doi.org/10.1073/pnas.2000653117.
- Oliveira S.L., Pillat M.M., Cheffer A., Lameu C., Schwindt T.T., Ulrich H. Functions of neurotrophins and growth factors in neurogenesis and brain repair. Cytometry A 2013; 83(1): 76–89, https://doi.org/10.1002/cyto.a.22161.
- Skaper S.D. Nerve growth factor: a neuroimmune crosstalk mediator for all seasons. Immunology 2017; 151(1): 1–15, https://doi.org/10.1111/imm.12717.
- Eu W.Z., Chen Y.J., Chen W.T., Wu K.Y., Tsai C.Y., Cheng S.J., Carter R.N., Huang G.J. The effect of nerve growth factor on supporting spatial memory depends upon hippocampal cholinergic innervation. Transl Psychiatry 2021; 11(1): 162, https://doi.org/10.1038/s41398-021-01280-3.
- Kale A., Joshi S., Pillai A., Naphade N., Raju M., Nasrallah H., Mahadik S.P. Reduced cerebrospinal fluid and plasma nerve growth factor in drug-naïve psychotic patients. Schizophr Res 2009; 115(2–3): 209–214, https://doi.org/10.1016/j.schres.2009.07.022.
- Zhuo C., Ma X., Qu H., Wang L., Jia F., Wang C. Schizophrenia patients demonstrate both inter-voxel level and intra-voxel level white matter alterations. PLoS One 2016; 11(9): e0162656, https://doi.org/10.1371/journal.pone.0162656.
- Xiong P., Zeng Y., Zhu Z., Tan D., Xu F., Lu J., Wan J., Ma M. Reduced NGF serum levels and abnormal P300 event-related potential in first episode schizophrenia. Schizophr Res 2010; 119(1–3): 34–39, https://doi.org/10.1016/j.schres.2010.02.1063.
- Ajami A., Hosseini S.H., Taghipour M., Khalilian A. Changes in serum levels of brain derived neurotrophic factor and nerve growth factor-beta in schizophrenic patients before and after treatment. Scand J Immunol 2014; 80(1): 36–42, https://doi.org/10.1111/sji.12158.
- Qin X.Y., Wu H.T., Cao C., Loh Y.P., Cheng Y. A meta-analysis of peripheral blood nerve growth factor levels in patients with schizophrenia. Mol Psychiatry 2017; 22(9): 1306–1312, https://doi.org/10.1038/mp.2016.235.
- Berry A., Bindocci E., Alleva E. NGF, brain and behavioral plasticity. Neural Plast 2012; 2012: 784040, https://doi.org/10.1155/2012/784040.
- Mubarik A., Tohid H. Frontal lobe alterations in schizophrenia: a review. Trends Psychiatry Psychother 2016; 38(4): 198–206, https://doi.org/10.1590/2237-6089-2015-0088.
- Li M., Li X., Das T.K., Deng W., Li Y., Zhao L., Ma X., Wang Y., Yu H., Meng Y., Wang Q., Palaniyappan L., Li T. Prognostic utility of multivariate morphometry in schizophrenia. Front Psychiatry 2019; 10: 245, https://doi.org/10.3389/fpsyt.2019.00245.
- Zhang T., Koutsouleris N., Meisenzahl E., Davatzikos C. Heterogeneity of structural brain changes in subtypes of schizophrenia revealed using magnetic resonance imaging pattern analysis. Schizophr Bull 2015; 41(1): 74–84, https://doi.org/10.1093/schbul/sbu136.
- Chee T.T., Chua L., Morrin H., Lim M.F., Fam J., Ho R. Neuroanatomy of patients with deficit schizophrenia: an exploratory quantitative meta-analysis of structural neuroimaging studies. Int J Environ Res Public Health 2020; 17(17): 6227, https://doi.org/10.3390/ijerph17176227.
- Kaladjian A., Belzeaux R., Adida M., Azorin J.M. Negative symptoms and cerebral imaging. Encephale 2015; 41(6 Suppl 1): 6S22–6S26, https://doi.org/10.1016/s0013-7006(16)30006-9.
- Khandaker G.M., Dantzer R. Is there a role for immune-to-brain communication in schizophrenia? Psychopharmacology (Berl) 2016; 233(9): 1559–1573, https://doi.org/10.1007/s00213-015-3975-1.