Комплекс методик на основе пиросеквенирования для определения соматических мутаций в кодонах 600 и 601 гена BRAF
Цель исследования — разработка методик для дифференцировки мутаций в кодоне 600 гена BRAF и повышения чувствительности определения мутации К601Е.
Материалы и методы. Нуклеотидную последовательность кодонов 592–602 гена BRAF определяли с помощью системы генетического анализа PyroMark Q24. Для поиска мутаций в кодоне 600 использовали праймер 600-S с порядком добавления нуклеотидов GCTGTCАTCTGCTAGCTAGAC (соответствует нуклеотидам 1799–1786). Для определения мутации K601E применяли праймер 601-S с порядком добавления нуклеотидов GCTACTCACTGTAG (соответствует нуклеотидам 1801–1793). Аналитические характеристики предлагаемых методик для выявления соматических мутаций определяли на разведениях образцов плазмидной ДНК, включающих участок гена BRAF без мутаций или с одной из мутаций: V600E, V600R, V600K, V600M, K601Е. Апробацию проводили на 132 образцах биологического материала, полученных из узловых образований щитовидной железы.
Результаты. С помощью разработанных методик в образцах с высокой концентрацией ДНК можно определять 2% мутации V600E или V600M, 1% — V600K и V600R, 3% — K601E; в образцах с низкой концентрацией (менее 500 копий/ПЦР) — уверенно выявлять от 5% мутантного аллеля для всех мутаций. При тестировании биологического материала обнаружено 53 образца с мутацией V600E, доля мутантного аллеля составляла 4,9–50,0%.
Заключение. Разработаны комплекс методик для определения нуклеотидной последовательности кодонов 592–601 гена BRAF и алгоритм тестирования образцов и анализа мутаций в кодонах 600–601 гена BRAF. Методика обеспечивает достаточную чувствительность для выявления частых мутаций в кодонах 600 и 601 и позволяет однозначно их дифференцировать.
Введение
Ген BRAF (v-Raf murine sarcoma viral oncogene homolog B) кодирует серин-треониновую протеинкиназу, входящую в сигнальный путь MAPK/ERK, конститутивная активация которого приводит к онкогенной трансформации клеток. Активирующие соматические мутации в гене BRAF выявляют в 6–8% случаев солидных опухолей [1, 2], в том числе при меланоме (в 44% опухолей), раке щитовидной железы (от 1,7 до 90,0% в зависимости от гистологического типа), аденокарциноме толстого кишечника (10%), аденокарциноме легкого (1,5–8,0%) [1, 3, 4].
Доля самой частой мутации c.1799 T>A p.V600E в гене BRAF сильно варьирует — от менее 10% при раке мочевого пузыря до более 90% при раке щитовидной железы [3, 4]. Для ряда нозологий показано, что опухоли с разными мутациями BRAF отличаются по клиническим характеристикам и течению, ответу на терапию и прогнозу [1, 2, 4].
Наличие мутаций в гене BRAF является предиктивным маркером ответа на терапию таргетными препаратами, направленными на сигнальный путь MAPK/ERK [1, 2, 5, 6]. При этом для опухолей с мутациями не-V600E и особенно не-V600 эффективность ингибиторов BRAF ниже [2, 7].
Опухоли с мутациями в гене BRAF часто демонстрируют более агрессивное течение, что было показанопри меланоме и раке щитовидной железы. При раке толстого кишечника наличие мутации V600E ассоциировано с меньшей общей выживаемостью и выживаемостью до прогрессирования по сравнению с опухолями без мутаций, в то время как для опухолей с мутациями не-V600E медиана общей выживаемости выше, чем при мутации V600E [1, 6]. Данные по прогностической значимости мутаций BRAF при раке легкого противоречивы. Это может быть связано с большой долей и разнообразием мутаций, отличных от V600E, которые учитываются не во всех исследованиях [1, 7].
При опухолях щитовидной железы мутация V600E характерна для папиллярного рака, а K601E — для фолликулярных новообразований [8], что позволяет использовать их выявление для уточнения диагноза при таких цитологических заключениях, как «атипия неясного значения» и «фолликулярная опухоль/подозрение на фолликулярную опухоль» (категории III и IV классификации Bethesda, 2017 г. [9]) при узловых образованиях щитовидной железы, а также для выбора тактики лечения [8, 10, 11]. Наличие мутации V600E, особенно в сочетании с мутациями в промоторе гена TERT, ассоциировано с экстратироидным распространением опухоли, более агрессивным фенотипом и высоким риском рецидива [1, 8, 10, 11].
В связи с этим при поиске мутаций в гене BRAF целесообразно использовать методы, позволяющие выявлять и дифференцировать клинически значимые мутации в присутствии интактной ДНК. В настоящее время с этой целью применяются методики, основанные на ПЦР в режиме реального времени и иммуногистохимии, которые отличаются высокой чувствительностью и относительно низкой стоимостью. Однако они позволяют определять только ограниченный спектр мутаций и не всегда специфичны к типу мутации. Методики, основанные на секвенировании, способны детектировать и дифференцировать как уже известные, так и новые мутации [12–14]. Пиросеквенирование превосходит метод секвенирования по Сэнгеру по чувствительности при детекции минорной фракции ДНК (около 15–20% — для секвенирования по Сэнгеру и 1–5% — для пиросеквенирования) [12–16]. По сравнению с высокопроизводительным секвенированием пиросеквенирование требует меньшего времени на проведение анализа и меньших затрат на реагенты [12–14]. Подбор оптимальных параметров анализа при пиросеквенировании позволяет получить высокие значения чувствительности и специфичности при детекции различных мутаций, а также измерять количественно долю мутантного аллеля [15–18].
Ранее в Центральном научно-исследовательском институте эпидемиологии Роспотребнадзора была разработана методика для определения нуклеотидной последовательности кодонов 592–602 BRAF и выявления всех клинически значимых мутаций в этом участке. Предел детекции составил 2% для V600R и V600K, 3% — для V600E и V600M, 10% — для K601E. Однако при доле мутации менее 7–10% было сложно точно определить тип мутации в кодоне 600 [16].
Цель данного исследования — разработка методик для дифференцировки мутаций в кодоне 600 гена BRAF и повышения чувствительности определения мутации K601E.
Материалы и методы
Методики пиросеквенирования. Для выявления мутаций и их количественного анализа определяли нуклеотидную последовательность методом пиросеквенирования на приборе PyroMark Q24 (QIAGEN, Германия) [16, 17] с праймерами для амплификации 5’biotin-gCT-TgC-TCT-gAT-Agg-AAA-ATg-AgA-TC3’ и 5’CCA-CAA-AAT-ggA-TCC-AgA-CAA-CT3’ (длина фрагмента — 172 пары оснований) и с праймерами для секвенирования BR-S 5’gAC-CCA-CTC-CAT-CgA3’, 600-S 5’CCC-ACT-CCA-TCg-AgA-TTT-C3’ и 601-S 5’gAC-CCA-CTC-CAT-CgA-gAT-T3’. Секвенирование проводили в обратном направлении. Для анализа результатов применяли программное обеспечение к прибору версии 2.0.6.
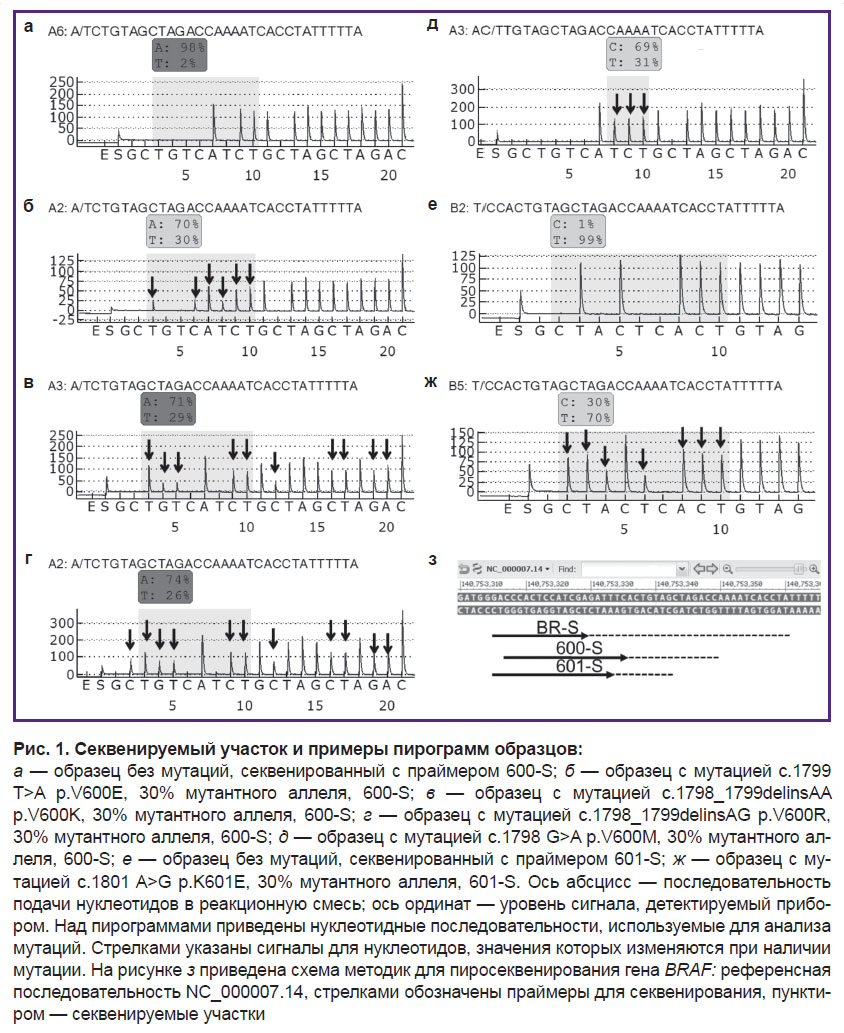
Амплификацию, пробоподготовку и пиросеквенирование выполняли согласно описанной ранее методике с использованием реагентов производства Центрального научно-исследовательского института эпидемиологии Роспотребнадзора (Россия) — «АмплиСенс» — и QIAGEN (Германия) [18, 19]. Секвенирование для определения нуклеотидной последовательности кодонов 592–602, соответствующих нуклеотидам 1805–1775 (140753330-140753361 по референсной последовательности NC_000007.14), проводили с праймером BR-S согласно [16]. Для поиска мутаций в кодоне 600 использовали праймер 600-S с порядком добавления нуклеотидов GCTGTCАTCTGCTAGCTAGAC (соответствует нуклеотидам 1799–1786). Для определения мутации K601E применяли праймер 601-S с порядком добавления нуклеотидов GCTACTCACTGTAG (соответствует нуклеотидам 1801–1793) (рис. 1).
Тип и долю мутантного аллеля устанавливали с помощью функции AQ Analyze программного обеспечения к прибору. Для мутаций V600K и V600R, нуклеотидная последовательность которых не позволяет использовать автоматический анализ, долю мутантного аллеля рассчитывали по высотам сигналов на пирограмме по формулам:
V600K=(1/3·G3+G4+T5+C12)/4;
V600R=(С2+1/2·G3+G4+T5+C12)/5,
где С2, G3, G4, T5, C12 — отношение высот соответствующих сигналов на пирограмме (см. рис. 1) к среднему уровню сигнала.
Аналитические характеристики методик. Для оценки аналитических характеристик определяли параметры limit of blank — LOB (наибольший сигнал, который ожидается при измерениях образца, не содержащего тестируемого материала) и limit of detection — LOD (наименьшая концентрация тестируемого материала, которая может быть достоверно дифференцирована от значения LOB) [20]:
LOB=M+1,645σ,
где M и σ — среднее и стандартное отклонение значений сигнала в выборке образцов без мутаций соответственно;
LOD=LOB+1,645σ,
где σ — стандартное отклонение значений сигнала в выборке образцов с мутацией.
Аналитические характеристики разработанных методик определяли на разведениях образцов плазмидной ДНК, включающих участок гена BRAF, клонированный в вектор pGem-T, без мутаций или с одной из следующих мутаций: c.1799 T>A p.V600E; c.1798_1799delinsAG p.V600R; c.1798_1799delinsAA p.V600K; c.1798 G>A p.V600M; c.1801 A>G p.K601Е. Мутагенез проводили с помощью набора QuikChange II Site-Directed Mutagenesis Kit (Agilent Technologies, США). Концентрацию клонов измеряли методом ПЦР в режиме реального времени с праймерами к последовательности вектора. Для каждой мутации анализировали смеси, содержащие 1, 2, 3, 5, 10 и 30% мутантного аллеля. Смеси с 1–5% мутантного аллеля тестировали как минимум в трех повторах, 10 и 30% — в двух повторах для двух концентраций ДНК (100 и 10 000 копий/ПЦР) на двух приборах. В качестве контроля в каждой постановке использовали клонированный фрагмент последовательности гена BRAF без мутаций в той же концентрации.
Биологические образцы. Апробация методик проведена на 132 образцах узловых образований щитовидной железы от 127 пациентов. Из них путем тонкоигольной аспирационной биопсии (ТАБ) получен 131 образец (смывы с иглы после ТАБ в ТЕ-буфере — 43; собранные стерильным скальпелем клеточные материалы ТАБ, нанесенные на стекло традиционным цитологическим методом и окрашенные по Романовскому, — 85; образцы ТАБ, помещенные в жидкую консервирующую среду BD SurePath Collection Vial (Becton Dickinson, США), — 3), 1 — из срезов парафиновых блоков. У четырех пациентов кроме пунктатов образований щитовидной железы были получены образцы ТАБ из лимфатических узлов, у одного — одновременно из узловых образований обеих долей щитовидной железы. 57 пациентов на момент завершения тестирования имели установленный гистологический диагноз. ДНК выделяли наборами «РИБО-преп» (Центральный научно-исследовательский институт эпидемиологии Роспотребнадзора) и QIAamp DNA FFPE Tissue Kit (QIAGEN). Концентрацию выделенной ДНК определяли методом ПЦР в режиме реального времени с праймерами к гену β-глобина. Образцы с низкой концентрацией (<500 копий/мкл) тестировали в нескольких повторах. Все образцы тестировали с праймером BR-S для поиска мутаций на всем участке. Образцы, в которых не было выявлено мутаций, секвенировали с праймером 601-S для поиска мутации K601Е. Образцы, в которых была определена мутация в кодоне 600 с долей мутантного аллеля менее 15%, секвенировали с праймером 600-S. Часть образцов была секвенирована с тремя праймерами для сравнения получаемых результатов. В каждой постановке вместе с биологическими образцами анализировали контрольный образец ДНК человека, полученный из клеток периферической крови и не содержащий мутаций.
Статистическая обработка данных. Предобработка данных, формирование и анализ таблиц, расчет основных аналитических показателей (LOB, LOD) и построение графиков проводили в Microsoft Excel. Для статистической обработки — анализа распределения, характеристики групп и межгрупповых различий, расчетов статистических показателей — использовали встроенные функции и дополнительные пакеты среды R (https://www.R-project.org/). Оценку категориальных данных проводили с помощью таблиц сопряженности, критерия ÷2 Пирсона и точного теста Фишера. Для анализа количественных показателей, характеризующихся распределением, отличным от нормального (определялось с помощью теста Шапиро–Уилка и построением графика квантиль-квантиль (Q-Q)), выбросами и малым объемом выборки, применяли непараметрические критерии: критерий Манна–Уитни, критерий Данна, парный критерий Вилкоксона (для анализа повторных наблюдений). Для коррекции множественных сравнений использовали поправку Бонферрони. Результаты тестов принимали за статистически значимые при значениях вероятности ошибки первого рода р<0,05.
Результаты
Аналитические характеристики методик. Определение LOB проводили на разведениях клонированного фрагмента последовательности гена BRAF без мутаций в количестве 100 и 10 000 копий/ПЦР (45 повторов с праймером 600-S для мутаций V600E, V600K, V600M и V600R; 63 повтора с праймером 601-S для мутации K601E) и на образцах геномной ДНК человека (18 и 29 повторов соответственно), выделенной из клеток периферической крови, в количестве около 4000 копий/ПЦР.
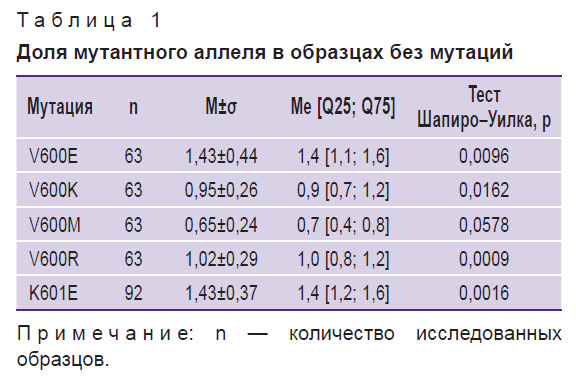
Характеристики мутационной нагрузки, полученные при анализе образцов без мутаций, представлены в табл. 1. Для мутаций V600E, V600K, V600R и K601E наблюдается отклонение от нормального распределения (по результатам теста Шапиро–Уилка и построения графика квантиль-квантиль), но в целом данные характеризуются наличием единичных выбросов, а средние значения измеренной доли мутантного аллеля совпадают с медианами.
|
Таблица 1. Доля мутантного аллеля в образцах без мутаций |
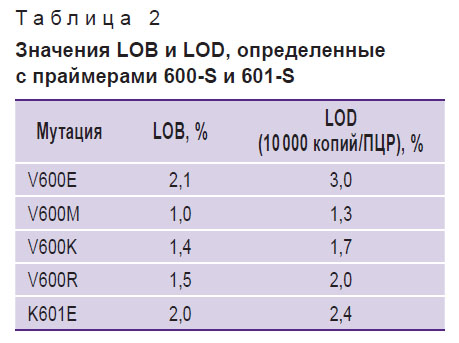
Уровень LOB для мутаций, рассчитанный на основе полученных данных, составил от 1,0 до 2,1% (табл. 2).
|
Таблица 2. Значения LOB и LOD, определенные с праймерами 600-S и 601-S |
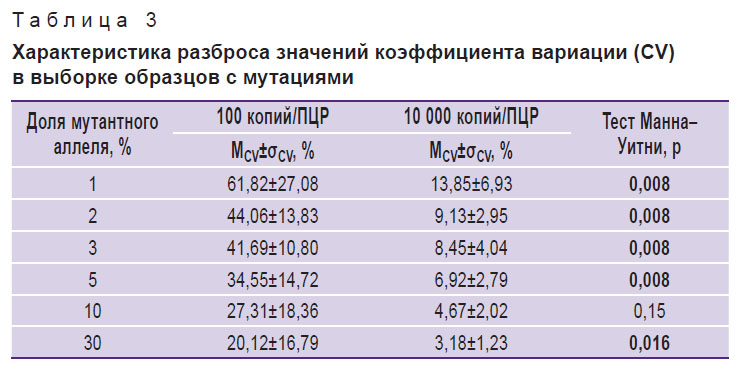
Значения LOD определяли с помощью панели разведений клонированных контролей с праймером 600-S для мутаций V600E, V600K, V600M и V600R, с праймером 601-S — для мутации K601E. Выявленные доли мутантного аллеля в группе образцов с разведением 100 копий/ПЦР имели высокий коэффициент вариации (CV) (табл. 3): при доле мутации 1–5% средний CV (MCV) составил 45,53±19,25, при доле мутации 30% — 20,12±16,79. При разведении 10 000 копий/ПЦР для образцов с долей мутантного аллеля 1–5% MCV составил 9,60±4,91, а при доле мутации 30% — 3,18±1,23. Сравнение средних CV между группами с разным разведением является статистически значимым для большинства значений доли мутантного аллеля.
|
Таблица 3. Характеристика разброса значений коэффициента вариации (CV) в выборке образцов с мутациями |
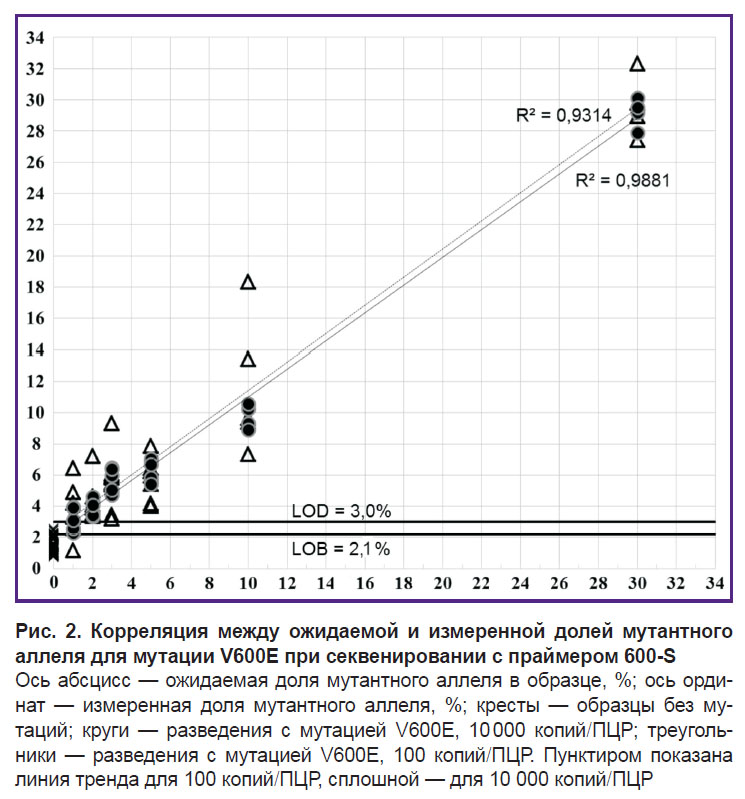
Таким образом, большой разброс значений измеренной доли мутантного аллеля (рис. 2) в образцах с концентрацией 100 копий/ПЦР может снижать надежность выявления мутаций. Исходя из полученных данных рассчитаны значения предела детекции (LOD) для образцов с концентрацией 10 000 (см. табл. 2) и 100 копий/ПЦР (данные не приводятся).
Тестирование биологического материала. Концентрация ДНК, выделенной из 132 биологических образцов, составила от 1,2 до 1128,0 копий/мкл. При тестировании обнаружено 53 образца с мутацией V600E, полученных от 51 пациента. Доля мутантного аллеля составляла 4,9–50,0%. В 8 образцах при анализе с праймером BR-S выявлена доля мутантного аллеля менее 10%, что не позволяло однозначно определить тип мутации в кодоне 600. Еще в 1 образце не удалось достоверно установить присутствие мутации в кодоне 600. Анализ этих образцов с праймером 600-S позволил подтвердить наличие мутации V600E во всех образцах. 77 из 132 образцов протестированы тремя методиками (BR-S, 600-S и 601-S), 41 — с праймерами BR-S и 601-S, 14 — с BR-S и 600-S. Дискордантных результатов получено не было.
Проведено также исследование парных образцов ТАБ узла щитовидной железы и сторожевого лимфатического узла, полученных от четырех пациентов. В одном случае в обоих образцах обнаружена мутация V600Е; гистологически установлен классический вариант папиллярного рака щитовидной железы с метастазами в 22 лимфатических узлах из 63. Во второй паре в обоих образцах также была выявлена мутация V600Е при цитологическом диагнозе анапластического рака. В третьем случае мутация была обнаружена только в образце ТАБ щитовидной железы, гистологически был установлен инкапсулированный фолликулярный вариант папиллярного рака щитовидной железы, с врастанием в капсулу железы без распространения за ее пределы, без метастазов в лимфатические узлы. В четвертой паре образцов мутации не наблюдалось, гистологически определена фолликулярная аденома. Для еще одного пациента с узловыми образованиями обеих долей щитовидной железы мутация V600Е была выявлена только в образце ТАБ левой доли; гистологически для левой доли диагностирован папиллярный рак щитовидной железы с мультицентрическим ростом; для правой доли — фолликулярная аденома щитовидной железы.
Обсуждение
Аналитические характеристики методик. В случае мутации V600E при тестировании с праймером 600-S проб с концентрацией 10 000 копий/ПЦР, содержащих 2% мутантного аллеля, все измерения находились в диапазоне 3,4–4,6% (3,9±0,5); при тестировании проб с концентрацией 100 копий/ПЦР, содержащих 5% мутантного аллеля, все измерения попали в диапазон 4,0–7,9% (5,80±1,26), что позволяет достоверно отличать их от образцов, не содержащих мутаций (см. рис. 2). Для мутаций V600K и V600R можно определять образцы с высокой концентрацией, содержащие 1% мутантного аллеля, для V600M — 2%. В образцах с низкой концентрацией можно уверенно выявлять от 5% мутантного аллеля для всех мутаций.
Для мутации K601E при тестировании проб с концентрацией 10 000 копий/ПЦР применение праймера 601-S позволяет определять образцы, содержащие 3% мутантного аллеля. Порядок добавления нуклеотидов, использованный для секвенирования с праймером 601-S, дает возможность выявлять мутации кодона 600, но с меньшей чувствительностью: например, для V600E значение LOD составило 3,4% для 10 000 копий/ПЦР.
Значения LOD при использовании концентрации 10 000 копий/ПЦР были меньше, чем для 100 копий/ПЦР. Для образцов с низкой концентрацией ДНК характерен высокий разброс значений измеренной доли мутантного аллеля, из-за чего не всегда возможно достоверно определять наличие мутации, что совпадает с ранее полученными данными [16]. В связи с этим при тестировании биологических образцов желательно использовать высокую концентрацию ДНК либо для повышения надежности анализа проводить тестирование в нескольких повторах в зависимости от концентрации ДНК.
Результаты исследования демонстрируют возможность применения пиросеквенирования для определения соматических мутаций на фоне значительного избытка интактной ДНК. Новые разработанные методики позволяют повысить чувствительность определения мутаций по сравнению с первым вариантом методики [16] для мутации K601E с 10% до 3–5%.
Дифференцировка мутаций в кодоне 600. Порядок добавления нуклеотидов для проведения секвенирования с праймером 600-S был подобран так, чтобы обеспечить возможность определения нуклеотидных замен в кодоне 600. Каждой анализируемой мутации соответствовал уникальный паттерн изменения уровня сигнала для нуклеотидов на пирограмме (см. рис. 1). Это позволяет однозначным образом идентифицировать мутации кодона 600 даже при низкой (менее 10%) доле мутантного аллеля.
Удобным способом для дифференцировки мутации в кодоне 600 является определение отношения величин сигналов, специфичных для разных мутаций. Для мутации V600E на пирограмме сигнал увеличивается в положениях Т3, С6 и T8, а уровень C2, G4, Т5 и C12 не превышает колебаний уровня фона в образцах без мутаций. При мутации V600R сигнал увеличивается в положениях C2, T3, G4, Т5 и C12; при V600K — в положениях T3, G4, Т5 и C124; при V600M сигнал увеличивается только для Т8 (см. рис. 1). Таким образом, для однозначного определения мутаций достаточно использовать сочетания сигналов в трех положениях — С2, Т3 и Т8 (табл. 4).

|
Таблица 4. Определение мутаций по сочетаниям сигналов С2, Т3 и Т8 |
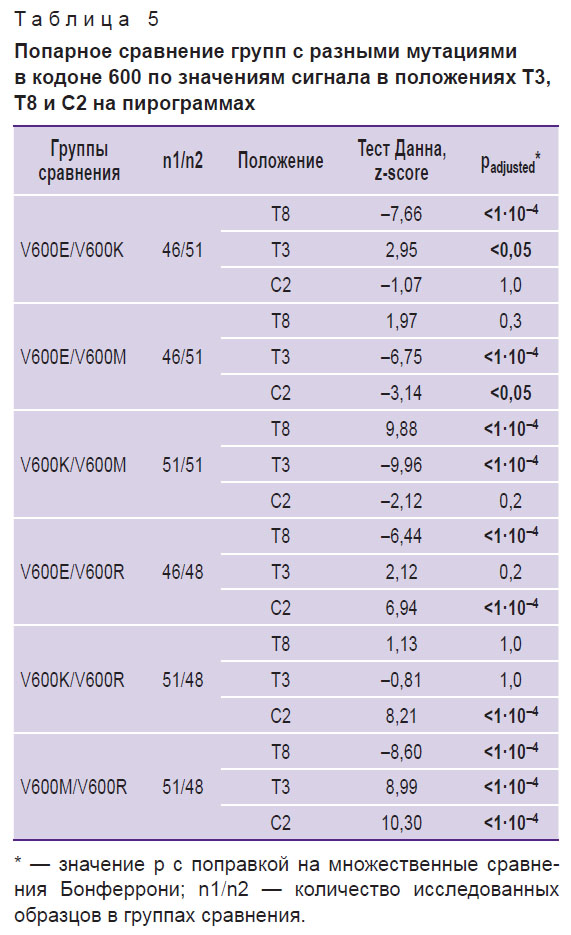
Установлены статистически значимые различия между выборками образцов с мутациями в кодоне 600 по уровню сигнала (тест Краскела–Уоллиса, p<0,0001). Результаты последующего post-hoc анализа попарных различий представлены в табл. 5. Каждая пара мутаций статистически значимо различается минимум по одному показателю, что подтверждает возможность дифференциации мутаций в кодоне 600 с помощью анализа сигнала в трех положениях пирограммы.
|
Таблица 5. Попарное сравнение групп с разными мутациями в кодоне 600 по значениям сигнала в положениях T3, T8 и С2 на пирограммах |
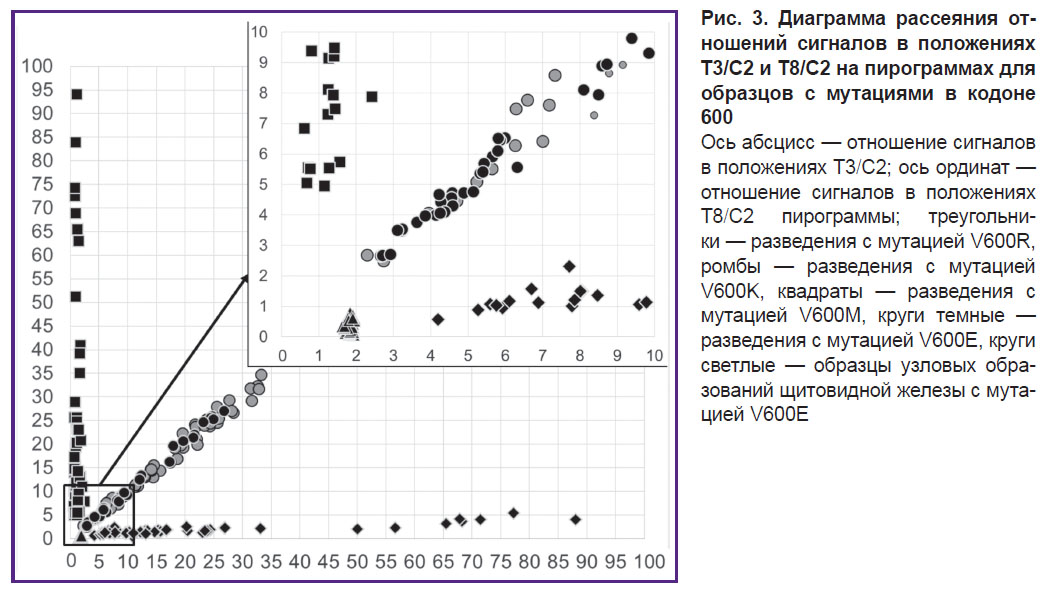
Поскольку три независимые переменные формируют трехмерное пространство, то для удобства графического представления размерность была снижена путем преобразования трех переменных в два отношения — Т3/С2 и Т8/С2. Образцы с мутациями в кодоне 600 по отношениям сигналов Т3/С2 и Т8/С2 кластеризуются в четыре непересекающиеся группы. Это позволяет по отношению высот T3/С2 и Т8/С2 дифференцировать мутации V600E, V600K, V600R и V600M для образцов, содержащих долю мутантного аллеля выше LOD для соответствующих мутаций (рис. 3).
Апробация разработанного комплекса методик на образцах биологического материала показала его эффективность для выявления и определения типов мутации в гене BRAF даже в образцах с низкой (менее 500 копий/ПЦР) концентрацией ДНК и низкой (менее 10%) долей мутантного аллеля. Установлена высокая корреляция между долями мутантного аллеля, полученными разными методиками: значение коэффициента корреляции Пирсона составило 0,99 (95% ДИ 0,98–0,99; p<0,001) для 600-S и 601-S; 0,96 (95% ДИ 0,92–0,98; p<0,001) для BR-S и 601-S; 0,96 (95% ДИ 0,93–0,98; p<0,001) для BR-S и 600-S. Использование дополнительного праймера для секвенирования (600-S) позволило точно определить наличие мутации V600E в 9 образцах с долей мутации менее 10%.
Таким образом, предлагаемый нами комплекс методик для поиска мутаций в кодонах 592–602 гена BRAF, диффренцировки мутаций в кодоне 600 и определения мутации K601E, а также алгоритм интерпретации результатов пиросеквенирования позволяют расширить спектр выявляемых мутаций и повысить чувствительность и специфичность по сравнению с ранее предложенными методиками [12–14, 16, 21].
Тестирование биологического материала. На момент проведения анализа у 42 из 51 пациента с мутацией V600E выявлен папиллярный рак щитовидной железы (у 28 диагноз определен гистологически), у 6/51 — подозрение на папиллярный рак (Bethesda V), у 1/51 пациента — анапластический рак (Bethesda VI), также у 1/51 — атипия неясного значения (Bethesda III) и у 1/51 — диагноз не определен.
При изучении 128 образцов от 127 пациентов мутации были выявлены у 42 из 53 человек с диагнозом «папиллярный рак щитовидной железы» (у 38 диагноз определен гистологически); у 6/13 — с подозрением на рак (Bethesda V); у 1/10 — с атипией неясного значения (Bethesda III); у единственного пациента с анапластическим раком (Bethesda VI) и у 1/7 пациентов без установленного диагноза. У 6 пациентов с доброкачественными образованиями (5 — аденоматозный зоб, 1 — гистологически определен многоузловой зоб), единственного пациента с NIFTP и 37 — с фолликулярными опухолями (Bethesda IV, из них 17 определены гистологически) мутации обнаружены не были. Результаты определения мутаций в 4 парах образцов щитовидной железы и лимфатического узла для всех пациентов соответствовали гистологическим заключениям. Более высокая частота мутации V600E (у 42 из 53 пациентов, 79%) по сравнению с описанной в других исследованиях для папиллярного рака [1, 3, 4, 9, 11] связана с тем, что для апробации новых методик в исследование была включена группа образцов, для которых ранее с помощью первого варианта методики уже было определено наличие мутации V600E [16].
Заключение
Разработаны комплекс методик для определения нуклеотидной последовательности кодонов 592–601 гена BRAF и алгоритм тестирования образцов и анализа мутаций в кодонах 600–601 гена BRAF на основе технологии пиросеквенирования. Новые методики позволили однозначным образом дифференцировать все тестированные мутации при низкой доле мутантного аллеля и повысить чувствительность анализа до 1–5% мутантного аллеля по сравнению с анализом с одним праймером для секвенирования.
При тестировании биологических образцов выявлено 53 образца с мутацией V600E, доля мутантного аллеля составляла 4,9–50,0%. Результаты, полученные с разными праймерами, совпали для всех образцов. Использование дополнительных праймеров для секвенирования (600-S, 601-S) позволило определять тип обнаруженных мутаций при доле мутантного аллеля менее 10%.
Предложенный подход позволяет разработать аналогичные методики для определения редких мутаций в секвенируемом фрагменте и мутаций в других онкогенах (K-, H-, N-RAS).
Благодарности. Коллектив авторов благодарит зав. клинико-диагностической лабораторией Московского клинического научного центра им. А.С. Логинова К.К. Носкову за помощь в получении биологического материала.
Финансирование. Исследование не потребовало дополнительного финансирования.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Литература
- Pisapia P., Pepe F., Iaccarino A., Sgariglia R., Nacchio M., Russo G., Gragnano G., Malapelle U., Troncone G. BRAF: a two-faced Janus. Cells 2020; 9(12): 2549, https://doi.org/10.3390/cells9122549.
- Frisone D., Friedlaender A., Malapelle U., Banna G., Addeo A. A BRAF new world. Crit Rev Oncol Hematol 2020; 152: 103008, https://doi.org/10.1016/j.critrevonc.2020.103008.
- Tate J.G., Bamford S., Jubb H.C., Sondka Z., Beare D.M., Bindal N., Boutselakis H., Cole C.G., Creatore C., Dawson E., Fish P., Harsha B., Hathaway C., Jupe S.C., Kok C.Y., Noble K., Ponting L., Ramshaw C.C., Rye C.E., Speedy H.E., Stefancsik R., Thompson S.L., Wang S., Ward S., Campbell P.J., Forbes S.A. COSMIC: the catalogue of somatic mutations in cancer. Nucleic Acids Res 2019; 47(D1): D941–D947, https://doi.org/10.1093/nar/gky1015.
- Dankner M., Rose A.A.N., Rajkumar S., Siegel P.M., Watson I.R. Classifying BRAF alterations in cancer: new rational therapeutic strategies for actionable mutations. Oncogene 2018; 37(24): 3183–3199, https://doi.org/10.1038/s41388-018-0171-x.
- Zaman A., Wu W., Bivona T.G. Targeting oncogenic BRAF: past, present, and future. Cancers (Basel) 2019; 11(8): 1197, https://doi.org/10.3390/cancers11081197.
- Ducreux M., Chamseddine A., Laurent-Puig P., Smolenschi C., Hollebecque A., Dartigues P., Samallin E., Boige V., Malka D., Gelli M. Molecular targeted therapy of BRAF-mutant colorectal cancer. Ther Adv Med Oncol 2019; 11: 1758835919856494, https://doi.org/10.1177/1758835919856494.
- Bracht J.W.P., Karachaliou N., Bivona T., Lanman R.B., Faull I., Nagy R.J., Drozdowskyj A., Berenguer J., Fernandez-Bruno M., Molina-Vila M.A., Rosell R. BRAF mutations classes I, II, and III in NSCLC patients included in the SLLIP trial: the need for a new pre-clinical treatment rationale. Cancers (Basel) 2019; 11(9): 1381, https://doi.org/10.3390/cancers11091381.
- Patel K.N., Yip L., Lubitz C.C., Grubbs E.G., Miller B.S., Shen W., Angelos P., Chen H., Doherty G.M., Fahey T.J. III, Kebebew E., Livolsi V.A., Perrier N.D., Sipos J.A., Sosa J.A., Steward D., Tufano R.P., McHenry C.R., Carty S.E. The American Association of Endocrine Surgeons guidelines for the definitive surgical management of thyroid disease in adults. Ann Surg 2020; 271(3): e21–e93, https://doi.org/10.1097/sla.0000000000003580.
- Али С.З., Сибас Э.С. Классификация Бетесда для цитологической диагностики заболеваний щитовидной железы: терминология, критерии и пояснения. Пер. с англ. Шапиро Н.А. М: Практическая медицина; 2020; 240 с.
- Бельцевич Д.Г., Мудунов А.М., Ванушко В.Э., Румянцев П.О., Мельниченко Г.А., Кузнецов Н.С., Подвязников С.О., Алымов Ю.В., Поляков А.П., Фадеев В.В., Болотин М.В., Севрюков Ф.Е., Крылов В.В., Феденко А.А., Болотина Л.В., Жаров А.А., Фалалеева Н.А., Филоненко Е.В., Невольских А.А., Иванов С.А., Хайлова Ж.В., Геворкян Т.Г. Клинические рекомендации. Дифференцированный рак щитовидной железы. Министерство здравоохранения Российской Федерации; 2020; 47 c. URL: https://cr.minzdrav.gov.ru/schema/329_1.
- Haugen B.R., Alexander E.K., Bible K.C., Doherty G.M., Mandel S.J., Nikiforov Y.E., Pacini F., Randolph G.W., Sawka A.M., Schlumberger M., Schuff K.G., Sherman S.I., Sosa J.A., Steward D.L., Tuttle R.M., Wartofsky L. 2015 American Thyroid Association Management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer: the American Thyroid Association guidelines task force on thyroid nodules and differentiated thyroid cancer. Thyroid 2016; 26(1): 1–133, https://doi.org/10.1089/thy.2015.0020.
- Malapelle U., Rossi G., Pisapia P., Barberis M., Buttitta F., Castiglione F., Cecere F.L., Grimaldi A.M., Iaccarino A., Marchetti A., Massi D., Medicina D., Mele F., Minari R., Orlando E., Pagni F., Palmieri G., Righi L., Russo A., Tommasi S., Vermi W., Troncone G. BRAF as a positive predictive biomarker: focus on lung cancer and melanoma patients. Crit Rev Oncol Hematol 2020; 156: 103118, https://doi.org/10.1016/j.critrevonc.2020.103118.
- Cardus B., Colling R., Hamblin A., Soilleux E. Comparison of Methodologies for the detection of BRAF mutations in bone marrow trephine specimens. J Clin Pathol 2019; 72(6): 406–411, https://doi.org/10.1136/jclinpath-2019-205734.
- Cheng L., Lopez-Beltran A., Massari F., MacLennan G.T., Montironi R. Molecular testing for BRAF mutations to inform melanoma treatment decisions: a move toward precision medicine. Mod Pathol 2018; 31(1): 24–38, https://doi.org/10.1038/modpathol.2017.104.
- Дунаева Е.А., Миронов К.О., Дрибноходова О.П., Субботина Т.Н., Башмакова Е.Е., Ольховский И.А., Шипулин Г.А. Количественное определение мутации V617F в гене JAK2 методом пиросеквенирования. Клиническая лабораторная диагностика 2014; 59(11): 60–63.
- Дрибноходова О.П., Дунаева Е.А., Лешкина Г.В., Ярыгина Е.А., Бухарина А.Ю., Войцеховская Я.А., Борисова Э.В., Бормотова С.К., Дауд А.И., Хлявич В.Н., Миронов К.О. Выявление соматических мутаций в гене BRAF методом пиросеквенирования. Сибирский онкологический журнал 2021; 20(5): 75–83, https://doi.org/10.21294/1814-4861-2021-20-5-75-83.
- Миронов К.О., Дунаева Е.А., Дрибноходова О.П., Шипулин Г.А. Опыт использования систем генетического анализа на основе технологии пиросеквенирования. Справочник заведующего КДЛ 2016; 5: 33–43.
- Дрибноходова О.П., Миронов К.О., Дунаева Е.А., Демидова И.А., Баринов А.А., Войцеховская Я.А., Маркелов М.Л., Шипулин Г.А. Выявление активирующих соматических мутаций в гене KRAS методом пиросеквенирования. Клиническая лабораторная диагностика 2013; 6: 49–51.
- Дунаева Е.А., Миронов К.О., Субботина Т.Н., Ольховский И.А., Шипулин Г.А. Разработка и сравнительная апробация методик для повышения чувствительности определения мутации V617F в гене JAK2 методом пиросеквенирования. Клиническая лабораторная диагностика 2017; 62(2): 125–128.
- Armbruster D.A., Pry T. Limit of blank, limit of detection and limit of quantitation. Clin Biochem Rev 2008; 29(Suppl 1): S49–S52.
- Ihle M.A., Fassunke J., König K., Grünewald I., Schlaak M., Kreuzberg N., Tietze L., Schildhaus H.U., Büttner R., Merkelbach-Bruse S. Comparison of high resolution melting analysis, pyrosequencing, next generation sequencing and immunohistochemistry to conventional Sanger sequencing for the detection of p.V600E and non-p.V600E BRAF mutations. BMC Cancer 2014; 14: 13, https://doi.org/10.1186/1471-2407-14-13.