Новый взгляд на структурные изменения корня аорты при стенозе аортального клапана
Цель исследования — выявить новые анатомические ориентиры корня аорты и взаимосвязи между размерами анатомических структур с использованием метода компьютерно-томографической ангиографии для усовершенствования моделей клапанов сердца и методики их подбора в клинической практике.
Материалы и методы. Проанализированы данные компьютерно-томографической ангиографии 262 пациентов, выполненной перед протезированием аортального клапана. Средний возраст составил 75,0±5,9 года. Количество мужчин в исследовании — 99 (37,8±3,0%), женщин — 163 (62,2±3,0%). Проведены измерения фиброзного кольца, синотубулярного соединения и высоты синусов Вальсальвы.
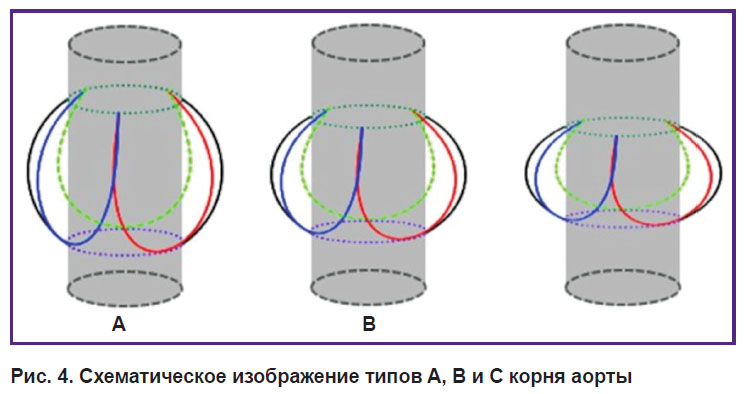
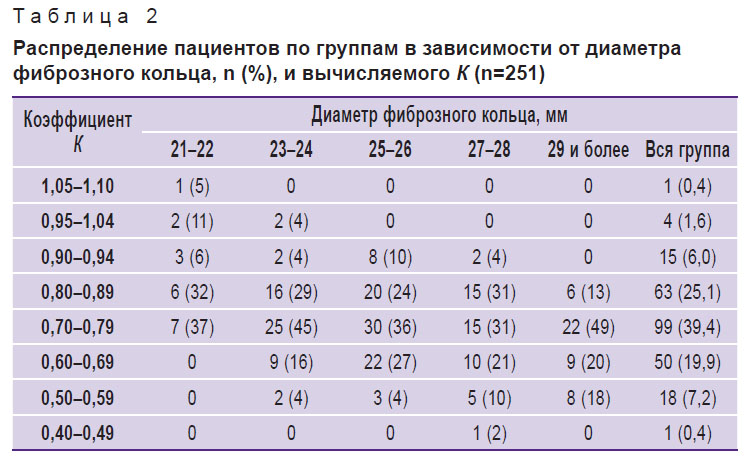
Результаты. В группе трехстворчатого аортального клапана (n=251) более чем в 50% случаев диаметр фиброзного кольца составил от 23 до 26 мм. Не были выявлены значимые связи между диаметром фиброзного кольца и ростом пациентов (r=0,35; p=0,01), а также площадью поверхности тела (r=0,25; p=0,01) и высотой синусов Вальсальвы (r=0,34; p=0,01). На основании измерения отношения высоты синусов Вальсальвы и диаметра фиброзного кольца было выделено три варианта строения корня аорты: тип А — К>1,05; тип В — 0,95≤К≤1,05; тип С — К<0,95. Установлено, что в большинстве случаев преобладал тип С корня аорты — 98,0±0,9% (n=246).
В группе двухстворчатого аортального клапана (n=11) 2 пациента имели тип А корня аорты, 1 пациент — тип В, 8 человек — тип С.
Заключение. Предложена классификация вариантов строения корня аорты, которая будет полезна не только практическим врачам при выборе метода лечения, но и исследователям для понимания структурных характеристик корня аорты у пациентов с его патологией.
Введение
Стеноз клапана аорты широко распространен среди стареющего населения и часто нуждается в оперативном лечении [1]. В последние десятилетия в хирургическую практику активно внедряется транскатетерная имплантация аортального клапана (transcatheter aortic valve implantation — TAVI), которая с течением времени эволюционировала из очень сложной и опасной операции в рутинную процедуру [2]. Совершенствование малоинвазивных методов лечения и расширение показаний к TAVI при умеренном и бессимптомном аортальном стенозе у пациентов с сердечной недостаточностью и аортальной регургитацией способствуют еще большей востребованности данного метода лечения. Развитие TAVI, а также разработка новых конструкций транскатетерных клапанов стимулируют все более глубокое изучение анатомо-функциональных характеристик корня аорты [3], поскольку в основе успеха любой хирургической манипуляции лежит точное понимание анатомических особенностей структурной патологии.
Термином «корень аорты» обозначают часть восходящего отдела грудной аорты, которая ограничена базально плоскостью фиброзного кольца, краниально — плоскостью синотубулярного соединения [4]. Анатомически корень аорты включает в себя три основных компонента: клапан, синусы Вальсальвы и межстворчатые треугольники, а также, по мнению некоторых авторов, устья коронарных артерий [5]. Корень аорты расположен между левым желудочком и аортой. Главной его функцией является уравновешивание давления в левом желудочке и в аорте.
В случае с TAVI неправильная оценка структур корня аорты на этапе предоперационной визуализации и, соответственно, неправильный выбор параметров имплантируемого биопротеза влекут за собой неуспех вмешательства и/или послеоперационные осложнения. Так, в случае, если размер выбранного протеза меньше оптимального, это приводит к параклапанной регургитации либо миграции протеза, тогда как превышение размера чревато разрывом фиброзного кольца, неполным раскрытием протеза с последующим риском центральной чресклапанной регургитации, а также нарушениями проводимости из-за чрезмерного давления на проводящую систему сердца в выходном отделе левого желудочка [6].
Разработана стандартизированная методика проведения предоперационной компьютерной томографии и интерпретации полученных изображений с выполнением определенных измерений [7]. Однако на сегодняшний день сохраняются непреодолимые препятствия в виде невозможности оценки функциональной составляющей патологии по результатам компьютерной томографии, а появление такого грозного послеоперационного осложнения, как поперечная атрио-вентрикулярная блокада, по-прежнему остается на высоком уровне. Таким образом, для реализации персонифицированного подхода необходима модернизация диагностических мероприятий.
Цель исследования — выявить новые анатомические ориентиры корня аорты и взаимосвязи между размерами анатомических структур с использованием метода компьютерно-томографической ангиографии для усовершенствования моделей клапанов сердца и методики их подбора в клинической практике.
Материалы и методы
Ретроспективно были проанализированы данные компьютерно-томографической ангиографии (КТА) 262 пациентов, из них 99 мужчин (37,8±3,0%) и 163 женщины (62,2±3,0%), со стенозом аортального клапана. Средний возраст составил 75,0±5,9 года. Выраженный кальциноз аортального клапана наблюдался у 140 пациентов (53,4±3,1%), умеренный кальциноз — у 72 (27,5±2,7%), мягкий кальциноз — у 30 (11,5±2,0%), отсутствие кальциноза аортального клапана — у 20 (7,6±1,6%).
Пациенты были разделены на две группы:
1-я группа — 251 пациент (95,8±1,2%), из них 159 женщин и 92 мужчины, с трехстворчатым аортальным клапаном (ТАоК), средний возраст — 75,0±5,9 года;
2-я группа — 11 пациентов (4,2±1,2%), из них 7 мужчин и 4 женщины, с двустворчатым аортальным клапаном (ДАоК), средний возраст — 69,9±6,5 года.
Детальному анализу подвергали пациентов группы ТАоК.
Всем пациентам в качестве предоперационной подготовки для TAVI выполняли КТА на компьютерном 320-срезовом томографе Toshiba Aquilion One (Toshiba, США) с толщиной реконструированного среза 0,5–1,0 мм. Область сканирования — от верхушек легких до нижнего края вертлужной впадины, для включения в зону исследования проксимальных отделов брахиоцефальных артерий (краниально) и проксимальных отделов подвздошных артерий (дистально). Скорость введения контрастного препарата составляла 4,5–5,0 мл/с. Объем введения контрастного препарата рассчитывали по формуле:
V = скорость введение препарата × общее время сканирования.
Анализ полученных изображений и все измерения были выполнены на специализированной рабочей станции тремя врачами-рентгенологами с опытом работы 5 и более лет.
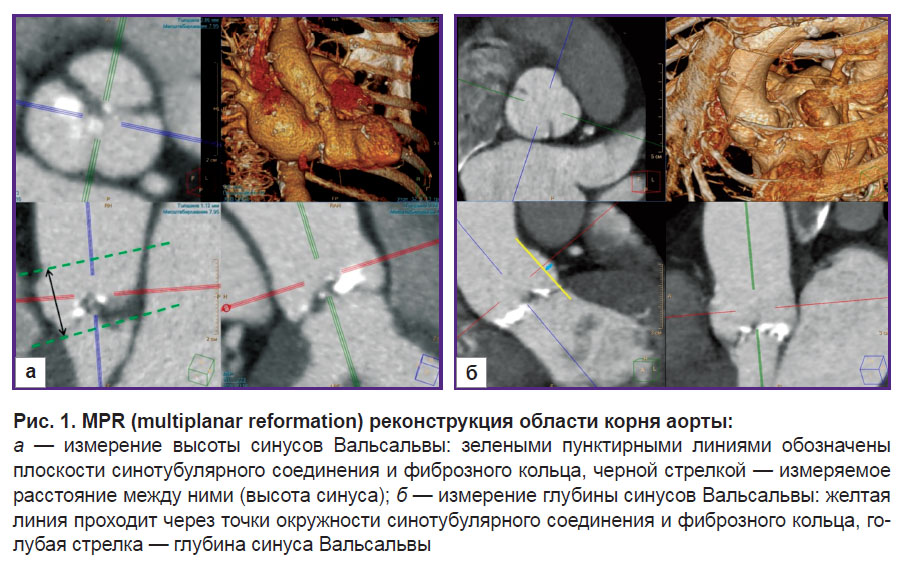
С учетом рекомендаций по проведению измерений корня аорты для планирования протезирования аортального клапана [7] были выполнены измерения фиброзного кольца, синотубулярного соединения и высоты синусов Вальсальвы. Диаметр аорты на уровне фиброзного кольца и синотубулярного соединения рассчитывали как среднее значение между максимальным и минимальным измерениями. Среднюю высоту синусов Вальсальвы рассчитывали как среднее трех отрезков, проведенных от плоскости фиброзного кольца до плоскости синотубулярного соединения через центр полудуги синуса (рис. 1, а).
Схема измерения глубины всех трех синусов Вальсальвы представлена на рис. 1, б.
Тип корня аорты определяли по формуле:
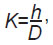
где h — средняя для данного пациента высота от фиброзного кольца до синотубулярного сочленения (мм); D — средний диаметр фиброзного кольца данного пациента (мм). Коэффициент К рассчитывали для каждого пациента.
Статистические методы. Статистический анализ проводили с использованием программного обеспечения SPSS Statistics 24.0 для Windows (SPSS Inc., США). Проверку нормальности распределения непрерывных переменных в каждой группе осуществляли с использованием критерия Шапиро–Уилка. Поскольку распределение соответствовало нормальному, результаты выражали в виде среднего значения и стандартного отклонения M±σ. О достоверности различий судили по t-критерию Стьюдента, считая различия статистически значимыми при р<0,05. Коэффициент корреляции Пирсона (r) применяли для оценки силы связи между сравниваемыми измерениями. Индекс массы тела рассчитывали по формуле Дюбуа и Дюбуа [8]. Непарный t-критерий Стьюдента использовали для сравнения непрерывных переменных между группами. Значение p<0,05 признавали статистически значимым.
Результаты
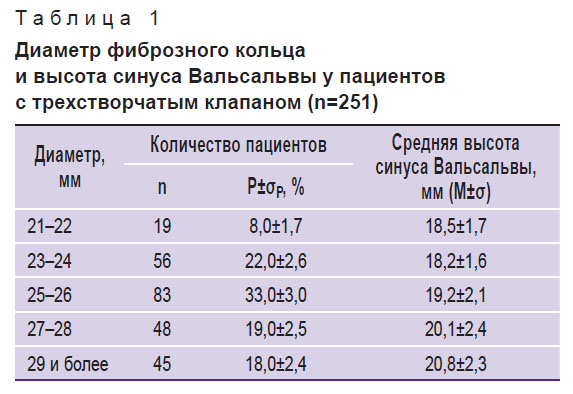
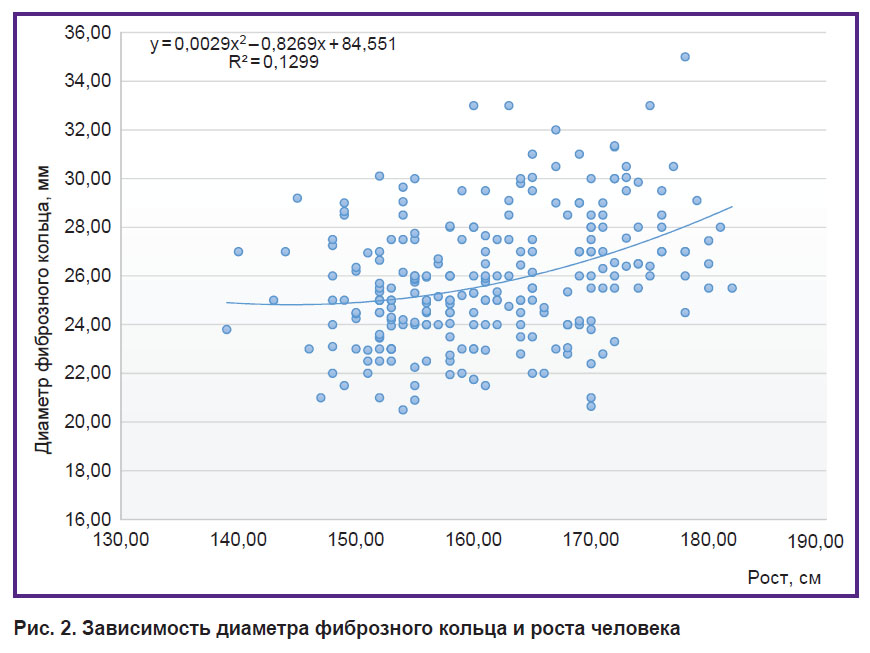
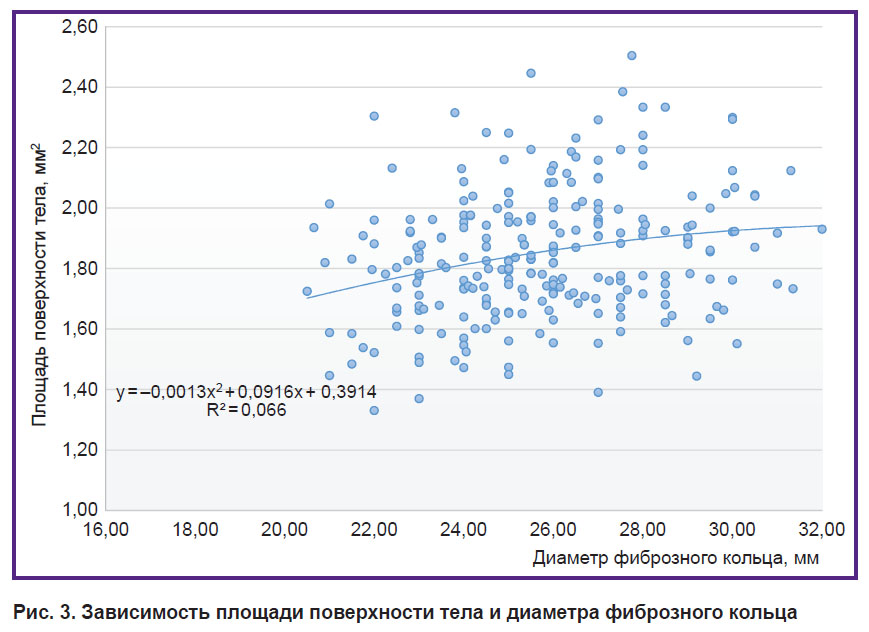
Группа с трехстворчатым аортальным клапаном. Более чем в 50% случаев диаметр фиброзного кольца у пациентов группы ТАоК составил от 23 до 26 мм (табл. 1). При этом мы не выявили значимых связей между диаметром фиброзного кольца и ростом пациентов (r=0,35; p=0,01), а также площадью поверхности тела (r=0,25; p=0,01) и высотой синусов Вальсальвы (r=0,34; p=0,01) (рис. 2 и 3).
|
Таблица 1. Диаметр фиброзного кольца и высота синуса Вальсальвы у пациентов с трехстворчатым клапаном (n=251) |
|
Рис. 2. Зависимость диаметра фиброзного кольца и роста человека |
|
Рис. 3. Зависимость площади поверхности тела и диаметра фиброзного кольца |
Стоит отметить наличие средней силы связи между диаметром фиброзного кольца и диаметром синотубулярного соединения (r=0,56; p=0,01).
При анализе данных КТА на основании измерения высоты синусов Вальсальвы и диаметра фиброзного кольца выделено три варианта строения корня аорты: тип А — К>1,05; тип В — 0,95≤К≤1,05; тип С — К<0,95 (рис. 4).
|
Рис. 4. Схематическое изображение типов A, B и С корня аорты |
У 1 из 251 пациента (0,4%) коэффициент К был более 1,05; у 4/251 (1,6%) — в интервале 0,95–1,05, что соответствует типам А и В корня аорты соответственно. В остальных случаях (n=246; 98,0±0,9%) преобладал тип С корня аорты. При этом у 63 пациентов (25,1±2,7%) коэффициент К находился в интервале от 0,80 до 0,89; у 99 (39,4±3,1%) — от 0,70 до 0,79; у 50 (19,9±2,5%) — от 0,60 до 0,69, что в сумме составляет 84,5±2,3% от общего числа пациентов с корнем аорты типа С (табл. 2).
|
Таблица 2. Распределение пациентов по группам в зависимости от диаметра фиброзного кольца, n (%), и вычисляемого К (n=251) |
Среднее значение глубины некоронарного синуса составило 4,97±0,97 мм, правого коронарного синуса — 4,26±0,77 мм, левого коронарного синуса — 4,60±0,81 мм, а среднее для всех трех синусов — 4,61±0,71 мм. Между диаметром фиброзного кольца и средней глубиной синусов также отсутствовала корреляционная зависимость (r=0,31; p=0,01), однако между глубиной и высотой синусов была выявлена средней степени связь (r=0,65; p=0,01).
Группа с двухстворчатым клапаном. У 2 из 11 пациентов (18%) наблюдали сохранение всех трех синусов Вальсальвы при сращении двух створок, тогда как у 9/11 пациентов (82%) дифференцировка правого и некоронарного синусов была затруднена, при этом отмечали расширение левого синуса, что визуально воспринималось как два симметричных синуса.
В этой группе наиболее часто встречали диаметр фиброзного кольца от 29 мм и более (4 пациента — 36%), у 2 пациентов диаметр фиброзного кольца составил 27–28 мм (18%), у 1 (9%) — 26–27 мм, также у 1 (9%) — 25–26 мм, у 2 (18%) — 23–24 мм и еще у 1 (9%) — 22–23 мм.
2 пациента группы ДАоК (18%) имели тип А корня аорты, 1 пациент (9%) — тип В корня аорты, 8 человек (72%) — тип С корня аорты.
Учитывая малый размер выборки группы с двухстворчатым аортальным клапаном, углубленный статистический анализ не проводили.
Обсуждение
В течение жизни аортальный клапан постоянно подвергается повторяющимся механическим нагрузкам, усиливающимся со временем ввиду широко распространенной в популяции артериальной гипертензии. Вследствие этого развивается склероз створок клапана и их кальциноз [9]. По мере прогрессирования заболевания нарастают нарушения механической функции клапана — стеноз или регургитация. Помимо этого, установлено, что вариантная анатомия в виде двухстворчатой формы аортального клапана приводит к его дегенерации в более раннем возрасте [10]. В нашей работе получен аналогичный результат: в группе ДАоК средний возраст составил 69,9±6,5 года, в группе ТАоК — 75,0±5,9 года.
Несмотря на то, что в литературе последнего десятилетия преобладают работы об особенностях планирования хирургического лечения аортального стеноза у пациентов с ДАоК [11, 12], в нашей работе основное внимание уделено ТАоК, так как данный анатомический вариант наиболее распространен, а частота развития послеоперационных осложнений и неудовлетворительных результатов лечения остается достаточно высокой и у этой категории пациентов [13]. Это обусловливает необходимость дальнейшего усовершенствования диагностических и лечебных технологий, а также разрабатываемых медицинских изделий.
Современные методы визуализации дают возможность детально изучить структурные изменения корня аорты при планировании оперативного вмешательства. Для изучения анатомических и функциональных показателей корня аорты возможно использовать ультразвуковую диагностику, компьютерную томографию или магнитно-резонансную томографию. Каждый из этих методов имеет свои преимущества и недостатки. В нашей работе мы использовали данные КТА как наиболее точного метода в определении размеров. Как известно, КТ превосходит многие методы визуализации в разрешении, но при этом не позволяет оценить функциональную состоятельность элементов сердечно-сосудистой системы, поскольку для уменьшения лучевой нагрузки используется сканирование с кардиосинхронизацией со сбором данных только в диастолическую фазу. Есть работы, свидетельствующие о возрастающей роли ультразвуковой диагностики при планировании хирургического лечения аортального стеноза [14]. При этом основной недостаток ультразвуковой диагностики — высокая операторозависимость — может быть минимизирован при использовании трехмерного ультразвукового исследования [15]. В дальнейшем наиболее перспективным методом оценки анатомо-функциональных характеристик корня аорты и сердца может стать магнитно-резонансная томография [16, 17].
В настоящей работе в качестве ключевого параметра был выбран диаметр фиброзного кольца аортального клапана, поскольку именно на него ориентированы все типоразмерные линейки и маркировка протезов клапанов сердца. Согласно полученным нами данным, у пациентов с аортальным стенозом наиболее часто встречается диаметр фиброзного кольца 23–26 мм. У здоровых людей этот диаметр преимущественно находится в интервале от 20 до 22 мм [9]. Мы полагаем, что аортальный стеноз и клапанная недостаточность закономерно приводят к изолированному увеличению размеров фиброзного кольца.
В нашем исследовании были проанализированы возможные варианты корреляции между размерами элементов корня аорты и общими анатомическими параметрами пациентов. Корреляционных связей между ними и диаметром фиброзного кольца не выявлено. Следует отметить, что данные некоторых источников свидетельствуют о наличии таких взаимосвязей у здоровых людей [9].
Средние корреляционные связи выявлены между диаметром фиброзного кольца и диаметром синотубулярного соединения, а также между глубиной и высотой синусов Вальсальвы. Первую зависимость можно объяснить взаимосвязью степени стеноза аортального клана и давления в восходящем отделе аорты. Считается, что чем значительнее сужение фиброзного кольца, тем ниже давление в аорте, так как из-за препятствия току крови снижается объем сердечного выброса [18]. Взаимосвязь между глубиной и высотой синусов Вальсальвы, вероятно, является анатомической и при развитии клапанной патологии клапана не претерпевает больших изменений. В настоящем исследовании сравнения с неизмененным клапаном не проводилось, а обнаружить работы, посвященные взаимоотношениям размеров синусов Вальсальвы у пациентов без клапанной патологии, не удалось.
Нами впервые предложена классификация корня аорты в зависимости от величины отношения высоты синусов Вальсальвы к диаметру фиброзного кольца. Выделено три типа корня аорты, при этом наибольшую группу составили пациенты с типом С (84,5±2,3%), у которых диаметр фиброзного кольца преобладает над высотой синусов, а предложенный нами коэффициент К составляет от 0,60 до 0,89.
В целом полученные данные указывают на индивидуальность строения корня аорты, не связанную с другими общими и локальными анатомическими параметрами. Все это свидетельствует о необходимости дальнейшего развития и внедрения в клиническую практику таких высокотехнологичных методов, как математическое моделирование корня аорты для каждого пациента с возможностью виртуального подбора оптимальной для него модели транскатетерного биопротеза.
Изучение вариантов строения корня аорты, выявление взаимоотношений между структурами корня позволяет более точно оценить его конфигурацию. Эти данные необходимы исследователям, выполняющим разработку новых моделей транскатетерных клапанов, применение которых будет способствовать уменьшению количества осложнений в послеоперационном периоде. Необходимо учитывать, что чаще всего встречается С тип корня аорты, а чем шире корень аорты, тем ниже высота синусов Вальсальвы по отношению к диаметру фиброзного кольца, соответственно, при имплантации биопротеза возникают риски перекрытия устьев коронарных артерий. С другой стороны, если используется клапан с креплением в восходящей аорте, то при снижении высоты имплантируемого клапана уменьшается площадь посадочной зоны, что может привести к его миграции.
Данные, полученные в этой работе, не только позволят исследователям расширить представление о структурной патологии корня при стенозе аортального клапана и помочь в подборе типа биопротеза, но и помогут найти новые пути решения многих проблем при разработке новых моделей транскатетерных устройств.
Заключение
На основании применения персонифицированного подхода для детализации особенностей корня аорты при аортальном стенозе предложена классификация, которая будет полезна не только практическим врачам при выборе метода лечения, но и исследователям в понимании структурных характеристик корня аорты у пациентов с его патологией — для усовершенствования и разработки принципиально новых моделей искусственных клапанов.
Финансирование. Исследование выполнено в рамках государственного задания Минздрава России №121032300337-5.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Литература
- Bonow R.O., Greenland P. Population-wide trends in aortic stenosis incidence and outcomes. Circulation 2015; 131(11): 969–971, https://doi.org/10.1161/circulationaha.115.014846.
- Eggebrecht H., Mehta R.H. Transcatheter aortic valve implantation (TAVI) in Germany 2008–2014: on its way to standard therapy for aortic valve stenosis in the elderly? EuroIntervention 2016; 11(9): 1029–1033, https://doi.org/10.4244/eijy15m09_11.
- Tchetche D., Van Mieghem N.M. New-generation TAVI devices: description and specifications. EuroIntervention 2014; 10(Suppl U): U90–U100, https://doi.org/10.4244/eijv10sua13.
- Randhawa A., Gupta T., Singh P., Aggarwal A., Sahni D. Description of the aortic root anatomy in relation to transcatheter aortic valve implantation. Cardiovasc Pathol 2019; 40: 19–23, https://doi.org/10.1016/j.carpath.2019.01.005.
- Sud A., Parker F., Magilligan D.J. Jr. Anatomy of the aortic root. Ann Thorac Surg 1984; 38(1): 76–79, https://doi.org/10.1016/s0003-4975(10)62195-9.
- Ait Said M., Coquard C., Horvilleur J., Manenti V., Fiorina L., Lacotte J., Salerno F. Transcatheter aortic valve implantation and conduction disturbances. Ann Cardiol Angeiol (Paris) 2019; 68(6): 443–449, https://doi.org/10.1016/j.ancard.2019.09.024.
- Achenbach S., Delgado V., Hausleiter J., Schoenhagen P., Min J.K., Leipsic J.A. SCCT expert consensus document on computed tomography imaging before transcatheter aortic valve implantation (TAVI)/transcatheter aortic valve replacement (TAVR). J Cardiovasc Comput Tomogr 2012; 6(6): 366–380, https://doi.org/10.1016/j.jcct.2012.11.002.
- Du Bois D., Du Bois E.F. A formula to estimate the approximate surface area if height and weight be known. 1916. Nutrition 1989; 5(5): 303–313.
- Бокерия Л.А., Скопин И.И., Сазоненков М.А., Тумаев Е.Н. К вопросу об анатомии корня аорты. Соотношение диаметров аортального кольца и синотубулярного соединения в норме у взрослых. Идеальная геометрическая модель корня аорты. Бюллетень НЦССХ им. А.Н. Бакулева РАМН 2008; 9(4): 77–85.
- Sophocleous F., Berlot B., Ordonez M.V., Baquedano M., Milano E.G., De Francesco V., Stuart G., Caputo M., Bucciarelli-Ducci C., Biglino G. Determinants of aortic growth rate in patients with bicuspid aortic valve by cardiovascular magnetic resonance. Open Heart 2019; 6(2): e001095, https://doi.org/10.1136/openhrt-2019-001095.
- Vincent F., Ternacle J., Denimal T., Shen M., Redfors B., Delhaye C., Simonato M., Debry N., Verdier B., Shahim B., Pamart T., Spillemaeker H., Schurtz G., Pontana F., Thourani V.H., Pibarot P., Van Belle E. Transcatheter aortic valve replacement in bicuspid aortic valve stenosis. Circulation 2021; 143(10): 1043–1061, https://doi.org/10.1161/circulationaha.120.048048.
- Ram D., Bouhout I., Karliova I., Schneider U., El-Hamamsy I., Schäfers H.J. Concepts of bicuspid aortic valve repair: a review. Ann Thorac Surg 2020; 109(4): 999–1006, https://doi.org/10.1016/j.athoracsur.2019.09.019.
- Баяндин Н.Л., Кротовский А.Г., Васильев К.Н., Моисеев А.А., Сетынь Т.В. Сравнительные результаты хирургического и транскатетерного (TAVI) лечения аортального стеноза у больных старше 75 лет. Российский кардиологический журнал 2018; 11: 21–26, https://doi.org/10.15829/1560-4071-2018-11-21-26.
- Baumgartner H., Hung J., Bermejo J., Chambers J.B., Edvardsen T., Goldstein S., Lancellotti P., LeFevre M., Miller F. Jr., Otto C.M. Recommendations on the echocardiographic assessment of aortic valve stenosis: a focused update from the European Association of Cardiovascular Imaging and the American Society of Echocardiography. J Am Soc Echocardiogr 2017; 30(4): 372–392, https://doi.org/10.1016/j.echo.2017.02.009.
- Haj-Ali R., Marom G., Ben Zekry S., Rosenfeld M., Raanani E. A general three-dimensional parametric geometry of the native aortic valve and root for biomechanical modeling. J Biomech 2012; 45(14): 2392–2397, https://doi.org/10.1016/j.jbiomech.2012.07.017.
- Стукалова О.В., Серова Н.С., Чеповский А.М., Терновой С.К. Компьютерное моделирование сердца на основе магнитно-резонансной томографии: клиническое применение в аритмологии. Российский электронный журнал лучевой диагностики 2021; 11(2): 32–45.
- Hussein N., Voyer-Nguyen P., Portnoy S., Peel B., Schrauben E., Macgowan C., Yoo S.J. Simulation of semilunar valve function: computer-aided design, 3D printing and flow assessment with MR. 3D Print Med 2020; 6(1): 2, https://doi.org/10.1186/s41205-020-0057-8.
- Marom G., Haj-Ali R., Rosenfeld M., Schäfers H.J., Raanani E. Aortic root numeric model: annulus diameter prediction of effective height and coaptation in post-aortic valve repair. J Thorac Cardiovasc Surg 2013; 145(2): 406–411.e1, https://doi.org/10.1016/j.jtcvs.2012.01.080.