Бисфосфонаты как потенциальные ингибиторы кальцификации биопротезов клапанов сердца (обзор)
Еще 50 лет назад бисфосфонаты превратились из реагента для водоподготовки в одну из самых широко используемых групп препаратов для лечения различных заболеваний кальциевого обмена (резорбции костной ткани, онкологических осложнений нейродегенеративных заболеваний и др.). Многолетние исследования бисфосфонатов способствовали пониманию молекулярных и клеточных путей их действия. Все бисфосфонаты имеют близкую структуру и общие свойства, однако между ними существуют очевидные химические, биохимические и фармакологические отличия. Для каждого бисфосфоната характерен свой уникальный профиль. В настоящем обзоре обобщены данные о механизмах действия бисфосфонатов, показаны опыт и перспективы их применения для модификации кардиоваскулярных биопротезов, поскольку вопрос предотвращения кальцификации бисфосфонатов до конца не решен.
Введение
Биcфосфонаты (БФ), или дифосфонаты, как их называли ранее, известны достаточно давно. Впервые они были синтезированы немецкими химиками еще в 1865 г. [1, 2], однако для лечения нарушений кальциевого обмена их используют только в последние 50 лет. В настоящее время БФ являются одной из самых широко применяемых групп препаратов для лечения болезни Педжета, остеопороза, рака молочной железы и неопластических метастазов в кости, множественной миеломы, некоторых других редких заболеваний костей, нейродегенеративных заболеваний, а также в стоматологии [3–11]. В ветеринарии к этим препаратам прибегают для решения тех же задач в лечении разных видов животных [12]. Кроме того, биcфосфонаты используют для адресной доставки в кость лекарственных веществ: антибиотиков, гормонов и противораковых препаратов [13]. С 1970 г. БФ применяют в качестве радиоактивно-меченых препаратов в диагностике болезней скелета [14]. Рассматривается возможность использования БФ Золедроната как иммуномодулятора в комплексном лечении пневмонии, вызванной SARS-CoV-2 [15].
Открытие биологических эффектов БФ берет свое начало в изучении механизмов кальцификации и роли в ней пирофосфата. Еще в 1930-е гг. было установлено, что полифосфаты действуют как естественные физиологические регуляторы процесса кальцификации из-за их способности ингибировать отложение солей кальция. В 1960-е гг. было обнаружено, что биологические жидкости (моча и плазма крови) содержат вещество, которое ингибирует осаждение фосфата кальция, а именно — пирофосфат [16, 17]. Он имеет высокое сродство к кристаллам кальция, тормозит их образование и растворение in vitro и подавляет кальцификацию in vivo, но при пероральном приеме быстро метаболизируется в организме за счет гидролиза в желудочно-кишечном тракте [18, 19]. Поиск соединений, устойчивых к ферментативному гидролизу и аналогичных пирофосфату по физико-химической активности, привел исследователей к БФ.
Строение молекул и фармакологическая эффективность бисфосфонатов
Бисфосфонаты — синтетические аналоги пирофосфата с двумя фосфонатными группами, связанными c центральным атомом углерода. Группа P–C–P в структуре БФ делает их устойчивыми к ферментативному гидролизу, в отличие от гидролитически нестабильной P–O–P-связи в структуре пирофосфата. Кроме того, БФ имеют в своей молекуле две дополнительные боковые цепи, которые отсутствуют в пирофосфате. Они называются R1 и R2 соответственно и также связаны с центральным атомом углерода (рис. 1) [20–24].
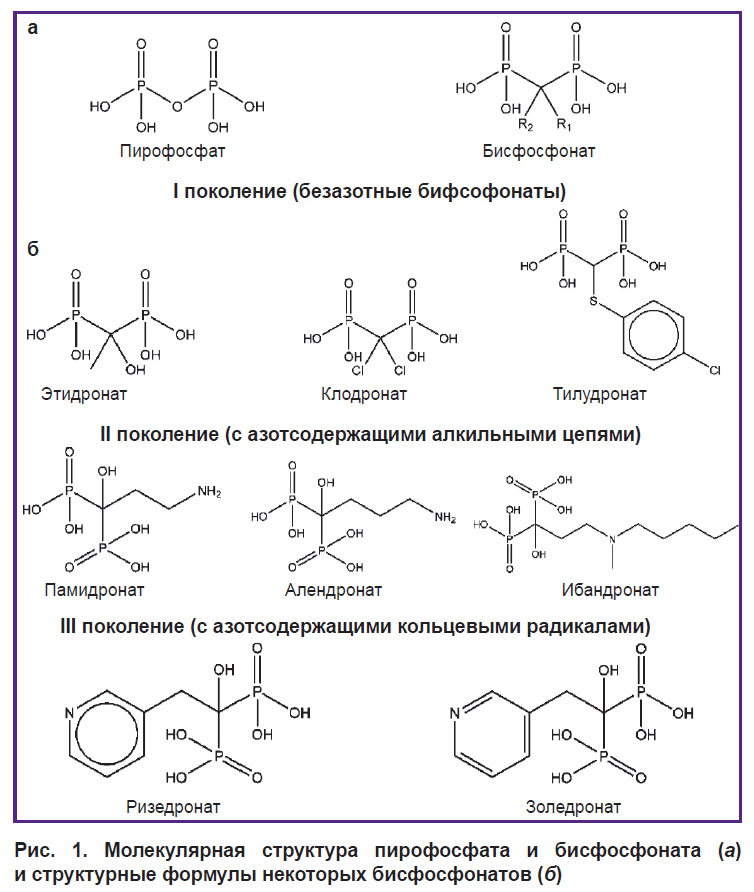
|
Рис. 1. Молекулярная структура пирофосфата и бисфосфоната (а) и структурные формулы некоторых бисфосфонатов (б) |
Связывание БФ с гидроксиапатитом происходит за счет хелатирования ионов кальция на поверхности кристаллов апатита двумя фосфонатными группами, находящимися в непосредственной близости, что приводит к образованию бидентатной связи [25–28].
Тип боковых цепей, присутствующих в БФ, является важным фактором, определяющим их свойства. Было обнаружено, что гидроксильное замещение в R1 увеличивает сродство БФ к кристаллам кальция за счет образования тридентатной связи [29]. Большинство клинически используемых БФ содержат в позиции R1 именно гидроксильную группу. БФ с R1, замещенным на ионы Cl– или H+ (Клодронат и Тилудронат), обеспечивают бидентатное связывание с кристаллами кальция и имеют значительно более низкую аффинность связывания [30, 31]. Конфигурация боковой цепи R2 определяет антирезорбтивную активность БФ по отношению к костной ткани [32, 33]. В целом же наличие боковых цепей R1 и R2 позволяет вводить многочисленные замены и синтезировать большое количество веществ с разными свойствами.
Согласно химическому строению R2, БФ подразделяют на безазотные и азотсодержащие соединения (см. рис. 1). Присутствующий в структуре атом азота влияет на антирезорбтивную эффективность азотсодержащих БФ, увеличивая ее в 10–10 000 раз относительно безазотных (см. таблицу).
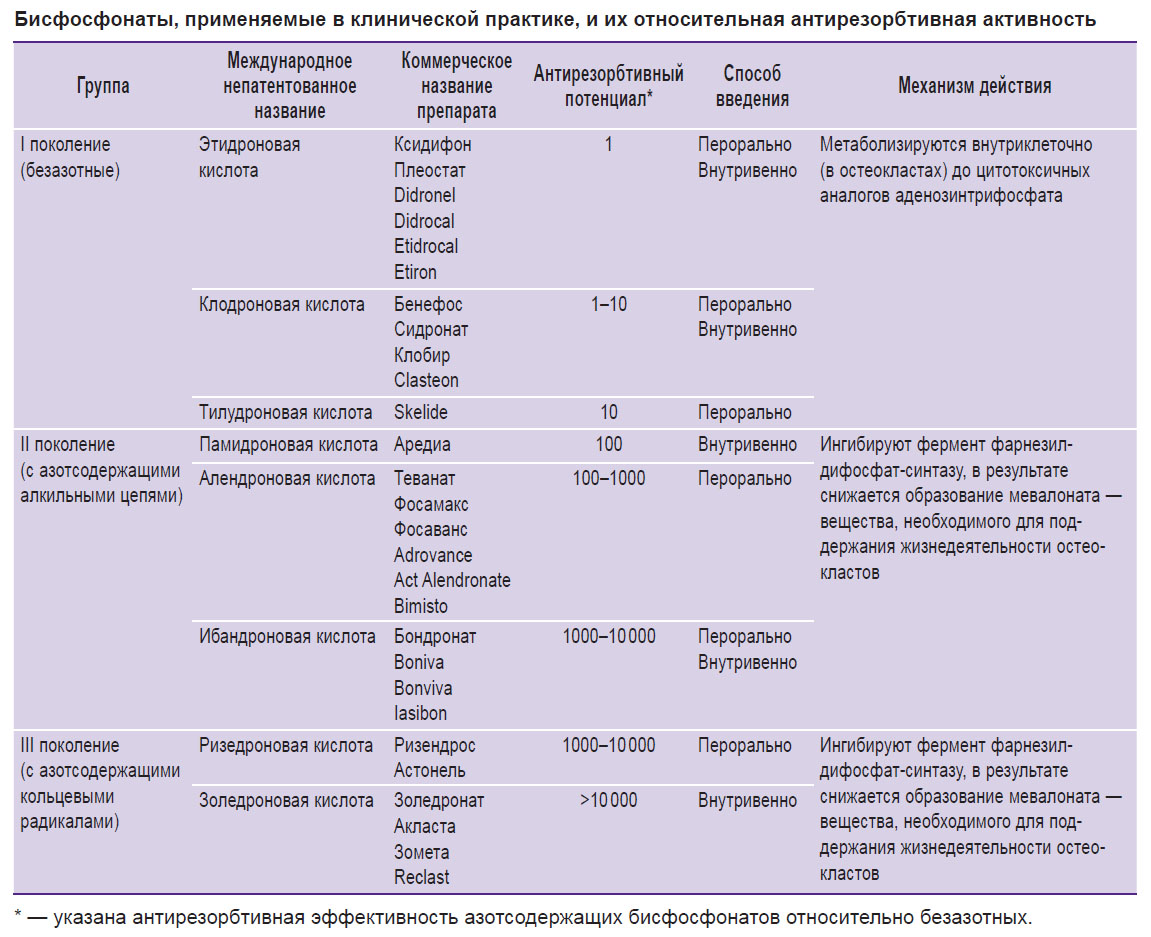
|
Бисфосфонаты, применяемые в клинической практике, и их относительная антирезорбтивная активность |
Наличие положительно заряженной группы R2 позволяет БФ связываться с минеральной поверхностью кости, что впоследствии увеличивает сродство гидроксиапатита к отрицательно заряженным фосфонатным группам в результате электростатических взаимодействий [34]. Другой важный фактор более высокой активности азотсодержащих БФ по сравнению с безазотными — возможность образования водородной связи между аминогруппой БФ и поверхностью гидроксиапатита; таким примером является Алендронат со свободной аминогруппой [35]. Этим объясняется сильное сродство аминосодержащих БФ к костной ткани и их применение в терапии заболеваний костей [36–39]. Кроме того, сообщается о связывании БФ с карбонат-апатитом [36–39]. Тем самым подтверждается влияние структуры R2 на поглощение, распределение и долгосрочное депонирование БФ в костной ткани.
Отличие БФ I поколения от других групп состоит в том, что в их составе нет азота (безазотные бисфосфонаты). Спектр действия этих веществ несколько уже, чем у аминобисфосфонатов. Тем не менее эффективность лечения и профилактики этими препаратами различных заболеваний, связанных с резорбцией костной ткани, очень высока. БФ I поколения успешно используются в коррекции гиперкальциемии, в профилактических целях — для предотвращения образования метастазов в костях при некоторых онкологических заболеваниях, болезни Педжета, а также в лечении остеопороза (но при детском остеопорозе противопоказаны) [7, 40–43].
Аминосодержащие БФ II поколения характеризуются более широким спектром действия и более высокой эффективностью. Так, например, Памидронат хорошо зарекомендовал себя в терапии больных множественной миеломой и раком молочной железы с метастазами в кости, т.е. опухолями, характеризующимися развитием прежде всего остеолитических метастазов [16, 44].
Несмотря на подтвержденный дозозависимый эффект Памидроната, его высокие дозы практически не используют из-за побочных влияний на желудочно-кишечный тракт [45, 46]. Отмечены преимущества Памидроната перед Клодронатом у больных с опухоль-индуцированной гиперкальциемией — прежде всего в продолжительности нормокальциемии, так как средняя продолжительность эффекта Клодроната составляет 14 дней в сравнении с 28 днями для Памидроната [47]. Была показана также возможность использования аминобисфосфонатов с целью предупреждения осложнений костного метастазирования. Результаты исследований с Клодронатом и Памидронатом выявили достоверное снижение частоты проявлений осложнений при пролонгированном применении Памидроната [38].
Разработка новых БФ III поколения с уменьшенной кратностью приема (один раз в неделю или в месяц) способствовала существенному повышению приверженности к лечению, оптимизации исходов терапии и уменьшению побочных эффектов. Так, золедроновая кислота, имеющая самую высокую аффинность к гидроксиапатиту костной ткани в сравнении с другими аминобисфосфонатами — Алендронатом, Ибандронатом, Ризедронатом, — обеспечивает больший терапевтический эффект и меньшую выраженность побочных явлений [48–53].
G.H. Nancollas с соавт. [54] в своих исследованиях определяли кинетическую способность связывания БФ. Ими установлено, что Клодронат был самым слабым ингибитором скорости роста гидроксиапатита и имел самую низкую кинетическую константу сродства. Другие авторы [7, 22] обнаружили различия между гидроксил-замещенными бисфосфонатами и ранжировали их в соответствии с аффинностью связывания гидроксиапатита следующим образом: Золедронат > Алендронат > Ибандронат > Ризедронат > Этидронат > Клодронат.
Клеточные и молекулярные механизмы действия бисфосфонатов
По мере того как были синтезированы новые, более мощные БФ, стало очевидно, что их биологическую активность невозможно объяснить только физико-химическими свойствами. Это стимулировало исследования механизмов действия БФ на клеточном уровне [3, 55–59].
Клеточные механизмы действия БФ основаны на ингибировании резорбции костной ткани за счет их избирательного связывания и адсорбции на минеральной поверхности кости. Обладая высоким сродством к ионам кальция, они прекрасно проникают в костную ткань. Там молекулы БФ концентрируются вокруг остеокластов, создавая высокую концентрацию в лакунах резорбции. В исследованиях in vitro было показано, что БФ влияют на глубину лакун резорбции, уменьшая ее. В пределах остеокластов они инициируют ряд изменений, снижающих способность костной ткани к резорбции (потерю щеточной каймы, разрушение цитоскелета, неспособность остеокластов к передвижению или связыванию с костной тканью). После того, как БФ связываются с остеокластами, они нарушают их биохимические процессы, вызывая апоптоз [34, 60].
На молекулярном уровне биохимические механизмы действия БФ также различаются и зависят от их строения. Существует два основных механизма их действия.
Безазотные БФ I поколения ведут себя как аналоги пирофосфата: включаются в метаболизм стабильных аналогов АТФ (в аденозин-5’-(β,γ-дихлорометилен)-трифосфат) за счет действия аминоацил-тРНК-синтазы [42]. Внутриклеточное накопление этих негидролизуемых метаболитов в остеокластах вызывает дефицит функциональных АТФ, а также ингибирует митохондриальную транслоказу АДФ/АТФ, что в свою очередь приводит к апоптозу остеокластов [61–63].
Высокоактивные азотсодержащие АБФ II поколения не метаболизируются, а непосредственно индуцируют апоптоз остеокластов путем ингибирования биосинтеза мевалоната, который участвует в образовании холестерина и изопреноидных липидов, в том числе изопентенил-пирофосфата (IPP), фарнезил-пирофосфата (FPP) и геранилгеранил-пирофосфата (GGPP). Но все же главной мишенью этой группы БФ является фарнезил-пирофосфат-синтаза (FPPS) — один из ферментов, участвующих в метаболизме пирофосфатсодержащих изопреноидных липидов [23, 39, 64]. FPP и GGPP необходимы для посттрансляционного пренилирования малых G-белков, таких как Rab, Rac, Ras и Rho. Эти ключевые G-белки, пренилированные по остатку цистеина, регулируют различные клеточные процессы функционирования остеокластов — созревание и выживание. Следовательно, торможение FPPS приводит к потере резорбционной способности остеокластов или ингибирует остеокластогенез [36, 65, 66]. Способность ингибировать процесс модификации белков в остеокластах ведет к апоптозу зрелых клеток, что подтверждается появлением специфических изменений в клетке и структуре ядра [67]. Одновременно отмечается потеря клетками-предшественниками остеокластов способности к дифференцировке и созреванию, что естественно приводит к уменьшению числа остеокластов [28]. Кроме того, данные in vitro свидетельствуют, что под влиянием БФ остеобласты снижают секрецию остеокласт-стимулирующего фактора [68]. БФ способны к рециклингу, т.е. возвращению в системный кровоток из резорбированной остеокластами поверхности кости. Молекулы БФ, высвободившиеся из костной ткани, могут присоединяться к другому участку кости. Непрерывное применение БФ увеличивает «бисфосфонатную нагрузку» на кость, что обусловливает уникальную особенность этого класса препаратов — сохранение клинического эффекта на протяжении длительного времени после отмены терапии [29, 69–72].
Механизм действия БФ частично сходен с механизмом действия статинов, так как они тоже ингибируют ферменты, участвующие в метаболизме мевалоната, однако статины участвуют только в одной из первых стадий, ингибируя HMG-CoA-редуктазу [67].
Таким образом, механизм действия БФ основан на тройном влиянии на ключевые процессы костного ремоделирования: физико-химическое связывание с гидроксиапатитом, прямое воздействие на резорбционную активность остеокластов и стимуляцию образования новой кости (рис. 2).
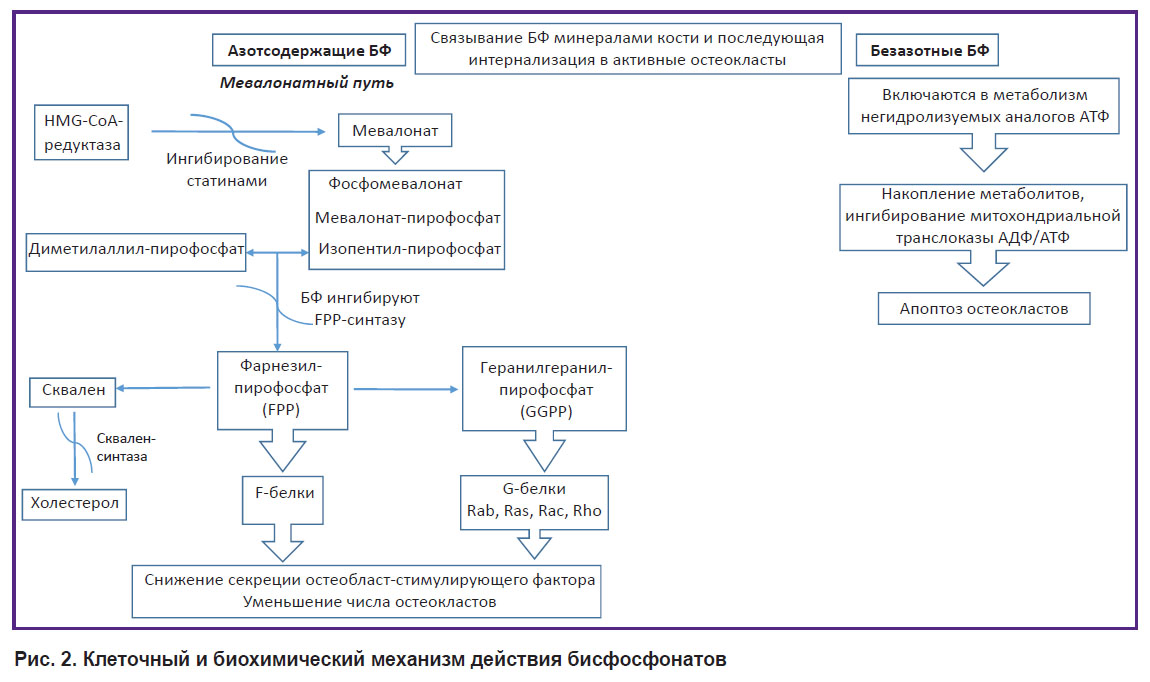
|
Рис. 2. Клеточный и биохимический механизм действия бисфосфонатов |
Использование бисфосфонатов для модификации кардиоваскулярных биопротезов
История применения биологических протезов для коррекции сердечно-сосудистых заболеваний насчитывает более 60 лет [73–75]. Для изготовления клапанных и сосудистых протезов применяют различные ксеногенные материалы: аорту, аортальный клапан и перикард свиньи, а также перикард, яремную вену и внутреннюю грудную артерию крупного рогатого скота. Эти материалы отличаются по микроструктуре, соотношению фибриллярных белков и аминокислот. С 1967 г. в производстве биологических протезов для консервации тканей используют глутаровый альдегид (ГА) [76–79]. ГА обеспечивает высокую плотность поперечной сшивки коллагена и значительно повышает его устойчивость к действию протеолитических ферментов. В то же время обработанные ГА биопротезные материалы приобретают выраженную склонность к патологической кальцификации [80–83].
Согласно современным представлениям, в основе кальцификации ткани биопротезов лежат особенности структуры химических связей, образуемых между коллагеном и ГА. Образование сшивок происходит в основном за счет реакции ε-аминогрупп лизина и гидроксилизина с полимерным ГА. Эти связи содержат несколько активных атомов кислорода, способных к образованию прочных комплексов с катионами кальция. Провоцировать кальцификацию может связь полимеризованных молекул ГА, аналогичная пиридиновым основаниям, обнаруженным в коллагене костной ткани [84–86]. При этом степень минерализации находится в прямой зависимости от плотности поперечных связей в коллагеновой матрице. Кроме того, в процессе консервации в биоматериале снижается уровень гликозаминогликанов и протеогликанов, сшитых с коллагеном и препятствующих самопроизвольному осаждению солей кальция в мягких тканях [87–89].
Многие годы исследователи работают над изучением механизмов кальцификации и поиском новых методов консервации биологической ткани [90–96]. Одно из направлений поиска связано с препаратами группы БФ. Так, системное парентеральное применение этидроновой и памидроновой кислот при подкожной имплантации биоматериала крысам позволило добиться 97% ингибирования кальцификации. Однако дозы вводимого препарата в данных опытах значительно превышали терапевтические, что вызывало такие осложнения, как остеомаляция и кальциевый дисбаланс. Длительное применение этих препаратов у экспериментальных животных приводило к нарушению общего соматического роста, а терапия короткими курсами была малоэффективна [97].
В стремлении избежать осложнений, связанных с системным применением БФ, началось изучение методов локальной терапии. Первым таким опытом стало использование полимерных матриц, обеспечивающих контролируемое выделение препарата. Биоматериал и полимерную матрицу имплантировали в непосредственной близости (таким образом удавалось избежать системных побочных эффектов), однако матрица довольно быстро истощалась, что не давало возможности длительно создавать терапевтическую концентрацию БФ [98–101]. Недавно был предложен метод локального применения (транскатетерная доставка) Золедроната для предотвращения кальцификации аортального клапана с развитием аортального стеноза у экспериментальных животных [102]. Исследование было проведено на небольшой группе новозеландских кроликов с высокой степенью выраженности аортального стеноза. В качестве антикальциевой терапии применяли лекарственную композицию, содержащую 500 мкг/л Золедроната, ее наносили непосредственно на створки клапана. Через 28 дней эксперимент был завершен. Гистологическое исследование створок показало достоверное уменьшение площади кальциевого поражения почти на 40% в группе, получавшей препарат Золедроната, в сравнении с контролем. Несмотря на хорошую результативность, эта методика достаточна сложна и большинство авторов рекомендуют пока системное применение БФ в клинической терапии аортального стеноза и при кальцификации аортального клапана [103–106].
Прогрессивным шагом явилось использование метода иммобилизации молекул БФ на биологических тканях [107]. Впервые он был описан H. Fleisch с соавт. еще в 1968 г. [108]. В конце прошлого века было опубликовано много работ, подтверждающих антикальциевый эффект БФ, иммобилизованных на коллагеновых биоматериалах, сшитых ГА [109–116].
Атом азота в R2 молекулы аминосодержащих БФ может ковалентно связываться со свободными группами бифункционального консерванта, остающимися по завершении процесса поперечной сшивки (masking group) [114]. Однако первичный, вторичный и третичный атомы азота в аминогруппе имеют разную реакционную способность связывания с альдегидными группами. Исторически первым и наиболее хорошо изученным для целей антикальциевой модификации является Памидронат [111]. Кроме того, были проведены исследования и других соединений этой группы [38, 112–119]. Установлено, что не все БФ обладают антикальцифицирующим эффектом в равной мере. Структура БФ и наличие свободных фосфоновых групп после иммобилизации на биоматериале определяют их биологическую и кальцийингибирующую активность. При этом корреляционная зависимость между кальцийингибирующей активностью и количеством препарата, фиксированного на биоматериале, отсутствует [120]. Наибольшую кальцийингибирующую активность при иммобилизации на ГА-обработанный биоматериал продемонстрировал Памидронат [120].
Следует отметить, что различные БФ при одинаковой концентрации рабочих растворов иммобилизуются на ГА-обработанных биотканях в разных количествах. Количество иммобилизованного БФ зависит от его структуры, а кроме того — от видовой и тканевой принадлежности материала [121–123]. Не было выявлено зависимости между количеством и эффективностью БФ, связанного с консервированным материалом. Интересно, что Золедронат, имеющий среди всех известных БФ самую высокую эффективность при системном применении, оказал наименьший антикальциевый эффект в иммобилизованном состоянии [120]. R.G.G. Russell с соавт. [34] предполагают, что некоторые молекулы БФ связываются с остаточными альдегидными группами, в то время как другие — напрямую с белками, образуя водородные связи (подобно взаимодействию БФ с Thr или Lys FPPS [36]) с аминокислотами, способными потенцировать кальцификацию. В том и другом случаях фосфоновые группы остаются свободными и могут влиять на минерализацию за счет прямого физико-химического связывания гидроксиапатита. В результате исследования [120] установлено, что при разработке стратегии модификации биоматериалов иммобилизованными БФ необходимо учитывать всю совокупность факторов, главные из которых — молекулярная структура самого БФ, консерванта и преобладающего белка соединительно-тканной матрицы. Их основными компонентами являются коллаген и эластин, состоящий из растворимых молекул тропоэластина, связанных десмозином и изодесмозином, который образует нерастворимый эластин [120]. Ранее [122, 123] было показано, что сшивка перикарда ГА способна стабилизировать коллаген, но не эластин, что может привести к деградации эластина, а значит, к снижению упруго-эластических свойств ткани. Это происходит главным образом потому, что эластин имеет очень мало свободных аминогрупп, которые необходимы для сшивания. Все биоматериалы, обработанные ГА, обладают высокой способностью связывать кальций (>100 мкг/мг сухой ткани). Консервация диглицидиловым эфиром этиленгликоля (ДЭЭ) снижает содержание кальция в стенке вены и перикарда в 4 и 40 раз соответственно, однако не влияет на стенку аорты. Минерализация в обработанных ГА и ДЭЭ стенках аорты и вены преимущественно связана с эластином. Таким образом, можно предположить, что улучшение стабилизации эластина позволит уменьшить кальцификацию и увеличить долговечность ткани. Модификация БФ снижает кальцификацию эластина, но не блокирует ее полностью. Работы по поиску «идеального» сшивающего агента для биоматериала продолжаются. Каждый ксеногенный материал требует индивидуальной стратегии защиты [124–126].
Заключение
За полувековую историю медицинского применения бисфосфонатов было синтезировано множество новых соединений, содержащих различные группы в положениях R1 и R2 и, соответственно, имеющих различную антикальциевую активность. У исследователей есть выбор среди уже имеющихся препаратов и широкие возможности для синтеза новых. Необходимо дальнейшее расширение показаний к применению бисфосфонатов, в частности для иммобилизации на ксеногенных биопротезных материалах с целью профилактики их кальцификации в организме реципиента. Данное направление пока недостаточно изучено: неизвестны причины тканеспецифичности различных бисфосфонатов, особенности их связывания и эффективность в зависимости от использованного для консервации сшивающего агента, а также механизмы антикальцифицирующего действия иммобилизованных бисфосфонатов.
Унифицированного метода модификации для различных бисфосфонатов и разных тканей пока не существует. Однако накопленный опыт свидетельствует о том, что перспективы использования бисфосфонатов в качестве антикальциевого агента для создания кардиоваскулярных биопротезов достаточно реальны, и эта проблема нуждается в дальнейшем изучении.
Информация об источниках финансирования. Исследование не имело спонсорской поддержки.
Конфликт интересов. Автор заявляет об отсутствии конфликта интересов.
Литература
- McClung М. Bisphosphonates. Arq Bras Endocrinol Metab 2006; 50(4): 735–744, https://doi.org/10.1590/s0004-27302006000400018.
- Bishop N.J., Russell R.G.G. Bisphosphonates. In: Osteogenesis imperfecta. Shapiro J.R., Byers P.H., Glorieux F.H., Sponseller P.D. (editors). Cambridge, Massachusetts: Academic Press; 2014; p. 495–500, https://doi.org/10.1016/b978-0-12-397165-4.00053-8.
- Peris P., Monegal A., Guañabens N. Bisphosphonates in inflammatory rheumatic diseases. Bone 2021; 146: 11588, https://doi.org/10.1016/j.bone.2021.115887.
- Shi M., Chen L., Wu H., Wang Y., Wang W., Zhang Y., Yan S. Effect of bisphosphonates on periprosthetic bone loss after total knee arthroplasty: a meta-analysis of randomized controlled trials. BMC Musculoskelet Disord 2018; 19(1): 177, https://doi.org/10.1186/s12891-018-2101-z.
- Zameer S., Najmi A.K., Vohora D., Akhtar M. Bisphosphonates: future perspective for neurological disorders. Pharmacol Rep 2018; 70(5): 900–907, https://doi.org/10.1016/j.pharep.2018.03.011.
- Biggin A., Munns C.F. Long-term bisphosphonates therapy in osteogenesis imperfecta. Curr Osteoporos Rep 2017; 15(5): 412–418, https://doi.org/10.1007/s11914-017-0401-0.
- Жабина А.С. Роль бисфосфонатов для профилактики и лечения метастазов в кости. Практическая онкология 2011; 12(3): 124–131.
- Coleman R. Bisphosphonates and breast cancer — from cautious palliation to saving lives. Bone 2020; 140: 115570, https://doi.org/10.1016/j.bone.2020.115570.
- Chapurlat R., Legrand M.A. Bisphosphonates for the treatment of fibrous dysplasia of bone. Bone 2021; 143: 115784, https://doi.org/10.1016/j.bone.2020.115784.
- Ralston S.H. Bisphosphonates in management of Paget’s disease. Bone 2020; 138: 115465, https://doi.org/10.1016/j.bone.2020.115465.
- Sedghizadeh P.P., Sun S., Jones A.C., Sodagar E., Cherian P., Chen C., Junka A.F., Neighbors J.D., McKenna C.E., Russell R.G.G., Ebetino F.H. Bisphosphonates in dentistry: historical perspectives, adverse effects, and novel applications. Bone 2021; 147: 115933, https://doi.org/10.1016/j.bone.2021.115933.
- Suva L.J., Cooper A., Watts A.E., Ebetino F.H., Price J., Gaddy D. Bisphosphonates in veterinary medicine: the new horizon for use. Bone 2021; 142: 115711, https://doi.org/10.1016/j.bone.2020.115711.
- Ossipov D.A. Bisphosphonate-modified biomaterials for drug delivery and bone tissue engineering. Expert Opin Drug Deliv 2015; 12(9): 1443–1458, https://doi.org/10.1517/17425247.2015.1021679.
- Compston J. Practical guidance for the use of bisphosphonates in osteoporosis. Bone 2020; 136: 115330, https://doi.org/10.1016/j.bone.2020.115330.
- Brufsky A., Marti J.L.G., Nasrazadani A., Lotze M.T. Boning up: amino-bisphophonates as immunostimulants and endosomal disruptors of dendritic cell in SARS-CoV-2 infection. J Transl Med 2020; 18(1): 261, https://doi.org/10.1186/s12967-020-02433-6.
- Russell R.G.G. Bisphosphonates: the first 40 years. Bone 2011; 49(1): 2–19, https://doi.org/10.1016/j.bone.2011.04.022.
- Fleisch H. Bisphosphonates: mechanisms of action. Endocr Rev 1998; 9(1): 80–100, https://doi.org/10.1210/edrv.19.1.0325.
- Li Q., Kingman J., Sundberg J.P., Levine M.A., Uitto J. Dual effects of bisphosphonates on ectopic skin and vascular soft tissue mineralization versus bone microarchitecture in a mouse model of generalized arterial calcification of infancy. J Invest Dermatol 2016; 136(1): 275–283, https://doi.org/10.1038/jid.2015.377.
- Orriss I.R., Arnett T.R., Russell R.G.G. Pyrophosphate: a key inhibitor of mineralization. Curr Opin Pharmacol 2016; 28: 57–68, https://doi.org/10.1016/j.coph.2016.03.003.
- Green J.R. Bisphosphonates: preclinical review. Oncologist 2004; 9(S4): 3–13, https://doi.org/10.1634/theoncologist.9-90004-3.
- Papapoulos S.E. Bisphosphonates: how do they work? Best Pract Res Clin Endocrinol Metab 2008; 22(5): 831–847, https://doi.org/10.1016/j.beem.2008.07.001.
- Cremers S., Papapoulos S. Pharmacology of bisphosphonates. Bone 2011; 49(1): 42–49, https://doi.org/10.1016/j.bone.2011.01.014.
- Ebetino F.H., Hogan A.M.L., Sun S., Tsoumpra M.K., Duan X., Triffitt J.T., Kwaasi A.A., Dunford J.E., Barnett B.L., Oppermann U., Lundy M.W., Boyde A., Kashemirov B.A., McKenna C.E., Russell R.G.G. The relationship between the chemistry and biological activity of the bisphosphonates. Bone 2011; 49(1): 20–33, https://doi.org/10.1016/j.bone.2011.03.774.
- Eriksen E.F., Halse J. When should bisphosphonate treatment be discontinued? Tidsskr Nor Laegeforen 2012; 132(14): 1630–1632, https://doi.org/10.4045/tidsskr.11.0788.
- Puljula E., Turhanen P., Vepsäläinen J., Monteil M., Lecouvey M., Weisell J. Structural requirements for bisphosphonate binding on hydroxyapatite: NMR study of bisphosphonate partial esters. ACS Med Chem Lett 2015; 6(4): 397–401, https://doi.org/10.1021/ml5004603.
- Henneman Z.J., Nancollas G.H., Ebetino F.H., Russell R.G.G., Phipps R.J. Bisphosphonate binding affinity as assessed by inhibition of carbonated apatite dissolution in vitro. J Biomed Mater Res A 2008; 85(4): 993–1000, https://doi.org/10.1002/jbm.a.31599.
- Lawson M.A., Xia Z., Barnett B.L., Triffitt J.T., Phipps R.J., Dunford J.E., Locklin R.M., Ebetino F.H., Russell R.G.G. Differences between bisphosphonates in binding affinities for hydroxyapatite. J Biomed Mater Res B Appl Biomater 2010; 92(1): 149–155, https://doi.org/10.1002/jbm.b.31500.
- Kuźnik A., Październiok-Holewa A., Jewula P., Kuźnik N. Bisphosphonates — much more than only drugs for bone diseases. Eur J Pharmacol 2010; 866: 172773, https://doi.org/10.1016/j.ejphar.2019.172773.
- Alwahhabi B.K., Alsuwaine B.A. Long-term use of bisphosphonates in osteoporosis. Saudi Med J 2017; 38(6): 604–608, https://doi.org/10.15537/smj.2017.6.19793.
- Cremers S., Pillai G., Papapoulos S.E. Pharmacokinetics/pharmacodynamics of bisphosphonates. Clin Pharmacokinet 2005; 44(6): 551–570, https://doi.org/10.2165/00003088-200544060-00001.
- Cremers S., Drake M.T., Ebetino F.H., Bilezikian J.P., Russell R.G.G. Pharmacology of bisphosphonates. Br J Clin Pharmacol 2019; 85(6): 1052–1062, https://doi.org/10.1111/bcp.13867.
- Baron R., Ferrari S., Russell R.G.G. Denosumab and bisphosphonates: different mechanisms of action and effects. Bone 2011; 48(4): 677–692, https://doi.org/10.1016/j.bone.2010.11.020.
- Cremers S., Ebetino F.H., Phipps R. On the pharmacological evaluation of bisphosphonates on humans. Bone 2020; 139: 11550, https://doi.org/10.1016/j.bone.2020.115501.
- Russell R.G.G., Watts N.B., Ebetino F.H., Rogers M.J. Mechanisms of action of bisphosphonates: similarities and differences and their potential influence on clinical efficacy. Osteoporos Int 2008; 19(6): 733–759, https://doi.org/10.1007/s00198-007-0540-8.
- Watts N.B., Chessnut C.H. III, Genant H.K., Harris S.T., Jackson R.D., Licata A.A., Miller P.D., Mysiw W.J., Richmond B., Valent D. History of etidronate. Bone 2020; 134: 115222, https://doi.org/10.1016/j.bone.2020.115222.
- Dunford J.E., Kavanagh K., Oppermann U., Ebetino F.H., Russell R.G.G., Rogers M.J. Investigations into the kinetic mechanism of inhibition of farnesyl diphosphate synthase by nitrogen containing bisphosphonates. Bone 2006; 38(3 Suppl 1): 47–48, https://doi.org/10.1016/j.bone.2005.12.037.
- Clarke B.L. The molecular mechanism of nitrogen-containing bisphosphonates as antiosteoporosis drugs. Yearbook of Endocrinology 2007; 2007: 330–331, https://doi.org/10.1016/s0084-3741(08)70151-3.
- Papapoulos S.E. Pamidronate: a model compound of the pharmacology of nitrogen-containing bisphosphonates; a Leiden historical perspective. Bone 2020; 134: 115244, https://doi.org/10.1016/j.bone.2020.115244.
- Dunford J.E., Kwaasi A.A., Rogers M.J., Barnett B.L., Ebetino F.H., Russell R.G.G., Oppermann U., Kavanagh K.L. Structure–activity relationships among the nitrogen containing bisphosphonates in clinical use and other analogues: time-dependent inhibition of human farnesyl pyrophosphate synthase. J Med Chem 2008; 51(7): 2187–2195, https://doi.org/10.1021/jm7015733.
- Князькова И.И. Клиническая фармакология бисфосфонатов. Фармакотерапія 2014; 5(6): 181–182.
- Baroncelli G.I., Bertelloni S. The use of bisphosphonates in pediatrics. Horm Res Paediatr 2014; 82(5): 290–302, https://doi.org/10.1159/000365889.
- Pazianas M., van der Geest S., Miller P. Bisphosphonates and bone quality. BoneKEy Rep 2014; 3, https://doi.org/10.1038/bonekey.2014.24.
- McCloskey E., Paterson A.H., Powles T., Kanis J.A. Clodronate. Bone 2021; 143: 115715, https://doi.org/10.1016/j.bone.2020.115715.
- Cummings S.R., Santora A.C., Black D.M., Russell R.G.G. History of alendronate. Bone 2020; 137: 115411, https://doi.org/10.1016/j.bone.2020.115411.
- Fleurence R.L., Iglesias C.L., Johnson J.M. The cost effectiveness of bisphosphonates for the prevention and treatment of osteoporosis. Pharmacoeconomics 2007; 25(11): 913–933, https://doi.org/10.2165/00019053-200725110-00003.
- Fuggle N.R., Curtis B., Clynes M., Zhang J., Ward K., Javaid M.K., Harvey N.C., Dennison E., Cooper C. The treatment gap: the missed opportunities for osteoporosis therapy. Bone 2021; 144: 115833, https://doi.org/10.1016/l.bone.2020.115833.
- Purohit O.P., Radstone C.R., Anthony C., Kanis J.A., Coleman R.E. A randomised double-blind comparison of intravenous pamidronate and clodronate in the hypercalcaemia of malignancy. Br J Cancer 1995; 72(5): 1289–1293, https://doi.org/10.1038/bjc.1995.502.
- McClung M., Omizo M., Minkoff J., Fiske D., Kriegman A., Beamer E., Zhou W. Single infusion of zoledronic acid 5 mg provides sustained benefits in bone mineral density and biomarkers at 12 months in postmenopausal women with low bone mineral density and prior alendronate therapy. J Clin Densitom 2007; 10(2): S220–S221, https://doi.org/10.1016/j.jocd.2007.03.082.
- Dhillon S., Lyseng-Williamson K.A. Zoledronic acid.Drugs 2008; 68(4): 507–534, https://doi.org/10.2165/00003495-200868040-00010.
- Djordjevic D. Benefits of use of zoledronic acid in carcinoma prostate bone metastases (zoledronic acid). Serb J Anesth Intensive Ther 2017; 39(7–8): 211–217, https://doi.org/10.5937/sjait1708211d.
- Anastasilakis A.D., Polyzos S.A., Efstathiadou Z.A., Savvidis M., Sakellariou G.T., Papatheodorou A., Kokkoris P., Makras P. Denosumab in treatment-naïve and pre-treated with zoledronic acid postmenopausal women with low bone mass: effect on bone mineral density and bone turnover markers. Metabolism 2015; 64(10): 1291–1297, https://doi.org/10.1016/j.metabol.2015.06.018.
- Brown J.P. Antiresorptives: safety concerns — clinical perspective. Toxicol Pathol 2017; 45(7): 859–863, https://doi.org/10.1177/0192623317737066.
- Fernández-Martín S., López-Peña M., Muñoz F., Permuy M., González-Cantalapiedra A. Bisphosphonates as disease-modifying drugs in osteoarthritis preclinical studies: a systematic review from 2000 to 2020. Arthritis Res Ther 2021; 23(1): 60, https://doi.org/10.1186/s13075-021-02446-6.
- Nancollas G.H., Tang R., Phipps R.J., Henneman Z., Gulde S., Wu W., Mangood A., Russell R.G.G., Ebetino F.H. Novel insights into actions of bisphosphonates on bone: differences in interactions with hydroxyapatite. Bone 2006; 38(5): 617–627, https://doi.org/10.1016/j.bone.2005.05.003.
- Price P.A., Faus S.A., Williamson M.K. Bisphosphonates alendronate and ibandronate inhibit artery calcification at doses comparable to those that inhibit bone resorption. Arterioscler Thromb Vasc Biol 2001; 21(5): 817–824, https://doi.org/10.1161/01.atv.21.5.817.
- Price P.A., Omid N., Than T.N., Williamson M.K. The amino bisphosphonate ibandronate prevents calciphylaxis in the rat at doses that inhibit bone resorption. Calcif Tissue Int 2002; 71(4): 356–363, https://doi.org/10.1007/s00223-002-1006-9.
- Lang M., Zhou Z., Shi L., Niu J., Xu S., Lin W., Chen Z., Wang Y. Influence of zoledronic acid on proliferation, migration, and apoptosis of vascular endothelial cells. Br J Oral Maxillofac Surg 2016; 54(8): 889–893, https://doi.org/10.1016/j.bjoms.2016.05.030.
- Jensen P.R., Andersen T.L., Chavassieux P., Roux J.P., Delaisse J.M. Bisphosphonates impair the onset of bone formation at remodeling sites. Bone 2021; 145: 115850, https://doi.org/10.1016/j.bone.2021.115850.
- Bauer C., le Saux O., Pomozi V., Aherrahrou R., Kriesen R., Stölting S., Liebers A., Kessler T., Schunkert H., Erdmann J., Aherrahrou Z. Etidronate prevents dystrophic cardiac calcification by inhibiting macrophage aggregation. Sci Rep 2018; 8(1): 5812, https://doi.org/10.1038/s41598-018-24228-y.
- Russel R.G.G., Xia Z., Dunford J.E., Opperman U., Kwaasi A., Hulley P.A., Kavanagh K.L., Triffitt J.T., Lundy M.W., Phipps R.J., Barnett B.L., Coxon F.P., Rogers M.J., Watts N.B., Ebetino F.H. Bisphosphonates: an update on mechanisms of action and how these relate to clinical efficacy. Ann N Y Acad Sci 2007; 1117(1): 209–257, https://doi.org/10.1196/annals.1402.089.
- Frith J.C., Mӧnkkӧnen J., Auriola S., Mӧnkkӧnen H., Rogers M.J. The molecular mechanism of action of the antiresorptive and antiinflammatory drug clodronate: evidence for the formation in vivo of a metabolite that inhibits bone resorption and causes osteoclast and macrophage apoptosis. Arthritis Rheum 2001; 44(9): 2201–2210, https://doi.org/10.1002/1529-0131(200109)44:92201::aid-art3743.0.co;2-e.
- Lehenkari P.P., Kellinsalmi M., Näpänkangas J.P., Ylitalo K.V., Mӧnkkӧnen J., Rogers M.J., Azhayev A., Väänänen H.K., Hassinen I.E. Further insight into mechanism of action of clodronate: inhibition of mitochondrial ADP/ATP translocase by a nonhydrolyzable, adenine-containing metabolite. Mol Pharmacol 2002; 61(5): 1255–1262, https://doi.org/10.1124/mol.61.5.1255.
- Bando K., Kuroishi T., Tada H., Oizumi T., Tanaka Y., Takahashi T., Mizoguchi I., Sugawara S., Endo Y. Nitrogen-containing bisphosphonates and lipopolysaccharide mutually augment inflammation via adenosine triphosphate (ATP)-mediated and interleukin 1β (IL-1β)-mediated production of neutrophil extracellular traps (NETs). J Bone Miner Res 2021; 36(9): 1866–1878, https://doi.org/10.1002/jbmr.4384.
- Göbel A., Zinna V.M., Dell’Endice S., Jaschke N., Kuhlmann J.D., Wimberger P., Rachner T.D. Anti-tumor effects of mevalonate pathway inhibition in ovarian cancer. BMC Cancer 2020; 20(1): 703, https://doi.org/10.1186/s12885-020-07164-x.
- Dunford J.E., Kwaasi A.A., Kavanagh K.L., Rogers M.J., Oppermann U., Barnett B.B., Ebetino F.H., Russell R.G.G. Structure activity relationships of nitrogen containing bisphosphonates which induce conformational changes in farnesyl pyrophosphate synthase. Bonе 2008; 42 (Suppl 1): S71, https://doi.org/10.1016/j.bone.2007.12.129.
- Tsoumpra M.K., Muniz J.R., Barnett B.L., Kwaasi A.A., Pilka E.S., Kavanagh K.L., Evdokimov A., Walter R.L., Von Delft F., Ebetino F.H., Oppermann U., Russell R.G.G., Dunford J.E. The inhibition of human farnesyl pyrophosphate synthase by nitrogen-containing bisphosphonates. Elucidating the role of active site threonine 201 and tyrosine 204 residues using enzyme mutants. Bone 2015; 81: 478–486, https://doi.org/10.1016/j.bone.2015.08.020.
- Elmariah S. Slowing the progression of aortic stenosis: the emerging role of bisphosphonates. In: Cardiac valvular medicine. Rajamannan N.M. (editor). London: Springer-Verlag; 2013; p. 123–132, https://doi.org/10.1007/978-1-4471-4132-7_1.
- Plotkin L.I., Buvinic S., Balanta-Melo J. In vitro and in vivo studies using non-traditional bisphosphonates. Bone 2020; 134: 115–301, https://doi.org/10.1016/j.bone.2020.115301.
- Watts N.B., Diab D.L. Long-term use of bisphosphonates in osteoporosis. J Clin Endocrinol Metab 2010; 95(4): 1555–1565, https://doi.org/10.1210/jc.2009-1947.
- Rizzoli R. Long-term use of bisphosphonates in osteoporosis. Womens Health 2006; 2(2): 309–315, https://doi.org/10.2217/17455057.2.2.309.
- Aro E., Moritz N., Mattila K., Aro H.T. A long-lasting bisphosphonate partially protects periprosthetic bone, but does not enhance initial stability of uncemented femoral stems: a randomized placebo-controlled trial of women undergoing total hip arthroplasty. J Biomech 2018; 75: 35–45, https://doi.org/10.1016/j.jbiomech.2018.04.041.
- Rogers M.J., Mönkkönen J., Munoz M.A. Molecular mechanisms of action of bisphosphonates and new insights into their effects outside the skeleton. Bone 2020; 139: 115493, https://doi.org/10.1016/j.bone.2020.115493.
- Li K.Y.C. Bioprosthetic heart valves: upgrading a 50-year old technology. Front Cardiovasc Med 2019; 6: 47, https://doi.org/10.3389/fcvm.2019.00047.
- Vyavahare N., Tam H. Bioprosthetic heart valves: from a biomaterials perspective. In: Advances in heart valve biomechanics. Sacks M.S., Liao J. (editors). Cham: Springer Nature Switzerland; 2018; p. 337–382, https://doi.org/10.1007/978-3-030-01993-8_14.
- Барбараш Л.С., Журавлева И.Ю. Эволюция биопротезов клапанов сердца: достижения и проблемы двух десятилетий. Комплексные проблемы сердечно-сосудистых заболеваний 2012; 1: 4–11.
- Mirani B., Parvin Nejad S., Simmons C.A. Recent progress toward clinical translation of tissue engineered heart valves. Can J Cardiol 2021; 37(7): 1064–1077, https://doi.org/10.1016/j.cjca.2021.03.022.
- Shemin R.J. The pursuit of optimal tissue valve durability: novel treatments. J Thorac Cardiovasc Surg 2018; 156(1): 196, https://doi.org/10.1016/j.jtcvs.2018.04.059.
- Braile-Sternieri M.C.V.B., Goissis G., Giglioti A.F., Ramirez V.D.A., Pereira N.P., Vasconcellos A., Basso-Frazzato G.G., Braile D.M. In vivo evaluation of Vivere bovine pericardium valvular bioprosthesis with a new anti-calcifying treatment. Artif Organs 2020; 44(11): E482–E493, https://doi.org/10.1111/aor.13718.
- Manji R.A., Lee W., Cooper D.K.C. Xenograft bioprosthetic heart valves: past, present and future. Int J Surg 2015; 23(Pt B): 280–284, https://doi.org/10.1016/j.ijsu.2015.07.009.
- Filová E., Staňková L., Eckhardt A., Svobodová J., Musílková J., Pala J., Hadraba D., Brynda E., Koňařík M., Pirk J., Bačáková L. Modification of human pericardium by chemical crosslinking. Physiol Res 202; 69(1): 49–59, https://doi.org/10.33549/physiolres.934335.
- Shaik T.A., Alfonso-García A., Zhou X., Arnold K.M., Haudenschild A.K., Krafft C., Leigh Griffiths L.G., Popp J., Marcu L. FLIm-guided Raman imaging to study cross-linking and calcification of bovine pericardium. Anal Chem 2020; 92(15): 10659–10667, https://doi.org/10.1021/acs.analchem.0c01772.
- Meuris B., De Praetere H., Strasly M., Trabucco P., Lai J.C., Verbrugghe P., Herijgers P. A novel tissue treatment to reduce mineralization of bovine pericardial heart valves. J Thorac Cardiovasc Surg 2018; 156(1): 197–206, https://doi.org/10.1016/j.jtcvs.2018.01.099.
- Borer J.S. Bioprosthesis failure: is calcification the only problem? J Am Coll Cardiol 2020; 76(15): 1749–1750, https://doi.org/10.1016/j.jacc.2020.08.065.
- Agathos E.A., Tomos P.I., Kostomitsopoulos N., Koutsoukos P.G. A novel anticalcification treatment strategy for bioprosthetic valves and review of the literature. J Card Surg 2019; 34(10): 895–900, https://doi.org/10.1111/jocs.14151.
- Kiesendahl N., Schmitz C., Von Berg A., Menne M., Schmitz-Rode J., Steinseifer U. In vitro calcification of bioprosthetic heart valves: investigation of test fluids. Ann Biomed Eng 2020; 48(1): 282–297, https://doi.org/10.1007/s10439-019-02347-5.
- D’Alessandro C., Dimopoulos A., Andriopoulou S., Messaris G.A.T., Korossis S., Koutsoukos P., Mavrilas D. In vitro calcification studies on bioprosthetic and decellularized heart valves under quasi-physiological flow conditions. Bio-Des Manuf 2020; 4: 10–21, https://doi.org/10.1007/s42242-020-00110-7.
- D’Alessandro C.C., Komninou M.A., Badria A.F., Korossis S., Koutsouko P., Mavrilas D. Calcification assessment of bioprosthetic heart valve tissues using an improved in vitro model. IEEE Trans Biomed Eng 2020; 67(9): 2453–2461, https://doi.org/10.1109/tbme.2019.2963043.
- Luo Y., Huang S., Ma L. A novel detergent-based decellularization combined with carbodiimide crosslinking for improving anti-calcification of bioprosthetic heart valve. Biomed Mater 2021; 16(4): 045022, https://doi.org/10.1088/1748-605x/ac0088.
- Park C.S., Kim Y.J., Lee J.R., Lim H.G., Chang J.H., Jeong S., Kwon N. Anticalcification effect of a combination of decellularization, organic solvents and amino acid detoxification on glutaraldehyde-fixed xenopericardial heart valves in a large-animal long-term circulatory model. Interact Cardiovasc Thorac Surg 2017; 25(3): 391–399, https://doi.org/10.1093/icvts/ivx131.
- Jorge-Herrero E., Garcia Paez J.M., Del Castilo-Olivares Ramos J.L. Tissue heart valve mineralization: review of calcification mechanisms and strategies for prevention. J Appl Biomater Biomech 2005; 3(2): 67–68.
- Schoen F.J., Levy R.J. Calcification of tissue heart valve substitutes: progress toward understanding and prevention. Ann Thorac Surg 2005; 79(3): 1072–1080, https://doi.org/10.1016/j.athoracsur.2004.06.033.
- Lee C.H. Physiological variables involved in heart valve substitute calcification. Expert Opin Biol Ther 2009; 9(8): 1031–1042, https://doi.org/10.1517/14712590903085091.
- Munnelly A., Schoen F., Vyavahare N. Biomaterial calcification: mechanisms and prevention. In: Degradation of implant materials. Eliaz N. (editor). New York: Springer; 2012; p. 359–392, https://doi.org/10.1007/978-1-4614-3942-4_14.
- Demer L.L., Tintut Y. Heart valve calcification. In: Principles of heart valve engineering. Kheradvar A. (editor). Cambridge, Massachusetts: Academic Press; 2019; p. 307–319, https://doi.org/10.1016/b978-0-12-814661-3.00011-3.
- Schoen F.J., Levy R.J. Bioprosthetic heart valve calcification: clinicopathologic correlations, mechanisms, and prevention. In: Contemporary cardiology. Aikawa E., Hutcheson J.D. (editors). Cham: Humana Press; 2020; p. 183–215, https://doi.org/10.1007/978-3-030-46725-8_9.
- Schoen F.J., Levy R.J., Tam H., Vyavahare N. Pathological calcification of biomaterials. In: Biomaterials science. Wagner W.R., Sakiyama-Elbert S.E., Zhang G., Yaszemski M.J. (editors). Cambridge, Massachusetts: Academic Press; 2020; p. 973–994, https://doi.org/10.1016/b978-0-12-816137-1.00065-9.
- Hirsch D., Schoen F.J., Levy R.J. Effects of metallic ions and diphosphonates on inhibition of pericardial bioprosthetic tissue calcification and associated alkaline phosphatase activity. Biomaterials 1993; 14(5): 371–377, https://doi.org/10.1016/0142-9612(93)90057-9.
- Golomb G., Dixon M., Smith M.S., Schoen F.J., Levy R.J. Controlled-release drug delivery of diphosphonates to inhibit bioprosthetic heart valve calcification: release rate modulation with silicone matrices via drug solubility and membrane coating. J Pharm Sci 1987; 76(4): 271–276, https://doi.org/10.1002/jps.2600760402.
- Golomb G., Dixon M., Smith M.S., Schoen F.J., Levy R.J. Inhibition of bioprosthetic heart valve calcification by sustained local delivery of Ca and Na diphosphonate via controlled release matrices. ASAIO Trans 1986; 32(1): 587–590, https://doi.org/10.1097/00002216-198609000-00045
- Sovány T., Csüllög A., Benkő E., Regdon G. Jr., Pintye-Hódi K. Comparison of the properties of implantable matrices prepared from degradable and non-degradable polymers for bisphosphonate delivery. Int J Pharm 2017; 533(2): 364–372, https://doi.org/10.1016/j.ijpharm.2017.07.023.
- Balas F., Manzano M., Horcajada P., Vallet-Regí M. Confinement and controlled release of bisphosphonates on ordered mesoporous silica-based materials. J Am Chem Soc 2006; 128(25): 8116–8117, https://doi.org/10.1021/ja062286z.
- Synetos A., Toutouzas K., Drakopoulou M., Koutagiar I., Benetos G., Kotronias R., Anousakis-Vlachochristou N., Latsios G., Karanasos A., Agrogiannis G., Metaxas M., Stathogiannis K., Papanikolaou A., Georgakopoulos A., Pianou N., Tsiamis E., Patsouris E., Papalois A., Cokkinos D., Anagnostopoulos C., Tousoulis D. Inhibition of aortic valve calcification by local delivery of zoledronic acid — an experimental study. J Cardiovasc Transl Res 2018; 11(3): 192–200, https://doi.org/10.1007/s12265-018-9802-4.
- Santos L.L., Cavalcanti T.B., Bandeira F.A. Vascular effects of bisphosphonates — a systematic review. Clin Med Insights Endocrinol Diabetes 2012; 5: 47–54, https://doi.org/10.4137/cmed.s10007.
- Donato M., Ferri N., Lupo M.G., Faggin E., Rattazzi M. Current evidence and future perspectives on pharmacological treatment of calcific aortic valve stenosis. Int J Mol Sci 2020; 21(21): 8263, https://doi.org/10.3390/ijms21218263.
- Cutini P.H., Rauschemberger M.B., Sandoval M.J., Massheimer V.L. Vascular action of bisphosphonates: in vitro effect of alendronate on the regulation of cellular events involved in vessel pathogenesis. J Mol Cell Cardiol 2016; 100: 83–92, https://doi.org/10.1016/j.yjmcc.2016.08.017.
- Dayanand P., Sandhyavenu H., Dayanand S., Martinez J., Rangaswami J. Role of bisphosphonates in vascular calcification and bone metabolism: a clinical summary. Curr Cardiol Rev 2018; 14(3): 192–199, https://scite.ai/reports/10.2174/1573403x14666180619103258.
- Elnashar M.M. Immobilized molecules using biomaterials and nanobiotechnology. J Biomater Nanobiotechnol 2010; 1(1): 61–77, https://doi.org/10.4236/jbnb.2010.11008.
- Fleisch H., Russell R.G., Bisaz S., Mühlbauer R. Influence of diphosphonates on the deposition and dissolution of ccalcium phosphate in vitro and in vivo. Helv Physiol Pharmacol Acta 1968; 26(3): CR345–CR346.
- Dewanjee M.K., Solis E., Lanker J., Mackey S.T., Lombardo G.M., Tidwell C., Ellefsen R.D., Kaye M.P. Effect of diphosphonate binding to collagen upon inhibition of calcification and promotion of spontaneous endothelial cell coverage on tissue valve prostheses. ASAIO Trans 1986; 32(1): 24–29.
- Dewanjee M.K. Treatment of collagen tissue with glutaraldehyde and aminophosphonate calcification inhibitor. Patent US 4553974. 1985.
- Webb C.L., Phelps L.L., Schoen F.J., Levy R.J. Aminodiphosphonate or AI preincubation inhibits calcification of aortic homografts in the rat subdermal model. ASAIO Trans 1988; 34(3): 851–854.
- Johnston T.P., Schoen F.J., Levy R.J. Prevention of calcification of bioprosthetic heart valve leaflets by Ca2+ diphosphonate pretreatment. J Pharm Sci 1988; 77(9): 740–744, https://doi.org/10.1002/jps.2600770903.
- Webb C.L., Benedict J.J., Schoen F.J., Linden J.A., Levy R.J. Inhibition of bioprosthetic heart valve calcification with aminodiphosphonate covalently bound to residual aldehyde groups. Ann Thorac Surg 1988; 46(3): 309–316, https://doi.org/10.1016/s0003-4975(10)65932-2.
- Webb C.L., Schoen F.J., Levy R.J. Covalent binding of aminopropanehydroxydiphosphonate to glutaraldehyde residues in pericardial bioprosthetic tissue: stability and calcification inhibition studies. Exp Mol Pathol 1989; 50(3): 291–302, https://doi.org/10.1016/0014-4800(89)90039-7.
- Nimni M.E., Ertl D., Villanueva J., Nimni B.S. Inhibition of ectopic calcification of glutaraldehyde crosslinked collagen and collagenous tissues by a covalently bound diphosphonate (APD). Am J Cardiovasc Pathol 1990; 3(3): 237–245.
- Levy R.J., Qu X., Underwood T., Trachy J., Schoen F.J. Calcification of valved aortic allografts in rats: effects of age, crosslinking, and inhibitors. J Biomed Mater Res 1995; 29(2): 217–226, https://doi.org/10.1002/jbm.820290212.
- Savino S., Toscano A., Purgatorio R., Profilo E., Laghezza A., Tortorella P., Angelelli M., Cellamare S., Scala R., Tricarico D., Marobbio C.M.T., Perna F., Vitale P., Agamennone M., Dimiccoli V., Tolomeo A., Scilimati A. Novel bisphosphonates with antiresorptive effect in bone mineralization and osteoclastogenesis. Eur J Med Chem 2018; 158: 184–200, https://doi.org/10.1016/j.ejmech.2018.08.044.
- Widler L., Jaeggi K.L., Glatt M., Müller K., Bachmann R., Bisping M., Born A.R., Cortesi R., Guiglia G., Jeker H., Klein R., Ramseier U., Schmid J., Schreiber G., Seltenmeyer Y., Green J.R. Highly potent geminal bisphosphonates. From pamidronate disodium (Aredia) to zoledronic acid (Zometa). J Med Chem 2002; 45(17): 3721–3738, https://doi.org/10.1021/jm020819i.
- Ishida K., Ashizawa N., Matsumoto K., Kobashi S., Kurita N., Shigematsu T., Iwanaga T. Novel bisphosphonate compound FYB-931 preferentially inhibits aortic calcifcation in vitamin D3-treated rats. J Bone Miner Metab 2019; 37(5): 796–804, https://doi.org/10.1007/s00774-019-00987-0.
- Zhuravleva I.Y., Polienko Y.F., Karpova E.V, Timchenko T.P., Vasilieva M.B., Baratova L.A., Shatskaya S.S., Kuznetsova E.V., Nichay N.R., Beshchasna N., Bogachev-Prokophiev A.V. Treatment with bisphosphonates to mitigate calcification of elastin-containing bioprosthetic materials. J Biomed Mater Res A 2020; 108(7): 1579–1588, https://doi.org/10.1002/jbm.a.36927.
- Jin W., Guo G., Chen L., Lei Y., Wang Y. Elastin stabilization through polyphenol and ferric chloride combined treatment for the enhancement of bioprosthetic heart valve anticalcification. Artif Organs 2018; 42(11): 1062–1069, https://doi.org/10.1111/aor.13151.
- Zhuravleva I.Y., Nichay N.R., Kulyabin Y.Y., Timchenko T.P., Korobeinikov A.A., Polienko Y.F., Shatskaya S.S., Kuznetsova E.V., Voitov A.V., Bogachev-Prokophiev A.V., Karaskov A.M. In search of the best xenogeneic material for a paediatric conduit: an experimental study. Interact Cardiovasc Thorac Surg 2018; 26(5): 738–744, https://doi.org/10.1093/icvts/ivx445.
- Nichay N.R., Zhuravleva I.Y., Kulyabin Y.Y., Timchenko T.P., Voitov A.V., Kuznetsova E.V., Soynov I.A., Zubritskiy A.V., Bogachev-Prokophiev A.V., Karaskov A.M. In search of the best xenogeneic material for a paediatric conduit: an analysis of clinical data. Interactive Interact Cardiovasc Thorac Surg 2018; 27(1): 34–41, https://doi.org/10.1093/icvts/ivy029.
- Hendriks M., Everaerts F., Verhoeven M. Bioprostheses and its alternative fixation. J Long Term Eff Med Implants 2017; 27(2–4): 137–157, https://doi.org/10.1615/jlongtermeffmedimplants.v27.i2-4.40.
- Резвова М.А., Овчаренко Е.А., Глушкова Т.В., Кудрявцева Ю.A., Барбараш Л.С. Оценка резистентности к кальцификации ксеноперикарда, обработанного полигидроксисоединениями. Вестник трансплантологии и искусственных органов 2021; 23(1): 75–83, https://doi.org/10.15825/1995-1191-2021-1-75-83.
- Yu T., Yang W., Zhuang W., Tian Y., Kong Q., Chen X., Li G., Wang Y. A bioprosthetic heart valve cross-linked by a non-glutaraldehyde reagent with improved biocompatibility, endothelialization, anti-coagulation and anti-calcification properties. J Mater Chem B 2021; 9(19): 4031–4038, https://doi.org/10.1039/d1tb00409c.










