Мультимодальная оптическая когерентная томография для интраоперационного определения границ опухоли и статуса краев резекции при органосохраняющем лечении рака молочной железы
Цель исследования — сравнить эффективность мультимодальной оптической когерентной томографии (ММ ОКТ) в традиционном режиме структурной ОКТ и режиме ОКТ-эластографии (OКЭ) для решения двух клинически важных задач: 1) обнаружения групп опухолевых клеток на хирургических краях резекции во время органосохраняющих операций (ОСО) при раке молочной железы (РМЖ) и 2) определения границ опухоли молочной железы, подтвердив полученные результаты с соответствующими гистологическими срезами.
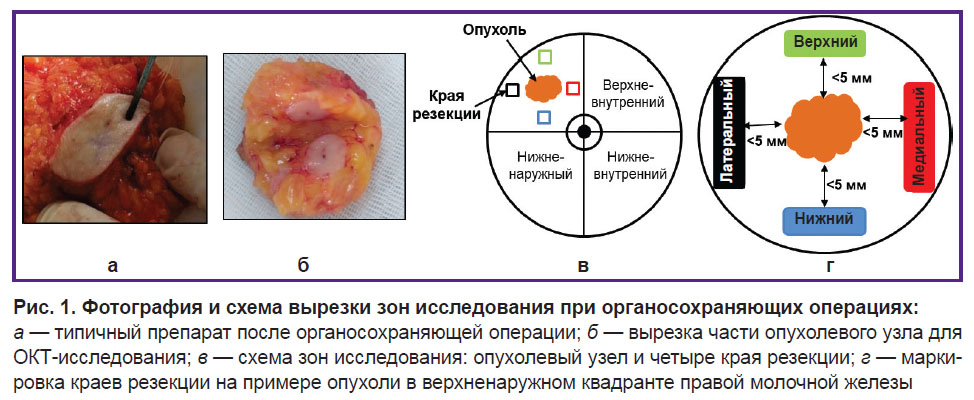
Материалы и методы. Исследование проводили на 100 образцах хирургического края резекции (верхний, нижний, медиальный и латеральный — по четыре образца от каждого пациента), полученных от 25 пациентов с РМЖ, перенесших ОСО (лампэктомию), и на 25 послеоперационных образцах опухоли (для определения границ опухоли). Методом ММ ОКТ визуально и численно оценивали рассеивающие (уровень и глубину проникновения сигнала ОКТ) и упругие (значения жесткости, или модуля Юнга, кПа) свойства опухолевой и неопухолевой тканей молочной железы. Полученные значения сравнивали с результатами послеоперационного гистологического исследования.
Результаты. В 4 образцах хирургического края (из 100) методом OКЭ были идентифицированы группы гистологически подтвержденных опухолевых клеток («положительные» края резекции) на расстоянии около 5 мм от видимого края опухоли. Во всех этих случаях выявленные зоны имели жесткость более 400 кПа и были по размеру больше 0,5 мм. Структурная ОКТ не могла идентифицировать эти группы опухолевых клеток, так как они по рассеивающим свойствам были не отличимы от окружающей фиброзной ткани.
В областях перехода опухоли в неопухолевую ткань молочной железы структурные ОКТ-изображения обнаруживали границы опухоли только в том случае, если опухоль граничила с жировой тканью, и не обнаруживали перехода, если опухоль граничила с неопухолевой фиброзной тканью. Изображения OКЭ с высокими значениями жесткости (более 400 кПа) и высокой контрастностью показали четкие границы опухоли как с жировой, так и с фиброзной тканью.
Заключение. Продемонстрирован потенциал ММ ОКТ как метода интраоперационной оценки чистоты краев резекции и хирургического определения границ опухоли во время ОСО при РМЖ в режиме реального времени. Изображения OКЭ по сравнению со структурными OКТ-изображениями демонстрируют более высокий контраст между различными типами ткани молочной железы (жировая ткань, фиброзная строма, гиалинизированная строма, скопления опухолевых клеток), а также более точную идентификацию границы опухоли и обнаружение небольших групп опухолевых клеток в краях резекции. Предложен алгоритм интраоперационного ММ ОКТ-исследования определения границы резекции в соответствии со стандартными клиническими рекомендациями по достижению чистых хирургических краев резекции у больных РМЖ.
Введение
Рак молочной железы (РМЖ) остается актуальной проблемой в онкологии. В России РМЖ занимает первое место по показателям заболеваемости и смертности среди злокачественных новообразований у женщин [1]. Раннее обнаружение является ключом к успешному его лечению, включая органосохраняющие операции (ОСО) и нехирургические подходы к лечению рака [2]. Рост числа ОСО в последние годы связан с улучшением диагностических возможностей и выявлением начальных стадий РМЖ.
Основным критерием для определения и подтверждения оптимально выполненного объема ОСО является чистота краев резекции (участков иссеченной ткани молочной железы, находящихся на границе с операционным разрезом) [3]. При этом научные исследования показали высокую частоту развития местного рецидива РМЖ (около 20%) у пациенток с наличием опухолевых клеток в краях резекции при выполнении ОСО, что требует применения в процессе операции срочного интраоперационного исследования краев резекции [4].
В настоящее время доступны несколько методов оценки хирургического края резекции, однако все они имеют свои недостатки. Например, у широко распространенных традиционных микроскопических методов, таких как экспресс-биопсия замороженных срезов и цитологическое исследование мазков-отпечатков, ошибки и сложности проведения объясняются недостаточностью количества забранного материала, техническими трудностями в работе с жировой тканью, необходимостью дополнительного времени для проведения исследования, вследствие чего эти методы имеют ограниченную эффективность, особенно для внутрипротокового рака in situ [5–8]. В некоторых исследованиях для контроля чистоты краев резекции было показано применение интраоперационного ультразвука, однако он в силу низкого разрешения имеет ограниченную чувствительность к небольшим опухолевым скоплениям, невысокую надежность для визуализации рака in situ [9, 10] и зависит от мастерства оператора. На решение задачи интраоперационно охарактеризовать опухолевую ткань и провести оценку края резекции направлен ряд оптических технологий, таких как Рамановская спектроскопия [11–13] и флуоресцентная микроскопия [14, 15]. Однако основными ограничениями данных методов являются исследование небольших участков ткани, низкая глубина и скорость сканирования.
Предлагаются и другие методы для интраоперационной оценки хирургических краев резекции [16, 17].
Перспективным методом решения задачи интраоперационного определения границы РМЖ и оценки чистоты краев резекции в режиме реального времени с высоким разрешением и без использования дополнительных красителей может стать оптическая когерентная томография (ОКТ), возможности которой расширяются с разработкой новых модальностей (поляризационно-чувствительной, эластографической и микроангиографической ОКТ). В работах [18–21] при исследовании РМЖ была использована высокоразрешающая ОКТ для классификации типов тканей молочной железы с применением ручного ОКТ-зонда для in vivo обнаружения опухолевых клеток как в ложе резекции, так и на удаленных образцах. Продемонстрирована возможность применения компрессионной ОКТ-эластографии (ОКЭ) для визуализации морфологической неоднородности ткани РМЖ и интраоперационного определения границы опухоли [22–26]. Однако все проведенные в этих работах исследования имеют все еще экспериментальный поисковый характер, в связи с чем требуется поиск новых подходов к проведению ОКТ-исследования, приближенного к реальным клиническим условиям.
На сегодняшний день не существует единого мнения по определению размера оптимальных краев резекции. Разными авторами обсуждаются разные диапазоны ширины этих краев — от 1 до 10 мм. Большинство (65%) хирургов считают приемлемой ширину краев резекции 2 мм или более, хотя 35% рассматривают в качестве приемлемой ширину менее 2 мм [27, 28]. Ожидается, что онкологи-хирурги, применяя ОКТ, получат важную новую информацию, которая может повысить надежность определения оптимальных краев резекции и чувствительность обнаружения опухолевых клеток на границе резекции опухоли в ходе ОСО.
Таким образом, актуальность настоящего исследования обусловлена объективными хирургическими трудностями в поиске «негативного» края резекции при лампэктомии и необходимостью применения новых неинвазивных высокоразрешающих методов интраоперационной визуализации в реальном масштабе времени.
Целью исследования является определение границ опухоли и статуса краев резекции при ОСО у больных РМЖ под контролем мультимодальной ОКТ с комплексным анализом структурных и эластографических ОКТ-изображений в режиме реального времени.
Материалы и методы
Послеоперационные образцы тканей молочной железы пациенток. Послеоперационные образцы опухолевой и неопухолевой тканей молочной железы получены от 25 женщин с РМЖ T1–2N0M0 (G2–3) стадии, которым была проведена ОСО в объеме радикальной резекции или лампэктомии с гистологическим контролем краев резекции. Возраст пациенток варьировал от 41 года до 78 лет.
Всем больным был выполнен стандартный комплекс обследований, включавший маммографию в двух проекциях, УЗИ молочных желез и регионарных зон, диагностические пункции с цитологическим исследованием при возможности их исполнения.
Критерии отбора пациенток: наличие узлового образования в ткани молочной железы, гистологически или цитологически верифицированного как злокачественное новообразование, размером ~10±10 мм (по шкале BI-RADS 5); отсутствие признаков мультифокальности и мультицентричности; отсутствие признаков диссеминации.
В зависимости от клинической ситуации и объема пораженной ткани предоперационную маркировку проводили под ультразвуковой или маммографической навигацией с использованием маркировочной пункционной иглы 19G с последующей топографической маркировкой на коже.
После ОСО выполняли плановое послеоперационное гистологическое и дополнительное мультимодальное ОКТ-исследование (ММ ОКТ) ex vivo образцов молочной железы из центральной части опухолевого узла с окружающей неопухолевой тканью, а также всех маркированных краев резекции окружающей неопухолевой ткани молочной железы. Края резекции ткани молочной железы исследовали на расстоянии около 5 мм от видимой границы опухоли. Удаленные 4 фрагмента края резекции прошивали хирургической нитью с указанием ориентации: «верх», «низ», «медиальный», «латеральный» (рис. 1), так же, как и для стандартного гистологического исследования [2].
После получения ОКТ- и ОКЭ-изображений на образце ткани молочной железы гистологической тушью отмечали область сканирования, из ткани маркированной области готовили гистологические срезы и проводили морфологический анализ.
На проведение экспериментальных исследований на ex vivo послеоперационных образцах тканей молочной железы получено информированное согласие пациенток и разрешение Этического комитета Приволжского исследовательского медицинского университета.
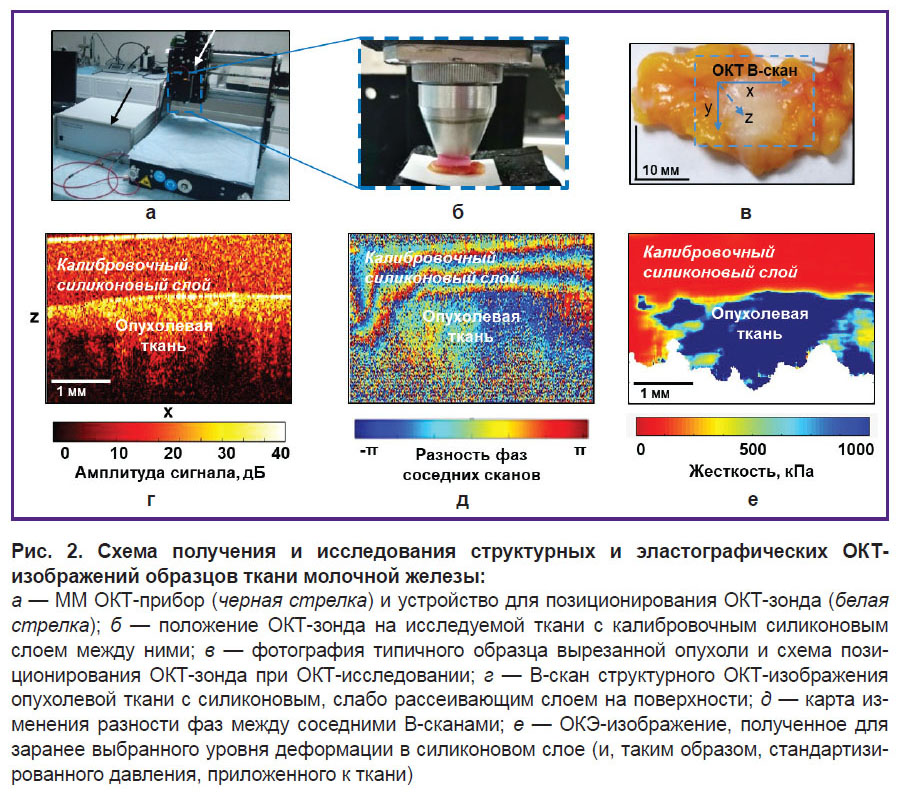
ММ ОКТ-устройство. В работе использован спектральный ММ ОКТ-прибор (Институт прикладной физики РАН, Н. Новгород) с комплексным получением структурных и эластографических ОКТ-изображений в режиме реального времени (рис. 2, а). В приборе используется зондирующее излучение с центральной длиной волны 1310 нм, шириной спектра 100 нм и мощностью на объекте 20 мВт. Разрешение по глубине (в воздухе) составляет ~15 мкм, поперечное разрешение ~20 мкм, глубина сканирования в воздухе ~2 мм, скорость получения спектральных отсчетов на приемной линейке — 20 кГц/с; запись 3D-изображения размером 2,40×2,40×1,25 мм занимает 26 с [29, 30]. ММ ОКТ-прибор оснащен торцевым волоконно-оптическим зондом с внешним диаметром объектива 10 мм, который подводится к исследуемой поверхности ткани контактно (рис. 2, б). Для точного позиционирования ОКТ-зонда на поверхности ткани использовано устройство PLRA4 (PureLogic R&D, Воронеж) (см. рис. 2, а), позволяющее перемещать ОКТ-зонд по осям х–у с минимальным шагом 10 мкм (рис. 2, в).
Из полученного 3D-изображения (256×256 В-сканов) в нашем исследовании детальному анализу подвергался только центральный B-скан (рис. 2, г), который представлен в псевдоцветной желто-коричневой палитре: оттенки желтого соответствуют высокому уровню ОКТ-сигнала, а оттенки коричневого — низкому уровню.
Анализ изображений оптической когерентной эластографии. Методом компрессионной фазово-чувствительной ОКЭ были изучены упругие свойства (жесткость) ткани молочной железы на основе визуализации деформаций, создаваемых в ткани прижатием ОКТ-зонда [31–36]. В основе картирования деформации ткани лежит метод оценки межкадровой вариации градиента фазы сигнала между соседними В-сканами (рис. 2, д). Чем больше вариация градиента фазы ОКТ-сигнала, тем выше процент деформации ткани. Метод компрессионной ОКЭ с использованием калибровочного силиконового слоя с известной жесткостью (100 кПа в данной работе) на поверхности биоткани позволяет количественно оценивать ее упругие свойства (модуль Юнга, кПа) со степенью детализации ~30–50 мкм (масштаб порядка десятка клеток). Одновременное оценивание деформаций в калибровочном слое силикона и ткани в ходе ее нагружения зондом позволяет получать для нее зависимость «напряжение–деформация» [35, 36]. Модуль Юнга исследуемой ткани молочной железы оценивали как наклон нелинейной зависимости «напряжение–деформация» для исследуемой ткани при выбираемой величине давления на ткань. Для количественной оценки и сравнительного анализа ОКЭ-изображений ткани молочной железы использовали стандартизированный диапазон давления на ткань (2±1 кПа). Такая стандартизация важна, так как исследования образцов РМЖ показали, что отношение нагружение/деформация для таких тканей может проявлять выраженную нелинейность [37, 38]. Это означает, что при умеренной деформации (в несколько процентов) модуль Юнга может изменяться в несколько раз.
Полученные в данном исследовании B-сканы ОКЭ-изображений были представлены в виде карт с цветовой кодировкой для модуля Юнга в диапазоне от нескольких единиц кПа до 1000 кПа. Диапазон значений жесткости для эластографических карт был подобран так, чтобы цвета наилучшим образом отображали разные типы ткани (опухолевую и неопухолевую). В наших предыдущих работах [22, 23] путем прицельного сопоставления гистологических и ОКЭ-изображений были определены характерные диапазоны значений модуля упругости (модуля Юнга) пяти основных морфологических компонентов ткани молочной железы. Самые жесткие участки (сине-зеленый цвет — более 400 кПа) указывают на наличие кластеров опухолевых клеток (масштаб порядка 300 мкм и более), а самые мягкие области (красный цвет — ниже 100 кПа) представляют собой жировую и неизмененную соединительную ткань. Ткани с промежуточной жесткостью (преобладание оранжевого и желтого цветов, соответствующих ~100–400 кПа) содержат такие дегенеративные изменения стромы молочной железы, как фиброз или гиалиноз коллагеновых волокон, а также лимфогистиоцитарное воспаление. Таким образом, в настоящем исследовании на основе визуального анализа ОКЭ-изображений значение модуля Юнга 400 кПа и более мы считаем порогом обнаружения комплексов опухолевых клеток.
Гистологический анализ. После ММ ОКТ-сканирования образцы ткани молочной железы фиксировали в 10% растворе нейтрального формалина в течение 48 ч, затем заливали в парафин. Плоскость, в которой получали серийные гистологические срезы, совпадала с плоскостью получения ОКТ- и ОКЭ-изображений. Серийные срезы окрашивали гематоксилином и эозином для постановки общего клинического диагноза. Гистологические препараты оценивали с помощью микроскопа Leica DM2500 (Leica Microsystems, Германия), оснащенного цифровой камерой DFC 245C.
Все образцы ткани молочной железы были разделены патологоанатомом на группы в соответствии с их морфологической структурой: жировая ткань (липоматоз) (n=31); жировая ткань с единичными прослойками соединительной ткани (n=28); фиброзная ткань с расширенными протоками/дольками и прослойками соединительной ткани (n=16); склерозирующая фиброзно-кистозная мастопатия (n=23); неинвазивный внутрипротоковый рак in situ (DCIS) (n=2); инфильтрирующий протоковый РМЖ (n=22) и дольковый РМЖ (n=3).
При ОСО, выполненных по поводу РМЖ, основным критерием радикальности хирургического вмешательства является чистота краев резекции. Согласно стандартному морфологическому заключению, «положительный» край резекции — это наличие опухолевых клеток или рака in situ по краю резекции. При «негативном» (чистом) крае резекции опухолевые клетки не обнаруживаются в краях иссеченных тканей молочной железы [39, 40].
Всего получено и проанализировано с помощью ОКТ и гистологически 125 образцов.
Результаты
Путем ММ ОКТ-исследования первичных опухолевых образцов были установлены точные границы опухоли и определены микроструктурные особенности инфильтрирующего протокового и долькового РМЖ. При исследовании 100 краев резекции с опухолью 96 образцов были определены как «негативные» края резекции. Они включали жировую ткань, жировую ткань с единичными прослойками соединительной ткани; фиброзную ткань с расширенными протоками; склерозирующую фиброзно-кистозную мастопатию — диффузный фиброз, в полях которого располагаются дольки и протоки с кистозным расширением. В 4 из 100 исследуемых образцов краев резекции были обнаружены «положительные» края резекции по гистологическим заключениям: инвазивный РМЖ или рак in situ.
Определение статуса краев резекции при ОСО у больных РМЖ. ОКТ- и ОКЭ-изображения на основе визуального анализа распределения рассевающих и упругих свойств ткани молочной железы позволили во всех случаях исследования краев резекции дифференцировать их как «негативные» и «положительные» на расстоянии около 5 мм от видимой границы с опухолью, что было подтверждено гистологическим исследованием.
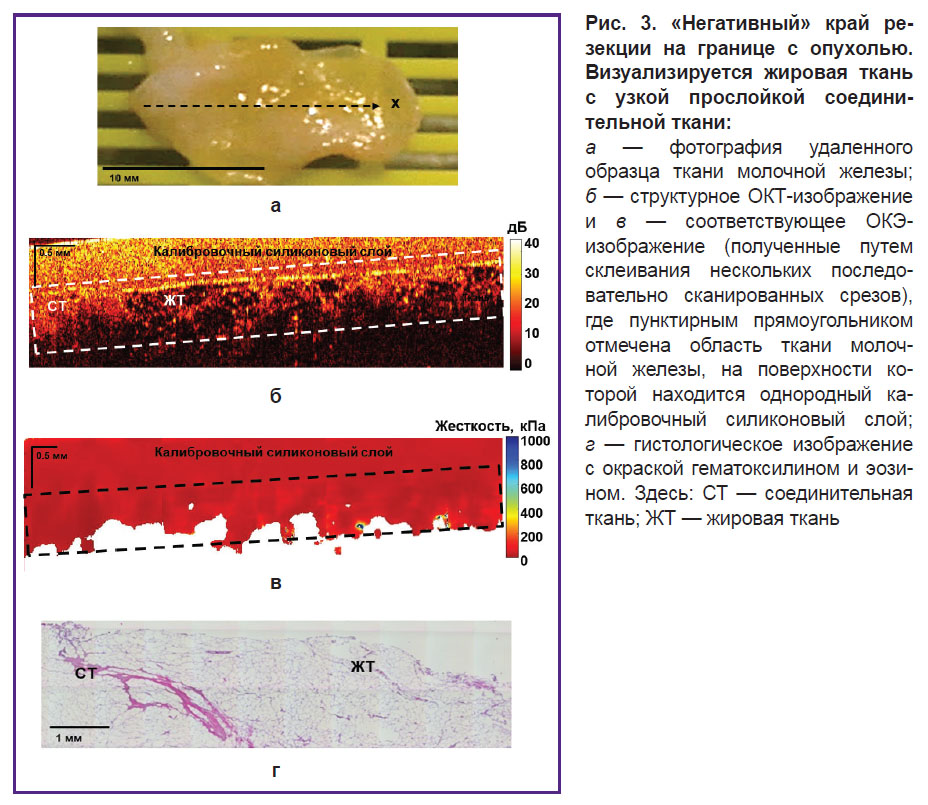
«Негативные» края резекции, как уже упоминалось, могут включать различные виды доброкачественных тканей. Так, на рис. 3 показан пример визуализации «негативного» края резекции ткани, представленной разрастанием жировой ткани молочной железы (липоматоз) с тонкими прослойками доброкачественной соединительной ткани, которая на структурных ОКТ-изображениях (рис. 3, б) характеризуется «сотовой» структурой с низким уровнем ОКТ-сигнала в области жировой ткани и более высоким уровнем сигнала в области соединительной ткани. Соответствующие ОКЭ-изображениях (рис. 3, в) неизмененной соединительной ткани и жировой ткани характеризуются самыми низкими значениями жесткости (менее 100 кПа).
На рис. 4 показан другой пример визуализации «негативного» края резекции ткани молочной железы с участками жировой ткани и более крупными областями доброкачественной соединительной ткани (склерозирующая фиброзно-кистозная мастопатия), которые на ОКТ-изображениях (рис. 4, б) характеризуются высоким уровнем ОКТ-сигнала и большой глубиной его проникновения. На соответствующих ОКЭ-изображениях (рис. 4, в) фиксируются как низкие значения жесткости (менее 100 кПа), так и незначительно повышенная жесткость в области доброкачественной фиброзной стромы (100–200 кПа). Кроме того, в данном случае наблюдается несколько точек с высокой жесткостью (более 400 кПа) (рис. 4, в, стрелки), соответствующих областям долек и протоков с кистозным расширением. Однако столь малые (точечные) зоны с высокой жесткостью не могут считаться подозрительными на опухолевые клетки.
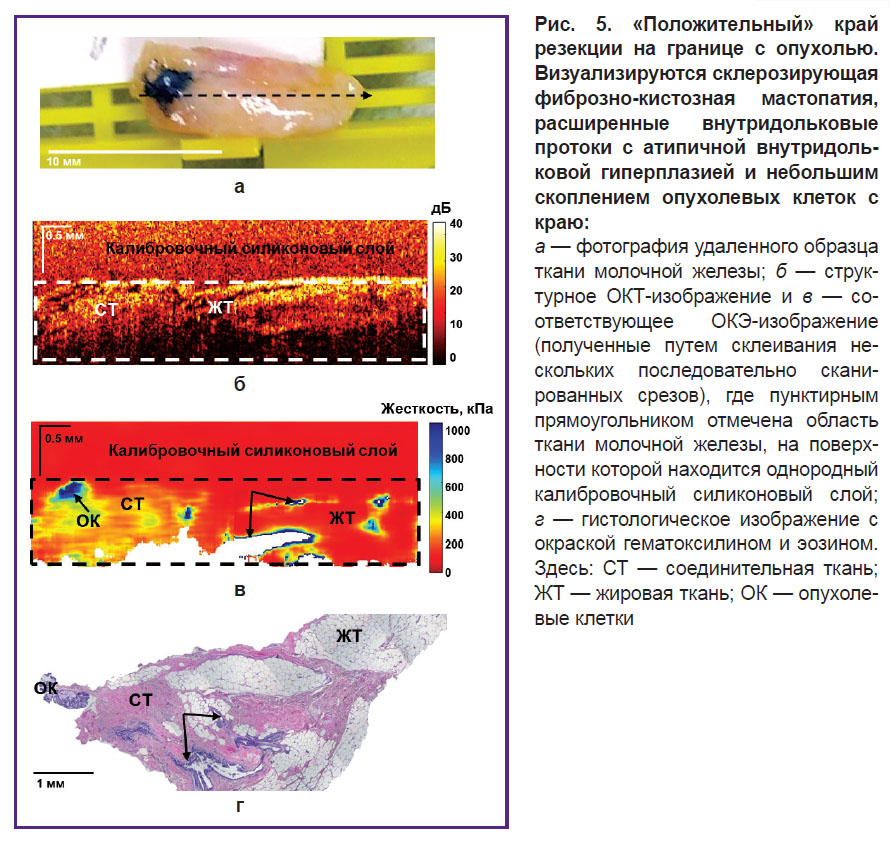
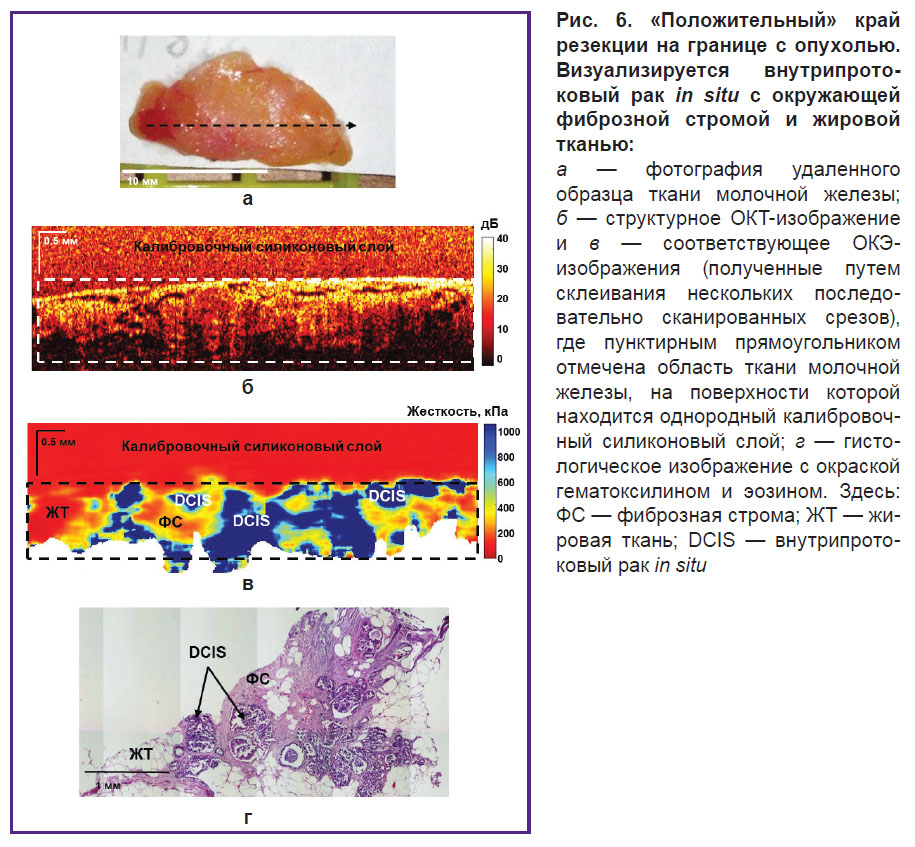
На рис. 5 и 6 показаны примеры идентификации «положительного» края резекции — инвазивный РМЖ и внутрипротоковый рак in situ. На рис. 5 показан пример идентификации небольших скоплений опухолевых клеток в окружающей неопухолевой фиброзной ткани с расширенными внутридольковыми протоками. Обнаружение высоких (более 400 кПа) значений модуля Юнга на ОКЭ-изображении (рис. 5, в) позволило предположить «положительный» край резекции. Послеоперационное гистологическое исследование подтвердило наличие небольших скоплений опухолевых клеток (размером более 0,5 мм) с левого края в окружающей жировой и фиброзной ткани (рис. 5, г). При этом на соответствующем ОКТ-изображении (рис. 5, б) в данном случае области небольшого скопления опухолевых клеток не были определены, вероятно, из-за неспособности ОКТ обнаружить небольшую инфильтрацию опухолевых клеток в окружающей фиброзной ткани с высоким уровнем ОКТ-сигнала.
На рис. 6 показан пример идентификации внутрипротокового рака in situ в окружающих фиброзной и жировой тканях. Так же, как и в предыдущем случае, ОКЭ-изображения по сравнению со структурными ОКТ-изображениями позволили более контрастно и четко определить наличие опухолевых клеток в крае резекции. Протоки, заполненные опухолевыми клетками, при внутрипротоковом раке in situ (DCIS) визуализируются в виде высококонтрастных зон с сильно повышенной жесткостью (более 500 кПа) на ОКЭ-изображениях (рис. 6, в), хорошо совпадающих с гистологическим изображением (рис. 6, г). Окружающая фиброзная ткань характеризуется значениями жесткости ~200 кПа, жировая ткань — менее 100 кПа.
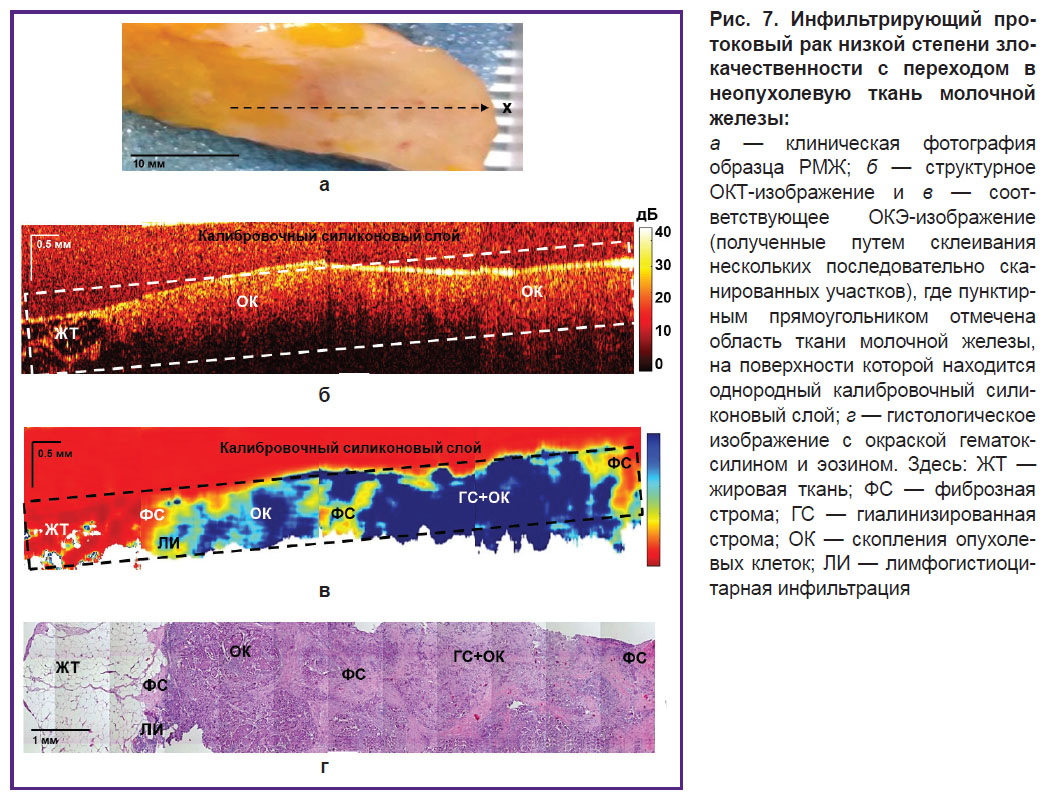
Определение границ опухоли при ОСО у больных РМЖ. На рис. 7 показаны результаты ОКТ, ОКЭ и гистологического исследования инфильтрирующего протокового РМЖ низкой степени злокачественности. ОКТ- и ОКЭ-изображения были получены на протяжении всего опухолевого узла с переходом в неопухолевую ткань молочной железы. Установлено, что ОКТ-изображения центральной области опухолевого узла характеризуются однородным и медленно затухающим с глубиной ОКТ-сигналом (рис. 7, б). На ОКТ-изображении видна граница перехода опухоли в окружающую жировую ткань, которая характеризуется характерной для нее «сотовой» структурой с низким уровнем ОКТ-сигнала. Соответствующие ОКЭ-изображения РМЖ показали неоднородное распределение высоких (более 400 кПа) и низких (менее 400 кПа) значений модуля упругости (рис. 7, в), что указывало на наличие как опухолевых клеток, так и стромы опухоли. При этом стоит отметить, что на ОКЭ-изображении граница перехода опухоли в жировую ткань молочной железы визуализируется намного более четко и контрастно по сравнению со структурными ОКТ-изображениями. На основе морфологического анализа диагностирован инфильтрирующий протоковый рак солидно-скиррозного строения с участками фиброзной стромы и гиалинозом единичных волокон коллагена, а также наличием умеренно выраженной лимфогистиоцитарной инфильтрации, преимущественно по периферии опухоли (рис. 7, г).
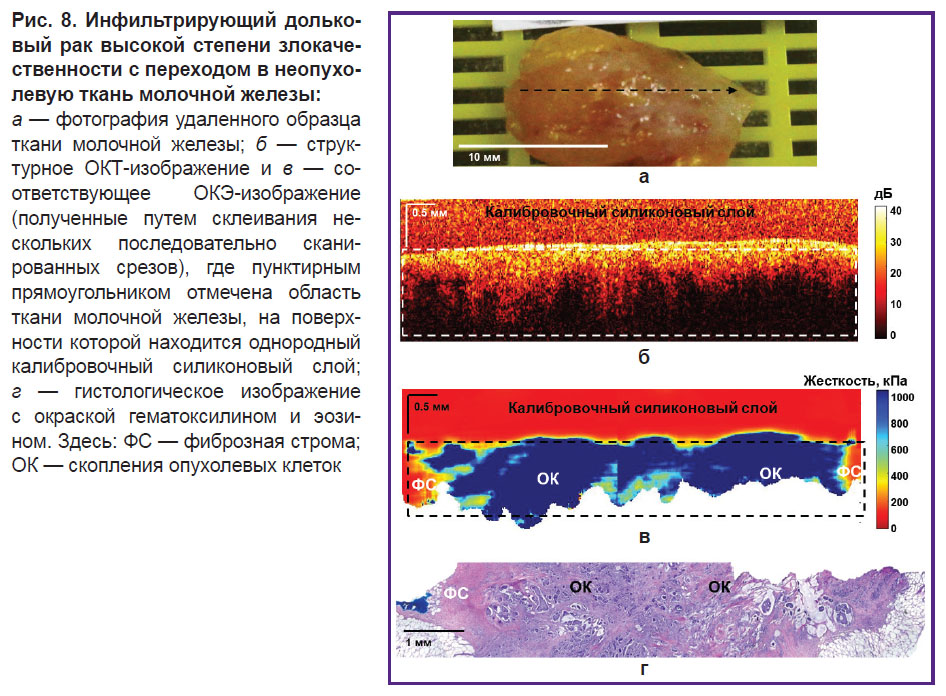
Результаты ОКТ, ОКЭ и гистологического исследования инфильтрирующего долькового РМЖ высокой степени злокачественности показаны на рис. 8. Как и в предыдущем случае, ОКТ- и ОКЭ-изображения получены на протяжении всего опухолевого узла с переходом в неопухолевую ткань молочной железы. Эти изображения в области опухолевого узла визуализируют однородное распределение высокого уровня обратного рассеяния и преобладание высоких значений жесткости (рис. 8, б и в соответственно). При этом на ОКТ-изображении затруднено определение границы опухолевой и неопухолевой тканей молочной железы из-за сходного уровня обратного рассеяния опухолевых клеток и соединительной ткани на границе с опухолью. Однако на ОКЭ-изображении граница опухоли визуализируется четко и контрастно, демонстрирует высокую жесткость в области опухолевого узла (более 500 кПа) и низкую жесткость — в окружающей неопухолевой фиброзной строме (менее 200 кПа). Гистологическое изображение на рис. 8, г показывает, что это инфильтрирующий дольковый раксолидного строения, окруженный соединительной тканью с фиброзом и гиалинозом волокон коллагена.
Таким образом, ОКЭ-изображения по сравнению со структурными ОКТ-изображениями продемонстрировали более высокую контрастность между различными типами тканей молочной железы и более точную границу перехода опухолевой ткани в неопухолевую для различных подтипов РМЖ. Полученные результаты могут быть использованы в качестве точного интраоперационного определения границы резекции опухоли при ОСО.
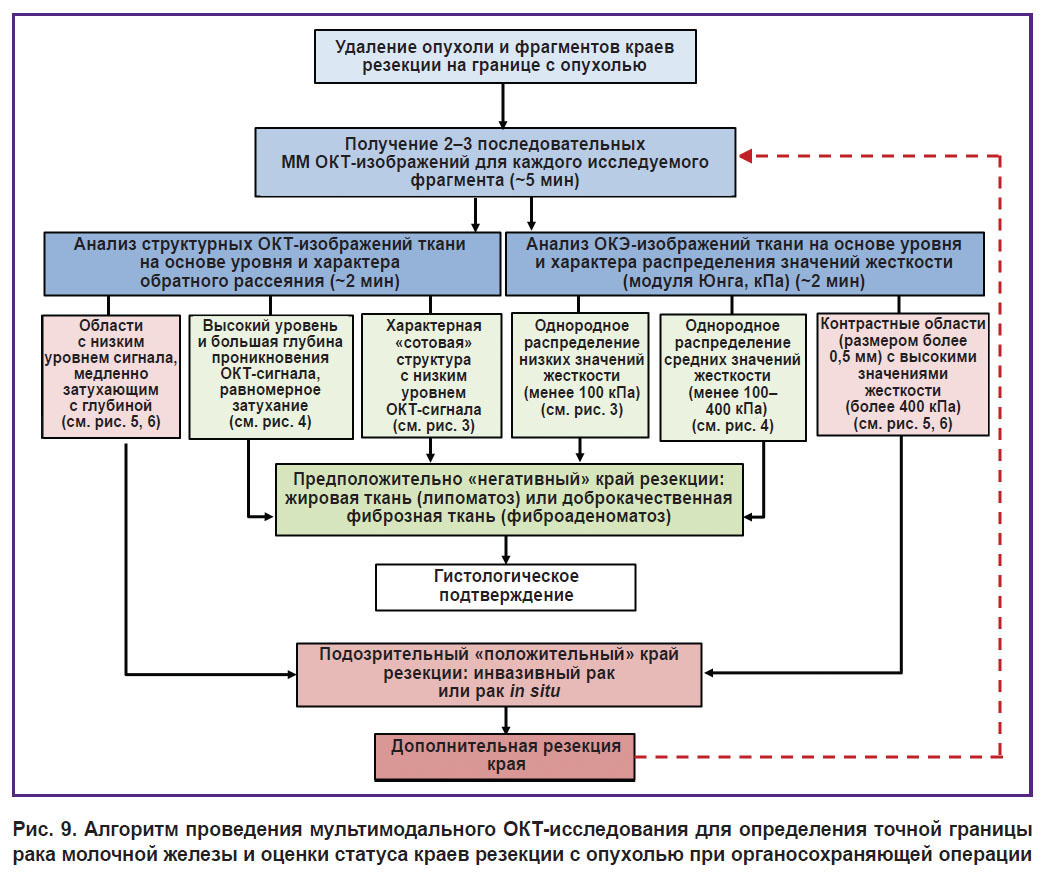
Алгоритм проведения ММ ОКТ-исследования при ОСО. Проведенные исследования позволили сформулировать алгоритм интраоперационного ММ ОКТ-исследования для определения точной границы РМЖ и оценки статуса краев резекции (рис. 9). Указанное время приблизительно характеризует продолжительность исследования всех интересующих фрагментов опухолевой и неопухолевой ткани молочной железы.
|
Рис. 9. Алгоритм проведения мультимодального ОКТ-исследования для определения точной границы рака молочной железы и оценки статуса краев резекции с опухолью при органосохраняющей операции |
Обсуждение
В настоящей работе продемонстрирован высокий потенциал применения интраоперационного ММ ОКТ-исследования (с комплексным анализом ОКТ- и ОКЭ-изображений) состояния границ резекции различных подтипов РМЖ и чистоты краев резекции с нескольких сторон опухоли (согласно стандартным клиническим рекомендациям) при ОСО и разработан алгоритм проведения такого исследования. По сравнению с гистологическим или цитологическим анализом, который требует времени, ОКТ можно использовать интраоперационно для оценки границ опухоли без использования экзогенных красителей, с высоким разрешением и в режиме реального времени. Полученные в данном исследовании результаты применения ОКЭ показывают, что распределение абсолютных значений модуля упругости ткани является наиболее точным и контрастным предиктором обнаружения злокачественности по сравнению с показателями традиционных структурных ОКТ-изображений. Эта тенденция определена для различных типов РМЖ и при оценке статуса краев резекции, демонстрируя значительное повышение жесткости (модуля Юнга) в области скопления опухолевых клеток. Контроль ОСО путем исследования краев резекции на наличие опухолевых клеток методом ОКЭ продемонстрировал точное соответствие результатов с гистологией, что подтверждает потенциал этого метода для использования в качестве дополнительного интраоперационного инструмента визуализации чистоты краев резекции в реальном масштабе времени.
По сравнению с ранними исследованиями структурных ОКТ-изображений [18, 19, 41, 42] полученные нами результаты демонстрируют высокую клиническую значимость применения метода ОКЭ согласно стандартным клиническим рекомендациям по достижению чистого края резекции при ОСО. Сложность интерпретации структурных ОКТ-изображений связана с неоднозначностью идентификации отдельных структур по уровню обратного рассеяния, что компенсируется контрастными цветокодированными изображениями ОКЭ. В работах [22–26] показано, что ОКЭ может определять злокачественную опухоль в ткани молочной железы и решать задачу поиска чистого края резекции. Наши исследования согласуются с результатами научной группы W.M. Allen с соавт. [24], которые применили количественную ОКЭ с широким полем для обнаружения «положительных» краев резекции в образцах после ОСО. Ими показана высокая чувствительность (100%) и специфичность (97,7%) метода для обнаружения опухоли в пределах 1 мм от края. Кроме того, эмпирическим путем установлено, что участок с высокой жесткостью может считаться опухолью только в том случае, если его размер составляет не менее 75% от области интереса диаметром 1 мм. Такой критерий необходим для исключения ошибочного определения небольших участков жесткой неопухолевой стромы в качестве опухоли.
В нашей работе при исследовании краев резекции на наличие опухолевых клеток у больных РМЖ методом ОКТ и ОКЭ выявлены как «негативные», так и «положительные» края резекции на расстоянии менее 5 мм от видимой границы опухоли, которые были исследованы с четырех сторон от опухоли для каждой пациентки согласно стандартным клиническим рекомендациям. При исследовании 25 пациенток с РМЖ в 4 из 100 исследуемых образцов краев резекции, полученных от разных пациенток, обнаружены «положительные» края резекции по гистологическим заключениям: инвазивный РМЖ или внутрипротоковый рак in situ (см. рис. 5 и 6). 96 образцов были определены как «негативные» края резекции: жировая ткань, жировая ткань с единичными прослойками соединительной ткани; фиброзная ткань с расширенными протоками; склерозирующая фиброзно-кистозная мастопатия — диффузный фиброз, в полях которого располагаются дольки и протоки с кистозным расширением (см. рис. 3 и 4).
Кроме того, при анализе ОКЭ-изображений тканей молочной железы, получаемых компрессионным способом, нами применен подход стандартизированного давления на ткани, что дает преимущество при сравнительном анализе данных, обеспечивая независимость от получения изображений оператором и надежную оценку результатов. Пространственное разрешение изображений ОКЭ, полученных на используемом нами устройстве, составляет 30–50 мкм, что позволяет надежно определять структуры размером, не превышающим ~500 мкм в поперечном направлении, и устанавливать наличие мелких групп скоплений опухолевых клеток в краях резекции. Надеемся, что примененный подход и расчет дополнительного параметра нелинейности позволит выявить еще более мелкие группы опухолевых клеток (диаметром менее 500 мкм) в окружающей фиброзной строме — это значительно повысит чувствительность метода ОКЭ для обнаружения опухолевых клеток и обеспечения чистого края резекции.
Как известно, наличие опухоли в краях резекции определяет высокую частоту местных рецидивов, однако на рецидив и на отдаленные результаты влияют и биологические особенности опухоли [43]. Нашими исследованиями продемонстрирована возможность метода ОКЭ не только точно детектировать границу опухоли различных подтипов РМЖ, но и определять микроструктурные особенности опухоли на основе значений жесткости, что позволяет устанавливать степень агрессивности (злокачественности) опухоли [22]. Опухоли с более однородным распределением высоких значений жесткости являются более агрессивными опухолями высокой степени злокачественности (см. рис. 8). Опухоли с гетерогенным распределением высоких и низких значений жесткости характеризуются как менее агрессивные, с низкой степенью злокачественности (см. рис. 7).
Опухоль, граничащая с жировой тканью, хорошо визуализируется как на структурных ОКТ-изображениях, так и на ОКЭ-изображениях. Однако граница опухоли с окружающей фиброзной стромой лучше и контрастнее визуализируется на ОКЭ-изображениях. В данном исследовании, как и в наших предыдущих работах [22, 23], продемонстрирована способность ОКЭ детектировать различные дегенеративные изменения соединительнотканной стромы РМЖ (фиброз, гиалиноз и т.д.), обнаруживать лимфогистиоцитарное воспаление, отличать жировую и соединительную ткани от скоплений опухолевых клеток.
В будущих исследованиях предстоит проанализировать чувствительность и специфичность ОКЭ, а также оценить количество повторных операций, которых удалось избежать, удалив дополнительные объемы ткани под контролем данного метода. Это важно, поскольку ожидается, что высокая чувствительность ОКЭ позволит гарантировать чистый край резекции. Высокая специфичность даст возможность сократить излишнее удаление доброкачественной ткани, однако она имеет меньшее значение по сравнению с высокой чувствительностью метода при оценке границ.
Следует отметить, что применение ОКТ и ОКЭ для визуализации опухоли имеет свои ограничения, которые заключаются в малой глубине проникновения инфракрасного излучения в ткани (1–2 мм) — это затрудняет просмотр всей толщины опухолевого узла [44]. Преодоление этого ограничения было предложено при исследовании послеоперационных образцов ткани, а также при использовании эндоскопических зондов и зондов-катетеров [45, 46].
Таким образом, метод ОКЭ, исследующий жесткость ткани (модуль Юнга, кПа), продемонстрировал высокий потенциал оценки чистоты краев резекции при ОСО. В будущем это может обеспечить надежный локальный интраоперационный контроль радикальности операции и привести к достоверному увеличению безрецидивной выживаемости больных РМЖ. ММ ОКТ может применяться как интраоперационно при хирургическом контроле резекции, так и на предоперационном этапе для контроля взятия биопсии в режиме реального времени.
Заключение
Использование режима ОКТ-эластографии мультимодального (многофункционального) ОКТ-устройства по сравнению с традиционной ОКТ обеспечивает более высокий контраст между различными типами тканей молочной железы, что позволяет определять точную границу опухоли и оценивать чистоту краев резекции. ОКТ-эластография демонстрирует высокий потенциал для интраоперационного выявления «положительного» хирургического края резекции на расстоянии менее 5 мм от видимой границы опухоли молочной железы на основе обнаружения скоплений опухолевых клеток размером около 500 мкм (0,5 мм) и жесткостью более 400 кПа. Использование мультимодальной ОКТ с оптимальным соотношением времени получения изображений, поля зрения и разрешения делает данный метод перспективным и многообещающим для улучшения интраоперационной оценки статуса краев резекции, а следовательно, оценки адекватности органосохраняющих операций при раке молочной железы, что позволит уменьшить риск рецидивов.
Финансирование исследования. Исследование выполнено за счет гранта Российского научного фонда №18-75-10068, https://rscf.ru/project/18-75-10068/.
№18-75-10068/.
Конфликт интересов. У авторов нет конфликта интересов.
Литература
- Sung H., Ferlay J., Siegel R.L., Laversanne M., Soerjomataram I., Jemal A., Bray F. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin 2021; 71(3): 209–249, https://doi.org/10.3322/caac.21660.
- Пожарийский К.М., Куйдабергенова А.Г., Савелов Н.А., Гриневич В.Н., Сазонов С.В.; Совет экспертов РООМ. Клинические рекомендации Российского общества онкомаммологов по патологоанатомическому исследованию рака молочной железы. Российское общество онкомаммологов; 2016; URL: http://www.breastcancersociety.ru/rek/view/29.
- Семиглазов В.Ф., Семиглазов В.В., Николаев К.С., Комяхов А.В., Брянцева Ж.В. Контроль хирургических краев резекции при органосохраняющем лечении рака молочной железы. Онкохирургия 2014; 6(1): 58–63.
- Houssami N., Macaskill P., Marinovich M.L., Dixon J.M., Irwig L., Brennan M.E., Solin L.J. Meta-analysis of the impact of surgical margins on local recurrence in women with early-stage invasive breast cancer treated with breast-conserving therapy. Eur J Cancer 2010; 46(18): 3219–3232, https://doi.org/10.1016/j.ejca.2010.07.043.
- Jorns J.M., Visscher D., Sabel M., Breslin T., Healy P., Daignaut S., Myers J.L., Wu A.J. Intraoperative frozen section analysis of margins in breast conserving surgery significantly decreases reoperative rates: one-year experience at an ambulatory surgical center. Am J Clin Pathol 2012; 138(5): 657–669, https://doi.org/10.1309/ajcp4iemxcj1gdts.
- Esbona K., Li Z., Wilke L.G. Intraoperative imprint cytology and frozen section pathology for margin assessment in breast conservation surgery: a systematic review. Ann Surg Oncol 2012; 19(10): 3236–3245, https://doi.org/10.1245/s10434-012-2492-2.
- Decker M.R., Trentham-Dietz A., Loconte N.K., Neuman H.B., Smith M.A., Punglia R.S., Greenberg C.C., Wilke L.G. The role of intraoperative pathologic assessment in the surgical management of ductal carcinoma in situ. Ann Surg Oncol 2016; 23(9): 2788–2794, https://doi.org/10.1245/s10434-016-5192-5.
- Harness J.K., Giuliano A.E., Pockaj B.A., Downs-Kelly E. Margins: a status report from the Annual Meeting of the American Society of Breast Surgeons. Ann Surg Oncol 2014; 21(10): 3192–3197, https://doi.org/10.1245/s10434-014-3957-2.
- Ahmed M., Douek M. Intra-operative ultrasound versus wire-guided localization in the surgical management of non-palpable breast cancers: systematic review and meta-analysis. Breast Cancer Res Treat 2013; 140(3): 435–446, https://doi.org/10.1007/s10549-013-2639-2.
- Olsha O., Shemesh D., Carmon M., Sibirsky O., Abu Dalo R., Rivkin L., Ashkenazi I. Resection margins in ultrasound-guided breast-conserving surgery. Ann Surg Oncol 2011; 18(2): 447–452, https://doi.org/10.1245/s10434-010-1280-0.
- Keller M.D., Vargis E., de Matos Granja N., Wilson R.H., Mycek M.A., Kelley M.C., Mahadevan-Jansen A. Development of a spatially offset Raman spectroscopy probe for breast tumor surgical margin evaluation. J Biomed Opt 2011; 16(7): 077006, https://doi.org/10.1117/1.3600708.
- Kothari R., Fong Y., Storrie-Lombardi M.C. Review of laser Raman spectroscopy for surgical breast cancer detection: stochastic backpropagation neural networks. Sensors (Basel) 2020; 20(21): 6260, https://doi.org/10.3390/s20216260.
- Thomas G., Nguyen T.Q., Pence I.J., Caldwell B., O’Connor M.E., Giltnane J., Sanders M.E., Grau A., Meszoely I., Hooks M., Kelley M.C., Mahadevan-Jansen A. Evaluating feasibility of an automated 3-dimensional scanner using Raman spectroscopy for intraoperative breast margin assessment. Sci Rep 2017; 7(1): 13548, https://doi.org/10.1038/s41598-017-13237-y.
- Wu X., Chen G., Qiu J., Lu J., Zhu W., Chen J., Zhuo S., Yan J. Visualization of basement membranes in normal breast and breast cancer tissues using multiphoton microscopy. Oncol Lett 2016; 11(6): 3785–3789, https://doi.org/10.3892/ol.2016.4472.
- Yoshitake T., Giacomelli M.G., Cahill L.C., Schmolze D.B., Vardeh H., Faulkner-Jones B.E., Connolly J.L., Fujimoto J.G. Direct comparison between confocal and multiphoton microscopy for rapid histopathological evaluation of unfixed human breast tissue. J Biomed Opt 2016; 21(12): 126021, https://doi.org/10.1117/1.jbo.21.12.126021.
- Houssami N., Macaskill P., Marinovich M.L., Morrow M. The association of surgical margins and local recurrence in women with early-stage invasive breast cancer treated with breast-conserving therapy: a meta-analysis. Ann Surg Oncol 2014; 21(3): 717–730, https://doi.org/10.1245/s10434-014-3480-5.
- Wood W.C. Close/positive margins after breast-conserving therapy: additional resection or no resection? Breast 2013; 22 (Suppl 2): S115–S117, https://doi.org/10.1016/j.breast.2013.07.022.
- Ha R., Friedlander L.C., Hibshoosh H., Hendon C., Feldman S., Ahn S., Schmidt H., Akens M.K., Fitzmaurice M., Wilson B.C., Mango V.L. Optical coherence tomography: a novel imaging method for post-lumpectomy breast margin assessment-a multi-reader study. Acad Radiol 2018; 25(3): 279–287, https://doi.org/10.1016/j.acra.2017.09.018.
- Schmidt H., Connolly C., Jaffer S., Oza T., Weltz C.R., Port E.R., Corben A. Evaluation of surgically excised breast tissue microstructure using wide-field optical coherence tomography. Breast J 2020; 26(5): 917–923, https://doi.org/10.1111/tbj.13663.
- Savastru D., Chang E.W., Miclos S., Pitman M.B., Patel A., Iftimia N. Detection of breast surgical margins with optical coherence tomography imaging: a concept evaluation study. J Biomed Opt 2014; 19(5): 056001, https://doi.org/10.1117/1.jbo.19.5.056001.
- Zysk A.M., Chen K., Gabrielson E., Tafra L., May Gonzalez E.A., Canner J.K., Schneider E.B., Cittadine A.J., Scott Carney P., Boppart S.A., Tsuchiya K., Sawyer K., Jacobs L.K. Intraoperative assessment of final margins with a handheld optical imaging probe during breast-conserving surgery may reduce the reoperation rate: results of a multicenter study. Ann Surg Oncol 2015; 22(10): 3356–3362, https://doi.org/10.1245/s10434-015-4665-2.
- Gubarkova E.V., Sovetsky A.A., Zaitsev V.Y., Matveyev A.L., Vorontsov D.A., Sirotkina M.A., Matveev L.A., Plekhanov A.A., Pavlova N.P., Kuznetsov S.S., Vorontsov A.Y., Zagaynova E.V., Gladkova N.D. OCT-elastography-based optical biopsy for breast cancer delineation and express assessment of morphological/molecular subtypes. Biomed Opt Express 2019; 10(5): 2244–2263, https://doi.org/10.1364/boe.10.002244.
- Gubarkova E.V., Kiseleva E.B., Sirotkina M.A., Vorontsov D.A., Achkasova K.A., Kuznetsov S.S., Yashin K.S., Matveyev A.L., Sovetsky A.A., Matveev L.A., Plekhanov A.A., Vorontsov A.Y., Zaitsev V.Y., Gladkova N.D. Diagnostic accuracy of cross-polarization OCT and OCT-elastography for differentiation of breast cancer subtypes: comparative study. Diagnostics (Basel) 2020; 10(12): 994, https://doi.org/10.3390/diagnostics10120994.
- Allen W.M., Foo K.Y., Zilkens R., Kennedy K.M., Fang Q., Chin L., Dessauvagie B.F., Latham B., Saunders C.M., Kennedy B.F. Clinical feasibility of optical coherence micro-elastography for imaging tumor margins in breast-conserving surgery. Biomed Opt Express 2018; 9(12): 6331–6349, https://doi.org/10.1364/boe.9.006331.
- Kennedy K.M., Zilkens R., Allen W.M., Foo K.Y., Fang Q., Chin L., Sanderson R.W., Anstie J., Wijesinghe P., Curatolo A., Tan H.E.I., Morin N., Kunjuraman B., Yeomans C., Chin S.L., DeJong H., Giles K., Dessauvagie B.F., Latham B., Saunders C.M., Kennedy B.F. Diagnostic accuracy of quantitative micro-elastography for margin assessment in breast-conserving surgery. Cancer Res 2020; 80(8): 1773–1783, https://doi.org/10.1158/0008-5472.can-19-1240.
- Allen W.M., Kennedy K.M., Fang Q., Chin L., Curatolo A., Watts L., Zilkens R., Chin S.L., Dessauvagie B.F., Latham B., Saunders C.M., Kennedy B.F. Wide-field quantitative micro-elastography of human breast tissue. Biomed Opt Express 2018; 9(3): 1082–1096, https://doi.org/10.1364/boe.9.001082.
- Azu M., Abrahamse P., Katz S.J., Jagsi R., Morrow M. What is an adequate margin for breast-conserving surgery? Surgeon attitudes and correlates. Ann Surg Oncol 2010; 17(2): 558–563, https://doi.org/10.1245/s10434-009-0765-1.
- Gatek J., Vrana D., Lukesova L., Pospiskova M., Vazan P., Melichar B. Significance of resection margin as a risk factor for local control of early stage breast cancer. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2013; 157(3): 209–213, https://doi.org/10.5507/bp.2013.067.
- Gelikonov V.M., Romashov V.N., Shabanov D.V., Ksenofontov S.Yu., Terpelov D.A., Shilyagin P.A., Gelikonov G.V., Vitkin I.A. Cross-polarization optical coherence tomography with active maintenance of the circular polarization of a sounding wave in a common path system. Radiophys Quantum Electron 2018; 60: 897–911, https://doi.org/10.1007/s11141-018-9856-9.
- Moiseev A., Ksenofontov S., Sirotkina M., Kiseleva E., Gorozhantseva M., Shakhova N., Matveev L., Zaitsev V., Matveyev A., Zagaynova E., Gelikonov V., Gladkova N., Vitkin A., Gelikonov G. Optical coherence tomography-based angiography device with real-time angiography B-scans visualization and hand-held probe for everyday clinical use. J Biophotonics 2018; 11(10): e201700292, https://doi.org/10.1002/jbio.201700292.
- Zaitsev V.Y., Matveyev A.L., Matveev L.A., Sovetsky A.A., Hepburn M.S., Mowla A., Kennedy B.F. Strain and elasticity imaging in compression optical coherence elastography: the two-decade perspective and recent advances. J Biophotonics 2021; 14(2): e202000257, https://doi.org/10.1002/jbio.202000257.
- Zaitsev V.Y., Matveyev A.L., Matveev L.A., Gelikonov G.V., Sovetsky A.A., Vitkin A. Optimized phase gradient measurements and phase-amplitude interplay in optical coherence elastography. J Biomed Opt 2016; 21(11): 116005, https://doi.org/10.1117/1.jbo.21.11.116005.
- Zaitsev V.Y., Matveyev A.L., Matveev L.A., Gelikonov G.V., Gubarkova E.V., Gladkova N.D., Vitkin A. Hybrid method of strain estimation in optical coherence elastography using combined sub-wavelength phase measurements and supra-pixel displacement tracking. J Biophotonics 2016; 9(5): 499–509, https://doi.org/10.1002/jbio.201500203.
- Matveyev A.L., Matveev L.A., Sovetsky A.A., Gelikonov G.V., Moiseev A.A., Zaitsev V.Y. Vector method for strain estimation in phase-sensitive optical coherence elastography. Laser Phys Lett 2018; 15(6): 065603, https://doi.org/10.1088/1612-202x/aab5e9.
- Zaitsev V.Y., Matveyev A.L., Matveev L.A., Gubarkova E.V., Sovetsky A.A., Sirotkina M.A., Gelikonov G.V., Zagaynova E.V., Gladkova N.D., Vitkin A. Practical obstacles and their mitigation strategies in compressional optical coherence elastography of biological tissues. J Innov Opt Health Sci 2017; 10(06): 1742006, https://doi.org/10.1142/s1793545817420068.
- Sovetsky A.A., Matveyev A.L., Matveev L.A., Shabanov D.V., Zaitsev V.Y. Manually-operated compressional optical coherence elastography with effective aperiodic averaging: demonstrations for corneal and cartilaginous tissues. Laser Phys Lett 2018; 15(8): 085602, https://doi.org/10.1088/1612-202x/aac879.
- Sovetsky A.A., Matveyev A.L., Matveev L.A., Gubarkova E.V., Plekhanov A.A., Sirotkina M.A., Gladkova N.D., Zaitsev V.Y. Full-optical method of local stress standardization to exclude nonlinearity-related ambiguity of elasticity estimation in compressional optical coherence elastography. Laser Phys Lett 2020; 17(6): 065601, https://doi.org/10.1088/1612-202x/ab8794.
- Plekhanov A.A., Sirotkina M.A., Sovetsky A.A., Gubarkova E.V., Kuznetsov S.S., Matveyev A.L., Matveev L.A., Zagaynova E.V., Gladkova N.D., Zaitsev V.Y. Histological validation of in vivo assessment of cancer tissue inhomogeneity and automated morphological segmentation enabled by optical coherence elastography. Sci Rep 2020; 10(1): 11781, https://doi.org/10.1038/s41598-020-68631-w.
- Зикиряходжаев А.Д., Ермощенкова М.В., Сухотько А.С., Фетисова Е.Ю., Тыщенко Е.В. Показания и технология определения краев резекции при органосохраняющих операциях по поводу рака молочной железы. Онкология и хирургия 2015; 1: 14–24.
- Blair S.L., Thompson K., Rococco J., Malcarne V., Beitsch P.D., Ollila D.W. Attaining negative margins in breast-conservation operations: is there a consensus among breast surgeons? J Am Coll Surg 2009; 209(5): 608–613, https://doi.org/10.1016/j.jamcollsurg.2009.07.026.
- Erickson-Bhatt S.J., Nolan R.M., Shemonski N.D., Adie S.G., Putney J., Darga D., McCormick D.T., Cittadine A.J., Zysk A.M., Marjanovic M., Chaney E.J., Monroy G.L., South F.A., Cradock K.A., Liu Z.G., Sundaram M., Ray P.S., Boppart S.A. Real-time imaging of the resection bed using a handheld probe to reduce incidence of microscopic positive margins in cancer surgery. Cancer Res 2015; 75(18): 3706–3712, https://doi.org/10.1158/0008-5472.can-15-0464.
- Nguyen F.T., Zysk A.M., Chaney E.J., Kotynek J.G., Oliphant U.J., Bellafiore F.J., Rowland K.M., Johnson P.A., Boppart S.A. Intraoperative evaluation of breast tumor margins with optical coherence tomography. Cancer Res 2009; 69(22): 8790–8796, https://doi.org/10.1158/0008-5472.can-08-4340.
- Lowery A.J., Kell M.R., Glynn R.W., Kerin M.J., Sweeney K.J. Locoregional recurrence after breast cancer surgery: a systematic review by receptor phenotype. Breast Cancer Res Treat 2012; 133(3): 831–841, https://doi.org/10.1007/s10549-011-1891-6.
- Huang D., Swanson E.A., Lin C.P., Schuman J.S., Stinson W.G., Chang W., Hee M.R., Flotte T., Gregory K., Puliafito C.A., Fujimoto J.G. Optical coherence tomography. Science 1991; 254(5035): 1178–1181, https://doi.org/10.1126/science.1957169.
- Wijesinghe P., Kennedy B.F., Sampson D.D. Optical elastography on the microscale. In: Tissue elasticity imaging. Alam S.K., Garra B.S. (editors). Amsterdam: Elsevier; 2020; p. 185–229, https://doi.org/10.1016/b978-0-12-809661-1.00009-1.
- Iftimia N., Park J., Maguluri G., Krishnamurthy S., McWatters A., Sabir S.H. Investigation of tissue cellularity at the tip of the core biopsy needle with optical coherence tomography. Biomed Opt Express 2018; 9(2): 694–704, https://doi.org/10.1364/boe.9.000694.