Особенности глазодвигательных реакций как маркеры нарушений когнитивного контроля у пациентов с обсессивно-компульсивным расстройством (обзор)
На основании многочисленных исследований у пациентов с обсессивно-компульсивным расстройством (ОКР) выявлено ухудшение избирательного внимания, тормозного контроля и рабочей памяти, что коррелирует с дисбалансом в активности кортико-стриарно-таламо-кортикальной цепи, связанной с поддержанием функций когнитивного контроля. Как следствие возможного нарушения нейрофизиологических основ когнитивного контроля, у пациентов с ОКР часто проявляются изменения параметров целенаправленных глазодвигательных реакций. В настоящем обзоре обобщены и проанализированы данные о нарушениях когнитивного контроля при ОКР, полученные при помощи методов регистрации движений глаз.
Установлено, что наиболее часто используются задачи на медленные прослеживающие движения, саккады по памяти и антисаккадические задачи. Данные по задачам на медленные прослеживающие движения глаз и на саккады по памяти противоречивы, хотя отчасти подтверждают ухудшение избирательного внимания и рабочей памяти. В большинстве исследований по антисаккадической задаче выявлены нарушения функции тормозного контроля у пациентов с ОКР. Схожие нарушения, выражающиеся в увеличенной латентности и большей частоте ошибок в антисаккадах, были отмечены и у родственников пациентов первой степени родства, что позволяет рассматривать такие нарушения как проявления эндофенотипа, связанного с предрасположенностью к ОКР. Подтверждение этих результатов в экспериментах с использованием сложных антисаккадических задач с применением изображений различной модальности (с учетом наличия повышенной тревожности у пациентов с ОКР как основы заболевания) в перспективе может способствовать валидации специфичных маркеров ОКР.
Введение
У большинства людей бывают навязчивые мысли или непреодолимые поведенческие побуждения. Когда эти состояния становятся частыми, чрезмерными и разрушающими жизнь человека, они диагностируются как обсессивно-компульсивное расстройство (ОКР). ОКР широко распространено среди населения в целом (1–3%) и ассоциируется со значительной коморбидностью и разнородностью клинических проявлений [1, 2].
Всемирной организацией здравоохранения ОКР названо одним из десяти ведущих расстройств, приводящих к инвалидности. Пациенты с ОКР стараются избегать ситуаций, которые доставляют им дискомфорт, даже при отсутствии реальной угрозы. Это может привести к снижению социальных взаимодействий и качества жизни, а также отразиться на социально-экономической ситуации общества в целом. Большинство людей, страдающих ОКР, годами не обращаются за лечением по причине стигматизации, несмотря на понимание бессмысленности навязчивых мыслей и/или неэффективности ритуалов [3, 4].
Обсессивно-компульсивное расстройство можно рассматривать в качестве «модельного» расстройства для исследования ригидности психических процессов как у нормотипичных людей, так и у людей с другими психическими заболеваниями. Несмотря на то, что знания об ОКР расширились, ряд вопросов о запускающих его механизмах остается нерешенным.
В исследованиях с использованием методов нейровизуализации, а также нейропсихологических и фармакологических показано, что при ОКР наблюдается дисфункция кортико-стриарно-таламо-кортикальной цепи (cortico-striato-thalamo-cortical (CSTС) curcuit), основанная на дисбалансе между возбуждающими глутаматергическими и тормозными ГАМК-ергическими системами, а также на дисбалансе серотонина и дофамина, что сопровождается нарушением когнитивного и эмоционального контроля [5, 6].
При исследовании нейротрансмиттеров у пациентов с ОКР установлен дисбаланс между прямыми и непрямыми проводящими путями в кортико-стриарно-таламо-кортикальной цепи [7] (рис. 1). Было высказано предположение, что смещение баланса в сторону прямого пути, связанного с повышением концентрации глутамата, может привести к развитию симптомов ОКР [8]. Соответственно гиперстимуляция орбитофронтальной коры и передней поясной извилины опосредует возникновение преувеличенных ощущений опасности, приводящих к постоянному вниманию к предполагаемой угрозе с последующими ритуалами, направленными на ее устранение. Альтернативно предполагается, что дисфункция стриатума снижает ингибирование латеральной части бледного шара, приводя к усилению ингибирования субталамического ядра, эффективно уменьшая возбуждение медиальной части бледного шара и черной субстанции, тем самым увеличивая возбуждение из таламуса в орбитофронтальную кору и переднюю поясную кору [9] (см. рис. 1). Преобладание активности центров прямых путей над центрами непрямых приводит к нарушениям функций когнитивного контроля, которые могут лежать в основе симптоматики ОКР [10–12].
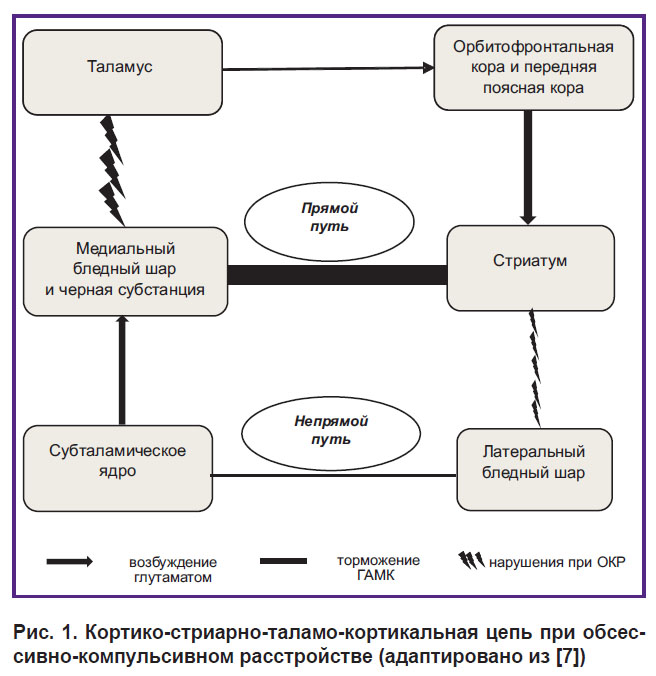
|
Рис. 1. Кортико-стриарно-таламо-кортикальная цепь при обсессивно-компульсивном расстройстве (адаптировано из [7]) |
В одном из наиболее крупных обзоров [13] обобщены результаты более 900 исследований по изучению ОКР с помощью позитронно-эмиссионной томографии, структурной и функциональной магнитно-резонансной томографии (фМРТ). Выдвигается гипотеза, что при ОКР изначальная дисфункция хвостатых ядер приводит к неэффективному сенсорному гейтингу на уровне таламуса с последующей гиперактивностью орбитофронтальной коры (при обсессиях) и передней поясной извилины (при компульсиях). При этом авторы подчеркивают, что вышеперечисленные изменения активности структур мозга в первую очередь коррелируют с нарушениями обработки пространственных стимулов зрительной модальности и контроля глазодвигательных реакций у пациентов с ОКР [13]. В более позднем обзоре [3] также обсуждается дисфункция кортико-стриарной цепи. В большинстве проанализированных авторами исследований отмечались чрезмерная активация орбитофронтальной коры и базальных ганглиев при провокации симптомов и их снижение после лечения пациентов селективными ингибиторами обратного захвата серотонина и когнитивно-поведенческой психотерапии. Наконец, в обзоре [14] у пациентов с ОКР, помимо нарушения работы кортико-стриарно-таламо-кортикальной цепи, отмечены структурные изменения и измененная функциональная активность лимбических областей: амигдалы, теменной и затылочной коры головного мозга, мозжечка.
Таким образом, большинство нейрофизиологических исследований указывают на нарушения активности и функциональной взаимосвязи базальных ганглиев, таламуса и медиальной префронтальной коры у пациентов с ОКР [15, 16]. Нейропсихологические исследования подтверждают ухудшение когнитивного контроля: рабочей памяти (РП), внимания, тормозного контроля, вербальной гибкости, планирования и принятия решений. Так как существуют данные о нарушении контроля глазодвигательных реакций [17, 18] при ОКР, метод регистрации движений глаз признан одним из неинвазивных нейрофизиологических подходов к изучению когнитивных нарушений у данных пациентов [19]. Неинвазивная регистрация движений глаз возможна при помощи окулографических электродов — окулографии, а также инфракрасной камеры, регистрирующей движения глаз по зрачку, — метод айтрекинга (eye tracking) [20]. По сравнению с фМРТ они менее ресурсозатратны и позволяют напрямую (а не косвенно, как фМРТ) оценить нейрофизиологические особенности когнитивного контроля по успешности выполнения задач на саккады или медленные прослеживающие движения глаз [21, 22].
Цель настоящего обзора — обобщить и проанализировать накопленные данные о нарушениях когнитивного контроля при ОКР, полученные при помощи окулографии и айтрекинга.
Поиск статей проводили в базе PubMed (https://pubmed.ncbi.nlm.nih.gov/). В качестве ключевых слов были выбраны “obsessive-compulsive disorder” AND “eye movements” OR “eye tracker” OR “saccade” OR “oculography” («обсессивно-компульсивное расстройство» И «движения глаз» ИЛИ «айтрекер» ИЛИ «саккада» ИЛИ «окулография»). Было найдено 122 работы, из которых отобраны 30 статей, где представлены данные по особенностям глазодвигательных реакций при ОКР (рис. 2). Критерии исключения статей: 1-я причина — исследование других пациентов (ОКР упоминалось только в обсуждении); 2-я — нет данных айтрекинга и/или окулографии; 3-я — данные получены на специфической популяции (без диагноза ОКР, но с частными признаками расстройства). Среди 30 отобранных исследований представлен только один обзор [23] и один метаанализ, совмещенный с экспериментальными данными авторов, который посвящен исключительно одному виду глазодвигательных задач [24]. Поиск статей с использованием методов регистрации движений глаз у пациентов с ОКР в русскоязычных базах не дал результатов. Сводные данные по исследованиям когнитивного контроля движений глаз при ОКР представлены в Приложении 1.
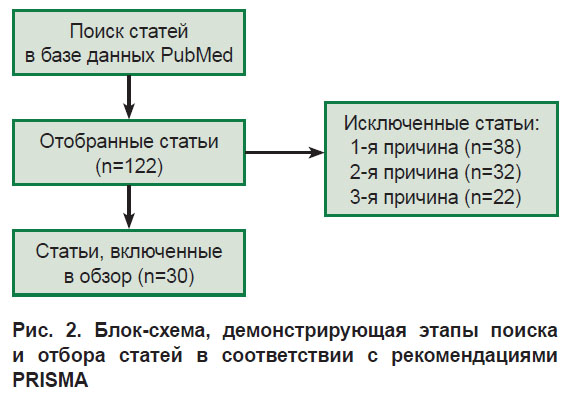
|
Рис. 2. Блок-схема, демонстрирующая этапы поиска и отбора статей в соответствии с рекомендациями PRISMA |
Обзор [23], опубликованный в 2011 г., наиболее широко охватывал накопленные к тому времени данные по регистрации глаз при ОКР. Авторы сделали вывод, что пациенты с ОКР демонстрируют лишь довольно неспецифические нарушения при выполнении простых задач (незначительные нарушения в медленных прослеживающих движениях и увеличение латентности при выполнении антисаккадической задачи) по сравнению с пациентами с шизофренией. В связи с этим показана необходимость разработки сложных задач, направленных на выявление специфических нарушений при ОКР, для последующего их использования в качестве надежных инструментов диагностики и классификации различных типов данного заболевания. Более поздних обзоров найти не удалось, поэтому данной работой мы пытаемся заполнить этот пробел.
Обсессивно-компульсивное расстройство
Существенной особенностью ОКР является наличие обсессий и/или компульсий. Обсессии представляют собой навязчивые, непроизвольные и чаще всего стереотипные идеи, образы или побуждения, которые практически всегда сопровождаются тревогой. Пациент с ОКР безуспешно пытается сопротивляться им, однако это не приводит к должному результату. Компульсии характеризуются повторяющимся поведением и/или ментальными актами, особенностью которых является стереотипность. Пациент с ОКР совершает их в ответ на навязчивую мысль для достижения чувства «комфорта». Такие действия не являются способом получить удовольствие или атрибутом выполнения полезных задач. Они служат средством предотвращения возможности наступления неприятного события, которое, как опасается пациент, в противном случае может произойти, нанеся вред ему или им — другому человеку. При ОКР почти всегда присутствует тревожность, поэтому, если компульсивные действия подавляются, тревожность становится более выраженной [25].
В исследованиях, использующих факторно-аналитический подход [26, 27], последовательно выстроена четырехфакторная модель симптомов ОКР, которая включает:
опасения по поводу загрязнения вместе с мытьем или чисткой;
опасения по поводу причинения вреда себе или другим вместе с проверкой;
навязчивые агрессивные или сексуальные мысли вместе с ментальными ритуалами;
беспокойство по поводу нарушения симметрии вместе с порядком или счетом.
Исторически ОКР классифицировалось как тревожное расстройство. В МКБ-10 и DSM-4 оно относилось к категории «Невротические, связанные со стрессом и соматоформные расстройства», поскольку компульсивное поведение — это попытка облегчить тревогу, вызванную навязчивыми идеями [15]. Однако нейробиологически и клинически ОКР имеет ряд различий с типичными тревожными расстройствами, что и послужило основанием для его исключения из данной рубрики [28–30]. В DSM-5 и в МКБ-11 ОКР перенесено в отдельную новую категорию под названием «Обсессивно-компульсивные и связанные с ними расстройства», которая включает состояния, характеризующиеся конкретными типами переживаний или повторяющимся поведением. В DSM-5 в данную категорию помимо ОКР входят дисморфическое расстройство, патологическое накопительство, трихотилломания, невротическая экскориация, вторичные причины ОКР (последствия употребления психоактивных веществ, лекарственных средств и т.д.) [31]. В МКБ-11 данная группа кроме ОКР включает дисморфическое расстройство, патологическое собирательство, трихотилломанию, невротическую экскориацию, а также обонятельное расстройство и ипохондрию [32].
Подобно ОКР, связанные с ним расстройства (obsessive-compulsive related disorders, OCRDs) также являются распространенными. Однако они недостаточно распознаваемы. Эти заболевания характеризуются повторяющимися и нежелательными мыслями или поведением. Некоторые OCRDs включают в себя навязчивые мысли и компульсивное поведение (например, дисморфическое расстройство), другие имеют преимущественно двигательные или поведенческие симптомы (например, трихотилломания) [16]. Несмотря на схожесть ОКР и OCRDs [33, 34], имеются ключевые различия в их нейробиологии, диагностике и лечении [35, 36].
Важно различать симптомы ОКР, которые могут быть обнаружены при некоторых неврологических заболеваниях, от истинного ОКР. При болезни Хантингтона, характеризующейся когнитивным снижением и прогрессирующими двигательными нарушениями, достаточно часто наблюдаются симптомы ОКР, которые имеют тенденцию становиться более выраженными по мере прогрессирования заболевания [37]. ОКР является одним из наиболее распространенных психических осложнений после инсульта и черепно-мозговой травмы [38]. Пациенты с болезнью Паркинсона могут демонстрировать своеобразное поведение, известное как пандинг, выражающееся в сложном, продолжительном, бесцельном, стереотипном поведении, которое может быть ошибочно идентифицировано как признак ОКР [39]. При хорее Сиденхема было замечено, что практически у всех пациентов симптомы ОКР развиваются на ранней стадии болезни [40], что обусловлено аутоиммунным ответом на стрептококковую инфекцию, приводящую к воспалению в базальных ганглиях — областях мозга, вовлеченных в патогенез ОКР [41]. Симптомы синдрома Туретта могут напоминать ритуалы ОКР, особенно «тикоподобные» компульсии, такие как прикосновение, постукивание, растирание и повторение обычных действий [42]. Однако важно понимать, что данные проявления при неврологических заболеваниях не вызваны явными навязчивыми мыслями (обсессиями).
На основании исследований нейроэндофенотипов ОКР выявлен широкий набор нарушений функций когнитивного контроля, ведущих к проблемам с тормозным контролем, избирательным вниманием, когнитивной гибкостью, планированием, РП и отслеживанием ошибок [43]. В настоящее время не установлено, являются ли эти нарушения специфическими для ОКР или возникают при многих психических расстройствах невротического спектра. Кроме того, с учетом того факта, что ОКР — это гетерогенное заболевание, возникает вопрос о целесообразности применения общих патофизиологическиех моделей ОКР при интерпретации проявлений различных симптомов заболевания, так как они могут различаться с точки зрения генетики, реактивности на медикаментозное лечение, различных паттернов проявления функциональной активности мозга [44, 45]. На сегодняшний день сравнительно немного исследований ОКР, в которых изучались эти параметры.
Нарушения функций когнитивного контроля у пациентов с обсессивно-компульсивным расстройством, показанные при помощи регистрации движений глаз
Дефицит контроля движений глаз при ОКР чаще всего связывают с нарушением кортико-стриарно-таламо-кортикальной цепи [46–48]. Глазодвигательные реакции исследуют с помощью различных парадигм: задач на медленные прослеживающие движения (SPEM — smooth pursuit eye movement); саккад по памяти (MGS — memory-guided saccade); антисаккад (AS — antisaccade). Задачи на зрительно-вызванные/непроизвольные саккады (VGS — visual guided saccade) и произвольные саккады (PS — prosaccade) используют в комплексном изучении глазодвигательных реакций совместно с антисаккадической задачей (Приложение 2). Вышеописанные парадигмы предназначены как для оценки базового глазодвигательного поведения, так и для измерения функций когнитивного контроля, таких как торможение реакции, планирование, РП.
Результаты исследований особенностей глазодвигательных реакций при ОКР противоречивы. В ряде работ у пациентов с ОКР отмечены различия глазодвигательных реакций по сравнению с контролем в виде удлиненного латентного периода саккад и/или увеличения частоты ошибок при выполнении антисаккадической задачи, а также снижение точности медленных прослеживающих движений глаз [49–53]. По данным других авторов, пациенты с ОКР не отличались от контрольной группы по частоте ошибок при выполнении антисаккад и не имели различий в медленных прослеживающих движениях глаз [24, 54, 55]. Возможно, это связано с наличием широкого разнообразия парадигм, задач и целей, что не дает возможности определить конкретный характер дефицита контроля движений глаз при данном заболевании (для примера см. метаанализ [24]).
Следует отметить, что правильная интерпретация данных при проведении исследования может способствовать различению ряда дифференциальных диагнозов в связи с тем, что нервные центры, участвующие в контроле саккадических и медленных прослеживающих движений глаз, некоторым образом различаются с точки зрения их местоположения и функции. В контроле саккад участвуют такие области, как лобные глазодвигательные поля, дополнительное глазодвигательное поле, заднетеменная кора, хвостатое ядро и черная субстанция; в контроле медленных прослеживающих движений — лобные глазодвигательные поля, а также средняя височная кора и медиальная верхняя височная кора [48].
Исследование медленных прослеживающих движений
Медленные прослеживающие движения — это плавные движения глаз во время слежения за небольшим объектом, движущимся с постоянной скоростью. Для правильного выполнения задачи скорость движения глаз должна постоянно адаптироваться к скорости объекта. Наиболее часто измеряемой переменной в исследовании медленных прослеживающих движений глазявляется коэффициент ускорения (gain), рассчитываемый как отношение скорости движения взгляда к скорости цели. Уменьшение этого коэффициента может указывать на трудности в согласовании взгляда со скоростью цели. Изучают также другие параметры: пространственную разность между положением цели и положением взгляда и количество корректирующих саккад. Если глаза не воспроизводят целевое движение, саккадическая система должна компенсировать эту ошибку с помощью корректирующих саккад [56].
Нейрофизиологические механизмы системы слежения за зрительной целью пересекаются с механизмами системы саккадических движений. Они обе работают интегративно [57, 58], несмотря на то, что некоторые области, задействованные в генерации медленных прослеживающих движений, отличаются от структур, осуществляющих саккадический контроль [48]. Наличие нормативных медленных прослеживающих движений может отражать интеграцию кортикальных и мозжечковых сетей, поддерживающих процессы прогнозирования, которые лежат в основе точности прослеживания цели [57, 58]. Таким образом, точность движений глаз при прослеживании отражает функции сетей мозга, которые обеспечивают сложное целенаправленное поведение.
Нарушение внимания связано с дисфункцией различных модулирующих медиаторных систем. Учитывая это, L.J. Siever с соавт. [59] изучили влияние амфетамина (психотропного вещества, способного воздействовать на процесс внимания) на точность медленных прослеживающих движений у пациентов с ОКР и с биполярным аффективным расстройством. Было показано, что амфетамин существенно не влиял на точность медленных прослеживающих движений в данных группах, однако у пациентов с ОКР наблюдался эффект улучшения внимания, заключавшийся в значительной отрицательной зависимости между исходным нарушением медленных прослеживающих движений и изменениями в точности отслеживания цели. Следовательно, на основании данного исследования нельзя говорить о том, что пациенты с ОКР имеют эндофенотипические нарушения в системе медленных прослеживающих движений глаз, а соответственно, и дефицит непроизвольного внимания [59].
B.A. Clementz c соавт. [60] обнаружили, что умеренный дефицит движений у пациентов с ОКР возникает только при отслеживании быстро двигающихся целей (24 °/с). При более медленной скорости движения цели (9 и 12 °/с) не наблюдается различий с контрольной группой [60].
Pallanti с соавт. [52] установили значительное снижение точности прослеживания за целью, а также увеличение частоты и амплитуды упреждающих саккад в задаче на прослеживание у пациентов с ОКР по сравнению с контрольной группой. R. Lencer с соавт. [53] выявили более низкую среднюю скорость в фовеафугальной задаче прослеживания как у пациентов с ОКР, так и у больных шизофренией и аффективными расстройствами. Однако постсаккадическая скорость глаз в данной задаче снижалась только у пациентов с шизофренией и аффективным расстройством. В фовеапетальной задаче средняя скорость прослеживания была снижена только у пациентов с шизофренией. Наблюдаемый дефицит у пациентов с ОКР, шизофренией и аффективными расстройствами говорит о дисфункции лобных долей, включая лобное глазодвигательное поле. В отличие от ОКР, при шизофрении и аффективных расстройствах снижение инициации постсаккадического прослеживания может указывать на нарушение взаимодействия между системой медленного прослеживания и саккадической системой [53]. В исследовании R.H. Farber с соавт. [55], напротив, показано, что пациенты с ОКР и контрольная группа имели статистически схожее время реакции прослеживания и среднее ускорение прослеживания во время выполнения задач с открытым и замкнутым циклом. Аналогично K. Bey с соавт. [61] показали, что пациенты с ОКР и их здоровые родственники не отличались по производительности ни в стандартных, ни в прогнозирующих медленных прослеживающих движениях.
Damilou с соавт. [62] выявили высокую частоту интрузивных саккад при выполнении задач на медленные прослеживающие движения у пациентов с ОКР и шизофренией по сравнению со здоровыми людьми из контрольной группы. При этом, в отличие от пациентов с шизофренией, пациенты с ОКР не показали выраженного снижения ускорения при прослеживании. Следовательно, у данных заболеваний имеются как общие, так и специфические нарушения нейробиологических механизмов, обеспечивающих контроль движений глаз.
Все вышеуказанные работы изучали один и тот же вид движений глаз. Однако по имеющимся данным сложно определить характер дефицита медленных прослеживающих движений у пациентов с ОКР в связи с методическими различиями, разными целями исследований, изучаемыми параметрами, а также небольшим количеством участников экспериментальной выборки.
Исследования антисаккад
Задачи на движения глаз могут быть использованы как модельные методики для изучения когнитивного контроля. При психопатологии, в том числе и при ОКР, когнитивный контроль уязвим в случае любого произвольного действия. Фундаментальной для функции когнитивного контроля является способность произвольно подавлять доминантные или рефлекторные реакции, чтобы совершить запланированный ответ — торможение первичной реакции произвольным образом [63]. Можно предположить, что нарушенная производительность в задачах на когнитивный контроль подтверждает нарушенную активность путей в кортико-стриарно-таламо-кортикальной цепи у пациентов с ОКР. Одним из известных методов исследования функций когнитивного контроля при помощи регистрации движений глаз является экспериментальная парадигма с антисаккадами.
В задаче с антисаккадами испытуемые должны подавить рефлекторное движение глаз (просаккаду) к зрительному стимулу и совершить произвольное движение к противоположной по местоположению точке в зрительном пространстве. Ошибочной реакцией является неспособность подавить рефлекторную реакцию движений глаз на периферический стимул. За этими ошибками обычно следует коррекционная саккада, указывающая, что инструкция была понята, но рефлекторный ответ подавить не удалось [19].
Исследователи, изучающие движения глаз с использованием антисаккадической парадигмы, обычно сравнивают характеристики антисаккад и зрительно вызванных саккад для определения нейрофизиологических механизмов и структур мозга, которые участвуют в процессах торможения движения, и их отличий от процессов, участвующих в генерации саккад на зрительные стимулы. У антисаккад более длительная латентность, чем при выполнении зрительно вызванных саккад на стимулы. Для успешного выполнения антисаккад требуются два процесса: подавление рефлекторной саккады к месту появления периферического стимула и произвольное движение глаз в точку, расположенную зеркально к периферическому стимулу в зрительном пространстве. Типичными показателями в задаче с антисаккадами являются ошибки, а именно саккады в неправильном направлении (отражающие проблемы тормозного контроля: неспособность подавить несоответствующий инструкции зрительный ответ вероятнее всего объясняется недостатком нисходящего контроля) и латентность саккады [64]. Как правило, нарушения в подавлении нерелевантного ответа связывают с дисфункциями лобных глазодвигательных полей.
В то время как при выполнении зрительно-вызванных саккад пациенты с ОКР не показывают различий относительно здоровых испытуемых по количеству ошибок и величине латентных периодов саккад [46], исследования с использованием антисаккадических задач демонстрируют большую вариативность результатов.
Так, P. Maruff с соавт. [65] не обнаружили различий в показателях антисаккадических ошибок у пациентов с ОКР и здоровых испытуемых. Величина латентных периодов зрительно-вызванных саккад в группах также не различалась, однако величина латентных периодов антисаккад и произвольных саккад была значительно длиннее у пациентов с ОКР, чем в контрольной группе. Авторы отметили, что при отсутствии цели не подтверждается дефицит тормозной функции, так как пациенты с ОКР сталкивались с трудностями только при выполнении тех задач, которые требовали от них управления движениями на основе внутреннего представления о цели задачи. При решении задач, в которых цель оставалась видимой на протяжении всего тестирования, разницы в величине латентных периодов саккад у пациентов с ОКР и здоровых испытуемых выявлено не было. На основе этих данных P. Maruff с соавт. предположили, что когнитивный дефицит при ОКР может быть связан со сложностью управления поведением при отсутствии внутреннего представления о цели задачи [65]. Это соотносится с поведенческими паттернами при ОКР — наличием сомнений и страхом неопределенности.
Увеличение латентности антисаккад у пациентов с ОКР при выполнении задач на антисаккады и произвольные саккады обнаружили N.J. van der Wee с соавт. [66]. Было высказано предположение, что у пациентов с ОКР отсутствуют серьезные нарушения глазодвигательного торможения, однако у них может быть нарушена способность инициировать произвольную саккаду к воображаемой цели. В другом исследовании [67] не было обнаружено изменения величины латентности у пациентов с ОКР, при этом наблюдалась увеличенная частота ошибок при выполнении задач на антисаккады по сравнению со здоровой контрольной группой. Недавнее исследование J.C. Narayanaswamy с соавт. [68] показало высокий процент ошибок и менее точное конечное положение глаз в задаче на антисаккады у пациентов с ОКР по сравнению с контрольной группой здоровых испытуемых, однако авторы не выявили значимой корреляции между параметрами антисаккад и тяжестью заболевания. Большее количество ошибок и более длительный латентный период у пациентов с ОКР в вышеперечисленных исследованиях все же свидетельствуют о наличии нарушений функций тормозного контроля при этом заболевании.
В работе L. Lennertz с соавт. [69] было показано, что пациенты с ОКР и их здоровые родственники первой степени родства имели повышенную частоту ошибок в задаче с антисаккадами, а также увеличение латентности антисаккад по сравнению с контрольной группой здоровых испытуемых. Это исследование стало первым свидетельством в пользу кандидатного эндофенотипа ОКР. Позже L. Kloft с соавт. [47] подтвердили, что здоровые родственники пациентов с ОКР первой степени родства имеют более длительный латентный период произвольных саккад по сравнению со здоровыми испытуемыми. В более раннем исследовании этих авторов [70] при выполнении антисаккадической задачи у пациентов с ОКР и у здоровых испытуемых контрольной группы не наблюдалось различий в виде частоты ошибок и разницы в величине латентного периода.
Исследуя детей с диагнозом ОКР, D.R. Rosenberg и соавт. [71] обнаружили, что данные пациенты имели больше неудач в подавлении ответа, чем контрольная группа, но только тогда, когда периферические зрительные цели были расположены близко к точке центральной фиксации; в случае задачи с отложенным ответом существенных различий между группами не наблюдалось. Авторы полагают, что базовое нарушение тормозного контроля при ОКР может лежать в основе характерного для данного заболевания повторяющегося поведения, связанного с аномалиями в орбитофронтально-вентрально-стриарных цепях. Кроме того, они установили, что дефицит подавления ответа был обусловлен выраженностью симптомов у детей с ОКР. Однако исследование A. Ray с соавт. [72] выявило, что между детьми с диагнозом ОКР и контрольной группой здоровых испытуемых не было значимой разницы в показателях частоты ошибок, пиковой скорости, смещении фиксаций на контрольной точке, изменении латентности в задачах на просаккады и антисаккады. Таким образом, результаты данного исследования не подтверждают, что нарушения глазодвигательных реакций могут быть использованы в качестве диагностических биомаркеров у детей с ОКР. Однако данные детей нельзя полностью соотносить с данными взрослых пациентов с ОКР, поскольку многие показатели движений глаз меняются в связи с развитием и формированием мозга. На наш взгляд, необходимо изучение характеристик просаккад и антисаккад в разных возрастных группах.
Интересным представляется сравнение характеристик антисаккад при ОКР и других психических заболеваниях. Так, J.E. McDowell и соавт. [73] при изучении пациентов с шизофренией с помощью антисаккадической задачи задались вопросом, являются ли частота ошибок и латентность специфичными только для этого заболевания. Результаты исследования показали, что у пациентов с шизофренией выраженно отличалась величина латентного периода саккад по сравнению с пациентами с ОКР и здоровой контрольной группой. Кроме того, пациенты с шизофренией показали меньшее количество корректирующих саккад, чем пациенты с ОКР и здоровые испытуемые. D. Spengler и соавт. [74] установили, что при предъявлении антисаккадической задачи частота ошибок и величина латентного периода саккад, наблюдаемые у пациентов с ОКР, не отличались от показателей контрольной группы здоровых испытуемых, в отличие от пациентов с шизофренией. A. Damilou и соавт. [62] выявили общие и специфические паттерны нарушения глазодвигательной реакции у пациентов с шизофренией и пациентов с ОКР. Общая картина дефицита работоспособности как при шизофрении, так и при ОКР включала более высокий уровень ошибок в антисаккадической задаче, увеличенную латентность корректирующих антисаккад по сравнению со здоровыми испытуемыми из контрольной группы. Этот общий паттерн может быть связан с нарушением функций когнитивного контроля, что присутствует при обоих заболеваниях. При этом только пациенты с шизофренией показали специфическое увеличение латентности корректирующих антисаккад и внутрисубъектную вариабельность латентного периода при ошибках в просаккадах. Специфический дефицит стабильности фиксации (увеличение частоты интрузивных саккад при активной фиксации) наблюдался только у пациентов с ОКР, что, по предположению авторов, свидетельствует о дефиците лобно-стриарного пути, контролирующего фиксацию взора.
При исследовании движений глаз с помощью антисаккадической задачи обнаружено, что такие показатели, как величина латентного периода антисаккад и частота ошибок, выше у пациентов с ОКР, чем у пациентов с генерализованным тревожным расстройством (ГТР) [75], несмотря на то, что ранее (по МКБ-10 и DSM-4) данные расстройства относились к одной группе заболеваний. В то же время обнаружено, что латентность произвольной саккады у пациентов с ОКР короче по сравнению со здоровыми испытуемыми, а также значительно короче их собственной антисаккадической латентности. Эти результаты являются возможным обоснованием наличия привычных компульсивных проявлений и ригидности поведения у пациентов с ОКР в отличие от пациентов с ГТР, где поведенческие реакции в виде навязчивостей отсутствуют [75]. Несмотря на то, что ГТР может пересекаться с ОКР по генетической основе [76], недавнее исследование [77] показало, что в условиях стресса у пациентов с ГТР способность когнитивного контроля улучшается в отличие от пациентов с ОКР.
Разнородные результаты исследований (см. Приложение 2), скорее всего, связаны с изучением небольших выборок. Однако К. Bey с соавт. [24] подтвердили данные многих предыдущих исследований на достаточно большой выборке (169 пациентов с ОКР) — показаны умеренные нарушения контроля антисаккад у пациентов с ОКР: увеличенные латентные периоды антисаккад, внутрисубъектная вариабельность латентных периодов антисаккад и увеличение антисаккадических ошибок по сравнению со здоровой контрольной группой. Последний эффект был вызван ошибками при экспресс-саккадах, при этом пациенты с ОКР мало отличались от контрольной группы в отношении ошибок при регулярных саккадах. Ранее эти параметры в виде ошибок при экспресс- и регулярных саккадах у пациентов с ОКР изучены не были, хотя с их помощью можно выявлять определенные нейронные механизмы тормозного контроля, нарушенные при ОКР. Здоровые родственники пациентов с ОКР также показали повышенный уровень ошибок и увеличение вариабельности латентного периода при выполнении антисаккадической задачи, что может указывать на предполагаемый эндофенотип ОКР.
Большинство исследований антисаккад (см. Приложение 2) указывают на нарушения тормозного контроля у пациентов с ОКР, проявляющиеся в увеличении латентного периода и частоты ошибок, что, возможно, коррелирует с дисбалансом передачи возбуждения и торможения в кортико-стриарно-таламо-кортикальной цепи.
Глазодвигательные парадигмы, направленные на изучение рабочей памяти и внимания
Рабочая память и внимание входят в состав функций когнитивного контроля человека. РП относится к когнитивной способности кратковременно хранить ограниченный объем информации и манипулировать ею в настоящий момент времени в отношении непосредственных стимулов для достижения необходимой цели, недоступной для непосредственного восприятия. Поскольку РП поддерживает волевые целенаправленные действия, ее изучение, вероятно, будет способствовать пониманию навязчивостей при ОКР, тем более что некоторые исследования указывают на то, что ритуалы (навязчивые действия) могут быть следствием дефицита РП [46].
Одной из стандартных экспериментальных схем, направленных на изучение памяти, является парадигма «саккады по памяти». Испытуемому предлагается смотреть на центральную точку фиксации, во время предъявления которой в периферическом поле зрения появляется цель. Испытуемый должен запомнить местоположение цели, при этом не смотреть на нее (не совершать саккаду к ней). При исчезновении точки фиксации следует совершить саккаду в сторону запомненного места. Время между исчезновением цели и моментом, когда испытуемому необходимо совершить саккаду (период задержки), может варьировать в зависимости от различной нагрузки на зрительно-пространственную РП. Типичными показателями, исследуемыми в задаче на саккады по памяти, являются точность, количество упреждающих саккад и величина латентного периода [56].
При выполнении задачи «саккады по памяти» наблюдается активация дорсолатеральной префронтальной коры, передней поясной извилины и дополнительного глазодвигательного поля [78]. Основываясь на этих данных, можно полагать, что дефицит в выполнении задачи на саккады по памяти связан с ухудшенной исполнительной функцией лобной коры.
Парадигма саккады по памяти в некоторых исследованиях называется задачей с отсроченным глазодвигательным ответом (oculomotor delayed response). Ее не так часто применяют при изучении глазодвигательных реакций пациентов с ОКР, в отличие от задачи на антисаккады. Показано, что у пациентов с ОКР количество ошибок в задаче фиксации является незначительно высоким по сравнению с контрольной группой, при этом ошибки возникают только тогда, когда периферический стимул находился близко от точки фиксации. Общая точность саккад в отношении запомненных целевых местоположений не различалась у пациентов с ОКР и здоровых испытуемых контрольной группы, хотя при ОКР наблюдалась тенденция к увеличенной латентности [71]. Необходимы дополнительные исследования с использованием задачи на саккады по памяти, чтобы сделать окончательные выводы о нарушении РП у пациентов с ОКР, поскольку при использовании других парадигм установлено, что нарушение зрительно-пространственной памяти у пациентов с ОКР является одним из наиболее часто регистрируемых когнитивных дефицитов [79–81].
Jaafari с соавт. [82] изучили вербальные и зрительно-пространственные компоненты РП у пациентов с ОКР с помощью тестов «Запоминание при чтении» (reading span test), «Запоминание обратного определения местоположения» (backward location span test), «Сравнение изображений». Объем РП в данных задачах у пациентов с ОКР был снижен, они выполняли большее количество саккад для сравнения изображений, чем контрольная группа. Причем показатели количества саккад у пациентов с ОКР были увеличены при сравнении разных, а не идентичных рисунков [82, 83]. Это противоречит данным J.Y. Rotge и соавт. [83], которые показали, что пациенты с ОКР делали большее количество проверочных саккад, когда изображения были идентичными. Возможно, такие отличия являются результатом различных способов представления двух изображений (последовательное или одновременное) и различной оценки поведения при проверке (количество добровольных проверок по сравнению с количеством движений взгляда между рисунками). Помимо этого, существовала сильная взаимосвязь между объемом РП участников и производительностью: низкий объем РП ассоциирован с более длительным временем при сравнении различных версий рисунков и с бóльшим количеством переводов взгляда между двумя рисунками, т.е. с более интенсивной проверкой [82, 83]. В целом вышеупомянутые исследования могут свидетельствовать, что интенсивность поведенческих симптомов пациентов и, в частности, проверяемость тесно связана с ухудшением их РП.
T.H. Lee с соавт. [84] также показали, что пациенты с ОКР намного чаще возвращаются к прочитанным словам, чем испытуемые контрольной группы и люди, страдающие игроманией. Возможно, это связано либо с заторможенной обработкой информации, либо с дефицитом РП. Хотя степень тяжести и проявлений симптомов ОКР, а также употребление лекарственных средств тоже могли способствовать некорректным результатам.
Исследование B. Harkin с соавт. [85] выявило, что люди с высоким уровнем подтипа «перепроверки» (checkers) чаще и дольше фиксируются на вводящей в заблуждение информации, чем контрольная группа. В частности, checkers тратят больше времени на проверку местоположений стимулов, в том числе и тех мест, которые фактически были пустыми во время предъявления. Видимо, нарушение внимания и РП во время решения задач, вводящих в заблуждение, приводит к тому, что checkers проводят чрезмерную проверку своих представлений в РП, сравнивая их даже с пустыми, неинформативными локациями [86, 87].
Были высказаны гипотезы, что нарушение РП при ОКР может быть связано с трудностями сосредоточения внимания на соответствующей информации и неспособностью подавить нерелевантные стимулы. Это в свою очередь может перегрузить РП несущественными для поставленной задачи входными данными, приводящими к дефициту РП [82, 88]. В таком случае, в соответствии с моделью Harkin и Kessler, нарушение РП у пациентов с ОКР является вторичным по отношению к исполнительной дисфункции [89].
В ряде исследований отмечено, что пациенты с ОКР с трудом игнорируют нерелевантные стимулы и демонстрируют нарушенные способности избирательного внимания. В обзорах H. Kashyap с соавт. [90] и H.R. Snyder с соавт. [91] показано, что дефицит внимания, наблюдаемый у пациентов с ОКР, является в основном побочным продуктом их нарушенных функций когнитивного контроля и указывает на снижение навыков в организации поступающей информации и оптимизации когнитивных ресурсов. Последнее предположение соотносится с выводом обзора, посвященного нейровизуализационным исследованиям пациентов с ОКР, о нарушенном сенсорном гейтинге при данном заболевании [13].
В нескольких работах, где использовалась парадигма зрительного поиска, изучалось только время отклика и точность без анализа движения глаз пациентов. Парадигма зрительного поиска позволяет исследовать внимание посредством движений глаз и заключается в поиске целевого объекта среди других зрительных стимулов, называемых «отвлекающими факторами» [92, 93]. Так, F. Botta с соавт. [94] показали, что пациентам с ОКР требовалось больше времени для выполнения зрительного поиска слов, чем здоровым участникам, и они больше фиксировали взгляд на нецелевых словах. Различные типы отвлекающих слов оказывают разное влияние на зрительный поиск у пациентов с ОКР и у контрольной группы. Это позволяет предположить, что механизмы управления вниманием различаются у пациентов с ОКР и у здоровых людей. Здоровые участники больше задерживают внимание на словах, визуально похожих на целевой стимул [95], в то время как пациенты с ОКР — на всех отвлекающих (нейтральных, орфографических и семантических) факторах, при этом они реже фиксируют взгляд на отвлекающих факторах, связанных с навязчивой идеей [94]. Эти данные свидетельствуют о проблемах оптимизации распределения ресурсов внимания у пациентов с ОКР, поскольку они не способны должным образом подавить не относящиеся к задаче стимулы. Переключение внимания на любой отвлекающий стимул может объяснить, почему в задачах зрительного поиска пациенты с ОКР в целом медленнее и менее эффективны, чем здоровые испытуемые. Интересен тот факт, что пациенты с ОКР делали меньше фиксаций на словах, связанных с навязчивыми идеями [94]. Возможно, это связано с тем, что, во-первых, согласно H.H. Greene с соавт. [96], во время зрительного поиска человек меньше фиксируется на знакомых отвлекающих факторах, чем на незнакомых. Во-вторых, пациенты с ОКР могут бессознательно избегать информации, связанной с их навязчивыми идеями. Интересно отметить, что в исследовании S. Najmi с соавт. [97] у пациентов с ОКР скорость приближения взгляда к изображениям, связанным с загрязнением, была медленнее, чем у контрольной группы, в то же время пациенты с ОКР не избегали взглядом эти изображения.
Данные об особенностях РП у пациентов с ОКР, полученные посредством нейропсихологических тестов, являются противоречивыми и неоднозначными [98, 99]. Тем не менее большинство исследований РП с помощью регистрации движений глаз подтверждают, что ее объем у пациентов с ОКР снижен. В свою очередь это может являться одной из причин возникновения навязчивого поведения (ритуалов). Однако не ясно, является ли нарушение РП первичным фактором, запускающим компульсивное поведение, или представляется вторичным по отношению к исполнительным функциям, в том числе и к функции избирательного внимания. Трудности в процессах сосредоточения внимания и подавлении нерелевантных стимулов, которые прослеживаются у пациентов с ОКР, на наш взгляд, отражают общую дисфункцию когнитивного контроля. Стоит также отметить, что описанные выше результаты исследований зависят и от того, насколько предъявляемые стимулы являются лично значимыми для испытуемого. ОКР часто сопровождается тревогой, а состояние тревожности пациентов с ОКР во время эксперимента может сокращать объем их РП и ухудшать общую производительность при решении тех или иных задач. Необходимы дальнейшие исследования с предварительным изучением ситуативной и личностной тревожности для определения однозначности и валидности данных о нарушении функций когнитивного контроля, в том числе РП, у пациентов с ОКР.
Заключение
Методы окулографии и айтрекинга активно используются для оценки сохранности когнитивного контроля у разных клинических групп, в том числе и у пациентов с обсессивно-компульсивным расстройством. При исследовании глазодвигательных функций у пациентов с таким расстройством наиболее часто применяют следующие парадигмы: задачи на медленные прослеживающие движения глаз, саккады по памяти, антисаккады. Данные по задачам на медленные прослеживающие движения глаз на настоящий момент противоречивы. Исследования саккад по памяти не показали достоверного нарушения рабочей памяти у пациентов с обсессивно-компульсивным расстройством, хотя была продемонстрирована связь глазодвигательных параметров с ухудшением рабочей памяти и избирательного внимания при этой патологии. Однако на результаты исследований могут влиять преморбидные черты личности, связанные с тревожностью, которые в будущем необходимо учитывать. Во многих работах при использовании антисаккадической задачи у пациентов с обсессивно-компульсивным расстройством выявили нарушения функции тормозного контроля. Схожие нарушения, проявляющиеся в увеличенной латентности и в большей частоте ошибок в антисаккадах, были отмечены и у их родственников первой линии, что может являться потенциальным эндофенотипом обсессивно-компульсивного расстройства. Подтверждение этих результатов в экспериментах с использованием сложных антисаккадических задач с применением изображений различной модальности (с учетом наличия повышенной тревожности у пациентов с обсессивно-компульсивным расстройством как основы заболевания) в перспективе может способствовать валидации специфичных маркеров обсессивно-компульсивного расстройства.
Вклад авторов: Г.М. Хайруллина — разработка концепции и написание текста статьи; В.В. Моисеева — анализ и интерпретация данных; О.В. Мартынова — научное редактирование рукописи.
Финансирование. Работа выполнена в рамках государственного задания Института высшей нервной деятельности и нейрофизиологии РАН Министерства образования и науки Российской Федерации на 2021–2023 гг. и в рамках Программы фундаментальных исследований Национального исследовательского университета «Высшая школа экономики» в 2021 г.
Конфликт интересов отсутствует.
Литература
- Adam Y., Meinlschmidt G., Gloster A.T., Lieb R. Obsessive-compulsive disorder in the community: 12-month prevalence, comorbidity and impairment. Soc Psychiatry Psychiatr Epidemiol 2012; 47(3): 339–349, https://doi.org/10.1007/s00127-010-0337-5.
- Ruscio A.M., Stein D.J., Chiu W.T., Kessler R.C. The epidemiology of obsessive-compulsive disorder in the National Comorbidity Survey Replication. Mol Psychiatry 2010; 15(1): 53–63, https://doi.org/10.1038/mp.2008.94.
- Nakao T., Okada K., Kanba S. Neurobiological model of obsessive-compulsive disorder: evidence from recent neuropsychological and neuroimaging findings. Psychiatry Clin Neurosci 2014; 68(8): 587–605, https://doi.org/10.1111/pcn.12195.
- Fineberg N.A., Apergis-Schoute A.M., Vaghi M.M., Banca P., Gillan C.M., Voon V., Chamberlain S.R., Cinosi E., Reid J., Shahper S., Bullmore E.T., Sahakian B.J., Robbins T.W. Mapping compulsivity in the DSM-5 obsessive compulsive and related disorders: cognitive domains, neural circuitry, and treatment. Int J Neuropsychopharmacol 2018; 21(1): 42–58, https://doi.org/10.1093/ijnp/pyx088.
- Brooks S.J., Stein D.J. Systematic review of the neural bases of psychotherapy for anxiety and related disorders. Dialogues Clin Neurosci 2015; 17(3): 261–279, https://doi.org/10.31887/dcns.2015.17.3/sbrooks.
- Saxena S., Rauch S.L. Functional neuroimaging and the neuroanatomy of obsessive-compulsive disorder. Psychiatr Clin North Am 2000; 23(3): 563–586, https://doi.org/10.1016/s0193-953x(05)70181-7.
- Karpinski M., Mattina G.F., Steiner M. Effect of gonadal hormones on neurotransmitters implicated in the pathophysiology of obsessive-compulsive disorder: a critical review. Neuroendocrinology 2017; 105(1): 1–16, https://doi.org/10.1159/000453664.
- Wu K., Hanna G.L., Rosenberg D.R., Arnold P.D. The role of glutamate signaling in the pathogenesis and treatment of obsessive-compulsive disorder. Pharmacol Biochem Behav 2012; 100(4): 726–735, https://doi.org/10.1016/j.pbb.2011.10.007.
- Kalra S.K., Swedo S.E. Children with obsessive-compulsive disorder: are they just “little adults”? J Clin Invest 2009; 119(4): 737–746, https://doi.org/10.1172/jci37563.
- Saxena S., Bota R.G., Brody A.L. Brain-behavior relationships in obsessive-compulsive disorder. Semin Clin Neuropsychiatry 2001; 6(2): 82–101, https://doi.org/10.1053/scnp.2001.21833.
- Göttlich M., Krämer U.M., Kordon A., Hohagen F., Zurowski B. Decreased limbic and increased fronto-parietal connectivity in unmedicated patients with obsessive-compulsive disorder. Hum Brain Mapp 2014; 35(11): 5617–5632, https://doi.org/10.1002/hbm.22574.
- van den Heuvel O.A., van der Werf Y.D., Verhoef K.M., de Wit S., Berendse H.W., Wolters E.Ch., Veltman D.J., Groenewegen H.J. Frontal-striatal abnormalities underlying behaviours in the compulsive-impulsive spectrum. J Neurol Sci 2010; 289(1–2): 55–59, https://doi.org/10.1016/j.jns.2009.08.043.
- Del Casale A., Kotzalidis G.D., Rapinesi C., Serata D., Ambrosi E., Simonetti A., Pompili M., Ferracuti S., Tatarelli R., Girardi P. Functional neuroimaging in obsessive-compulsive disorder. Neuropsychobiology 2011; 64(2): 61–85, https://doi.org/10.1159/000325223.
- Hazari N., Narayanaswamy J.C., Venkatasubramanian G. Neuroimaging findings in obsessive-compulsive disorder: a narrative review to elucidate neurobiological underpinnings. Indian J Psychiatry 2019; 61(Suppl 1): S9–S29, https://doi.org/10.4103/psychiatry.indianjpsychiatry_525_18.
- Robbins T.W., Vaghi M.M., Banca P. Obsessive-compulsive disorder: puzzles and prospects. Neuron 2019; 102(1): 27–47, https://doi.org/10.1016/j.neuron.2019.01.046.
- Stein D.J., Costa D.L.C., Lochner C., Miguel E.C., Reddy Y.C.J., Shavitt R.G., van den Heuvel O.A., Simpson H.B. Obsessive-compulsive disorder. Nat Rev Dis Primers 2019; 5(1): 52, https://doi.org/10.1038/s41572-019-0102-3.
- Славуцкая М.В., Лебедева И.С., Карелин С.А., Омельченко М.А. Нейробиологические маркеры нарушения когнитивного контроля у больных с ультравысоким риском развития шизофрении. Медицинская психология в России 2020; 12(3): 4, https://doi.org/10.24412/2219-8245-2020-3-4.
- Fitzgerald K.D., Schroder H.S., Marsh R. Cognitive control in pediatric obsessive-compulsive and anxiety disorders: brain-behavioral targets for early intervention. Biol Psychiatry 2021; 89(7): 697–706, https://doi.org/10.1016/j.biopsych.2020.11.012.
- Luna B., Velanova K., Geier C.F. Development of eye-movement control. Brain Cogn 2008; 68(3): 293–308, https://doi.org/10.1016/j.bandc.2008.08.019.
- Николаева Е.И., Сутормина Н.В. Окулография как психологический инструмент: параметры и их психологическое и психофизиологическое обеспечение. Вестник психофизиологии 2020; 3: 42–56, https://doi.org/10.34985/g9536-2433-1133-b.
- Шмуклер А.Б., Костюк Г.П., Латанов А.В., Сидорова М.Ю., Анисимов В.Н., Захарова Н.В., Карякина М.В., Резник А.М., Соколов А.В., Спектор В.А., Сухачевский И.С., Чурикова М.А. Сетевой анализ когнитивных, глазодвигательных и речевых показателей при шизофрении. Журнал неврологии и психиатрии им. C.C. Корсакова 2020; 120(6–2): 54–60.
- Cutsuridis V. Behavioural and computational varieties of response inhibition in eye-movements. Philos Trans R Soc Lond B Biol Sci 2017; 372(1718): 20160196, https://doi.org/10.1098/rstb.2016.0196.
- Jaafari N., Rigalleau F., Rachid F., Delamillieure P., Millet B., Olié J.P., Gil R., Rotge J.Y., Vibert N. A critical review of the contribution of eye-movement recordings to the neuropsychology of obsessive compulsive disorder. Acta Psychiatr Scand 2011; 124(2): 87–101, https://doi.org/10.1111/j.1600-0447.2011.01721.x.
- Bey K., Lennertz L., Grützmann R., Heinzel S., Kaufmann C., Klawohn J., Riesel A., Meyhöfer I., Ettinger U., Kathmann N., Wagner M. Impaired antisaccades in obsessive-compulsive disorder: evidence from meta-analysis and a large empirical study. Front Psychiatry 2018; 9: 284, https://doi.org/10.3389/fpsyt.2018.00284.
- Всемирная организация здравоохранения (ВОЗ). Международная классификация болезней 10 пересмотра (МКБ-10). URL: https://mkb-10.com/.
- Mataix-Cols D., Rosario-Campos M.C., Leckman J.F. A multidimensional model of obsessive-compulsive disorder. Am J Psychiatry 2005; 162(2): 228–238, https://doi.org/10.1176/appi.ajp.162.2.228.
- Bloch M.H., Landeros-Weisenberger A., Rosario M.C., Pittenger C., Leckman J.F. Meta-analysis of the symptom structure of obsessive-compulsive disorder. Am J Psychiatry 2008; 165(12): 1532–1542, https://doi.org/10.1176/appi.ajp.2008.08020320.
- Van Ameringen M., Patterson B., Simpson W. DSM-5 obsessive-compulsive and related disorders: clinical implications of new criteria. Depress Anxiety 2014; 31(6): 487–493, https://doi.org/10.1002/da.22259.
- Alexander G.E., DeLong M.R., Strick P.L. Parallel organization of functionally segregated circuits linking basal ganglia and cortex. Annu Rev Neurosci 1986; 9: 357–381, https://doi.org/10.1146/annurev.ne.09.030186.002041.
- Wehry A.M., Beesdo-Baum K., Hennelly M.M., Connolly S.D., Strawn J.R. Assessment and treatment of anxiety disorders in children and adolescents. Curr Psychiatry Rep 2015; 17(7): 52, https://doi.org/10.1007/s11920-015-0591-z.
- American Psychiatric Association. Diagnostic and Statistical Manual of Mental Disorders, Fifth Edition (DSM-5). USA: American Psychiatric Publishing; 2013.
- World Health Organization. International classification of diseases 11th revision. URL: https://icd.who.int/en.
- Bienvenu O.J., Samuels J.F., Riddle M.A., Hoehn-Saric R., Liang K.Y., Cullen B.A., Grados M.A., Nestadt G. The relationship of obsessive-compulsive disorder to possible spectrum disorders: results from a family study. Biol Psychiatry 2000; 48(4): 287–293, https://doi.org/10.1016/s0006-3223(00)00831-3.
- Monzani B., Rijsdijk F., Harris J., Mataix-Cols D. The structure of genetic and environmental risk factors for dimensional representations of DSM-5 obsessive-compulsive spectrum disorders. JAMA Psychiatry 2014; 71(2): 182–189, https://doi.org/10.1001/jamapsychiatry.2013.3524.
- Phillips K.A., Stein D.J., Rauch S.L., Hollander E., Fallon B.A., Barsky A., Fineberg N., Mataix-Cols D., Ferrão Y.A., Saxena S., Wilhelm S., Kelly M.M., Clark L.A., Pinto A., Bienvenu O.J., Farrow J., Leckman J. Should an obsessive-compulsive spectrum grouping of disorders be included in DSM-V? Depress Anxiety 2010; 27(6): 528–555, https://doi.org/10.1002/da.20705.
- Stein D.J., Kogan C.S., Atmaca M., Fineberg N.A., Fontenelle L.F., Grant J.E., Matsunaga H., Reddy Y.C.J., Simpson H.B., Thomsen P.H., van den Heuvel O.A., Veale D., Woods D.W., Reed G.M. The classification of obsessive-compulsive and related disorders in the ICD-11. J Affect Disord 2016; 190: 663–674, https://doi.org/10.1016/j.jad.2015.10.061.
- Epping E.A., Kim J.I., Craufurd D., Brashers-Krug T.M., Anderson K.E., McCusker E., Luther J., Long J.D., Paulsen J.S.; PREDICT-HD Investigators and Coordinators of the Huntington Study Group. Longitudinal psychiatric symptoms in prodromal huntington’s disease: a decade of data. Am J Psychiatry 2016; 173(2): 184–192, https://doi.org/10.1176/appi.ajp.2015.14121551.
- Ahmed S., Venigalla H., Mekala H.M., Dar S., Hassan M., Ayub S. Traumatic brain injury and neuropsychiatric complications. Indian J Psychol Med 2017; 39(2): 114–121, https://doi.org/10.4103/0253-7176.203129.
- Lin C.I., Lin Y.C., Lien W.C., Hsieh P.C., Lin S.H., Kuan T.S. Punding following posterior cerebral artery infarction: a case report and literature review. Neuropsychiatr Dis Treat 2017; 13: 981–985, https://doi.org/10.2147/ndt.s132775.
- Swedo S.E., Seidlitz J., Kovacevic M., Latimer M.E., Hommer R., Lougee L., Grant P. Clinical presentation of pediatric autoimmune neuropsychiatric disorders associated with streptococcal infections in research and community settings. J Child Adolesc Psychopharmacol 2015; 25(1): 26–30, https://doi.org/10.1089/cap.2014.0073.
- Chiarello F., Spitoni S., Hollander E., Matucci Cerinic M., Pallanti S. An expert opinion on PANDAS/PANS: highlights and controversies. Int J Psychiatry Clin Pract 2017; 21(2): 91–98, https://doi.org/10.1080/13651501.2017.1285941.
- Robertson M.M., Eapen V., Singer H.S., Martino D., Scharf J.M., Paschou P., Roessner V., Woods D.W., Hariz M., Mathews C.A., Črnčec R., Leckman J.F. Gilles de la Tourette syndrome. Nat Rev Dis Primers 2017; 3: 16097, https://doi.org/10.1038/nrdp.2016.97.
- Benzina N., Mallet L., Burguière E., N’Diaye K., Pelissolo A. Cognitive dysfunction in obsessive-compulsive disorder. Curr Psychiatry Rep 2016; 18(9): 80, https://doi.org/10.1007/s11920-016-0720-3.
- Mataix-Cols D., Rauch S.L., Baer L., Eisen J.L., Shera D.M., Goodman W.K., Rasmussen S.A., Jenike M.A. Symptom stability in adult obsessive-compulsive disorder: data from a naturalistic two-year follow-up study. Am J Psychiatry 2002; 159(2): 263–268, https://doi.org/10.1176/appi.ajp.159.2.263.
- Mataix-Cols D., Wooderson S., Lawrence N., Brammer M.J., Speckens A., Phillips M.L. Distinct neural correlates of washing, checking, and hoarding symptom dimensions in obsessive-compulsive disorder. Arch Gen Psychiatry 2004; 61(6): 564–576, https://doi.org/10.1001/archpsyc.61.6.564.
- Jaafari N., Aouizerate B., Tignol J., El-Hage W., Wassouf I., Guehl D., Bioulac B., Daniel M.L., Lacoste J., Gil R., Burbaud P., Rotge J.Y.; Insight Study Group. The relationship between insight and uncertainty in obsessive-compulsive disorder. Psychopathology 2011; 44(4): 272–276, https://doi.org/10.1159/000323607.
- Kloft L., Reuter B., Riesel A., Kathmann N. Impaired volitional saccade control: first evidence for a new candidate endophenotype in obsessive-compulsive disorder. Eur Arch Psychiatry Clin Neurosci 2013; 263(3): 215–222, https://doi.org/10.1007/s00406-012-0331-x.
- Kennard C. Disorders of higher gaze control. Handb Clin Neurol 2011; 102: 379–402, https://doi.org/10.1016/B978-0-444-52903-9.00020-0.
- Tien A.Y., Pearlson G.D., Machlin S.R., Bylsma F.W., Hoehn-Saric R. Oculomotor performance in obsessive-compulsive disorder. Am J Psychiatry 1992; 149(5): 641–646, https://doi.org/10.1176/ajp.149.5.641.
- Sweeney J.A., Palumbo D.R., Halper J.P., Shear M.K. Pursuit eye-movement dysfunction in obsessive-compulsive disorder. Psychiatry Res 1992; 42(1): 1–11, https://doi.org/10.1016/0165-1781(92)90034-z.
- Gambini O., Abbruzzese M., Scarone S. Smooth pursuit and saccadic eye-movements and Wisconsin Card Sorting Test performance in obsessive-compulsive disorder. Psychiatry Res 1993; 48(3): 191–200, https://doi.org/10.1016/0165-1781(93)90071-n.
- Pallanti S., Grecu L.M., Gangemi P.F., Massi S., Parigi A., Arnetoli G., Quercioli L., Zaccara G. Smooth-pursuit eye-movement and saccadic intrusions in obsessive-compulsive disorder. Biol Psychiatry 1996; 40(11): 1164–1172, https://doi.org/10.1016/s0006-3223(95)00607-9.
- Lencer R., Trillenberg P., Trillenberg-Krecker K., Junghanns K., Kordon A., Broocks A., Hohagen F., Heide W., Arolt V. Smooth pursuit deficits in schizophrenia, affective disorder and obsessive-compulsive disorder. Psychol Med 2004; 34(3): 451–460, https://doi.org/10.1017/s0033291703001314.
- Nickoloff S.E., Radant A.D., Reichler R., Hommer D.W. Smooth pursuit and saccadic eye-movements and neurological soft signs in obsessive-compulsive disorder. Psychiatry Res 1991; 38(2): 173–185, https://doi.org/10.1016/0165-1781(91)90042-n.
- Farber R.H., Clementz B.A., Swerdlow N.R. Characteristics of open- and closed-loop smooth pursuit responses among obsessive-compulsive disorder, schizophrenia, and nonpsychiatric individuals. Psychophysiology 1997; 34(2): 157–162, https://doi.org/10.1111/j.1469-8986.1997.tb02126.x.
- Rommelse N.N., Van der Stigchel S., Sergeant J.A. A review on eye-movement studies in childhood and adolescent psychiatry. Brain Cogn 2008; 68(3): 391–414, https://doi.org/10.1016/j.bandc.2008.08.025.
- Fukushima J., Akao T., Kurkin S., Kaneko C.R., Fukushima K. The vestibular-related frontal cortex and its role in smooth-pursuit eye-movements and vestibular-pursuit interactions. J Vestib Res 2006; 16(1–2): 1–22.
- Fukushima J., Akao T., Takeichi N., Kaneko C.R.S., Fukushima K. Involvement of the frontal oculomotor areas in developmental compensation for the directional asymmetry in smooth-pursuit eye-movements in young primates. Ann N Y Acad Sci 2003; 1004(1): 451–456, https://doi.org/10.1111/j.1749-6632.2003.tb00258.x.
- Siever L.J., Insel T.R., Hamilton J., Nurnberger J., Alterman I., Murphy D.L. Eye-tracking, attention and amphetamine challenge. J Psychiatr Res 1987; 21(2): 129–135, https://doi.org/10.1016/0022-3956(87)90013-6.
- Clementz B.A., Farber R.H., Lam M.N., Swerdlow N.R. Ocular motor responses to unpredictable and predictable smooth pursuit stimuli among patients with obsessive-compulsive disorder. J Psychiatry Neurosci 1996; 21(1): 21–28.
- Bey K., Meyhöfer I., Lennertz L., Grützmann R., Heinzel S., Kaufmann C., Klawohn J., Riesel A., Ettinger U., Kathmann N., Wagner M. Schizotypy and smooth pursuit eye-movements as potential endophenotypes of obsessive-compulsive disorder. Eur Arch Psychiatry Clin Neurosci 2019; 269(2): 235–243, https://doi.org/10.1007/s00406-018-0899-x.
- Damilou A., Apostolakis S., Thrapsanioti E., Theleritis C., Smyrnis N. Shared and distinct oculomotor function deficits in schizophrenia and obsessive compulsive disorder. Psychophysiology 2016; 53(6): 796–805, https://doi.org/10.1111/psyp.12630.
- Miyake A., Friedman N.P., Emerson M.J., Witzki A.H., Howerter A., Wager T.D. The unity and diversity of executive functions and their contributions to complex “frontal lobe” tasks: a latent variable analysis. Cogn Psychol 2000; 41(1): 49–100, https://doi.org/10.1006/cogp.1999.0734.
- Fischer B., Biscaldi M., Gezeck S. On the development of voluntary and reflexive components in human saccade generation. Brain Res 1997; 754(1–2): 285–297, https://doi.org/10.1016/s0006-8993(97)00094-2.
- Maruff P., Purcell R., Tyler P., Pantelis C., Currie J. Abnormalities of internally generated saccades in obsessive-compulsive disorder. Psychol Med 1999; 29(6): 1377–1385, https://doi.org/10.1017/s0033291799008843.
- van der Wee N.J., Hardeman H.H., Ramsey N.F., Raemaekers M., Van Megen H.J., Denys D.A., Westenberg H.G., Kahn R.S. Saccadic abnormalities in psychotropic-naive obsessive-compulsive disorder without co-morbidity. Psychol Med 2006; 36(9): 1321–1326, https://doi.org/10.1017/S0033291706007926.
- Agam Y., Greenberg J.L., Isom M., Falkenstein M.J., Jenike E., Wilhelm S., Manoach D.S. Aberrant error processing in relation to symptom severity in obsessive-compulsive disorder: a multimodal neuroimaging study. Neuroimage Clin 2014; 5: 141–151, https://doi.org/10.1016/j.nicl.2014.06.002.
- Narayanaswamy J.C., Subramaniam A., Bose A., Agarwal S.M., Kalmady S.V., Jose D., Joseph B., Shivakumar V., Hutton S.B., Venkatasubramanian G., Reddy Y.C.J. Antisaccade task performance in obsessive-compulsive disorder and its clinical correlates. Asian J Psychiatr 2021; 57: 102508, https://doi.org/10.1016/j.ajp.2020.102508.
- Lennertz L., Rampacher F., Vogeley A., Schulze-Rauschenbach S., Pukrop R., Ruhrmann S., Klosterkötter J., Maier W., Falkai P., Wagner M. Antisaccade performance in patients with obsessive-compulsive disorder and unaffected relatives: further evidence for impaired response inhibition as a candidate endophenotype. Eur Arch Psychiatry Clin Neurosci 2012; 262(7): 625–634, https://doi.org/10.1007/s00406-012-0311-1.
- Kloft L., Kischkel E., Kathmann N., Reuter B. Evidence for a deficit in volitional action generation in patients with obsessive-compulsive disorder. Psychophysiology 2011; 48(6): 755–761, https://doi.org/10.1111/j.1469-8986.2010.01138.x.
- Rosenberg D.R., Averbach D.H., O'Hearn K.M., Seymour A.B., Birmaher B., Sweeney J.A. Oculomotor response inhibition abnormalities in pediatric obsessive-compulsive disorder. Arch Gen Psychiatry 1997; 54(9): 831–838, https://doi.org/10.1001/archpsyc.1997.01830210075008.
- Ray A., Subramanian A., Chhabra H., Kommu J.V.S., Venkatsubramanian G., Srinath S., Girimaji S., Sheshadri S.P., Philip M. Eye-movement tracking in pediatric obsessive compulsive disorder. Asian J Psychiatr 2019; 43: 9–16, https://doi.org/10.1016/j.ajp.2019.04.003.
- McDowell J.E., Clementz B.A. The effect of fixation condition manipulations on antisaccade performance in schizophrenia: studies of diagnostic specificity. Exp Brain Res 1997; 115(2): 333–344, https://doi.org/10.1007/pl00005702.
- Spengler D., Trillenberg P., Sprenger A., Nagel M., Kordon A., Junghanns K., Heide W., Arolt V., Hohagen F., Lencer R. Evidence from increased anticipation of predictive saccades for a dysfunction of fronto-striatal circuits in obsessive-compulsive disorder. Psychiatry Res 2006; 143(1): 77–88, https://doi.org/10.1016/j.psychres.2005.08.020.
- Hu Y., Liao R., Chen W., Kong X., Liu J., Liu D., Maguire P., Zhou S., Wang D. Investigating behavior inhibition in obsessive-compulsive disorder: evidence from eye-movements. Scand J Psychol 2020; 61(5): 634–641, https://doi.org/10.1111/sjop.12620.
- Radua J., van den Heuvel O.A., Surguladze S., Mataix-Cols D. Meta-analytical comparison of voxel-based morphometry studies in obsessive-compulsive disorder vs other anxiety disorders. Arch Gen Psychiatry 2010; 67: 701–711, https://doi.org/10.1001/archgenpsychiatry.2010.70.
- Hallion L.S., Tolin D.F., Diefenbach G.J. Enhanced cognitive control over task-irrelevant emotional distractors in generalized anxiety disorder versus obsessive-compulsive disorder. J Anxiety Disord 2019; 64: 71–78, https://doi.org/10.1016/j.janxdis.2019.02.004.
- Ettinger U., Antonova E., Crawford T.J., Mitterschiffthaler M.T., Goswani S., Sharma T., Kumari V. Structural neural correlates of prosaccade and antisaccade eye-movements in healthy humans. Neuroimage 2005; 24(2): 487–494, https://doi.org/10.1016/j.neuroimage.2004.08.019.
- Shin M.S., Park S.J., Kim M.S., Lee Y.H., Ha T.H., Kwon J.S. Deficits of organizational strategy and visual memory in obsessive-compulsive disorder. Neuropsychology 2004; 18(4): 665–672, https://doi.org/10.1037/0894-4105.18.4.665.
- Abramovitch A., Cooperman A. The cognitive neuropsychology of obsessive-compulsive disorder: a critical review. J Obsessive Compuls Relat Disord 2015; 5: 24–36.
- Dittrich W.H., Johansen T. Cognitive deficits of executive functions and decision-making in obsessive-compulsive disorder. Scand J Psychol 2013; 54(5): 393–400, https://doi.org/10.1111/sjop.12066.
- Jaafari N., Frasca M., Rigalleau F., Rachid F., Gil R., Olié J.P., Guehl D., Burbaud P., Aouizerate B., Rotgé J.Y., Vibert N. Forgetting what you have checked: a link between working memory impairment and checking behaviors in obsessive-compulsive disorder. Eur Psychiatry 2013; 28(2): 87–93, https://doi.org/10.1016/j.eurpsy.2011.07.001.
- Rotge J.Y., Clair A.H., Jaafari N., Hantouche E.G., Pelissolo A., Goillandeau M., Pochon J.B., Guehl D., Bioulac B., Burbaud P., Tignol J., Mallet L., Aouizerate B. A challenging task for assessment of checking behaviors in obsessive-compulsive disorder. Acta Psychiatr Scand 2008; 117(6): 465–473, https://doi.org/10.1111/j.1600-0447.2008.01173.x.
- Lee T.H., Kim M., Kwak Y.B., Hwang W.J., Kim T., Choi J.S., Kwon J.S. Altered eye-movement patterns during text reading in obsessive-compulsive disorder and internet gaming disorder. Front Behav Neurosci 2018; 12: 248, https://doi.org/10.3389/fnbeh.2018.00248.
- Harkin B., Miellet S., Kessler K. What checkers actually check: an eye-tracking study of inhibitory control and working memory. PLoS One 2012; 7(9): e44689, https://doi.org/10.1371/journal.pone.0044689.
- Omori I.M., Murata Y., Yamanishi T., Nakaaki S., Akechi T., Mikuni M., Furukawa T.A. The differential impact of executive attention dysfunction on episodic memory in obsessive-compulsive disorder patients with checking symptoms vs. those with washing symptoms. J Psychiatr Res 2007; 41(9): 776–784, https://doi.org/10.1016/j.jpsychires.2006.05.005.
- van den Hout M., Kindt M. Obsessive-compulsive disorder and the paradoxical effects of perseverative behaviour on experienced uncertainty. J Behav Ther Exp Psychiatry 2004; 35(2): 165–181, https://doi.org/10.1016/j.jbtep.2004.04.007.
- de Vries F.E., de Wit S.J., Cath D.C., van der Werf Y.D., van der Borden V., van Rossum T.B., van Balkom A.J., van der Wee N.J., Veltman D.J., van den Heuvel O.A. Compensatory frontoparietal activity during working memory: an endophenotype of obsessive-compulsive disorder. Biol Psychiatry 2014; 76(11): 878–887, https://doi.org/10.1016/j.biopsych.2013.11.021.
- Harkin B., Kessler K. The role of working memory in compulsive checking and OCD: a systematic classification of 58 experimental findings. Clin Psychol Rev 2011; 31(6): 1004–1021, https://doi.org/10.1016/j.cpr.2011.06.004.
- Kashyap H., Kumar J.K., Kandavel T., Reddy Y.C.J. Neuropsychological functioning in obsessive-compulsive disorder: are executive functions the key deficit? Compr Psychiatry 2013; 54(5): 533–540, https://doi.org/10.1016/j.comppsych.2012.12.003.
- Snyder H.R., Kaiser R.H., Warren S.L., Heller W. Obsessive-compulsive disorder is associated with broad impairments in executive function: a meta-analysis. Clin Psychol Sci 2015; 3(2): 301–330, https://doi.org/10.1177/2167702614534210.
- Kaplan O., Dar R., Rosenthal L., Hermesh H., Fux M., Lubow R.E. Obsessive-compulsive disorder patients display enhanced latent inhibition on a visual search task. Behav Res Ther 2006; 44(8): 1137–1145, https://doi.org/10.1016/j.brat.2005.09.005.
- Morein-Zamir S., Papmeyer M., Durieux A., Fineberg N.A., Sahakian B.J., Robbins T.W. Investigation of attentional bias in obsessive compulsive disorder with and without depression in visual search. PLoS One 2013; 8(11): e80118, https://doi.org/10.1371/journal.pone.0080118.
- Botta F., Vibert N., Harika-Germaneau G., Frasca M., Rigalleau F., Fakra E., Ros C., Rouet J.F., Ferreri F., Jaafari N. Visual search for verbal material in patients with obsessive-compulsive disorder. Psychiatry Res 2018; 264: 244–253, https://doi.org/10.1016/j.psychres.2018.03.054.
- Léger L., Rouet J.F., Ros C., Vibert N. Orthographic versus semantic matching in visual search for words within lists. Can J Exp Psychol 2012; 66(1): 32–43, https://doi.org/10.1037/a0026111.
- Greene H.H., Rayner K. Eye-movements and familiarity effects in visual search. Vision Res 2001; 41(27): 3763–3773, https://doi.org/10.1016/s0042-6989(01)00154-7.
- Najmi S., Kuckertz J.M., Amir N. Automatic avoidance tendencies in individuals with contamination-related obsessive-compulsive symptoms. Behav Res Ther 2010; 48(10): 1058–1062, https://doi.org/10.1016/j.brat.2010.06.007.
- Boldrini M., Del Pace L., Placidi G.P., Keilp J., Ellis S.P., Signori S., Placidi G.F., Cappa S.F. Selective cognitive deficits in obsessive-compulsive disorder compared to panic disorder with agoraphobia. Acta Psychiatr Scand 2005; 111(2): 150–158, https://doi.org/10.1111/j.1600-0447.2004.00247.x.
- Kuelz A.K., Hohagen F., Voderholzer U. Neuropsychological performance in obsessive-compulsive disorder: a critical review. Biol Psychol 2004; 65(3): 185–236, https://doi.org/10.1016/j.biopsycho.2003.07.007.96.










