Комбинация мультимодальной МРТ, нейронавигации и краниотомии в сознании при удалении опухолей функционально значимых областей головного мозга
Цель исследования — оценить возможности комбинированного подхода с использованием мультимодальной МРТ, нейронавигации и краниотомии в сознании при резекции опухолей функционально значимых областей головного мозга.
Материалы и методы. Проанализированы результаты 30 последовательно выполненных хирургических вмешательств с пробуждением у пациентов с опухолями функционально значимых областей головного мозга в 2017–2019 гг. Основным критерием отбора для данного типа операций являлось расположение опухоли в проекции или в непосредственной близости от корковых центров речи и движения. Для уменьшения и минимизации повреждений пациентам на догоспитальном этапе выполняли функциональную МРТ и DTI-трактографию для определения областей коры и трактов белого вещества, принимающих участие в выполнении моторной и речевой функций; непосредственно перед операцией — загрузку полученных данных в навигационную станцию StealthStation S7 (Medtronic, США) для планирования и контроля этапов операции; во время операции — прямую кортикальную и субкортикальную стимуляцию для определения моторных и речевых областей (операция по технологии asleep–awake–asleep) с проведением нейролингвистического тестирования. Для определения общего состояния пациентов и исходов операции использовали индекс Карновского, оценку неврологического статуса пациента, частоты эпилептических приступов до и после операции и степени резекции образований, анализ данных после лингвистического тестирования.
Результаты. Улучшение общего состояния после операции в сравнении с дооперационным состоянием отмечено у 30% пациентов, отсутствие динамики неврологического дефицита наблюдалось у 33% пациентов. По результатам послеоперационной мультимодальной МРТ тотальное удаление опухоли было достигнуто в 37% случаев, субтотальное — в 40%, частичное удаление — в 23% случаев.
Заключение. Комбинированный подход к резекции опухоли мозга с использованием мультимодальной МРТ, нейронавигации и краниотомии в сознании, с картированием речевых и моторных зон позволяет минимизировать риск возникновения стойкого неврологического дефицита и дает возможность выполнить максимально возможную резекцию при сохранении функционального статуса пациента. Описанная методология является воспроизводимой, что позволяет расширять возможности хирургического лечения при локализации поражений в функционально-значимых зонах мозга.
Введение
Объемные образования, локализующиеся в проекции или в непосредственной близости от функционально значимых зон головного мозга, представляют собой серьезную хирургическую проблему. Резекция опухоли вблизи этих областей ассоциирована с высоким риском возникновения стойкого неврологического дефицита. Так, степень резекции коррелирует с выживаемостью у пациентов с глиомами различной степени злокачественности [1–3].
Основная цель операции по поводу поражения таких функционально значимых зон — выполнение максимально возможной резекции с сохранением функционального статуса пациента. Решающую роль в возникновении стойкого неврологического дефицита, негативно влияющего на дальнейшее течение заболевания и выживаемость пациентов, играют зоны, отвечающие за такие функции, как движение, речь и когнитивные навыки [4–6].
Чтобы сохранить функциональный статус пациента, важно на предоперационном этапе установить взаимосвязь опухоли с двигательными и речевыми корковыми центрами и с трактами белого вещества мозга. Для выполнения этой задачи сегодня активно используются возможности мультимодальной МРТ. Проводится функциональное картирование, к методам которого относят функциональную МРТ (фМРТ) и диффузно-тензорную визуализацию (DTI-трактографию) [7]. Для интраоперационного контроля используется прямая кортикальная и субкортикальная стимуляция с контролем функционального статуса пациента при его пробуждении [8, 9].
Выбор тактики хирургического лечения опухолей функционально значимых зон головного мозга в пользу комбинированного подхода, включающего в себя фМРТ, DTI-трактографию и краниотомию в сознании, дает ряд преимуществ, среди которых — снижение рисков возникновения стойкого неврологического дефицита, возможность проводить более обширную резекцию и выполнять интраоперационный контроль за сохранением функционального статуса пациента.
Цель исследования — оценить результаты применения комбинированного подхода при резекции опухолей функционально значимых зон головного мозга.
Материалы и методы
Пациенты. На базе нейрохирургического отделения Университетской клиники Приволжского исследовательского медицинского университета за 2017–2019 гг. было проведено 30 резекций опухолей головного мозга с пробуждением. В исследование включено 29 пациентов (14 женщин, 15 мужчин), у одного из пациентов процедура была выполнена дважды с интервалом в 4 мес. Средний возраст составил 41 [37; 51] год.
Критериями отбора для данного типа операции являлись: 1) расположение опухоли в проекции или в непосредственной близости от корковых центров речи и движения; 2) отсутствие выраженного неврологического дефицита, который может препятствовать проведению тестов (выраженные афатические нарушения, моторный дефицит); 3) согласие пациента.
Клаустрофобия, неконтролируемый кашель, крайне молодой возраст, патологическое ожирение, хронические заболевания, выраженный отек головного мозга рассматривались как относительные противопоказания.
Анализ предоперационного неврологического статуса показал наличие эпилептических припадков до операции в 47% случаев (14/30), среднее значение индекса Карновского составило 80 [70; 90] баллов. Очаговый неврологический дефицит до операции наблюдался в 27% случаев (8/30), в его структуру входили только афатические (10%), только когнитивные (6,7%) или афатические и моторные (10%) нарушения.
Наиболее распространенными образованиями являлись глиомы Grade III (13 пациентов) и Grade II (6 пациентов). Глиобластома Grade IV была верифицирована у 2 пациентов, глиома Grade I — у 5 пациентов. Прооперировано также 4 пациента с метастатическим поражением головного мозга. Объем опухоли по данным МРТ составил 62,25 [26,30; 101,0] см3. У 15 пациентов опухоль затрагивала 2 и более долей головного мозга.
Из 30 проведенных операций 21 была проведена впервые, а 9 — повторно после хирургического (n=1) или комбинированного (n=8) лечения. Перед операцией с каждым пациентом проводилась беседа о предстоящем вмешательстве, его этапах, возможных ощущениях пациента, о необходимости информировать хирурга или анестезиолога об ухудшении самочувствия, появлении тошноты, боли или онемения в какой-либо части тела. Работа выполнена в соответствии с положениями Хельсинкской декларации (2013). На проведение исследования получено информированное согласие пациентов и разрешение Этического комитета Приволжского исследовательского медицинского университета.
Мультимодальная МРТ. Всем пациентам перед операцией выполняли МРТ-исследование на аппарате Magnetom Essenza 1,5 Т (Siemens, Германия). Протокол предоперационного МРТ-обследования пациентов включал следующие режимы: Т2-ВИ; FLAIR в аксиальной плоскости; Т1-ВИ MPR iso (1 мм); DTI (64 направления диффузии; b-value — 1000 c/мм²; размер вокселя — 3×3×3 мм); BOLD (с предъявлением парадигм на пассивную речь, активную речь, движения рукой, движения ногой). Постобработку осуществляли в пакете программ Nordic Neurolab (Норвегия). Она включала в себя МР-трактографию с реконструкцией основных проводящих путей пораженного полушария (мозолистое тело, кортикоспинальные тракты, лучистый венец, верхний и нижний продольный пучки, нижний лобно-затылочный пучок, крючковидный, дугообразный, косой лобный пучки), а также построение карты активности головного мозга в соответствии с перечисленными выше парадигмами. Полученные МРТ-данные загружались в навигационную станцию StealthStation S7 (Medtronic, США), при помощи которой планировались этапы оперативного вмешательства.
Предоперационное тестирование речи. Каждому пациенту было проведено нейролингвистическое тестирование, в структуру которого входили дооперационное тестирование для определения общего речевого статуса пациента; подбор и проведение интраоперационных тестов, соответствующих локализации опухоли; интраоперационное лингвистическое картирование речи; послеоперационное тестирование с целью обнаружения изменений в речи. Тестирование выполняли при помощи русского афазиологического теста (РАТ) [10]. Данная батарея тестов состоит из 13 субтестов, направленных на оценку способности к порождению, пониманию и повторению речи, и является валидной и надежной для отслеживания изменений в речи на каждом языковом уровне. Тестирование проводили в среднем за 1–2 дня до операции с целью формирования индивидуальной батареи тестовых заданий. Из результатов исключали те пробы, в которых были допущены ошибки. Данный этап необходим, чтобы во время тестирования на операции пациенту предъявлялись только те стимулы, которые не вызывали у него трудностей, с целью минимизировать риск ошибок, не связанных с электрической стимуляцией.
Интраоперационное определение речевых зон головного мозга. Нейролингвистическое тестирование могло включать 1, 2 или 3 теста в зависимости от локализации опухоли. Выбор теста определяли с учетом анатомического расположения образования. Так, для картирования функций лобной доли и нижележащих проводящих путей (лобный косой пучок и передние отделы дугообразного пучка) использовали задания на называние действий и заканчивание предложений [11]. Для картирования височной, теменной долей и нижележащих путей (дугообразный пучок — короткий и задний сегменты, верхний продольный пучок, нижний продольный пучок, лобно-затылочный пучок) использовали задания на называние объектов, фонологическую дискриминацию [12]. При обнаружении речевого дефицита выявленную зону помечали стерильной меткой.
Кортикальная и субкортикальная стимуляция. Нейрофизиологический мониторинг осуществляли на аппарате ISIS IOM (inomed Medizintechnik GmbH, Германия). Зону воздействия электродов выбирали на основании данных нейронавигации. Эта зона захватывала область патологического очага и прилежащие участки коры на расстоянии не менее 1–2 см от краев образования. Для кортикального картирования использовали биполярный электрод, подающий двухфазный ток, сила тока которого устанавливалась в пределах стандартных значений — 6–12 мА. Для субкортикального картирования использовали монополярный электрод с диапазоном силы тока 1–20 мА.
Для картирования корковых представительств моторной функции осуществляли стимуляцию током с регистрацией моторного ответа на контралатеральной стороне подкожными игольчатыми электродами.
Оперативное вмешательство. Операции проводили с применением микрохирургической техники. Область трепанации и кожного разреза планировали с помощью нейронавигационной системы, в которую загружались данные мультимодального МРТ-исследования.
Каждому пациенту проводили локорегионарную анестезию ветвей нервов, иннервирующих скальп, с целью предупреждения болевых ощущений после пробуждения. Также выполняли анестезию кожи в месте фиксации скобы Мэйфилда и зоны разреза. Для блокады использовали Ропивакаин 0,375% с адреналином 1:200 000 в объеме 40–60 мл. После вводного наркоза и интубации трахеи поддержание анестезии осуществляли непрерывной инфузией пропофола 20–40 мл/ч и фентанила 0,5 мл/ч.
После пробуждения пациента и установления контакта с ним нейрохирург приступал к кортикальной стимуляции. Параллельно нейролингвист проводил его тестирование. Удаление опухоли включало в себя попеременную резекцию и электростимуляцию для контроля сохранности функций. Возникающие при стимуляции судороги купировали стерильным ледяным раствором Рингера с последующим снижением силы тока. Резекцию продолжали до визуально неизмененного вещества мозга, при получении ответа на стимуляцию при силе тока 1–2 мА (соответствует расстоянию в 1–2 мм) резекция прекращалась. После завершения основного этапа проводили седацию пациента с использованием дексмедетомидина или пропофола с мидазоламом в зависимости от клинической необходимости.
Все операции осуществляли под нейронавигационным контролем, дополнительно использовали методы интраоперационной нейровизуализации: в 10 случаях (33%) — ультразвуковой контроль, в 4 случаях (13%) — оптическую когерентную томографию.
После операции пациенты находились под наблюдением реаниматологов, после чего при отсутствии противопоказаний переводились в отделение нейрохирургии.
Было проведено 30 краниотомий в сознании, в одном случае процедуру пробуждения пришлось прекратить, так как выполнение нейролингвистического тестирования оказалось невозможным из-за гиперреакции пациента после пробуждения. Пациенту повторно дали наркоз и операция продолжалась под общей анестезией.
Оценка радикальности резекции и результатов лечения. В послеоперационном периоде каждому пациенту выполняли контрольную МРТ и проводили повторное нейролингвистическое тестирование. Степень резекции определяли количественно путем расчета отношения остаточного объема опухоли к дооперационному методом ручной сегментации зоны патологического Т2/FLAIR-сигнала — для неконтрастируемых глиом и зоны накопления контрастного препарата — для метастазов и контрастируемых глиом.
Сегментацию и вычисление объема опухоли проводили с помощью навигационной станции StealthStation S7. Удаление считали тотальным при степени резекции опухоли более 99% (допускалось незначительное накопление контрастного усиления по стенкам послеоперационной кисты), субтотальным — при радикальности 70–99% и парциальным — при радикальности менее 70%.
Для оценки общего состояния пациентов использовали индекс Карновского, частоту эпилептических приступов до и после операции, анализ до- и послеоперационных неврологических дефицитов, повторное лингвистическое тестирование.
Статистическая обработка данных. Анализ статистических данных выполняли с помощью пакета программ Statistica 10.0. В связи с тем, что количество пациентов в генеральной совокупности было менее 50, а распределение числовых значений в части выборки отличалось от нормального закона распределения, были применены непараметрические методы статистического анализа. Для анализа изменений параметров в ходе исследования использовали критерий знаковых рангов Вилкоксона, а в качестве нижней границы достоверности был принят уровень статистической значимости p<0,05. Числовые данные представлены в виде медианы (Ме) и межквартильного интервала [Q1; Q3].
Результаты
Длительность оперативного вмешательства и время пребывания в стационаре. Длительность подготовительного этапа, включающего определение оптимального доступа с использованием нейронавигации, составила в среднем 85 [75; 105] мин. Доступ осуществляли в среднем за 60 [50; 65] мин. Средняя продолжительность основного этапа операции составила 220 [180; 250] мин.
После удаления максимально возможного объема опухоли под общей анестезией проводили заключительный этап операции, который длился в среднем 85 [65; 95] мин. Средний объем кровопотери — 150 [100; 200] мл.
Средняя продолжительность пребывания пациента в стационаре составила 8,5 [7,0; 11,0] дней.
Результаты картирования коры. При кортикальной стимуляции положительный результат тестирования определялся в 70% случаев, при субкортикальной — в 30% случаев (положительная стимуляция — это такая стимуляция, в результате которой был выявлен дефицит).
Во время стимуляции в 7% случаев (2/30) наблюдались эпилептические приступы: генерализованный и парциальный простой приступы. Ни один из них не требовал прекращения фазы бодрствования и купировался вышеперечисленными методами.
Динамика неврологического дефицита. В послеоперационном периоде в 17% случаев (5/30) возникли эпилептические приступы, у двух пациентов они были зарегистрированы впервые. Нарастание неврологического дефицита после операции выявлено в 38% случаев (11/30): в 17% (5/30) диагностировали афатические нарушения, в 10% (3/30) — моторные, в 3% (1/30) — когнитивные и в 7% случаев (2/30) определялись и моторные, и афатические нарушения. К моменту выписки полный регресс неврологической симптоматики отмечался в 13% случаев (4/30).
Индекс Карновского после операции составил 80 [70; 90] баллов. Улучшение общего состояния после операции в сравнении с дооперационным состоянием отмечено в 30% случаев (9/30), отсутствие динамики неврологического дефицита — в 33% случаев (10/30). Общие данные состояния пациентов в послеоперационном периоде представлены в таблице.
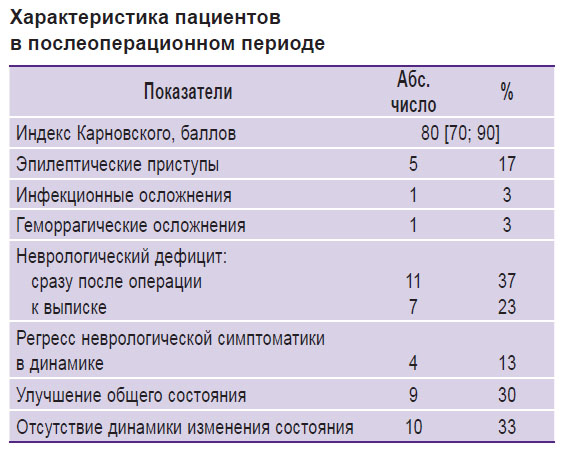
|
Характеристика пациентов в послеоперационном периоде |
По результатам РАТ до и после операции не получено статистически значимой разницы в выраженности афотических нарушений: до — 9,8 [9,4; 9,9] балла, после — 9,75 [9,10; 10,0] балла; p=0,67.
Радикальность резекции опухолей. По данным послеоперационного МРТ-исследования, тотальное удаление опухоли достигнуто у 11 пациентов (37%), субтотальное — у 12 пациентов (40%). Частичное удаление опухоли проведено 7 пациентам (23%).
Обсуждение
Радикальная резекция улучшает общую выживаемость при глиальных опухолях различной степени злокачественности. Однако сохранение при этом качества жизни и функционального статуса пациента не менее важно. Расположение корковых центров двигательных, чувствительных и речевых зон достаточно вариабельно у разных пациентов, что обусловливает высокий риск возникновения неврологических нарушений при резекции опухоли, особенно при нечетких визуально определяемых границах между здоровой и опухолевой тканью [13].
Прямая кортикальная и субкортикальная стимуляция являются основными методами определения функционально значимых зон. Также в практике нейрохирургов активно применяется предоперационное картирование с помощью неинвазивных методик, таких как мультимодальная МРТ и DTI-трактография. При этом каждая методика имеет как преимущества, так и ограничения в применении.
Согласно данным исследования F.E. Roux с соавт. [14], чувствительность фМРТ составляет 59–98%, а специфичность — 97–98%. Такие широкие диапазоны объясняются неоднородностью языковых стимулов и протоколов визуализации [14, 15]. Одним из ограничений применения фМРТ служит влияние на полученные результаты биологических аспектов опухоли и функционального состояния пациента [16, 17]. В работе I.Z. Kapsalakis с соавт. [18] анализ данных показал, что пациенты с лучшим функциональным состоянием демонстрировали более высокое соответствие данных фМРТ и прямой кортикальной стимуляции. Была также выявлена связь между степенью злокачественности опухоли и частотой соответствия данных двух методик.
Авторы работы [19] при исследовании точности фМРТ в сравнении с прямой кортикальной стимуляцией пришли к выводу, что использование только фМРТ является менее надежным методом. Другие авторы в аналогичном исследовании [20] утверждают, что данные фМРТ достаточно точны для предоперационного хирургического планирования и определения необходимости интраоперационного прямого кортикального картирования. При этом фМРТ является полезным дополнением к прямой кортикальной стимуляции, так как данные, загруженные в систему нейронавигации, помогают при выборе места установки электродов [18, 20].
Метод прямой кортикальной стимуляции также имеет свои ограничения: недоступность для предоперационного планирования, риски интраоперационных эпилептических припадков и перехода к общей анестезии, увеличение общей продолжительности операции, а также психологическая нагрузка как для пациента, так и для команды [21].
В ходе данного исследования частота перехода к общей анестезии составила 3%, причиной его стало отсутствие продуктивного контакта с пациентом. По данным метаанализа [22], переход к общей анестезии составляет 2% и практически не зависит от используемого протокола анестезии (asleep–awake–asleep / monitored anaesthesia сare / awake–awake–awake). Снизить риски возникновения данного осложнения позволяет тщательный отбор пациентов и детальное разъяснение им предстоящей процедуры.
Важно отметить, что в данном исследовании после перехода к общей анестезии нейрохирург продолжил операцию, пользуясь данными фМРТ и DTI-трактографии. В исследовании L. Rigolo и соавт. [17] сравниваются две группы пациентов: первой была успешно проведена прямая кортикальная стимуляция; второй не удалось провести стимуляцию, и дальнейшая операция продолжалась с использованием данных фМРТ. Авторы сообщают о том, что достоверной разницы в частоте послеоперационного дефицита между этими группами не отмечено. Это демонстрирует дополнительную ценность фМРТ за пределами предоперационного планирования.
Основными факторами, ограничивающими применение кортикальной и субкортикальной стимуляции, являются интраоперационные эпилептические приступы и невозможность установить контакт с пациентом после пробуждения. По данным работ [23–25], интраоперационные приступы возникают в 2,2–21,9% случаев краниотомии в сознании. Такую разницу в значениях можно объяснить разными протоколами корковой стимуляции. A. Szelényi и соавт. [26] сообщают, что интраоперационные припадки коррелируют с длительностью стимула, интенсивностью силы тока и числом повторных стимуляций одного и того же участка. В данном исследовании частота эпилептических приступов составила 7% (у 2 пациентов), при этом длительность стимуляции была не более 3 с, а верификация функциональной зоны проводилась от 1 до 3 раз, без повторного стимулирования зоны, при силе тока 1–20 мА. Интраоперационные эпилептические приступы могут стать причиной прекращения этапа бодрствования или всей операции [27, 28]. В исследовании E. Nossek и соавт. [28] сообщается о частоте припадков 12,6%, причем в 18% таких случаев это стало причиной прекращения операции. В нашем исследовании ни одна из операций не была прекращена из-за возникшего приступа, а после купирования припадка в одном случае пациент был в состоянии продолжить тестирование. Следование протоколу электрической стимуляции и своевременное купирование приступов минимизируют возможные интраоперационные риски.
Пробуждение пациента и проведение нейролингвистических тестов увеличивают продолжительность операции. Среднее время основного этапа хирургических вмешательств в статье H. Joswig и соавт. [29], в которой освещены результаты первого опыта проведения «бодрствующей» краниотомии, составило 205 [90; 300] мин, что приблизительно сходно с нашими данными. Продолжительность операции в этом случае зависит от различных факторов, включающих слаженную работу операционной бригады, индивидуальную чувствительность пациента к анестезии и интраоперационные осложнения.
Процент «положительной» стимуляции в нашем исследовании составил 78 и 40% при кортикальной и субкортикальной стимуляции соответственно. Данные других авторов различаются: одни придерживаются концепции положительного картирования, другие — концепции отрицательного картирова-
ния. На сегодняшний день положительное картирование, т.е. идентификация хотя бы одной речевой зоны, общепринято в качестве стандартной интраоперационной методики сохранения функционального статуса пациента [15]. Однако не всегда удается найти речевую зону либо этот поиск может быть длительным, поэтому, по мнению некоторых авторов, в условиях ограниченного кортикального воздействия отрицательное картирование позволяет проводить более агрессивную резекцию глиом [6]. У данной стратегии есть ряд преимуществ, таких как минимальное корковое воздействие, менее обширное интраоперационное картирование и, как следствие, меньшая продолжительность операции [26]. Остается открытым вопрос эффективности отрицательного картирования: влияет ли данная методика на частоту возникновения стойкого неврологического дефицита. В работе N. Sanai и соавт. [30], где у половины пациентов речевые зоны не были идентифицированы, только у 1% пациентов через 6 мес после операции определялись стойкие афатические нарушения. Однако H. Duffau [31] говорит о том, что метод отрицательного картирования может применяться только по отношению к высокодифференцированным глиомам, так как целью хирургического вмешательства является резекция как можно большей части опухоли.
DTI-трактография на предоперационном этапе может быть использована для оценки влияния опухолевой ткани на волокна белого вещества, определения ее резектабельности и для планирования хирургического вмешательства [32]. Кроме того, 3D-реконструкция полученных данных, загруженных в систему нейронавигации, может помочь в выполнении полной резекции опухоли. А в сочетании с прямой кортикальной стимуляцией трактография помогает сократить время бодрствования пациента и количество электрических стимулов за счет меньшего времени на поиски функциональных зон [33, 34]. D.C. Vanderweyen и соавт. в своем обзоре на данную тему [33] выделяют две группы факторов, ограничивающих применение метода. Внешними ограничениями являются сдвиг мозга и перитуморальный отек. Использование комбинации интраоперационных методов (к примеру, как в данном исследовании — фМРТ и прямой кортикальной стимуляции) помогает добиться лучших исходов. А к внутренним ограничениям авторы отнесли все сложности, связанные с получением и анализом данных, что решается совершенствованием данной техники в структуре развивающегося направления коннектомики [34].
Выбор тактики хирургического лечения опухолей функционально значимых зон головного мозга в пользу комбинированного подхода, включающего в себя мультимодальную МРТ, DTI-трактографию и кортикальную стимуляцию в условиях бодрствования, дает ряд преимуществ.
Данная комбинация методов обеспечивает снижение рисков возникновения стойкого неврологического дефицита. В нашем исследовании послеоперационный дефицит в первый день наблюдался в 37% случаев, к моменту выписки дефицит сохранялся в 23% случаев. По данным зарубежных источников [29, 35], ранний неврологический дефицит у пациентов, перенесших awake-краниотомию, составляет 29–30%, что сопоставимо с нашими результатами. В исследовании A. Kumar и соавт. [7], где использовался аналогичный комбинированный метод, ранний послеоперационный дефицит определялся у 26% пациентов, тогда как стойкий неврологический дефицит к 6 мес после операции — только у 6%.
Комбинация вышеперечисленных методов позволяет компенсировать ограничения каждого из них. Так, R. Rolinski и соавт. [36] в своей работе сделали предположение, что фМРТ может быть более чувствительной и менее специфичной, чем прямая кортикальная стимуляция, но совместное их использование помогает предотвратить возможный дефицит лучше, чем любой метод по отдельности.
Мультимодальный подход помогает хирургу выполнить более обширную резекцию. В нашем исследовании удалось провести тотальное удаление опухоли без нарастания неврологического дефицита в 37% случаев. F. Incekara и соавт. [37], изучая влияние различных методов на степень резекции низкодифференцированных глиом, пришли к выводу, что использование прямой кортикальной стимуляции в сочетании с фМРТ и DTI-трактографией значительно улучшает степень резекции, особенно в сравнении с теми случаями, когда применяется только система нейронавигации.
Заключение
Применение комбинированного подхода на основании мультимодальной МРТ, нейронавигации и краниотомии в сознании, с картированием речевых и моторных зон к удалению опухолей функционально значимых областей головного мозга позволяет минимизировать риск возникновения стойкого неврологического дефицита и дает возможность выполнить максимально возможную резекцию при сохранении функционального статуса пациента. Описанная методология является воспроизводимой, что позволяет расширять возможности хирургического лечения при локализации поражений в функционально значимых зонах.
Благодарности. За внедрение оперативных вмешательств с применением предложенного комбинированного подхода в Университетской клинике Приволжского исследовательского медицинского университета коллектив авторов выражает благодарность ректору, д.м.н. Н.Н. Карякину; директору Университетской клиники, к.м.н. И.Ю. Арефьеву; зав. кафедрой травматологии, ортопедии и нейрохирургии им. М.В. Колокольцева, к.м.н. С.Г. Млявых.
Финансирование исследования. Нейролингвистическое тестирование, оценка уровня афазии, предоперационное построение трактов, участвующих в речевой продукции, выполнены в рамках гранта Российского научного фонда, проект №20-18-00399.
Конфликт интересов отсутствует.
Литература
- Kim S.S., McCutcheon I.E., Suki D., Weinberg J.S., Sawaya R., Lang F.F., Ferson D., Heimberger A.B., DeMonte F., Prabhu S.S. Awake craniotomy for brain tumors near eloquent cortex: correlation of intraoperative cortical mapping with neurological outcomes in 309 consecutive patients. Neurosurgery 2009; 64(5): 836–346, https://doi.org/10.1227/01.neu.0000342405.80881.81.
- Almenawer S.A., Badhiwala J.H., Alhazzani W., Greenspoon J., Farrokhyar F., Yarascavitch B., Algird A., Kachur E., Cenic A., Sharieff W., Klurfan P., Gunnarsson T., Ajani O., Reddy K., Singh S.K., Murty N.K. Biopsy versus partial versus gross total resection in older patients with high-grade glioma: a systematic review and meta-analysis. Neuro Oncol 2015; 17(6): 868–881, https://doi.org/10.1093/neuonc/nou349.
- Jung T.Y., Jung S., Moon J.H., Kim I.Y., Moon K.S., Jang W.Y. Early prognostic factors related to progression and malignant transformation of low-grade gliomas. Clin Neurol Neurosurg 2011; 113(9): 752–757, https://doi.org/10.1016/j.clineuro.2011.08.002.
- Zhang J.J.Y., Lee K.S., Voisin M.R., Hervey-Jumper S.L., Berger M.S., Zadeh G. Awake craniotomy for resection of supratentorial glioblastoma: a systematic review and meta-analysis. Neurooncol Adv 2020; 2(1): vdaa111, https://doi.org/10.1093/noajnl/vdaa111.
- Rahman M., Abbatematteo J., De Leo E.K., Kubilis P.S., Vaziri S., Bova F., Sayour E., Mitchell D., Quinones-Hinojosa A. The effects of new or worsened postoperative neurological deficits on survival of patients with glioblastoma. J Neurosurg 2017; 127(1): 123–131, https://doi.org/10.3171/2016.7.jns16396.
- van Kessel E., Snijders T.J., Baumfalk A.E., Ruis C., van Baarsen K.M., Broekman M.L., van Zandvoort M.J.E., Robe P.A. Neurocognitive changes after awake surgery in glioma patients: a retrospective cohort study. J Neurooncol 2020; 146(1): 97–109, https://doi.org/10.1007/s11060-019-03341-6.
- Kumar A., Chandra P.S., Sharma B.S., Garg A., Rath G.K., Bithal P.K., Tripathi M. The role of neuronavigation-guided functional MRI and diffusion tensor tractography along with cortical stimulation in patients with eloquent cortex lesions. Br J Neurosurg 2014; 28(2): 226–233, https://doi.org/10.3109/02688697.2013.835370.
- Whiting B.B., Lee B.S., Mahadev V., Borghei-Razavi H., Ahuja S., Jia X., Mohammadi A.M., Barnett G.H., Angelov L., Rajan S., Avitsian R., Vogelbaum M.A. Combined use of minimal access craniotomy, intraoperative magnetic resonance imaging, and awake functional mapping for the resection of gliomas in 61 patients. J Neurosurg 2019; 132(1): 159–167, https://doi.org/10.3171/2018.9.jns181802.
- Sarubbo S., Tate M., De Benedictis A., Merler S., Moritz-Gasser S., Herbet G., Duffau H. A normalized dataset of 1821 cortical and subcortical functional responses collected during direct electrical stimulation in patients undergoing awake brain surgery. Data Brief 2019; 28: 104892, https://doi.org/10.1016/j.dib.2019.104892.
- Ivanova M., Dragoy O., Akinina J., Soloukhina O., Iskra E., Khudyakova M., Akhutina T. AutoRAT at your fingertips: introducing the new Russian Aphasia Test on a tablet. In: Frontiers in Psychology. Conference Abstract: 54th Annual Academy of Aphasia Meeting. Llandudno, Wales; 2016, https://doi.org/10.3389/conf.fpsyg.2016.68.00116.
- Dragoy O., Chrabaszcz A., Tolkacheva V., Buklina S. Russian intraoperative naming test: a standardized tool to map noun and verb production during awake neurosurgeries. The Russian Journal of Cognitive Science 2016; 3(4): 4–25, https://doi.org/10.47010/16.4.1.
- Dragoy O., Zyryanov A., Bronov O., Gordeyeva E., Gronskaya N., Kryuchkova O., Klyuev E., Kopachev D., Medyanik I., Mishnyakova L., Pedyash N., Pronin I., Reutov A., Sitnikov A., Stupina E., Yashin K., Zhirnova V., Zuev A. Functional linguistic specificity of the left frontal aslant tract for spontaneous speech fluency: evidence from intraoperative language mapping. Brain Lang 2020; 208: 104836, https://doi.org/10.1016/j.bandl.2020.104836.
- Chang E.F., Breshears J.D., Raygor K.P., Lau D., Molinaro A.M., Berger M.S. Stereotactic probability and variability of speech arrest and anomia sites during stimulation mapping of the language dominant hemisphere. J Neurosurg 2017; 126(1): 114–121, https://doi.org/10.3171/2015.10.jns151087.
- Roux F.E., Boulanouar K., Lotterie J.A., Mejdoubi M., LeSage J.P., Berry I. Language functional magnetic resonance imaging in preoperative assessment of language areas: correlation with direct cortical stimulation. Neurosurgery 2003; 52(6): 1335–1347, https://doi.org/10.1227/01.neu.0000064803.05077.40.
- De Witte E., Mariën P. The neurolinguistic approach to awake surgery reviewed. Clin Neurol Neurosurg 2013; 115(2): 127–145, https://doi.org/10.1016/j.clineuro.2012.09.015.
- Silva M.A., See A.P., Essayed W.I., Golby A.J., Tie Y. Challenges and techniques for presurgical brain mapping with functional MRI. Neuroimage Clin 2017; 17: 794–803, https://doi.org/10.1016/j.nicl.2017.12.008.
- Rigolo L., Essayed W., Tie Y., Norton I., Mukundan S. Jr., Golby A. Intraoperative use of functional MRI for surgical decision making after limited or infeasible electrocortical stimulation mapping. J Neuroimaging 2020; 30(2): 184–191, https://doi.org/10.1111/jon.12683.
- Kapsalakis I.Z., Kapsalaki E.Z., Gotsis E.D., Verganelakis D., Toulas P., Hadjigeorgiou G., Chung I., Fezoulidis I., Papadimitriou A., Robinson J.S., Lee G.P., Fountas K.N. Preoperative evaluation with FMRI of patients with intracranial gliomas. Radiol Res Pract 2012; 2012: 727810, https://doi.org/10.1155/2012/727810.
- Weng H.H., Noll K.R., Johnson J.M., Prabhu S.S., Tsai Y.H., Chang S.W., Huang Y.C., Lee J.D., Yang J.T., Yang C.T., Tsai Y.H., Yang C.Y., Hazle J.D., Schomer D.F., Liu H.L. Accuracy of presurgical functional MR imaging for language mapping of brain tumors: a systematic review and meta-analysis. Radiology 2018; 286(2): 512–523, https://doi.org/10.1148/radiol.2017162971.
- Lee J.J., Luckett P., Fakhri M.M., Leuthardt E.C., Shimony J.S. Resting state functional MR imaging of language function. Neuroimaging Clin N Am 2021; 31(1): 69–79, https://doi.org/10.1016/j.nic.2020.09.005.
- Mato D., Velasquez C., Gómez E., Marco de Lucas E., Martino J. Predicting the extent of resection in low-grade glioma by using intratumoral tractography to detect eloquent fascicles within the tumor. Neurosurgery 2021; 88(2): E190–E202, https://doi.org/10.1093/neuros/nyaa463.
- Stevanovic A., Rossaint R., Veldeman M., Bilotta F., Coburn M. Anaesthesia management for awake craniotomy: systematic review and meta-analysis. PLoS One 2016; 11(5): e0156448, https://doi.org/10.1371/journal.pone.0156448.
- Hervey-Jumper S.L., Li J., Lau D., Molinaro A.M., Perry D.W., Meng L., Berger M.S. Awake craniotomy to maximize glioma resection: methods and technical nuances over a 27-year period. J Neurosurg 2015; 123(2): 325–339, https://doi.org/10.3171/2014.10.jns141520.
- Boetto J., Bertram L., Moulinié G., Herbet G., Moritz-Gasser S., Duffau H. Low rate of intraoperative seizures during awake craniotomy in a prospective cohort with 374 supratentorial brain lesions: electrocorticography is not mandatory. World Neurosurg 2015; 84(6): 1838–1844, https://doi.org/10.1016/j.wneu.2015.07.075.
- Gonen T., Grossman R., Sitt R., Nossek E., Yanaki R., Cagnano E., Korn A., Hayat D., Ram Z. Tumor location and IDH1 mutation may predict intraoperative seizures during awake craniotomy. J Neurosurg 2014; 121(5): 1133–1138, https://doi.org/10.3171/2014.7.jns132657.
- Szelényi A., Bello L., Duffau H., Fava E., Feigl G.C., Galanda M., Neuloh G., Signorelli F., Sala F.; Workgroup for Intraoperative Management in Low-Grade Glioma Surgery within the European Low-Grade Glioma Network. Intraoperative electrical stimulation in awake craniotomy: methodological aspects of current practice. Neurosurg Focus 2010; 28(2): E7, https://doi.org/10.3171/2009.12.focus09237.
- Akay A., Islekel S. Awake craniotomy procedure: its effects on neurological morbidity and recommendations. Turk Neurosurg 2018; 28(2): 186–192, https://doi.org/10.5137/1019-5149.jtn.19391-16.1.
- Nossek E., Matot I., Shahar T., Barzilai O., Rapoport Y., Gonen T., Sela G., Grossman R., Korn A., Hayat D., Ram Z. Intraoperative seizures during awake craniotomy: incidence and consequences: analysis of 477 patients. Neurosurgery 2013; 73(1): 135–140, https://doi.org/10.1227/01.neu.0000429847.91707.97.
- Joswig H., Bratelj D., Brunner T., Jacomet A., Hildebrandt G., Surbeck W. Awake craniotomy: first-year experiences and patient perception. World Neurosurg 2016; 90: 588–596.e2, https://doi.org/10.1016/j.wneu.2016.02.051.
- Sanai N., Mirzadeh Z., Berger M.S. Functional outcome after language mapping for glioma resection. N Engl J Med 2008; 358(1): 18–27, https://doi.org/10.1056/nejmoa067819.
- Duffau H. Surgery of low-grade gliomas: towards a ‘functional neurooncology’. Curr Opin Oncol 2009; 21(6): 543–549, https://doi.org/10.1097/cco.0b013e3283305996.
- Aibar-Durán J.Á., de Quintana-Schmidt C., Álvarez Holzpafel M.J., Hernández F.M., Cortés C.A., Martínez G.V., Bertrán G.C. Intraoperative use and benefits of tractography in awake surgery patients. World Neurosurg 2020; 137: e347–e353, https://doi.org/10.1016/j.wneu.2020.01.210.
- Vanderweyen D.C., Theaud G., Sidhu J., Rheault F., Sarubbo S., Descoteaux M., Fortin D. The role of diffusion tractography in refining glial tumor resection. Brain Struct Funct 2020; 225(4): 1413–1436, https://doi.org/10.1007/s00429-020-02056-z.
- Henderson F., Abdullah K.G., Verma R., Brem S. Tractography and the connectome in neurosurgical treatment of gliomas: the premise, the progress, and the potential. Neurosurg Focus 2020; 48(2): E6, https://doi.org/10.3171/2019.11.focus19785.
- Pallud J., Dezamis E. Functional and oncological outcomes following awake surgical resection using intraoperative cortico-subcortical functional mapping for supratentorial gliomas located in eloquent areas. Neurochirurgie 2017; 63(3): 208–218, https://doi.org/10.1016/j.neuchi.2016.08.003.
- Rolinski R., Austermuehle A., Wiggs E., Agrawal S., Sepeta L.N., Gaillard W.D., Zaghloul K.A., Inati S.K., Theodore W.H. Functional MRI and direct cortical stimulation: prediction of postoperative language decline. Epilepsia 2019; 60(3): 560–570, https://doi.org/10.1111/epi.14666.
- Incekara F., Olubiyi O., Ozdemir A., Lee T., Rigolo L., Golby A. The value of pre- and intraoperative adjuncts on the extent of resection of hemispheric low-grade gliomas: a retrospective analysis. J Neurol Surg A Cent Eur Neurosurg 2016; 77(2): 79–87, https://doi.org/10.1055/s-0035-1551830.










