Радиомический фенотип периатриальной жировой ткани в прогнозе позднего постабляционного рецидива идиопатической фибрилляции предсердий
Цель исследования — поиск новых предикторов постабляционного рецидива фибрилляции предсердий (ФП) у пациентов с идиопатической формой ФП с использованием текстурного анализа периатриальной жировой ткани (ПАЖТ) левого предсердия.
Материалы и методы. В исследование включено 43 пациента с идиопатической ФП, планировавшихся на проведение катетерной абляции, которым была проведена мультиспиральная коронароангиография. Сегментацию ПАЖТ выполняли в приложении 3D Slicer с последующей экстракцией 93 радиомических характеристик. По истечении периода наблюдения пациенты были разделены на 2 группы в зависимости от наличия или отсутствия рецидива ФП.
Результаты. Через 12 мес наблюдения после катетерной абляции постабляционный рецидив был зарегистрирован у 19 пациентов из 43. Из 93 извлеченных радиомических характеристик ПАЖТ статистически значимые различия наблюдались по 3 радиомическим характеристикам матрицы Gray Level Size Zone. В то же время только одна радиомическая характеристика ПАЖТ, Size Zone Non Uniformity Normalized, являлась независимым предиктором постабляционного рецидива ФП после катетерной абляции в течение 12 мес наблюдения (McFadden’s R2=0,451; ОШ — 0,506; 95% CI: 0,331–0,776; p<0,001).
Заключение. Использование радиомического анализа периатриальной жировой ткани можно рассматривать как перспективный неинвазивный метод прогнозирования неблагоприятного исхода катетерного лечения, что открывает возможности для планирования и коррекции тактики ведения пациента после интервенционного вмешательства.
Введение
Катетерная абляция — один из наиболее эффективных и безопасных методов лечения фибрилляции предсердий (ФП). В то же время частота рецидивов ФП после однократной процедуры достигает 50% [1]. На сегодняшний день выделяют большое количество факторов риска, в том числе воспалительного генеза [2], которые являются независимыми предикторами рецидива ФП [3]. Данные факторы были использованы для создания оценочных шкал с целью прогнозирования результатов процедуры катетерной абляции и аритмии [4]. Эти шкалы применимы к различным когортам больных [3]. Однако не у всех пациентов удается установить причину развития ФП. Для данной когорты не может быть использована ни одна из существующих оценочных шкал стратификации рисков рецидива ФП после катетерной абляции. Это создает необходимость поиска новых предикторов постабляционного рецидива.
В свете вышеизложенного периатриальная жировая ткань (ПАЖТ) как структура, наиболее тесно контактирующая с миокардом предсердий и устьями легочных вен, представляет большой интерес в аспекте изучения не только механизмов аритмогенеза, но и постабляционного рецидива ФП [5]. Показано, что жировая ткань представляет собой паракринный орган, способный оказывать проаритмогенный эффект, главным образом за счет инфильтрации миокарда адипоцитами и секреции адипокинов, способствуя структурному ремоделированию миокарда предсердий [6, 7]. Исследования, основанные на определении массы, толщины и плотности ПАЖТ, посредством компьютерной томографии подтверждают их ассоциацию с рецидивом аритмии после катетерного лечения [6–8].
На сегодняшний день технологии медицинской визуализации вышли на более высокий уровень благодаря возможности извлечения новых количественных характеристик из стандартных медицинских изображений, используемых для обнаружения клинически значимой информации, невидимой невооруженным глазом [9, 10], что открывает новые перспективы для персонализированной медицины [11]. Радиомика нашла свое применение в оценке структуры атеросклеротических бляшек коронарных артерий [12, 13] и в прогнозе развития осложнений после инфаркта миокарда [14]. Перспективными также считаются исследования в области патологии миокарда (кардиомиопатия, миокардит), оценки коронарного кальция и прогнозирования неблагоприятных сердечно-сосудистых осложнений, а также исследования эпикардиальной жировой ткани (ЭЖТ) при различных сердечно-сосудистых заболеваниях [15, 16], в том числе при ФП [17].
Таким образом, целью данного исследования является поиск новых предикторов постабляционного рецидива фибрилляции предсердий у пациентов с идиопатической формой фибрилляции предсердий с использованием текстурного анализа периатриальной жировой ткани левого предсердия.
Материалы и методы
В исследование вошли 43 пациента (35 мужчин, 8 женщин) с идиопатической формой ФП, направленные в клинику для проведения катетерной абляции, которым была проведена мультиспиральная коронароангиография (МСКТ-КАГ). Коронароангиографию выполняли по клиническим показаниям [18] и для предоперационной оценки размеров устьев легочных вен, анатомии их дренирования, измерения размеров и объема левого предсердия [19].
Критериями включения в исследование являлись возраст 18–60 лет, пароксизмальная, персистирующая или длительно персистирующая форма ФП [4] неизвестной этиологии; информированное согласие пациентов на участие в исследовании.
Критерии исключения: патология сердечно-сосудистой системы, включая гипертонию, гиперхолестеринемию, коронарную болезнь сердца, перенесенный инфаркт или инсульт в анамнезе, застойную сердечную недостаточность (ФВ менее 50%), заболевания периферических сосудов, клапанную патологию сердца, наличие внутриполостных тромбов и эффекта спонтанного контрастирования по данным чреспищеводного ультразвукового исследования; диабет, патология щитовидной железы и мочевыделительной системы. Наличие значимых артефактов на КТ-изображениях, несоответствие параметров рентгеновской трубки (изложенных в подразделе «Протокол МСКТ-КАГ») во время сканирования также являлись критериями исключения из исследования.
Характеристика пациентов. Клиническая характеристика пациентов представлена в табл. 1.

|
Таблица 1. Клиническая характеристика пациентов с фибрилляцией предсердий |
Антиаритмическая и антитромботическая терапия, применяемая на момент включения пациентов в исследование, назначалась в соответствии со стратегией ABC [3] и не менялась в течение первых 3 мес периода наблюдения. Медикаментозная терапия состояла из бета-блокаторов (30% пациентов), амиодарона/соталола/пропафенона (93% пациентов), антикоагулянтов (100% пациентов).
Протокол МСКТ-КАГ. Во время исследования все пациенты имели синусовый ритм с ЧСС 50–65 в минуту. У пациентов с персистирующей и длительно персистирующей ФП, с целью восстановления синусового ритма, перед исследованием проводили электрическую кардиоверсию под внутривенной седацией в палате интенсивной терапии.
Мультиспиральную коронароангиографию выполняли на 64-детекторном КТ-сканере (Discovery NM/CT 570c, GE Healthcare, США). Исследование состояло из двух фаз сканирования. Первая фаза — бесконтрастная (Ca-scoring), была проведена в ЭКГ-синхронизированном режиме с напряжением трубки 120 мА, скорость оборота трубки — 400 мс, толщина срезов — 1,25 мм.
Контрастная серия исследований выполнена в ретроспективном ЭКГ-синхронизированном спиральном режиме с напряжением трубки 120–140 кВ, силой тока 200–700 мА (в зависимости от веса пациента), скоростью оборота трубки 400 мс, толщиной срезов 0,625 мм и питчем 0,18:1–0,24:1 (в зависимости от ЧСС). Контрастирование коронарного русла, крупных сосудов и полостей сердца осуществляли посредством внутривенного введения йодсодержащего контрастного вещества (концентрация йода — 350–370 мг/мл) в объеме 70–110 мл (в зависимости от веса пациента) со скоростью 5 мл/с. Полученные данные были реконструированы в фазе диастолы (преимущественно, 75% продолжительности интервала R–R) и проанализированы при помощи рабочей станции Advantage Workstation 4.6 (GE Healthcare, США) [20].
Суммарная эффективная доза на каждого пациента составила 4,0–5,5 мЗв.
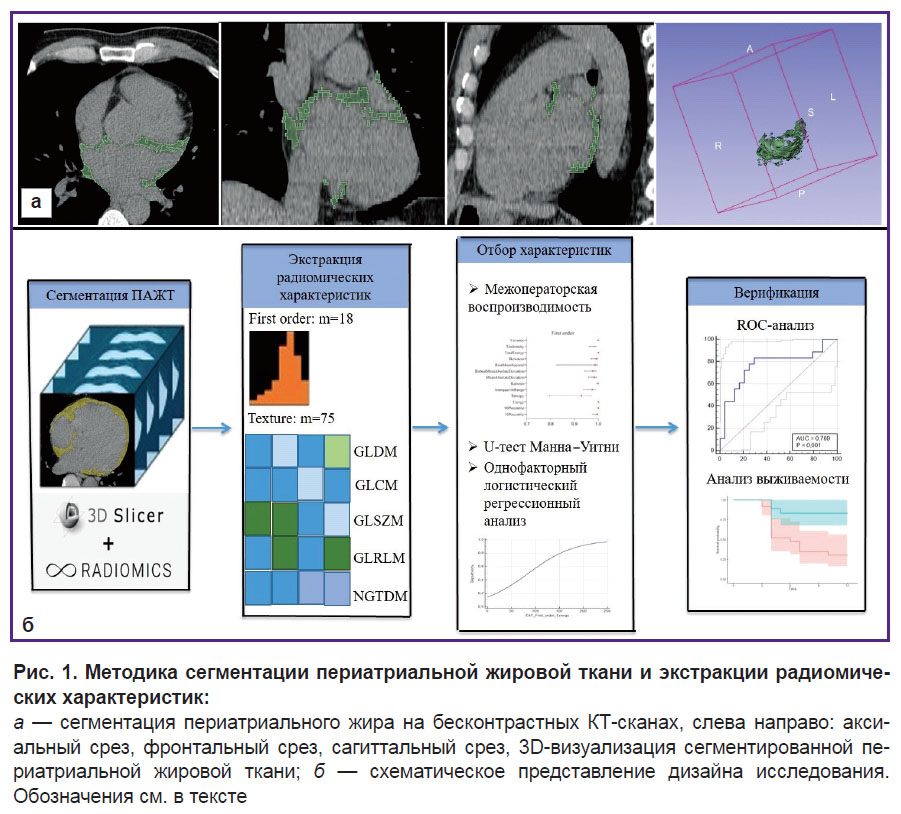
Сегментация периатриальной жировой ткани и экстракция радиомических характеристик. Сегментацию и последующий радиомический анализ ПАЖТ выполняли на бесконтрастной ЭКГ-синхронизированной серии трехмерных DICOM-изображений (серия Ca-scoring), которые экспортировались в приложение 3D Sliсer (США) [21]. Сегментацию ЭЖТ проводили с помощью ручного инструмента разного размера в диапазоне значений плотности жировой ткани от –190 HU до –30 HU срез за срезом вокруг левого предсердия с захватом устьев легочных вен (рис. 1).
При помощи модуля SliсerRadiomics (v. 4.10.2) вычисляли показатели средней плотности ПАЖТ, объем, а также радиомические характеристики ПАЖТ, которые включали в себя 18 параметров статистики первого порядка, 24 параметра Gray Level Co-Occurrence Matrix (GLCM), 16 параметров Gray Level Run Length Matrix (GLRLM), 14 параметров Gray Level Dependence Matrix (GLDM), 16 параметров Gray Level Size Zone Matrix (GLSZM) и 5 параметров Neighboring Gray-Tone Difference Matrix (NGTDM). Полный перечень радиомических характеристик представлен на рис. 2.
|
Рис. 2. Лесовидная диаграмма межоператорской воспроизводимости (среднее, 95% CI) радиомических характеристик, сгруппированных по матрицам. Обозначения см. в тексте |
Все исследования, включая интерпретацию изображений, сегментацию ПАЖТ и экстракцию радиомических характеристик, были выполнены двумя радиологами с опытом работы в области торакальной и сердечно-сосудистой мультимодальной визуализации более 10 лет, которые не знали клинического анамнеза пациентов и результатов предшествующего анализа.
Протокол радиочастотной абляции эктопических очагов фибрилляции предсердий. Доступ к бедренной вене осуществляли по методу Сельдингера под медикаментозной седацией и местной инфильтрационной анестезией. Правую бедренную вену трижды пунктировали для установки трех интродьюсеров: 9Fr, 6Fr и Fast-Cath 8,5Fr. Через интродьюсеры 9Fr и 6Fr в полость правого предсердия проводили электроды-катетеры NaviStar ThermoCool 3,5 мм (Biosense Webster, США) и 4-полюсный диагностический Viking (Boston Scientific, США). Межпредсердную перегородку пунктировали под контролем чреспищеводной эхокардиографии при помощи интродьюсера Fast-Cath 8,5Fr и иглы BRK-1 (St. Jude Medical, США), после чего в левое предсердие проводили абляционный электрод и циркулярный электрод Lasso (Biosense Webster, США). После пункции межпредсердной перегородки начинали инфузию гепарина с поддержанием показателя активированного времени свертывания в течение всей операции — 300–350 с. Электрофизиологическое исследование выполняли на аппаратно-программном комплексе «Элкарт» («Электропульс», Россия). Анатомическую реконструкцию левого предсердия осуществляли с использованием трехмерной нефлюороскопической системы CARTO 3 (Biosense Webster, США) с применением технологии FAM. Циркулярный электрод помещали поочередно в каждую легочную вену, регистрировали электрическую активность в них. Радиочастотную энергию наносили с помощью радиочастотного деструктора RF100-TZ («Электропульс», Россия) с контролем мощности 45 Вт и температурой 500°С. Орошение проводили насосом CoolFlow (Biosense Webster, США) со скоростью 17 мл/мин. Поточечное формирование линий радиочастотного повреждения осуществляли путем непрерывного нанесения радиочастотной энергии. Время нанесения энергии в каждой точке составляло 20–30 с до уменьшения предсердного потенциала. Кроме того, проводили радиочастотную деструкцию вокруг каждого устья легочной вены, отступая от нее 0,5–1,0 см. Электрофизиологическим критерием изоляции левой вены служило исчезновение ее потенциалов на циркулярном электроде Lasso. При проведении стимуляции левой вены и левого предсердия регистрировали блок «входа» и «выхода» [22].
Период наблюдения и конечные точки. Пациентов наблюдали амбулаторно в течение 12 мес после катетерной абляции. Для контроля наличия рецидивов ФП пациентам выполняли холтеровское мониторирование ЭКГ через 3, 6 и 12 мес после интервенционного вмешательства. Эпизоды ритма ФП продолжительностью более 30 с являлись критериями рецидива. Первой конечной точкой исследования был рецидив ФП в период от 3 до 12 мес после абляции; второй конечной точкой — основные неблагоприятные сердечно-сосудистые события.
По окончании наблюдения все пациенты были разделены на две группы: группа 1 — пациенты с рецидивом ФП; группа 2 — пациенты без рецидива ФП.
Статистическая обработка данных. Статистическую обработку проводили с помощью программной среды R (v. 4.1.3) с использованием пакетов ggplot2, peacock.test, gMWT, WMWssp, linkspotter, ROCS, jackknifeKME, KMunicate, manhattanly, blorr, irrICC, извлеченных из Comprehensive R Archive Network (CRAN). Количественные данные представляли как медиану и квартили — Me [Q1; Q3]; среднее арифметическое ± стандартное отклонение — M±σ; качественные признаки — в абсолютных значениях и процентах. Статистическую значимость межгрупповых различий оценивали в соответствии с непараметрическими критериями Манна–Уитни или Крускала–Уоллиса. Категориальные переменные сравнивались с помощью точного теста Фишера. Для определения значимых радиомических предикторов рецидивов ФП и создания модели прогнозирования использовали логистический регрессионный анализ. Значения чувствительности и специфичности модели рассчитывали на основе общепринятых формул и ROC-кривых. Определение доли пациентов, у которых не произошло событие (рецидив ФП), для любого момента времени в течение всего периода наблюдения проводили с применением метода Каплана–Майера. Сравнение кривых Каплана–Майера выполняли с помощью лог-рангового теста.
Межоператорскую воспроизводимость рассчитывали с помощью двусторонней случайной модели (тип абсолютного согласия) коэффициентов внутриклассовой корреляции (interclass correlation, ICC) и их 95% доверительных интервалов (CI) для каждого признака. Значения ICC интерпретировали следующим образом: плохая (ICC CI < 0,5), умеренная (0,5 < ICC CI < 0,75), хорошая (0,75 < ICC CI < 0,9) и отличная (ICC CI > 0,9) надежность [23].
Корреляционный анализ проводили с помощью коэффициента корреляции Спирмена (ρ).
Результаты
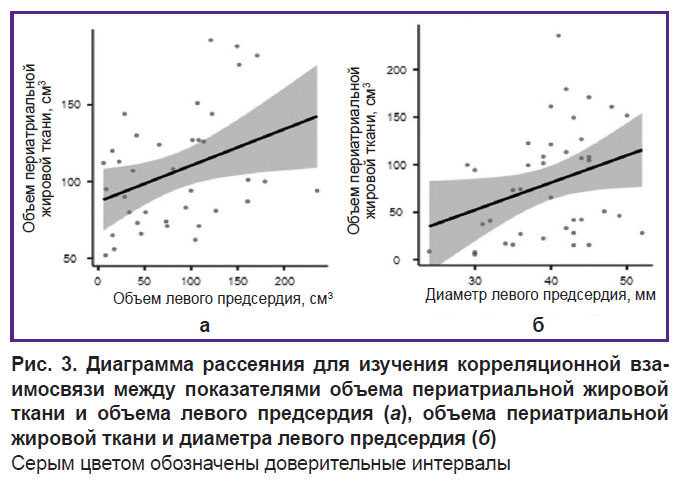
Основные КТ-характеристики периатриальной жировой ткани. Медиана объема ПАЖТ составила 77 [63; 97] см3, а плотность составила –81 [–79; –81] HU (единицы Хаунсфилда). Между показателями объема ПАЖТ, объема и диаметра левого предсердия выявлена слабая положительная корреляционная взаимосвязь (ρ=0,337; p=0,041 и ρ=0,352; p=0,026 соответственно). На рис. 3 представлена диаграмма рассеяния корреляционной взаимосвязи, из которой следует, что при увеличении объема и диаметра левого предсердия увеличивается объем ПАЖТ. С другими клиническими факторами риска развития (тип ФП, аритмологический стаж, курение, ИМТ) и постабляционного рецидива ФП корреляционных взаимосвязей выявлено не было.
Результаты наблюдения через 12 мес после интервенционного вмешательства. Через 12 мес после катетерной абляции рецидив ФП наблюдался у 19 пациентов (44%). Статистически значимых различий и корреляционных взаимосвязей между основными клиническими факторами риска развития и рецидива ФП, объемом и плотностью ПАЖТ не выявлено (табл. 2).
|
Таблица 2. Клиническая характеристика пациентов с постабляционным рецидивом и без такового через 12 мес наблюдения |
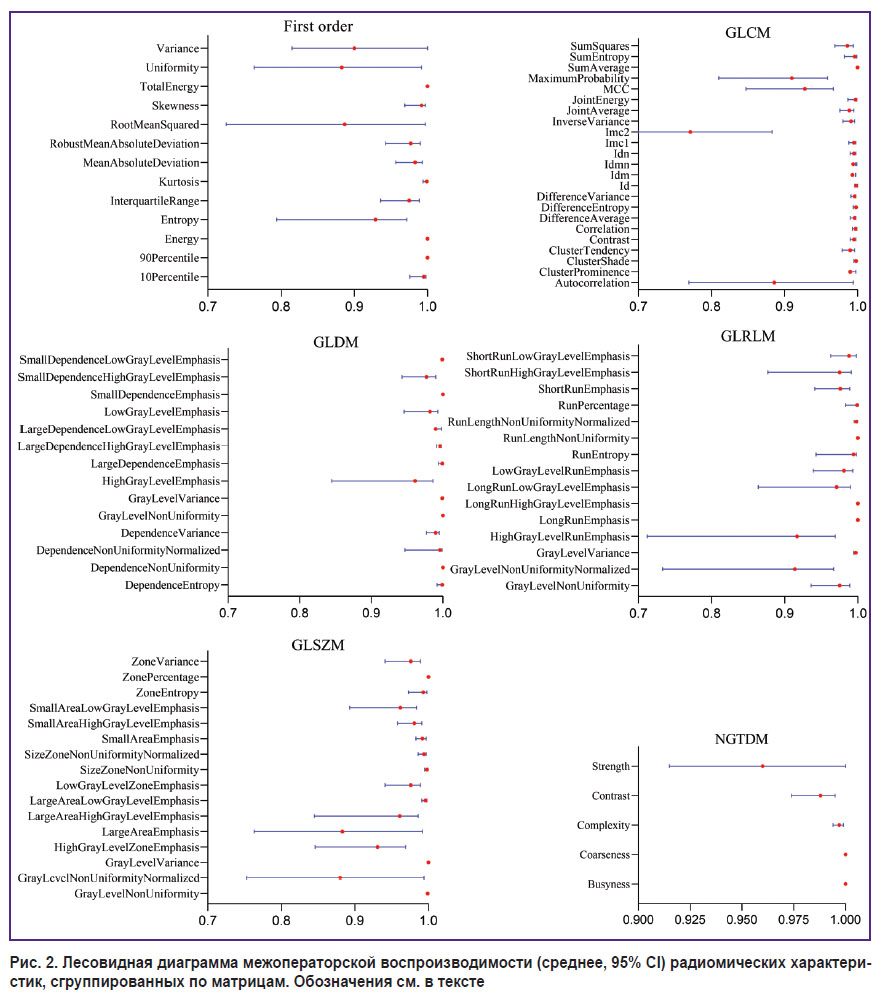
Межоператорская воспроизводимость. Межоператорская воспроизводимость была хорошего и отличного качества для всех радиомических характеристик. Для объема ПАЖТ ICC составила 0,835 (95% CI: 0,812–0,867, p<0,001), для плотности ПАЖТ — 0,991 (95% CI: 0,977–0,996, p<0,001). Рис. 2 иллюстрирует значения коэффициентов внутриклассовой корреляции (среднее, 95% CI) для каждого радиомического признака, сгруппированного по матрицам.
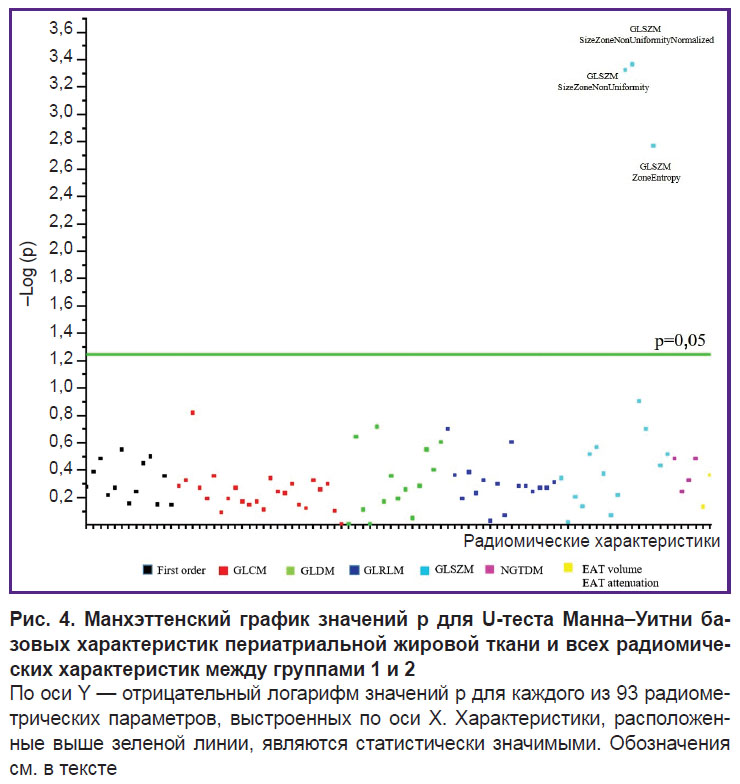
Результаты радиомического анализа периатриальной жировой ткани. Из 93 извлеченных радиомических характеристик статистически значимые различия наблюдались по трем характеристикам матрицы GLSZ: Size Zone Non Uniformity (р<0,001), Size Zone Non Uniformity Normalized (р<0,001) и Zone Entropy (р<0,001) (рис. 4). Между диаметром левого предсердия и Size Zone Non Uniformity Normalized (ρ=0,337; p=0,034), Size Zone Non Uniformity (ρ=0,350; p=0,027), Zone Entropy (ρ=0,334; p=0,03) отмечены статистически значимые положительные или отрицательные корреляционные взаимосвязи.
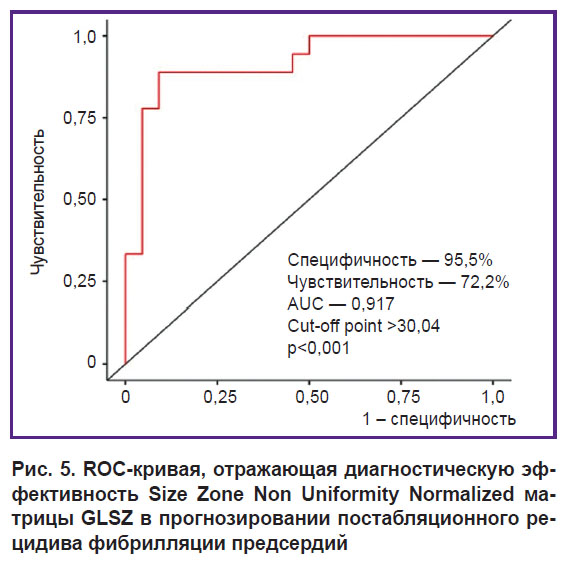
По результатам логистического регрессионного анализа только одна радиомическая характеристика ПАЖТ, Size Zone Non Uniformity Normalized, являлась независимым предиктором постабляционного рецидива ФП после катетерной абляции в течение 12 мес наблюдения (McFadden’s R2=0,451; ОШ — 0,506; 95% CI: 0,331–0,776; p<0,001). На основании результатов ROC-анализа логистическая модель демонстрирует высокие показатели чувствительности и специфичности в прогнозе развития постабляционной ФП (cut-off point >30,04; специфичность — 95,5%, чувствительность — 72,2%, точность — 85%, AUC — 0,917; p<0,001) (рис. 5). Следует отметить, что клинические факторы риска такими свойствами не обладают.
|
Рис. 5. ROC-кривая, отражающая диагностическую эффективность Size Zone Non Uniformity Normalized матрицы GLSZ в прогнозировании постабляционного рецидива фибрилляции предсердий |
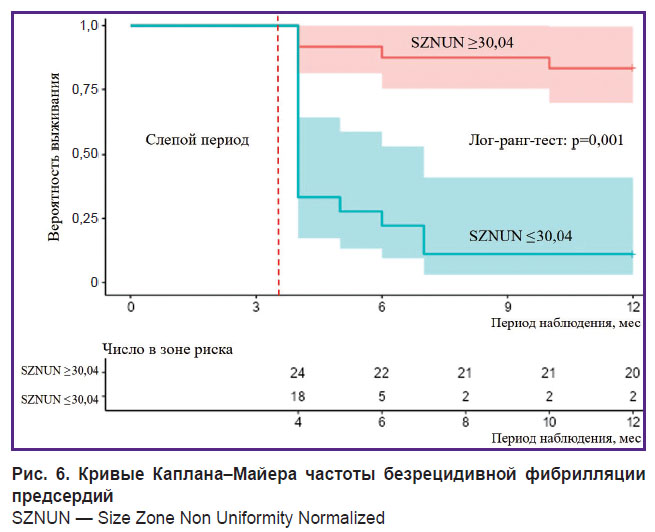
Анализ Каплана–Майера показал, что значение Size Zone Non Uniformity Normalized матрицы GLSZ более 30,04 значительно повышает риск постабляционного рецидива ФП (рис. 6).
|
Рис. 6. Кривые Каплана–Майера частоты безрецидивной фибрилляции предсердий SZNUN — Size Zone Non Uniformity Normalized |
Обсуждение
В последние годы большое внимание уделяется ПАЖТ как структуре, находящейся в непосредственном контакте с миокардом предсердия и устьями легочных вен. Установлены взаимосвязи между толщиной, массой, плотностью ПАЖТ, развитием ФП и ее тяжестью [24, 25]. С точки зрения патофизиологии периатриальный жир способен оказывать проаритмогенный эффект посредством двух механизмов воздействия. Первый из них, механоструктурный, возникает за счет непосредственной инфильтрации миокарда адипоцитами [5]. Второй механизм — паракринный, обеспечивается благодаря продуцированию провоспалительных цитокинов собственно жировой тканью и инфильтрацией макрофагами [5, 25]. Конечным результатом воздействия является электрическое и структурное ремоделирование миокарда левого предсердия с последующим формированием субстрата, препятствующего адекватному проведению импульса.
В аспекте прогнозирования рецидива ФП характеристикам ПАЖТ уделяется гораздо меньшее внимание, чем ЭЖТ. Тем не менее в этом направлении тоже были достигнуты определенные результаты. Так, D. Kocyigit с соавт. [8] показали, что толщина ПАЖТ по данным КТ является независимым предиктором постабляционного рецидива ФП у пациентов с сохраненной фракцией выброса левого желудочка без клапанной патологии. В исследовании L. Ciuffo с соавт. [9] продемонстрировано, что плотность ПАЖТ — независимый предиктор постабляционного рецидива ФП даже после коррекции на клинические факторы риска. N. Gaibazzi с соавт. [26] на основании измерения плотности жировой ткани в области задней стенки левого предсердия выявили независимую ассоциацию объема ПАЖТ и ее плотности с наличием ФП и постабляционным рецидивом. При этом плотность ПАЖТ ниже –76 HU с высокой чувствительностью, но достаточно низкой специфичностью позволяла прогнозировать рецидив [26]. В аналогичном исследовании M. El Mahdiui с соавт. [6] значение плотности ПАЖТ ниже –96 HU также являлось перспективным предиктором рецидива аритмии. Авторы полагают, что снижение плотности жировой ткани может считаться маркером воспалительного процесса в окружающей предсердие жировой клетчатке или в миокарде предсердия [6, 26]. Однако авторы не приводят подтверждений своей гипотезы, таких как анализ уровня адипокинов, провоспалительных цитокинов, гистологический анализ. Кроме того, стоит отметить, что в указанные исследования вошли пациенты, имеющие клинические факторы риска развития и рецидивирования ФП, которые также могут оказывать влияние на метаболические процессы, происходящие в жировой ткани [5]. По этой причине мы сконцентрировали свое внимание на отдельной когорте пациентов, у которых сложно установить причину развития ФП.
В нашем исследовании мы не обнаружили взаимосвязи между базовыми КТ-характеристиками ПАЖТ (объем и плотность) и развитием поздних постабляционных рецидивов ФП, что не согласуется с результатами M. El Mahdiui [6] и N. Gaibazzi [26]. Подобное расхождение может быть связано с методологией исследования: для анализа нами использовался весь объем периатриальной жировой клетчатки. Кроме того, среднее значение плотности жировой ткани нами вычислялось во всем сегментированном объеме. Нельзя исключить, что плотность жира в различных отделах (задняя стенка, передняя стенка, устья легочных вен) имеет гетерогенность и зависит от выраженности протекающего в ней воспалительного процесса [6]. Воспалительный процесс в жировой клетчатке тесно взаимосвязан с атеросклеротическим процессом в коронарных сосудах, ожирением, сахарным диабетом [27–29], которые также являются общепризнанными факторами риска развития и рецидивирования ФП. Учитывая, что в наше исследование вошли пациенты молодого и среднего возраста, мы полагаем, что вклад воспалительного процесса в постабляционный рецидив минимален и на первый план выходит механоструктурный механизм воздействия. Эта гипотеза подтверждается умеренной положительной корреляционной взаимосвязью между объемом ПАЖТ, объемом левого предсердия и его диаметром. Тем не менее использование текстурного анализа рентгеновских томографических изображений жировой ткани предсердий могло бы улучшить понимание процессов, происходящих в ПАЖТ, с точки зрения ее влияния на постабляционный рецидив ФП.
Успешное и широкое применение радиомики в клинической практике возможно только при хорошей воспроизводимости радиомических параметров, что достигается за счет использования единых критериев записи и постпроцессинговой обработки изображений. Известно, что текстурные характеристики чувствительны к методу сегментации (ручной или автоматический), параметрам рентгеновской трубки, алгоритму реконструкции изображения и типу используемого программного обеспечения [30, 31]. По этой причине для анализа мы выбрали бесконтрастную серию изображений, выполненную по протоколу Ca-scoring, который является стандартизованным [32]. Такой подход позволяет сохранить высокую воспроизводимость результатов и дает возможность проведения мультицентровых исследований. Использование серий с контрастным усилением для извлечения радиомических характеристик имеет преимущество только за счет более высокого разрешения изображений, поскольку характеристики рентгеновской трубки настраиваются индивидуально в зависимости от массы тела, ЧСС и количества контрастного препарата, что неизбежно влияет на радиомические характеристики. Проверка воспроизводимости объема, плотности и радиомических характеристик ПАЖТ двумя независимыми радиологами показала очень хорошие результаты для абсолютного большинства показателей. Данный результат указывает на то, что ручной метод сегментации в приложении SliсerRadiomics в заданных значениях плотности жировой ткани может быть использован любым оператором. Таким образом, выбор в пользу анализа нативных изображений, по нашему мнению, является обоснованным.
В оценке эффективности катетерного лечения при межгрупповом сравнении радиомический фенотип ПАЖТ имел всего 3 статистически значимо отличающихся параметра из матрицы GLSZ. Данная матрица является примером матриц высшего порядка, которые подходят для оценки непериодических и неоднородных текстур. Она используется для количественного описания зон уровня серого в изображении, определяющихся количеством связанных пикселей с одинаковой интенсивностью [33, 34]. Матрица содержит 16 текстурных характеристик, каждая из которых в той или иной степени отражает однородность и грубость текстуры объекта. Текстурная характеристика Size Zone Non Uniformity и ее нормализованная версия Size Zone Non Uniformity Normalized измеряют изменчивость объемов размерных зон по всему изображению, причем чем меньше значение, тем однороднее объемы размерных зон на изображении. Характеристика Zone Entropy является своего рода «антиподом» Size Zone Non Uniformity и Size Zone Non Uniformity Normalized, и ее большие значения указывают на неоднородность текстуры в случайном распределении зон и уровней серого [32]. В отсутствие гистологического анализа образцов жировой ткани сложно рассматривать данные факты с позиции патоморфологии. Однако мы полагаем, что изменения этих показателей у пациентов с постабляционным рецидивом могут быть обусловлены изменениями в структуре жировой ткани на молекулярном уровне и характеризуют ее как морфологически гетерогенную вследствие гипертрофии и гиперплазии адипоцитов. Из указанных статистически значимых текстурных характеристик в многофакторном логистическом регрессионном анализе только один радиомический биомаркер ПАЖТ — Size Zone Non Uniformity Normalized — являлся независимым предиктором постабляционного рецидива ФП. Учитывая корреляционную взаимосвязь Size Zone Non Uniformity, Size Zone Non Uniformity Normalized и Zone Entropy с диаметром левого предсердия, полученные результаты вновь подтверждают механоструктурный тип воздействия морфологически измененной жировой ткани на миокард левого предсердия с последующим фиброзным ремоделированием.
Ограничения исследования. Исследование имеет несколько ограничений. Во-первых, одноцентровое проспективное когортное исследование небольшой выборки не исключает влияния систематической ошибки отбора и не позволяет провести адекватный статистический анализ между подгруппами пациентов с разными формами ФП. Во-вторых, из-за небольшого размера выборки мы не использовали продвинутые алгоритмы машинного обучения и искусственного интеллекта. В-третьих, результаты текстурного анализа стоит подкрепить данными об уровне биохимических маркеров воспаления, таких как вч-СРБ (высокочувствительный С-реактивный белок) и интерлейкин-6, сравнительным анализом с результатами внутрисердечного электрофизиологического исследования, а также данными гистологического исследования ЭЖТ.
Заключение
Радиомический анализ медицинских изображений направлен на извлечение полезных количественных характеристик, на основе которых могут быть построены модели для классификации, прогнозирования течения заболевания и ответа на лечение. Несмотря на то, что радиомический фенотип периатриальной жировой ткани у пациентов с поздним постабляционным рецидивом фибрилляции предсердий не носит выраженного характера, использование данного подхода можно рассматривать как перспективный неинвазивный метод прогнозирования неблагоприятного исхода катетерного лечения, что открывает возможности для планирования и коррекции тактики ведения пациента после интервенционного вмешательства.
Источники финансирования. Работа выполнена в рамках проекта по прикладным научным исследованиям «Разработка технологий персонализированной инвазивной аритмологии у детей и взрослых», АААА-А20-120041090006-1, а также гранта Российского научного фонда №17-75-20118 «Изучение механизмов развития дисфункции автономной нервной системы при нарушениях ритма сердца».
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Литература
- Kirchhof P., Benussi S., Kotecha D., Ahlsson A., Atar D., Casadei B., Castella M., Diener H.C., Heidbuchel H., Hendriks J., Hindricks G., Manolis A.S., Oldgren J., Popescu B.A., Schotten U., Van Putte B., Vardas P.; ESC Scientific Document Group. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur Heart J 2016; 37(38): 2893–2962, https://doi.org/10.1093/eurheartj/ehw210.
- Sazonova S.I., Ilyushenkova Yu.N., Lishmanov Yu.B., Batalov R.E., Sazonov A.E., Larionova L.A., Nesterov E.A., Varlamova N.V., Rogovskaya Yu.V., Shelkovnikova T.A., Popov S.V. Assessment of radiological techniques application possibility for non-invasive diagnostics of latent inflammatory processes in myocardium in patients with atrial fibrillation. Ann Nucl Med 2016; 30(10): 738–748, https://doi.org/10.1007/s12149-016-1120-9.
- Hindricks G., Potpara T., Dagres N., Arbelo E., Bax J.J., Blomström-Lundqvist C., Boriani G., Castella M., Dan G.A., Dilaveris P.E., Fauchier L., Filippatos G., Kalman J.M., La Meir M., Lane D.A., Lebeau J.P., Lettino M., Lip G.Y.H., Pinto F.J., Thomas G.N., Valgimigli M., Van Gelder I.C., Van Putte B.P., Watkins C.L.; ESC Scientific Document Group. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS): The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC). Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Eur Heart J 2021; 42(5): 373–498, https://doi.org/10.1093/eurheartj/ehaa612.
- Deng H., Bai Y., Shantsila A., Fauchier L., Potpara T.S., Lip G.Y.H. Clinical scores for outcomes of rhythm control or arrhythmia progression in patients with atrial fibrillation: a systematic review. Clin Res Cardiol 2017; 106(10): 813–823, https://doi.org/10.1007/s00392-017-1123-0.
- Gaborit B., Sengenes C., Ancel P., Jucquier A., Dutour A. Role of epicardial adipose tissue in health and disease: a matter of fat? Compr Physiol 2017; 7(3): 1051–1082, https://doi.org/10.1002/cphy.c160034.
- El Mahdiui M., Simon J., Smit J.M., Kuneman J.H., van Rosendael A.R., Steyerberg E.W., van der Geest R.J., Száraz L., Herczeg S., Szegedi N., Gellér L., Delgado V., Merkely B., Bax J.J., Maurovich-Horvat P. Posterior left atrial adipose tissue attenuation assessed by computed tomography and recurrence of atrial fibrillation after catheter ablation. Circ Arrhythm Electrophysiol 2021; 14(4): e009135, https://doi.org/10.1161/circep.120.009135.
- Sepehri Shamloo A., Schoene K., Stauber A., Darma A., Dagres N., Dinov B., Bertagnolli L., Hilbert S., Müssigbrodt A., Husser D., Bollmann A., Hindricks G., Arya A. Epicardial adipose tissue thickness as an independent predictor of ventricular tachycardia recurrence following ablation. Heart Rhythm 2019; 16(10): 1492–1498, https://doi.org/10.1016/j.hrthm.2019.06.009.
- Kocyigit D., Gurses K.M., Yalcin M.U., Turk G., Evranos B., Yorgun H., Sahiner M.L., Kaya E.B., Hazirolan T., Tokgozoglu L., Oto M.A., Ozer N., Aytemir K. Periatrial epicardial adipose tissue thickness is an independent predictor of atrial fibrillation recurrence after cryoballoon-based pulmonary vein isolation. J Cardiovasc Comput Tomogr 2015; 9(4): 295–302, https://doi.org/10.1016/j.jcct.2015.03.011.
- Ciuffo L., Nguyen H., Marques M.D., Aronis K.N., Sivasambu B., de Vasconcelos H.D., Tao S., Spragg D.D., Marine J.E., Berger R.D., Lima J.A.C., Calkins H., Ashikaga H. Periatrial fat quality predicts atrial fibrillation ablation outcome. Circ Cardiovasc Imaging 2019; 12(6): e008764, https://doi.org/10.1161/circimaging.118.008764.
- Avanzo M., Stancanello J., El Naqa I. Beyond imaging: the promise of radiomics. Phys Med 2017; 38: 122–139, https://doi.org/10.1016/j.ejmp.2017.05.071.
- Avery E., Sanelli P.C., Aboian M., Payabvash S. Radiomics: a primer on processing workflow and analysis. Semin Ultrasound CT MR 2022; 43(2): 142–146, https://doi.org/10.1053/j.sult.2022.02.003.
- Slart R.H.J.A., Williams M.C., Juarez-Orozco L.E., Rischpler C., Dweck M.R., Glaudemans A.W.J.M., Gimelli A., Georgoulias P., Gheysens O., Gaemperli O., Habib G., Hustinx R., Cosyns B., Verberne H.J., Hyafil F., Erba P.A., Lubberink M., Slomka P., Išgum I., Visvikis D., Kolossváry M., Saraste A. Position paper of the EACVI and EANM on artificial intelligence applications in multimodality cardiovascular imaging using SPECT/CT, PET/CT, and cardiac CT. Eur J Nucl Med Mol Imaging 2021; 48(5): 1399–1413, https://doi.org/10.1007/s00259-021-05341-z.
- Mahabadi A.A., Rassaf T. Radiomic assessment of pericoronary adipose tissue: detecting the vulnerable patient. JACC Cardiovasc Imaging 2020; 13(11): 2384–2385, https://doi.org/10.1016/j.jcmg.2020.07.006.
- Lin A., Kolossváry M., Išgum I., Maurovich-Horvat P., Slomka P.J., Dey D. Artificial intelligence: improving the efficiency of cardiovascular imaging. Expert Rev Med Devices 2020; 17(6): 565–577, https://doi.org/10.1080/17434440.2020.1777855.
- Ma Q., Ma Y., Wang X., Li S., Yu T., Duan W., Wu J., Wen Z., Jiao Y., Sun Z., Hou Y. A radiomic nomogram for prediction of major adverse cardiac events in ST-segment elevation myocardial infarction. Eur Radiol 2021; 31(2): 1140–1150, https://doi.org/10.1007/s00330-020-07176-y.
- Oikonomou E.K., Siddique M., Antoniades C. Artificial intelligence in medical imaging: a radiomic guide to precision phenotyping of cardiovascular disease. Cardiovasc Res 2020; 116(13): 2040–2054, https://doi.org/10.1093/cvr/cvaa021.
- Zhang L., Xu Z., Jiang B., Zhang Y., Wang L., de Bock G.H., Vliegenthart R., Xie X. Machine-learning-based radiomics identifies atrial fibrillation on the epicardial fat in contrast-enhanced and non-enhanced chest CT. Br J Radiol 2022; 95(1135): 20211274, https://doi.org/10.1259/bjr.20211274.
- Knuuti J., Wijns W., Saraste A., Capodanno D., Barbato E., Funck-Brentano C., Prescott E., Storey R.F., Deaton C., Cuisset T., Agewall S., Dickstein K., Edvardsen T., Escaned J., Gersh B.J., Svitil P., Gilard M., Hasdai D., Hatala R., Mahfoud F., Masip J., Muneretto C., Valgimigli M., Achenbach S., Bax J.J.; ESC Scientific Document Group. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. Eur Heart J 2020; 41(3): 407–477, https://doi.org/10.1093/eurheartj/ehz425.
- Donal E., Lip G.Y., Galderisi M., Goette A., Shah D., Marwan M., Lederlin M., Mondillo S., Edvardsen T., Sitges M., Grapsa J., Garbi M., Senior R., Gimelli A., Potpara T.S., Van Gelder I.C., Gorenek B., Mabo P., Lancellotti P., Kuck K.H., Popescu B.A., Hindricks G., Habib G., Cardim N.M., Cosyns B., Delgado V., Haugaa K.H., Muraru D., Nieman K., Boriani G., Cohen A. EACVI/EHRA Expert Consensus Document on the role of multi-modality imaging for the evaluation of patients with atrial fibrillation. Eur Heart J Cardiovasc Imaging 2016; 17(4): 355–383, https://doi.org/10.1093/ehjci/jev354.
- Abbara S., Blanke P., Maroules C.D., Cheezum M., Choi A.D., Han B.K., Marwan M., Naoum C., Norgaard B.L., Rubinshtein R., Schoenhagen P., Villines T., Leipsic J. SCCT guidelines for the performance and acquisition of coronary computed tomographic angiography: a report of the society of Cardiovascular Computed Tomography Guidelines Committee: endorsed by the North American Society for Cardiovascular Imaging (NASCI). J Cardiovasc Comput Tomogr 2016; 10(6): 435–449, https://doi.org/10.1016/j.jcct.2016.10.002.
- Fedorov A., Beichel R., Kalpathy-Cramer J., Finet J., Fillion-Robin J.C., Pujol S., Bauer C., Jennings D., Fennessy F., Sonka M., Buatti J., Aylward S., Miller J.V., Pieper S., Kikinis R. 3D Slicer as an image computing platform for the Quantitative Imaging Network. Magn Reson Imaging 2012; 30(9): 1323–1341, https://doi.org/10.1016/j.mri.2012.05.001.
- Шелемехов А.Е., Баталов Р.Е., Роговская Ю.В., Усенков С.Ю., Арчаков Е.А., Гусакова А.М., Ребенкова М.С. Клиническая эффективность катетерного лечения фибрилляции предсердий в зависимости от динамики гистологических изменений в миокарде по результатам эндомиокардиальной биопсии правого желудочка. Патология кровообращения и кардиохирургия 2020; 24(3): 90–106, https://doi.org/10.21688/1681-3472-2020-3-90-106.
- Koo T.K., Li M.Y. A guideline of selecting and reporting intraclass correlation coefficients for reliability research. J Chiropr Med 2016; 15(2): 155–163, https://doi.org/10.1016/j.jcm.2016.02.012.
- Yorgun H., Canpolat U., Aytemir K., Hazırolan T., Şahiner L., Kaya E.B., Kabakci G., Tokgözoğlu L., Özer N., Oto A. Association of epicardial and peri-atrial adiposity with the presence and severity of non-valvular atrial fibrillation. Int J Cardiovasc Imaging 2015; 31(3): 649–657, https://doi.org/10.1007/s10554-014-0579-5.
- van Rosendael A.R., Dimitriu-Leen A.C., van Rosendael P.J., Leung M., Smit J.M., Saraste A., Knuuti J., van der Geest R.J., van der Arend B.W., van Zwet E.W., Scholte A.J., Delgado V., Bax J.J. Association between posterior left atrial adipose tissue mass and atrial fibrillation. Circ Arrhythm Electrophysiol 2017; 10(2): e004614, https://doi.org/10.1161/circep.116.004614.
- Gaibazzi N., Martini C., Benatti G., Palumbo A.A., Cacciola G., Tuttolomondo D. Atrial fibrillation and peri-atrial inflammation measured through adipose tissue attenuation on cardiac computed tomography. Diagnostics (Basel) 2021; 11(11): 2087, https://doi.org/10.3390/diagnostics11112087.
- Liu Z., Wang S., Wang Y., Zhou N., Shu J., Stamm C., Jiang M., Luo F. Association of epicardial adipose tissue attenuation with coronary atherosclerosis in patients with a high risk of coronary artery disease. Atherosclerosis 2019; 284: 230–236, https://doi.org/10.1016/j.atherosclerosis.2019.01.033.
- Patel V.B., Mori J., McLean B.A., Basu R., Das S.K., Ramprasath T., Parajuli N., Penninger J.M., Grant M.B., Lopaschuk G.D., Oudit G.Y. ACE2 deficiency worsens epicardial adipose tissue inflammation and cardiac dysfunction in response to diet-induced obesity. Diabetes 2016; 65(1): 85–95, https://doi.org/10.2337/db15-0399.
- Gullaksen S., Funck K.L., Laugesen E., Hansen T.K., Dey D., Poulsen P.L. Volumes of coronary plaque disease in relation to body mass index, waist circumference, truncal fat mass and epicardial adipose tissue in patients with type 2 diabetes mellitus and controls. Diab Vasc Dis Res 2019; 16(4): 328–336, https://doi.org/10.1177/1479164119825761.
- Berenguer R., Pastor-Juan M.D.R., Canales-Vázquez J., Castro-García M., Villas M.V., Mansilla Legorburo F., Sabater S. Radiomics of CT features may be nonreproducible and redundant: influence of CT acquisition parameters. Radiology 2018; 288(2): 407–415, https://doi.org/10.1148/radiol.2018172361.
- Meyer M., Ronald J., Vernuccio F., Nelson R.C., Ramirez-Giraldo J.C., Solomon J., Patel B.N., Samei E., Marin D. Reproducibility of CT radiomic features within the same patient: influence of radiation dose and CT reconstruction settings. Radiology 2019; 293(3): 583–591, https://doi.org/10.1148/radiol.2019190928.
- Agatston A.S., Janowitz W.R. Ultrafast computed tomography in coronary screening. Circulation 1994; 89(4): 1908–1909, https://doi.org/10.1161/01.cir.89.4.1908.
- van Griethuysen J.J.M., Fedorov A., Parmar C., Hosny A., Aucoin N., Narayan V., Beets-Tan R.G.H., Fillion-Robin J.C., Pieper S., Aerts H.J.W.L. Computational radiomics system to decode the radiographic phenotype. Cancer Res 2017; 77(21): e104–e107, https://doi.org/10.1158/0008-5472.can-17-0339.
- Umesh Pai M., Ardakani A.A., Kamath A., Raghavendra U., Gudigar A., Venkatesh N., Samanth J., Devasia T., Prabhu M.A., Sampathila N., Bairy G.M. Novel radiomics features for automated detection of cardiac abnormality in patients with pacemaker. Comput Math Methods Med 2022; 2022: 1279749, https://doi.org/10.1155/2022/1279749.