3D-модель опухолевого сфероида из краткосрочных культур клеток глиобластомы пациента и ее исследование методом метаболического флуоресцентного времяразрешенного имиджинга
Пациент-специфические in vitro модели опухолей являются перспективной платформой для изучения механизмов онкогенеза и персонифицированного подбора лекарственных препаратов. В случае глиальных опухолей мозга создание и использование таких моделей особенно актуально, так как эффективность лечения этих опухолей остается крайне неудовлетворительной.
Цель исследования — разработка 3D-модели опухолевого сфероида глиобластомы на основе операционного материала пациента и исследование ее метаболических особенностей методом флуоресцентной времяразрешенной микроскопии метаболических коферментов.
Материалы и методы. В работе использованы образцы опухолей пациентов с диагнозом «глиобластома, Grade IV». Для создания сфероидов из фрагментов опухолевой ткани выделены краткосрочные культуры, охарактеризованы морфологически и иммуноцитохимически и высажены в круглодонные низкоадгезивные планшеты. Количество клеток для посадки выбрано эмпирически. Проведено сравнение особенностей роста клеточных культур и сфероидов из глиобластом пациентов с библиотечной линией глиобластомы человека U373 MG. Визуализацию автофлуоресценции метаболических коферментов никотинамидадениндинуклеотида (фосфата) НАД(Ф)Н и флавинадениндинуклеотида (ФАД) в сфероидах осуществляли с помощью лазерного сканирующего микроскопа LSM 880 (Carl Zeiss, Германия) с FLIM-модулем (Becker & GmbH, Германия). Параметры затухания автофлуоресценции исследованы в условиях нормоксии и гипоксии (3,5% О2).
Результаты. Разработан оригинальный протокол культивирования 3D-сфероидов глиобластомы. Получены и охарактеризованы краткосрочные глиальные культуры из операционного материала пациентов. Выделенные клетки глиобластом имели веретенообразную морфологию с многочисленными отростками и выраженную зернистость цитоплазмы. Все культуры экспрессировали глиальный кислый фибриллярный белок GFAP. Подобрана оптимальная доза посева — 2000 клеток на лунку, приводящая к формированию сфероидов с плотной структурой и стабильным ростом в течение 7 дней. Методом FLIM установлено, что клетки сфероидов из материала пациентов имеют в целом схожий метаболизм со сфероидами из библиотечной линии глиобластомы, однако демонстрируют более выраженную метаболическую гетерогенность. При культивировании сфероидов в условиях гипоксии зарегистрирован более гликолитический тип метаболизма, что выражается в увеличении вклада свободной формы НАД(Ф)Н в затухание флуоресценции.
Заключение. Разработанная модель опухолевых сфероидов из глиобластомы пациентов с использованием краткосрочных культур в комбинации с методом FLIM-имиджинга может служить инструментом для исследования особенностей опухолевого метаболизма и разработки предиктивных тестов для оценки эффективности противоопухолевой терапии.
Введение
Глиобластома составляет 48,3% всех первичных злокачественных образований головного мозга и является наиболее агрессивной опухолью [1]. Несмотря на радикальную тактику лечения, включающую максимально возможное удаление опухоли, лучевую и химиотерапию, медиана выживаемости не превышает двух лет.
Существующие схемы лечения не учитывают индивидуальные особенности опухоли пациента, что является ключевой проблемой в борьбе с глиобластомой. Перспективным решением служит разработка персонализированного подхода к лечению на основе использования опухолевых моделей из клеточного материала от пациента [2–4].
Среди пациент-специфичных моделей глиобластомы выделяют две основные группы: 1) модели in vitro — монослойные культуры, культуры и ко-культуры в скаффолдах, 3D-сфероиды и органоиды [5]; 2) модели in vivo — опухолевые ксенографты у мышей [6]. Однако единые подходы к получению и охарактеризованию таких моделей не выработаны.
В ряду опухолевых моделей опухолевые сфероиды занимают промежуточное положение между монослойными клеточными культурами и опухолями животных. Опухолевые сфероиды представляют собой трехмерные многоклеточные агрегаты шарообразной формы, имеющие гетерогенную структуру. Морфологическая гетерогенность сфероидов обусловлена в первую очередь наличием градиентов питательных веществ, метаболитов и кислорода. У крупных сфероидов (диаметром более 500 мкм) можно выделить три основные зоны: некротическое ядро, внутренняя зона покоящихся клеток и внешний активно пролиферирующий слой [7]. Известно, что в сфероидах экспрессируются мембранные рецепторы, регулирующие клеточную адгезию и метаболизм, синтезируется межклеточный матрикс, что важно для межклеточного взаимодействия и взаимодействия с клетками иммунной системы [8]. С одной стороны, опухолевые сфероиды значительно лучше моделируют все виды межклеточных контактов, диффузию питательных веществ и кислорода в опухоли по сравнению с монослойными культурами и ближе по своим свойствам к реальным опухолям. С другой стороны, сфероиды намного более просты и дешевы в обращении по сравнению с опухолями мышей и органоидами, в особенности в случае опухолей головного мозга.
Все большее значение отводится использованию опухолевых сфероидов в доклиническом тестировании новых противоопухолевых агентов и терапевтических воздействий [9, 10]. Системы на основе сфероидов из клеток опухолей пациентов также рассматриваются как перспективная платформа для индивидуального подбора лекарственных препаратов [11, 12].
Помимо сугубо прикладных задач пациент-специфические модели, включая опухолевые сфероиды, играют важную роль в исследовании опухолевого метаболизма [13]. Значительные перестройки во многих метаболических путях — характерная особенность опухолей, которая в последние годы рассматривается не просто как следствие злокачественной трансформации, а как обязательное условие для опухолевой прогрессии [14]. Наиболее изученными особенностями метаболизма опухолевых клеток являются повышенный гликолиз, как анаэробный, так и аэробный (эффект Варбурга), нарушение митохондриального дыхания, активация пентозофосфатного пути, использование глутамина и жирных кислот в качестве энергетических субстратов [15, 16]. Современные исследования показывают, что метаболические процессы в опухолевых клетках отличаются высокой пластичностью, а сами опухолевые клетки, даже внутри одной опухоли, высокогетерогенны по своему метаболическому профилю, что позволяет им быстро адаптироваться и выживать в неблагоприятных условиях [17, 18]. Эти аспекты опухолевого метаболизма изучены гораздо меньше.
Высокий потенциал в исследованиях опухолевого метаболизма имеет технология метаболического имиджинга на основе двухфотонной флуоресцентной микроскопии с временны´м разрешением (FLIM, fluorescence lifetime imaging microscopy) [19–21]. Данный метод основан на оценке времени жизни автофлуоресценции метаболических кофакторов, таких как восстановленный никотинамидадениндинуклеотид (фосфат) (НАД(Ф)Н) и окисленный флавинадениндинуклеотид (ФАД). Эти кофакторы участвуют в качестве переносчиков электронов во многих биохимических реакциях и присутствуют в клетке в восстановленной (НАД(Ф)Н, ФАДН2) и окисленной (НАД+/НАДФ+, ФАД) формах. Из них только НАД(Ф)Н и ФАД обладают автофлуоресценцией, при этом, как правило, НАД(Ф)Н демонстрирует более высокую интенсивность флуоресценции внутри опухолевых клеток по сравнению с ФАД.
Нарушения в различных энергетических и анаболических путях могут приводить к изменению параметров затухания автофлуоресценции метаболических коферментов, что можно наблюдать на клеточном уровне с помощью FLIM [22–24]. В типичной ситуации затухание флуоресценции НАД(Ф)Н и ФАД описывается биэкспоненциальной функцией. В случае НАД(Ф)Н короткая компонента времени жизни соответствует свободной форме кофактора, ассоциированной с гликолизом, а длинная компонента — связанной с белками форме НАД(Ф)Н, ассоциированной с митохондриальной дыхательной цепью. В случае ФАД короткая и длинная компоненты обусловлены соответственно закрытой и открытой конформациями кофактора, первая из которых преобладает в структуре белков.
Цель исследования — разработать методику создания пациент-специфической 3D-модели сфероида глиобластомы и оценить метаболический статус полученных сфероидов с помощью FLIM.
Материалы и методы
Операционный материал. Все исследования на опухолевом материале одобрены локальным этическим комитетом Приволжского исследовательского медицинского университета, Н. Новгород (протокол №12 от 5 августа 2022 г.).
Осуществлен набор операционного материала от 5 пациентов с предполагаемым (по данным предоперационного МРТ с контрастным усилением) и подтвержденным гистологически диагнозом «глиобластома, Grade IV». Оперативное вмешательство было выполнено в отделении онкологии и нейрохирургии Университетской клиники Приволжского исследовательского медицинского университета. Исследование проведено в соответствии с Хельсинкской декларацией (2013) и одобрено Этическим комитетом Приволжского исследовательского медицинского университета. От каждого пациента получено информированное согласие.
Размер образцов опухолей составлял порядка 5×5×5 мм. Транспортировку их осуществляли в пробирках с транспортной средой DMEM (dulbecco’s modified eagle medium)/F12 («ПанЭко», Россия) с двукратной концентрацией антибиотика-антимикотика (Gibco, США) на льду.
Для получения первичной культуры клеток глиобластомы фрагмент опухолевой ткани механически измельчали в условиях стерильного бокса в чашках Петри стерильными лезвиями и дополнительно ферментативно диссоциировали с применением реактива Liberase ΤL (Roche, Швейцария), который представляет собой смесь коллагеназ I и II, 5–7 мин в CO2-инкубаторе (Sheldon Manufacturing Inc., США). Затем проводили очищение суспензии клеток от эритроцитов при помощи лизирующего АCK-буфера (Buffer EL; Qiagen, Германия). После центрифугирования конечной суспензии осадок ресуспендировали в питательной среде и переносили в 25-см2 культуральный флакон либо в 6-луночный планшет (Corning, США). Спустя 24–48 ч, когда глиальные клетки адгезировались на пластике, питательную среду с клеточным дебрисом заменяли на свежую полную среду DMEM со стандартной концентрацией антибиотика.
Культивирование клеток и сфероидов. Полученные краткосрочные культуры глиобластом, а также библиотечную линию глиобластомы человека U373 MG культивировали в питательной среде DMEM, содержащей 10% телячьей сыворотки (FCS), 0,06% глутамина, 50 ед./мл пенициллина и 50 мкг/мл стрептомицина сульфата, в СО2-инкубаторе при 5% СО2, температуре 37оС и влажности 85%. Субкультивирование проводили один раз в 2–3 сут по достижении культурой 80% конфлюентности. Снятие клеток происходило путем добавления 1 мл раствора трипсин–ЭДТА (25%) в течение 5 мин. Подсчет клеток выполняли в камере Горяева.
Изображения клеток в проходящем свете для оценки их морфологии и жизнеспособности, а также иммунофлуоресцентные изображения получали с использованием флуоресцентного инвертированного микроскопа DM IL LED (Leica, Германия).
Авторами разработан оригинальный протокол создания модели сфероида из краткосрочных клеточных культуры глиобластомы, который будет подробно описан в разделе «Результаты».
Опухолевые 3D-сфероиды формировали путем культивирования опухолевых клеток в 96-луночных круглодонных планшетах с низкой адгезией (Corning, США). Для получения сфероидов из линейных клеток глиобластомы U373 MG количество высеваемых клеток составляло 2000 клеток на лунку. Оценку роста и морфологии опухолевых сфероидов осуществляли с использованием микроскопа DM IL LED (Leica, Германия). Временны´е точки были выбраны таким образом, чтобы проследить все стадии формирования опухолевого сфероида: с начала образования клеточного агрегата до этапа гибели клеток. На каждой временнóй точке было проанализировано 5–7 сфероидов. Количественный анализ изображений проводили с помощью программного обеспечения ImageJ (National Institutes of Health, США), рассчитывая площадь сфероида по формуле 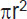 .
.
Для моделирования гипоксии опухолевые сфероиды с 3-го по 7-й день роста культивировали в инкубаторе (Sanyo, Япония) с содержанием кислорода 3,5%. Пониженное содержание кислорода достигалось путем вытеснения его азотом. FLIM выполняли на 3-й и 7-й дни культивирования.
Для проведения метаболического имиджинга опухолевые сфероиды переносили на специальные чашки со стеклянным дном для конфокальной микроскопии FluoroDish (WPI, Китай) на 2–3 ч для прикрепления. За час до процедуры визуализации стандартную питательную среду заменяли средой FluoroLite™ DMEM без фенолового красного (Gibco, США).
Иммуноцитохимический анализ. Клетки глиобластом за сутки до окрашивания высаживали на плоскодонный адгезивный пластик. Клетки фиксировали раствором 4% параформальдегида в течение 10 мин и обрабатывали раствором 0,1% Triton X-100 в течение 5 мин, инкубировали с первичными антителами к глиальному кислому фибриллярному белку GFAP (glial fibrillary acidic protein) (Boster Biological Technology, Ltd., США) в течение ночи при 4оС, затем инкубировали с вторичными антителами, конъюгированными с флуоресцентной меткой Alexa Fluor 594 в течение 1 ч при комнатной температуре. Ядра контрастировали флуоресцентным красителем DAPI. Визуализацию осуществляли с использованием фильтра TX2 с возбуждением 560/40 нм и эмиссией 645/75 нм — для Alexa Fluor 594 и фильтра CFP с возбуждением 436/20 нм и эмиссией 480/40 нм — для DAPI.
FLIM-имиджинг. FLIM проводили с помощью лазерного сканирующего микроскопа LSM 880 (Cаrl Zeiss, Германия). В качестве источника возбуждения использовали фемтосекундный Τi:Sa-лазер (Spectra Physics, США) с частотой следования импульсов 80 МГц и длительностью 120 фс. Детекцию времен жизни флуоресценции осуществляли с помощью FLIM-модуля TCSPC (Becker & Hickl GmbH, Германия), основанного на время-коррелированном счете единичных фотонов. Изображения получены с использованием масляного иммерсионного объектива 40х/1.3. Возбуждение флуоресценции НАД(Ф)Н осуществляли в двухфотонном режиме на длине волны 750 нм, сигнал принимали в диапазоне 450–490 нм. Флуоресценцию ФАД возбуждали на длине волны 900 нм, регистрацию осуществляли в интервале 500–550 нм. Мощность возбуждающего излучения в обоих случаях — 7 мВт. Время сбора фотонов составляло порядка 60 с. Количество фотонов в пикселе было не менее 5000. Во время эксперимента клетки находились в инкубаторе при 37°С, 5% СО2.
Данные FLIM обрабатывали в программе SPCImаge (Becker & Hickl GmbH, Германия). Для получения параметров кривых затухания в каждом пикселе использовали аппроксимацию методом наименьших квадратов. Кривые затухания флуоресценции НАД(Ф)Н и ФАД были аппроксимированы би-экспоненциальной моделью. Точность аппроксимации оценивали посредством параметра χ2. Для всех данных χ2 лежал в диапазоне от 0,8 до 1,2. Были оценены короткая и длинная компоненты затухания (τ1 и τ2 соответственно), относительные амплитуды этих компонент (α1 и α2), а также среднее время жизни флуоресценции (τm = α1τ1 + α2τ2).
Анализ автофлуоресценции проводили поклеточно в области цитоплазмы клетки. Для каждой группы получены изображения 5–7 сфероидов. В каждом сфероиде проанализировано по 15–20 клеток.
Статистический анализ. Для сравнительного анализа данных и их графического отображения использовали программное обеспечение GraphPad Prism 8.4.3 (GraphPad Software, США). Проверку непрерывных переменных на нормальность распределения проводили с использованием критерия Шапиро–Уилка (при p≥0,05 распределение считалось нормальным).
В ходе мониторинга роста сфероидов вычисляли усредненную площадь сфероида (у всех сфероидов в каждой экспериментальной группе на определенный день, по 5–7 сфероидов в каждой группе). Данные представлены как среднее значение ± стандартная ошибка среднего (M±SEM).
В экспериментах по FLIM вычисляли среднее значение параметров FLIM по 15–20 клеткам для каждого сфероида, затем определяли усредненное значение по всем сфероидам в каждой исследуемой группе (по 5–7 сфероидов в каждой группе).
При сравнительном анализе автофлуоресценции НАД(Ф)Н и ФАД между сфероидами из библиотечной линии U373 MG и первичной культуры глиобластомы для нахождения статистически значимых отличий между исследуемыми группами применяли параметрический t-критерий Стьюдента (при р≤0,05 различия считались статистически значимыми).
В эксперименте по гипоксии для сравнения показателей в зависимых группах данных использовали параметрический парный t-критерий Стьюдента (при p≤0,05 различия считались статистически значимыми). Для нахождения различий между независимыми группами данных также использовали параметрический t-критерий Стьюдента (при p≤0,05 различия считались статистически значимыми).
Результаты
Характеристика краткосрочных клеточных культур
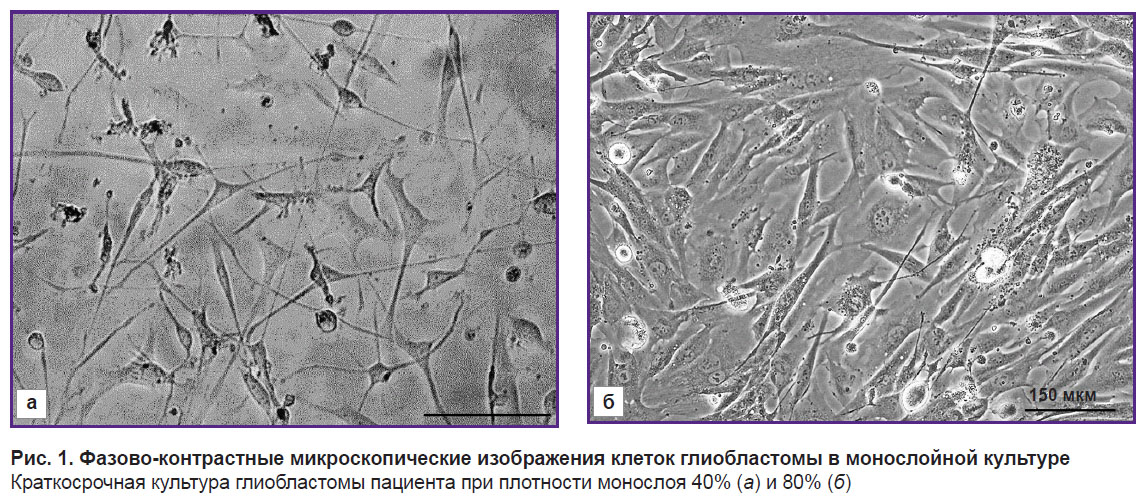
Выделенные краткосрочные культуры клеток глиобластомы демонстрировали диффузное распределение клеток и умеренный клеточный полиморфизм (рис. 1). Обнаружены многочисленные крупные клетки веретенообразной морфологии (фибробластоподобные клетки). Кроме того, наблюдались клетки треугольной, овальной, круглой или неправильной формы. У всех клеток отмечены выраженная зернистость цитоплазмы и многочисленные отростки.
|
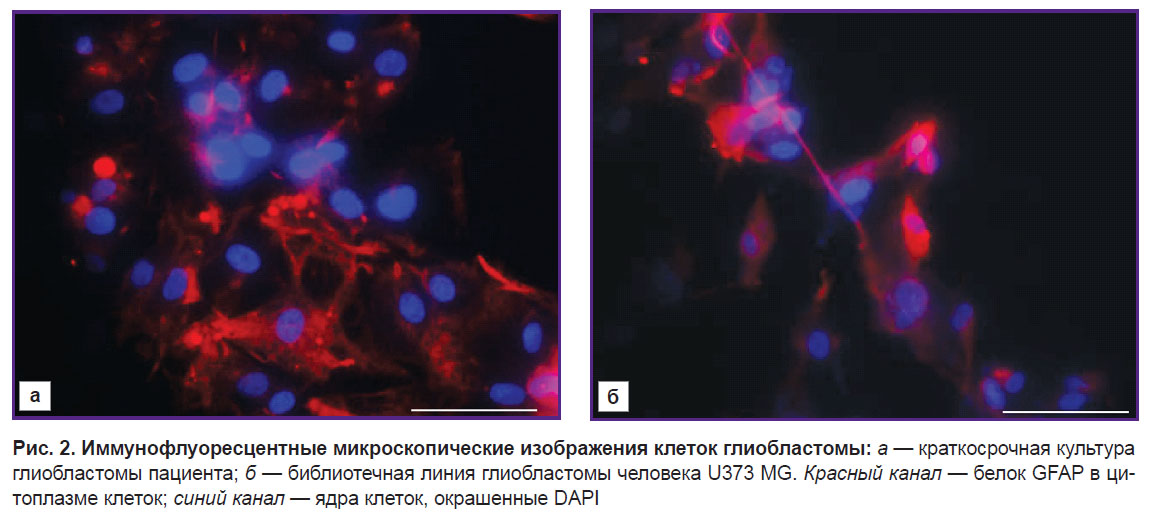
Рис. 1. Фазово-контрастные микроскопические изображения клеток глиобластомы в монослойной культуре Краткосрочная культура глиобластомы пациента при плотности монослоя 40% (а) и 80% (б) |
Для подтверждения природы выделенных клеток было проведено иммуноцитохимическое окрашивание на экспрессию основного глиального маркера — белка GFAP. Установлено, что все полученные культуры глиобластом экспрессировали данный белок. В качестве положительного контроля выступала библиотечная линия глиобластомы человека U373 MG, также экспрессирующая GFAP (рис. 2).
Рост и морфология опухолевых 3D-сфероидов из клеток глиобластомы пациентов
На первом этапе работы разработана оригинальная модель сфероида из краткосрочной культуры глиобластомы.
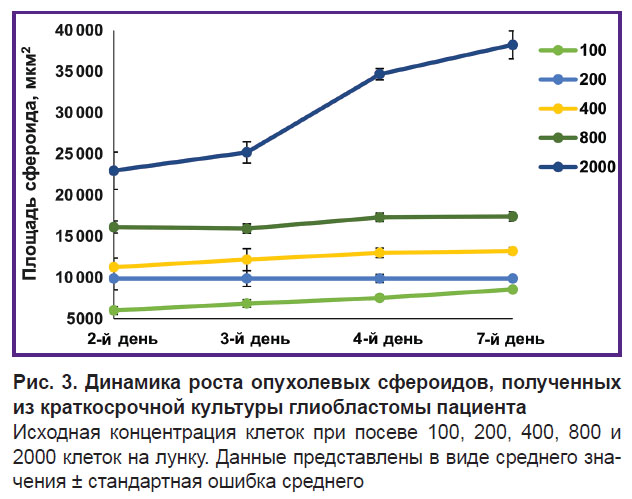
С целью получения опухолевых сфероидов из клеток глиобластом пациентов апробированы различные количества клеток для высевания и проведено сравнение динамики их роста и морфологии. Установлено, что при посадке 100 клеток в лунку наблюдается незначительный рост клеточного агломерата в течение 7 дней (рис. 3). Данный агломерат имеет неправильную форму, рыхлую структуру без характерного оптически плотного ядра и светлого наружного слоя, что ставило под сомнение формирование сфероида. При посадке 200, 400 и 800 клеток в лунку на 2-й день культивирования образовывались некомпактные агломераты, размеры которых составляли порядка 40–70 мкм в диаметре и не менялись в течение 7 дней роста. Стоит отметить, что при посадке 800 клеток на лунку агломераты приобретали более правильную сферическую форму. Однако при всех указанных концентрациях сфероиды практически не демонстрировали роста и развития.
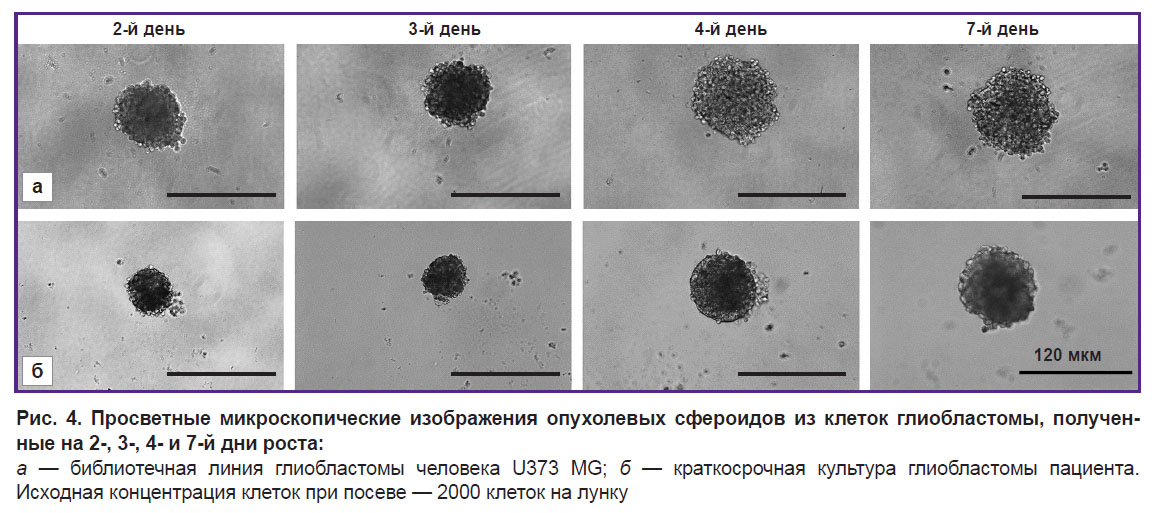
При посадке 2000 клеток в лунку сфероиды постепенно увеличивались в размере с 85 до 112 мкм и формировали зональную структуру в процессе развития (рис. 4).
Начиная со 2-го дня культивирования клеточные агломераты приобретали правильную сферическую форму. К 4-му дню роста сфероиды становились более крупными и плотными и приобретали характерное разделение на слои — имели выраженную наружную оболочку с поверхностным слоем светлых, активно пролиферирующих клеток и плотное темное однородное ядро. На 7-й день роста зрелые сфероиды начинали терять свою плотную структуру, становились более рыхлыми, что впоследствии приводило к их дезагрегации. На основании этих результатов концентрация 2000 клеток на лунку была признана оптимальной для получения опухолевых сфероидов из краткосрочных культур глиобластом.
Библиотечная линия глиобластомы человека U373 MG при посеве 2000 клеток в лунку демонстрировала сходные этапы развития сфероида, появление зональности на 3-й день роста и быстрое увеличение размеров сфероида со 100 до 134 мкм.
Разработанная методика была воспроизведена на образцах глиобластом (Grade IV) 5 пациентов. Во всех случаях наблюдали устойчивое формирование опухолевых сфероидов и их рост со схожей динамикой, как у представленного образца.
Исследование метаболического статуса опухолевых 3D-сфероидов методом FLIM
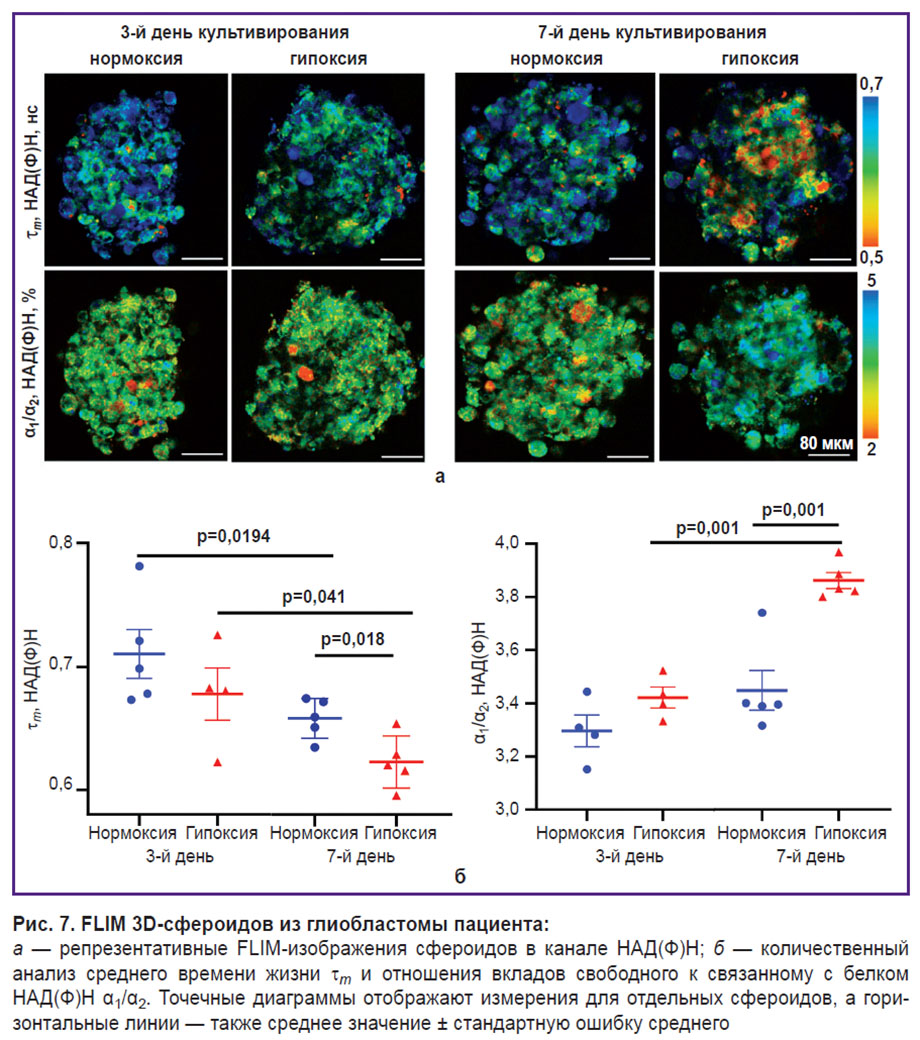
Сравнение сфероидов из клеток пациента и библиотечной линии. На втором этапе работы было проведено исследование метаболического статуса опухолевых сфероидов, полученных из глиобластомы пациента и библиотечной культуры. В экспериментах по метаболическому имиджингу были использованы сфероиды на 4-й день культивирования, демонстрирующие плотную структуру с характерным разделением на зоны.
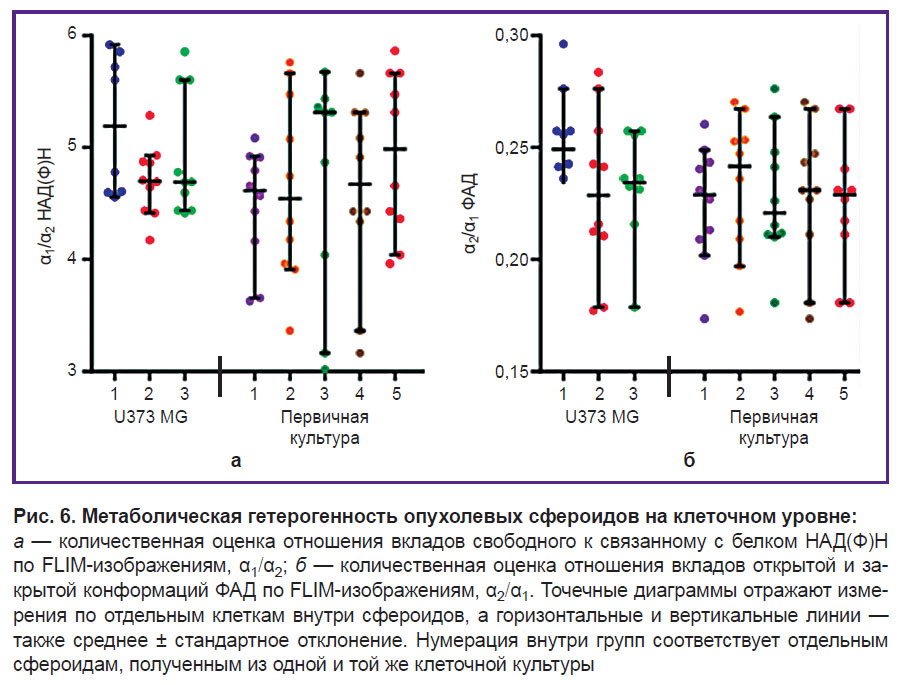
Методом FLIM получены изображения автофлуоресценции коферментов НАД(Ф)Н и ФАД в клетках сфероидов и проанализированы параметры времени жизни. В случае НАД(Ф)Н время жизни свободной (τ1) и связанной с белком форм (τ2) варьировало в диапазоне от 0,33 до 0,41 нс и от 2,46 до 2,63 нс соответственно и значимо не различалось между культурами опухолевых клеток. Однако для ФАД времена жизни закрытой (τ1) и открытой (τ2) конформаций отличались в зависимости от культуры клеток и были статистически значимо длиннее в сфероидах, сформированных из клеток пациента, по сравнению с библиотечной линией (см. таблицу). Между тем абсолютные значения времен жизни флуоресценции коферментов НАД(Ф)Н и ФАД, зарегистрированные во всех глиальных клетках, соответствовали типичным значениям, указанным в литературе [19, 23].
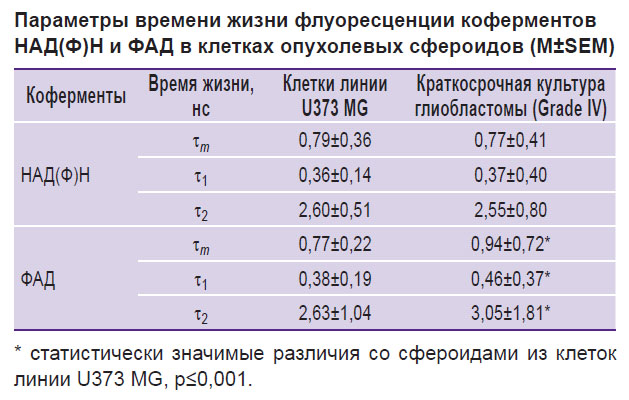
|
Параметры времени жизни флуоресценции коферментов НАД(Ф)Н и ФАД в клетках опухолевых сфероидов (M±SEM) |
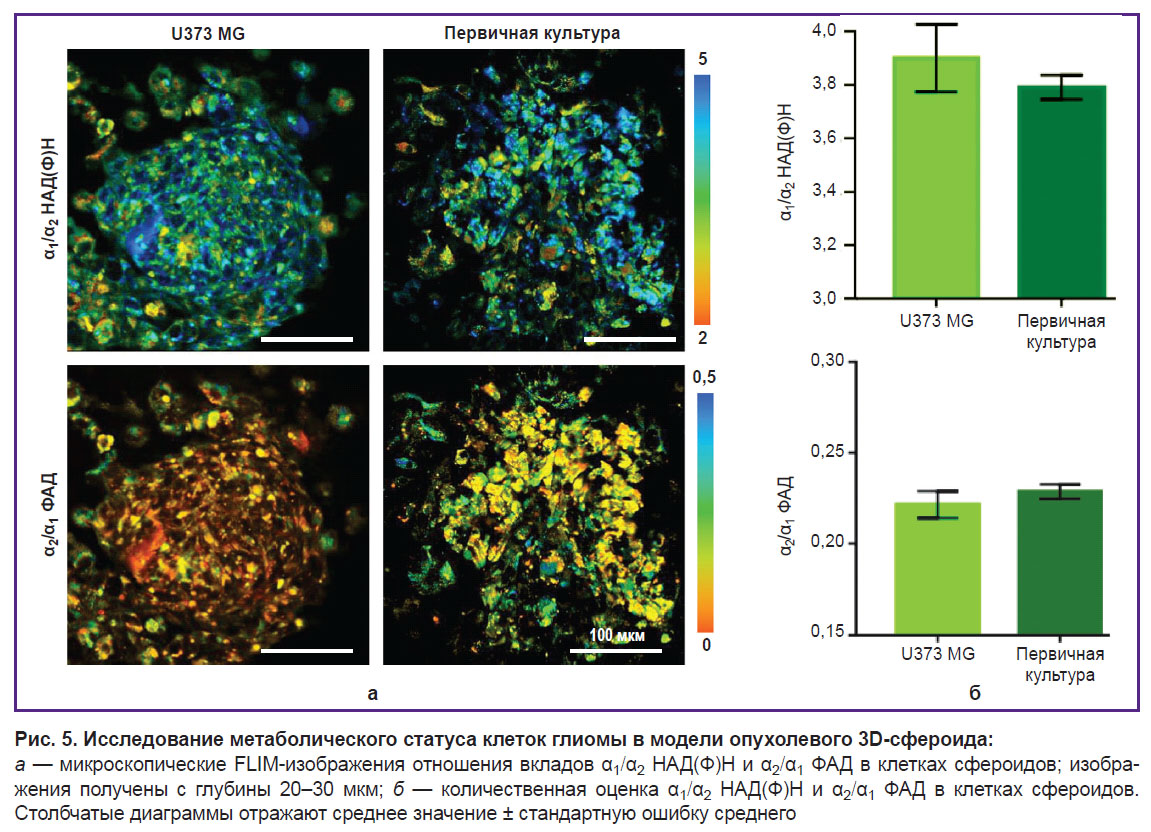
Отношение вкладов свободного НАД(Ф)Н к связанному с белком (α1/α2) в сфероидах, полученных из первичной культуры глиобластомы (~4,6), и библиотечной линии U373 MG (~4,8) было схожим (рис. 5). Отношения вкладов ФАД в открытой и закрытой конформации (α2/α1) также статистически значимо не различались в сфероидах из глиобластомы пациента (~0,22) и линейной культуры U373 MG (~0,22).
По данным FLIM-имиджинга, НАД(Ф)Н и ФАД более детально была проанализирована межклеточная гетерогенность метаболизма внутри каждого сфероида. Сравнение оптических метаболических показателей для периферической и центральной зон сфероидов не выявило метаболической зональности. Средние значения отношения α1/α2 НАД(Ф)Н и α2/α1 ФАД в сфероидах из одной культуры отличались незначительно. В то же время межклеточная гетерогенность метаболизма в каждом отдельно взятом сфероиде была выше в случае сфероидов, полученных из первичных культур глиобластомы, по сравнению со сфероидами из линейной культуры U373 MG, что выражалось в большом разбросе значений α1/α2 НАД(Ф)Н и α2/α1 ФАД (рис. 6).
Изменение метаболизма в условиях гипоксии. Кислородный статус злокачественных новообразований рассматривается в настоящее время как один из ключевых факторов, определяющих прогноз заболевания и эффективность лечебных воздействий [3]. Для того, чтобы установить, чувствительны ли параметры автофлуоресценции сфероидов к метаболическим перестройкам, индуцированным гипоксией, нами с помощью метода FLIM проведено исследование опухолевых сфероидов, сформированных из краткосрочных культур глиобластом, в условиях нормоксии (21% О2) и гипоксии (3,5% О2).
Установлено, что начиная с 3-го дня культивирования сфероидов в условиях гипоксии наблюдается тенденция к снижению среднего времени жизни τm НАД(Ф)Н (с 0,71±0,02 до 0,68±0,02 нс) за счет снижения вклада связанной компоненты α2 (с 23,11±0,30 до 22,62±0,20%) в отличие от нормоксии (рис. 7, б). На 7-й день культивирования данная тенденция становится более выраженной. Снижение τm и α2 становится статистически значимым: 0,62±0,01 нс и 20,60±0,10% в условиях гипоксии против 0,65±0,01 нс и 22,50±0,40% в условиях нормоксии (p=0,018 и p=0,001 соответственно). Наблюдаемые изменения ожидаемы и связаны с переходом клеток на более гликолитический метаболизм в условиях пониженного содержания кислорода.
Обращает на себя внимание, что в более зрелых сфероидах (7-й день роста) значения τm и α2 НАД(Ф)Н были ниже, чем у более «молодых» (3-й день), как при нормоксии, так и при гипоксии, что может свидетельствовать о сдвиге метаболизма в сторону гликолиза. Усиление гликолиза со временем при естественном росте сфероида может быть обусловлено ограниченной диффузией кислорода в сфероиды с плотной структурой.
Таким образом, проведенное с помощью метода FLIM исследование показало, что опухолевые сфероиды из первичной культуры глиобластомы, полученные по нашему протоколу, схожи по своим метаболическим особенностям со сфероидами из стандартной клеточной линии, адекватно отвечают на изменения в содержании кислорода в микроокружении и демонстрируют более высокую степень межклеточной метаболической гетерогенности.
Обсуждение
Глиобластомы известны своим уникальным опухолевым микроокружением, гипоксией, высокой гетерогенностью внутри опухоли и существенными различиями между опухолями разных пациентов. Именно поэтому при их исследовании важен переход от применения «устоявшихся» трансформированных глиомных линий и монослойных культур к использованию пациент-специфических моделей, приближенных по структуре к солидной опухоли [25, 26].
Краткосрочные клеточные культуры, полученные из операционного материала пациента, сохраняют молекулярный профиль и клеточную гетерогенность исходной опухоли, тем самым гораздо лучше отражая биологические свойства опухолей, чем коммерческие клеточные линии [27].
Получение культуры опухолевых клеток из опухоли пациента представляет собой сложную задачу из-за частой контаминации первичного материала и быстрого роста стромальных клеток. В литературе описано несколько методик получения временных опухолевых культур, основными среди которых являются прямое раскультивирование тканей опухоли (кусочками или клеточными взвесями) и использование ксенографтов, где в качестве первичного реципиента опухолевых клеток выступает организм животного [28, 29]. Значительным недостатком последнего метода является нежелательная селекция опухолевых клеток в организме животного. В связи с этим методика прямого раскультивирования опухолевых клеток признается более релевантной. Ткань для культивирования должна быть лишена некротических участков, по возможности стерильна и достаточно богата теми клетками, которые предполагается выращивать. В отличие от многих других типов опухолей глиомы характеризуются хорошим выходом жизнеспособных опухолевых клеток. Так что в случае глиальных опухолей, особенно глиобластом, вероятность получения первичных культур наиболее высока по сравнению с другими локализациями.
В результате исследования нами была разработана 3D-модель опухолевого сфероида на основе краткосрочной культуры, полученной из операционного материала от пациента, и проведено сравнение ее свойств со свойствами сфероидов из линейной культуры клеток глиобластомы. В литературных источниках для получения сфероидов из операционных образцов опухоли пациента в основном используют специально обработанные фрагменты опухоли диаметром 200–400 мкм, которые помещают в агар с питательной средой [30], либо сразу после ферментации образца клеточную суспензию помещают на пластик с низкоадгезивным дном, где сфероиды образуются спонтанно [31]. Для стандартизации ростовых свойств сфероидов в нашей работе была использована методика их выращивания на круглодонных низкоадгезивных планшетах из первичной клеточной культуры с фиксированным количеством клеток (2000 клеток в 200 мкл среды на лунку) для посадки, что позволило получить плотные многоклеточные структуры с воспроизводимым ростом на протяжении 7 дней.
При использовании линейных опухолевых культур количество клеток, помещенных в лунку для получения сфероидов, составляет обычно от 100 до 5000 клеток в зависимости от скорости их пролиферации [32–34].
В ходе исследования нами был выполнен анализ метаболических параметров в опухолевых сфероидах с помощью метода FLIM эндогенных коферментов НАД(Ф)Н и ФАД. Ввиду своей неинвазивности и отсутствия необходимости введения в клетку или ткань экзогенных красителей данный метод представляет собой мощный инструмент оценки метаболического статуса на клеточном уровне и уже зарекомендовал себя в исследованиях опухолевого метаболизма in vitro и in vivo [20–24]. Однако работы с применением метода FLIM на опухолевых сфероидах или подобных им структурах немногочисленны. Ранее [33] методом FLIM мы провели исследование метаболического статуса клеток опухолевых сфероидов, полученных из библиотечной линии рака шейки матки человека HeLa, и впервые продемонстрировали неоднородность клеточного метаболизма, обусловленную различной пролиферативной активностью клеток на периферии и в центре сфероида. Выявлено, что клетки периферии (зона активной пролиферации) сфероида имеют более гликолитический тип метаболизма, чем клетки центральной части (зона покоя). В настоящем исследовании метаболическая зональность в опухолевых сфероидах из клеток глиом отсутствовала, что может объясняться иными закономерностями их роста, например более умеренной скоростью роста или диффузным распределением пролиферирующих клеток.
В ряде работ метод FLIM применялся для оценки метаболических параметров опухолевых органоидов — многоклеточных 3D-структур из материала опухолей пациентов, содержащих различные типы клеток [13, 35, 36]. В недавнем исследовании M. Morelli с соавт. [13] модель органоидов из глиобластом пациентов в сочетании с FLIM была предложена для предсказания ответа на терапию темозоломидом. Cтоит отметить, что в отличие от сфероидов органоиды имеют неконтролируемые размеры и состав, что требует набора большего количества данных и затрудняет интерпретацию результатов. По нашим сведениям, работ по изучению метаболического статуса глиальных сфероидов на основе первичного материала с помощью метода FLIM не проводилось, что обусловливает актуальность и новизну поставленной в исследовании задачи.
Выполненное исследование показало, что опухолевые сфероиды из глиобластом пациентов практически не отличаются по оптическим метаболическим параметрам от сфероидов из библиотечной линии глиобластомы и адекватно реагируют на гипоксию изменением метаболического профиля на более гликолитический. В условиях гипоксии в сфероидах наблюдалось снижение относительного вклада связанной формы НАД(Ф)Н, ассоциированной с окислительным фосфорилированием. Состояние хронической гипоксии является характерной физиологической особенностью многих солидных опухолей, включая глиобластомы [37]. Гипоксия опосредованно воздействует на пути сигнальной трансдукции и регуляцию транскрипции ряда генов и белков, являясь таким образом независимым фактором опухолевой прогрессии [38]. В глиобластомах гипоксия коррелирует с устойчивостью к лучевой и химиотерапии. Наблюдение метаболических перестроек в условиях гипоксии при естественном росте и терапевтических воздействиях на клетки глиобластом в in vitro модели важно для понимания механизмов адаптации и развития резистентности опухолей.
FLIM-имиджинг метаболических кофакторов является высокочувствительным инструментом для оценки раннего ответа опухолевых клеток на химиотерапию. Нами и другими авторами это было продемонстрировано на различных опухолевых моделях in vitro и in vivo [20, 23, 24, 33, 39]. Перспективным приложением метода FLIM считается прогнозирование эффективности лекарственной терапии для пациентов путем оценки метаболических параметров выделенных из опухоли клеток после лекарственного воздействия на них в условиях in vitro. Созданная в нашем исследовании опухолевая модель на основе клеток глиобластом пациентов и методика метаболического имиджинга FLIM могут стать методологической основой для развития персонализированных подходов в терапии глиом.
Заключение
Созданная in vitro 3D-модель опухолевых сфероидов из клеток, выделенных из операционного материала глиобластом пациентов, позволила получить плотные сфероиды с устойчивым ростом, демонстрирующие высокую степень клеточной метаболической гетерогенности и адекватный ответ на гипоксию. Разработанная модель опухолевых сфероидов из глиобластомы пациентов в комбинации с методом FLIM может служить инструментом для исследования особенностей опухолевого метаболизма, прогнозирования эффективности противоопухолевой терапии для пациентов и доклинического тестирования новых лекарственных препаратов.
Финансирование исследования. Работа проведена при поддержке грантов Российского научного фонда №21-75-00098 (получение и охарактеризование первичных клеточных культур) и №22-64-00057 (FLIM-исследование сфероидов).
Конфликт интересов. У авторов нет конфликта интересов.
Литература
- Oronsky B., Reid T.R., Oronsky A., Sandhu N., Knox S.J. A review of newly diagnosed glioblastoma. Front Oncol 2020; 10: 574012, https://doi.org/10.3389/fonc.2020.574012.
- Zhang C., Jin M., Zhao J., Chen J., Jin W. Organoid models of glioblastoma: advances, applications and challenges. Am J Cancer Res 2020; 10(8): 2242–2257.
- da Hora C.C., Schweiger M.W., Wurdinger T., Tannous B.A. Patient-derived glioma models: from patients to dish to animals. Cells 2019; 8(10): 1177, https://doi.org/10.3390/cells8101177.
- Rybin M.J., Ivan M.E., Ayad N.G., Zeier Z. Organoid models of glioblastoma and their role in drug discovery. Front Cell Neurosci 2021; 15: 605255, https://doi.org/10.3389/fncel.2021.605255.
- Paolillo M., Comincini S., Schinelli S. In vitro glioblastoma models: a journey into the third dimension. Cancers (Basel) 2021; 13(10): 2449, https://doi.org/10.3390/cancers13102449.
- Haddad A.F., Young J.S., Amara D., Berger M.S., Raleigh D.R., Aghi M.K., Butowski N.A. Mouse models of glioblastoma for the evaluation of novel therapeutic strategies. Neurooncol Adv 2021; 3(1): vdab100, https://doi.org/10.1093/noajnl/vdab100.
- Browning A.P., Sharp J.A., Murphy R.J., Gunasingh G., Lawson B., Burrage K., Haass N.K., Simpson M. Quantitative analysis of tumour spheroid structure. Elife 2021; 10: e73020, https://doi.org/10.7554/elife.73020.
- Han S.J., Kwon S., Kim K.S. Challenges of applying multicellular tumor spheroids in preclinical phase. Cancer Cell Int 2021; 21(1): 152, https://doi.org/10.1186/s12935-021-01853-8.
- Yuzhakova D.V., Shirmanova M.V., Klimenko V.V., Lukina M.M., Gavrina A.I., Komarova A.D., Gorbachev D.A., Sapogova N.V., Lukyanov K.A., Kamensky V.A. PDT with genetically encoded photosensitizer miniSOG on a tumor spheroid model: a comparative study of continuous-wave and pulsed irradiation. Biochim Biophys Acta Gen Subj 2021; 1865(12): 129978, https://doi.org/10.1016/j.bbagen.2021.129978.
- Perche F., Torchilin V.P. Cancer cell spheroids as a model to evaluate chemotherapy protocols. Cancer Biol Ther 2012; 13(12): 1205–1213, https://doi.org/10.4161/cbt.21353.
- Zhu Y., Kang E., Wilson M., Basso T., Chen E., Yu Y., Li Y.R. 3D tumor spheroid and organoid to model tumor microenvironment for cancer immunotherapy. Organoids 2022; 1(2): 149–167, https://doi.org/10.3390/organoids1020012.
- Hofmann S., Cohen-Harazi R., Maizels Y., Koman I. Patient-derived tumor spheroid cultures as a promising tool to assist personalized therapeutic decisions in breast cancer. Transl Cancer Res 2022; 11(1): 134–147, https://doi.org/10.21037/tcr-21-1577.
- Morelli M., Lessi F., Barachini S., Liotti R., Montemurro N., Perrini P., Santonocito O.S., Gambacciani C., Snuderl M., Pieri F., Aquila F., Farnesi A., Naccarato A.G., Viacava P., Cardarelli F., Ferri G., Mulholland P., Ottaviani D., Paiar F., Liberti G., Pasqualetti F., Menicagli M., Aretini P., Signore G., Franceschi S., Mazzanti C.M. Metabolic-imaging of human glioblastoma live tumors: a new precision-medicine approach to predict tumor treatment response early. Front Oncol 2022; 12: 969812, https://doi.org/10.3389/fonc.2022.969812.
- Martínez-Reyes I., Chandel N.S. Cancer metabolism: looking forward. Nat Rev Cancer 2021; 21(10): 669–680, https://doi.org/10.1038/s41568-021-00378-6.
- Läsche M., Emons G., Gründker C. Shedding new light on cancer metabolism: a metabolic tightrope between life and death. Front Oncol 2020; 10: 409, https://doi.org/10.3389/fonc.2020.00409.
- Chae H.S., Hong S.T. Overview of cancer metabolism and signaling transduction. Int J Mol Sci 2022; 24(1): 12, https://doi.org/10.3390/ijms24010012.
- Tong Y., Gao W.Q., Liu Y. Metabolic heterogeneity in cancer: an overview and therapeutic implications. Biochim Biophys Acta Rev Cancer 2020; 1874(2): 188421, https://doi.org/10.1016/j.bbcan.2020.188421.
- Kim J., DeBerardinis R.J. Mechanisms and implications of metabolic heterogeneity in cancer. Cell Metab 2019; 30(3): 434–446, https://doi.org/10.1016/j.cmet.2019.08.013.
- Kolenc O.I., Quinn K.P. Evaluating cell metabolism through autofluorescence imaging of NAD(P)H and FAD. Antioxid Redox Signal 2019; 30(6): 875–889, https://doi.org/10.1089/ars.2017.7451.
- Shirshin E.A., Shirmanova M.V., Gayer A.V., Lukina M.M., Nikonova E.E., Yakimov B.P., Budylin G.S., Dudenkova V.V., Ignatova N.I., Komarov D.V., Yakovlev V.V., Becker W., Zagaynova E.V., Shcheslavskiy V.I., Scully M.O. Label-free sensing of cells with fluorescence lifetime imaging: the quest for metabolic heterogeneity. Proc Natl Acad Sci U S A 2022; 119(9): e2118241119, https://doi.org/10.1073/pnas.2118241119.
- Ouyang Y., Liu Y., Wang Z.M., Liu Z., Wu M. FLIM as a promising tool for cancer diagnosis and treatment monitoring. Nanomicro Lett 2021; 13(1): 133, https://doi.org/10.1007/s40820-021-00653-z.
- Blacker T.S., Mann Z.F., Gale J.E., Ziegler M., Bain A.J., Szabadkai G., Duchen M.R. Separating NADH and NADPH fluorescence in live cells and tissues using FLIM. Nat Commun 2014; 5: 3936, https://doi.org/10.1038/ncomms4936.
- Skala M.C., Riching K.M., Bird D.K., Gendron-Fitzpatrick A., Eickhoff J., Eliceiri K.W., Keely P.J., Ramanujam N. In vivo multiphoton fluorescence lifetime imaging of protein-bound and free nicotinamide adenine dinucleotide in normal and precancerous epithelia. J Biomed Opt 2007; 12(2): 024014, https://doi.org/10.1117/1.2717503.
- Alam S.R., Wallrabe H., Svindrych Z., Chaudhary A.K., Christopher K.G., Chandra D., Periasamy A. Investigation of mitochondrial metabolic response to doxorubicin in prostate cancer cells: an NADH, FAD and tryptophan FLIM assay. Sci Rep 2017; 7(1): 10451, https://doi.org/10.1038/s41598-017-10856-3.
- Boucherit N., Gorvel L., Olive D. 3D tumor models and their use for the testing of immunotherapies. Front Immunol 2020; 11: 603640, https://doi.org/10.3389/fimmu.2020.603640.
- Hirschhaeuser F., Menne H., Dittfeld C., West J., Mueller-Klieser W., Kunz-Schughart L.A. Multicellular tumor spheroids: an underestimated tool is catching up again. J Biotechnol 2010; 148(1): 3–15, https://doi.org/10.1016/j.jbiotec.2010.01.012.
- Abdolahi S., Ghazvinian Z., Muhammadnejad S., Saleh M., Asadzadeh Aghdaei H., Baghaei K. Patient-derived xenograft (PDX) models, applications and challenges in cancer research. J Transl Med 2022; 20(1): 206, https://doi.org/10.1186/s12967-022-03405-8.
- Yoshida G.J. Applications of patient-derived tumor xenograft models and tumor organoids. J Hematol Oncol 2020; 13(1): 4, https://doi.org/10.1186/s13045-019-0829-z.
- Chen C., Lin W., Huang Y., Chen X., Wang H., Teng L. The essential factors of establishing patient-derived tumor model. J Cancer 2021; 12(1): 28–37, https://doi.org/10.7150/jca.51749.
- Aaberg-Jessen C., Nørregaard A., Christensen K., Pedersen C.B., Andersen C., Kristensen B.W. Invasion of primary glioma- and cell line-derived spheroids implanted into corticostriatal slice cultures. Int J Clin Exp Pathol 2013; 6(4): 546–560.
- Witusik-Perkowska M., Rieske P., Hułas-Bigoszewska K., Zakrzewska M., Stawski R., Kulczycka-Wojdala D., Bieńkowski M., Stoczyńska-Fidelus E., Grešner S.M., Piaskowski S., Jaskólski D.J., Papierz W., Zakrzewski K., Kolasa M., Ironside J.W., Liberski P.P. Glioblastoma-derived spheroid cultures as an experimental model for analysis of EGFR anomalies. J Neurooncol 2011; 102(3): 395–407, https://doi.org/10.1007/s11060-010-0352-0.
- Stadler M., Scherzer M., Walter S., Holzner S., Pudelko K., Riedl A., Unger C., Kramer N., Weil B., Neesen J., Hengstschläger M., Dolznig H. Exclusion from spheroid formation identifies loss of essential cell-cell adhesion molecules in colon cancer cells. Sci Rep 2018; 8(1): 1151, https://doi.org/10.1038/s41598-018-19384-0.
- Lukina M.M., Dudenkova V.V., Ignatova N.I., Druzhkova I.N., Shimolina L.E., Zagaynova E.V., Shirmanova M.V. Metabolic cofactors NAD(P)H and FAD as potential indicators of cancer cell response to chemotherapy with paclitaxel. Biochim Biophys Acta Gen Subj 2018; 1862(8): 1693–1700, https://doi.org/10.1016/j.bbagen.2018.04.021.
- Shirmanova M.V., Druzhkova I.N., Lukina M.M., Matlashov M.E., Belousov V.V., Snopova L.B., Prodanetz N.N., Dudenkova V.V., Lukyanov S.A., Zagaynova E.V. Intracellular pH imaging in cancer cells in vitro and tumors in vivo using the new genetically encoded sensor SypHer2. Biochim Biophys Acta 2015; 1850(9): 1905–1911, https://doi.org/10.1016/j.bbagen.2015.05.001.
- Pasch C.A., Favreau P.F., Yueh A.E., Babiarz C.P., Gillette A.A., Sharick J.T., Karim M.R., Nickel K.P., DeZeeuw A.K., Sprackling C.M., Emmerich P.B., DeStefanis R.A., Pitera R.T., Payne S.N., Korkos D.P., Clipson L., Walsh C.M., Miller D., Carchman E.H., Burkard M.E., Lemmon K.K., Matkowskyj K.A., Newton M.A., Ong I.M., Bassetti M.F., Kimple R.J., Skala M.C., Deming D.A. Patient-derived cancer organoid cultures to predict sensitivity to chemotherapy and radiation. Clin Cancer Res 2019; 25(17): 5376–5387, https://doi.org/10.1158/1078-0432.ccr-18-3590.
- Sharick J.T., Walsh C.M., Sprackling C.M., Pasch C.A., Pham D.L., Esbona K., Choudhary A., Garcia-Valera R., Burkard M.E., McGregor S.M., Matkowskyj K.A., Parikh A.A., Meszoely I.M., Kelley M.C., Tsai S., Deming D.A., Skala M.C. Metabolic heterogeneity in patient tumor-derived organoids by primary site and drug treatment. Front Oncol 2020; 10: 553, https://doi.org/10.3389/fonc.2020.00553.
- Park J.H., Lee H.K. Current understanding of hypoxia in glioblastoma multiforme and its response to immunotherapy. Cancers Basel 2022; 14(5): 1176, https://doi.org/10.3390/cancers14051176.
- Sebestyén A., Kopper L., Dankó T., Tímár J. Hypoxia signaling in cancer: from basics to clinical practice. Pathol Oncol Res 2021; 27: 1609802, https://doi.org/10.3389/pore.2021.1609802.
- Shirmanova M.V., Druzhkova I.N., Lukina M.M., Dudenkova V.V., Ignatova N.I., Snopova L.B., Shcheslavskiy V.I., Belousov V.V., Zagaynova E.V. Chemotherapy with cisplatin: insights into intracellular pH and metabolic landscape of cancer cells in vitro and in vivo. Sci Rep 2017; 7(1): 8911, https://doi.org/10.1038/s41598-017-09426-4.