Современные технологии диагностики грибкового кератита (обзор)
Травмы и инфекционные заболевания глаз играют ведущую роль в развитии роговичной слепоты, ответственной за потерю зрения у 1,5–2 млн человек в год. На сегодняшний день вопрос о снижении заболеваемости грибковым кератитом стоит остро и требует решения повсеместно. Считается, что грибковое поражение роговицы вследствие травмы преимущественно характерно для развивающихся стран в связи с вовлечением населения в сельское хозяйство; в развитых странах к возникновению заболевания приводят такие достижения медицины, как контактная коррекция зрения и современные офтальмологические операции. Глубокое изучение патогенеза позволяет описать особенности действия грибковых ферментов, формирования биопленок и механизма резистентности грибов к антибиотикам, что, с одной стороны, объясняет агрессивность течения заболевания и трудности его обнаружения, а с другой — способствует поиску новых методов диагностики и лечения. Полиморфная клиническая картина грибкового кератита, многообразие и доступность антибиотиков в наши дни становятся помехой для быстрого выявления данной патологии. Препятствием для успешной борьбы с возрастающей заболеваемостью грибковым кератитом также является низкая осведомленность населения и поздние сроки обращения к офтальмологу. Несвоевременная диагностика, резистентность грибов к антибиотикам и отсутствие зарегистрированных противогрибковых офтальмологических препаратов в свою очередь объясняют низкую эффективность лечения, что приводит к снижению или потере зрения.
Существующие методы диагностики нуждаются в систематизации и подробном сравнении, выявлении преимуществ и недостатков каждого. В настоящем обзоре рассмотрены особенности возбудителей и их влияние на патогенез заболевания, описаны сложности диагностики грибкового кератита и возможные пути их преодоления с помощью новых разработок, а также намечены перспективы дальнейших исследований в данном направлении.
Введение
Грибковый кератит — это инфекционное заболевание, характеризующееся поражением роговицы патогенными грибами, тяжелым течением и высоким риском неблагоприятного исхода с потерей зрения или глаза как органа.
По выражению ряда микробиологов, медицинская микология долгое время играла роль Золушки в микробиологическом семействе [1, 2]. В последние годы на фоне широкого и зачастую нерационального применения антибиотиков, а также увеличения количества пациентов, получающих гормональную и иммуносупрессивную терапию, грибковые инфекции стали встречаться значительно чаще, а медико-социальный и медико-экономический ущерб от них вызывает большие опасения [3, 4]. Та же тенденция прослеживается и в отношении грибковых кератитов, доля которых среди общего числа инфекционных кератитов постепенно растет в течение последних десятилетий [5, 6]. Так, в 2017–2019 гг. заболеваемость микозами роговицы не падала ниже отметки в 1 млн случаев в год [7, 8]. Ежегодно патология роговицы приводит к потере зрения у 1,5–2 млн человек [9]. Наибольшее число случаев приходится на развивающиеся страны с жарким и влажным климатом, где значительная доля населения вовлечена в сельское хозяйство. Так, с 1990 по 2020 гг. лидирующими странами по заболеваемости грибковым кератитом были Парагвай, Эфиопия, Шри-Ланка, Бангладеш, Индия и Китай [10]. Кроме того, факторами риска являются офтальмологические операции и ношение мягких контактных линз (МКЛ). Если одно из этих событий приводит к инфицированию, запускается цепочка процессов, обусловливающих более глубокое повреждение роговицы. Патогенез грибкового кератита включает поражение роговицы непосредственно грибковым агентом и опосредованно — за счет бурно развивающейся воспалительной реакции.
Распространенность заболевания не всегда обеспечивает достоверность диагностики, особенно в регионах с низкой настороженностью врачей. Клиницисты из США установили, что американские офтальмологи правильно определили наличие инфекционного кератита в 73% случаев среди пациентов с положительным результатом посева, а грибковую этиологию идентифицировали лишь в 38% случаев [11]. Стертая клиническая картина и отсутствие патогномоничных признаков ограничивают возможности раннего выявления и своевременного назначения специфического лечения.
Разнообразие грибковой инфекции, сложность диагностики, отсутствие официнальных офтальмологических препаратов, универсальных схем терапии и способов доставки препаратов объясняют как частую необходимость хирургического вмешательства, так и высокие риски снижения и потери зрения: ежегодно в связи с осложнениями грибкового кератита удаляют 84 143–115 697 глаз [8]. По данным литературы, перфорация роговицы в связи с грибковой инфекцией развивается в 6 раз чаще, чем при кератитах другой этиологии [12, 13], значительно чаще требуется кератопластика [14]. Чтобы избежать этих неблагоприятных последствий, постоянно ведутся поиски нового оптимального метода диагностики, поскольку посев грибковой культуры и прямая микроскопия окрашенных мазков, являющиеся «золотым стандартом», соответствуют не всем современным требованиям. Метод должен быть достаточно простым и независимым от опыта специалиста, доступным по стоимости, должен быстро и точно определять этиологический фактор. Подобный метод в сочетании с анализом на чувствительность к антибиотикам позволит выбрать дальнейшую тактику и улучшить прогноз.
Стратегия поиска литературы. Поиск работ проводился в базах PubMed (MEDLINE) и eLIBRARY.RU с использованием ключевых слов «микоз роговицы» («keratomycosis») или «грибковый кератит» («fungal keratitis»), «грибковые заболевания» («fungal diseases») и «глаз» («eye»). Тематические публикации выявляли при просмотре списков литературы соответствующих статей.
Этиология
Царство грибов включает в себя более 1,5 млн видов, и лишь некоторые из них известны как патогенные для человека. Классификация грибов, ранее основанная на морфологических признаках, в последние годы претерпела существенные изменения, связанные с тем, что в ее основу легли генотипические различия. В результате произошла значимая перегруппировка видов между известными типами грибов. Клиническое значение имеет разделение патогенных грибов по морфологии на нитчатые и дрожжевые, а также по месту их естественного обитания — на зоофильные, геофильные и антропофильные. Средой обитания последних является тело человека, и многие из них способны вызвать кератит. Следует выделить наиболее часто встречаемые, а соответственно, и более значимые для клиницистов патогенные грибы. При анализе клинических случаев грибкового кератита за последние 20 лет род Fusarium был обнаружен в 40% случаев, род Aspergillus — в 31%, Curvularia — в 6%, а дрожжевой гриб рода Candida стал причиной заболевания в 4,5% случаев (из них C. albicans составил 67,87%) [10]. Спектр и соотношение этиологических факторов меняются от региона к региону даже в пределах одной страны. В отдельных исследованиях встречаемость рода Fusarium достигала 61,9% [15], а Candida — 72,22% [16]. При этом пациенты предъявляют сходные жалобы: ощущение инородного тела, слезотечение, светобоязнь, покраснение глаза, затуманивание и снижение зрения [17]. Ни один из симптомов не является патогномоничным для грибкового кератита, и отличить его от инфекции другой этиологии часто не представляется возможным из-за схожей клинической картины [18]. Сложность определения этиологического фактора и широкое разнообразие возбудителей создают трудности в диагностике и подборе этиотропной терапии, в связи с этим врачам во многом приходится ориентироваться на данные тщательно собранного анамнеза и выявлять характерные факторы риска.
Факторы риска
Считается, что здоровая роговица устойчива к инфицированию грибковыми агентами, а значит, необходимы факторы, способствующие заражению и приводящие к развитию инфекции [19].
Факторы риска грибкового кератита:
травмы глаза — от 26% [20] до 39% [21] случаев;
оперативные вмешательства на роговице — 37,6% [22];
использование контактных линз — от 24,5% [23] до 42% [20];
заболевания роговицы — от 28% [23] до 51,3% [22];
системная и местная иммуносупрессия — 35,9% [22].
Как правило, грибковой инфекции предшествует механическое повреждение роговицы, поэтому наиболее распространенными факторами риска являются травмы и вмешательства с нарушением ее целостности. Наиболее опасны травмы предметами органической и неорганической природы (ветками, листьями, камнями, песком) с попаданием частиц почвы. Контактная коррекция нередко сопровождается микротравмами, особенно при несоблюдении правил использования МКЛ; постоянное ношение линз также вызывает локальные гипоксию и гиперкапнию, которые влияют на способность эпителия реагировать на повреждение [24]. Возрастает число зарегистрированных фузариозных кератитов у пациентов, использующих МКЛ [25, 26], а редкие случаи кератита, вызванные оппортунистом Arthrograthis kalrae, в абсолютном большинстве связаны с контактной коррекцией [27]. По результатам одного из исследований, применение МКЛ чаще ассоциировалось с кератитом, вызванным нитевидными грибами (50%), чем дрожжевыми (18,2%), а заболевания глазной поверхности были распространенным фактором риска при любой этиологии [22]. Из числа офтальмологических операций наибольшую опасность для возникновения грибкового кератита создает сквозная кератопластика [28], причем грибковый кератит может рецидивировать в трансплантате [29]. Интересно, что различные варианты послойной кератопластики имеют больший риск микотических осложнений (0,023% [30]) по сравнению со сквозной кератопластикой (от 0,012 [30] до 0,016% [31]). В ходе наблюдений замечено, что грибковый кератит осложняет восстановление после трансплантации эндотелия и десцеметовой мембраны не только в раннем постоперационном периоде (0,15% случаев [32]), но и спустя несколько лет после операции [32, 33]. Описаны случаи осложнений после имплантации бостонского кератопротеза 1-го типа (kpro) [34].
Стоит заметить, что и более щадящие вмешательства не гарантируют отсутствия осложнений. M. Soleimani и A.A. Haydar [35] столкнулись со случаем тяжелого одностороннего грибкового кератита через четыре дня после лазерной коррекции зрения по методике SMILE, известной своей малой инвазивностью. Сформировавшаяся язва не поддавалась медикаментозному лечению и требовала сквозной кератопластики в связи с перфорацией. Из-за интрастромального расположения лентикулы и, как следствие, быстрого распространения инфекции в глубокие слои роговицы лечение инфекционного кератита после SMILE оказалось наиболее сложным [35].
Серьезным фактором риска развития грибковых поражений роговицы считается применение местных антибиотиков и кортикостероидов [36]. Ингибируя воспалительный процесс, кортикостероиды усугубляют иммуносупрессивный эффект, оказываемый грибами. Вначале возможен промежуток мнимого улучшения от использования кортикостероидов, но вскоре наблюдается ухудшение: инфильтрация роговицы нарастает, количество секрета увеличивается, зрение снижается [37]. Кроме того, применение кортикостероидов после операции по поводу грибкового кератита в ряде случаев приводит к развитию реинфекции [35].
В зависимости от вида инфекционного агента и способа его попадания в толщу роговицы патогенез грибкового кератита может иметь некоторые особенности, однако во всех случаях это комплексный процесс, обусловленный множеством факторов.
Патогенез
Борьба между грибковым микроорганизмом и иммунной системой макроорганизма часто приобретает ожесточенный характер, поскольку факторы патогенности грибов разнообразны, а иммунный ответ не всегда соответствует им. Патогенность микроорганизма и биологическая нагрузка являются ведущими факторами, определяющими тяжесть течения кератита [38].
Грибы попадают в толщу роговицы через дефект эпителия и выделяют микотоксины, протеазы и лектины. Иммунные клетки идентифицируют чужеродный агент с помощью рецепторов опознавания паттерна, после чего нейтрофилы, макрофаги и дендритные клетки начинают активно секретировать хемокины (CXCL1 и CXCL2) и провоспалительные цитокины (IL-1b и TNF), которые привлекают все больше иммунных клеток в роговицу с целью элиминации патогена [39]. Избыточное число нейтрофилов и нарастающее воспаление обусловливают прогрессирование кератита, что ведет к поражению стромы и помутнению роговицы [40, 41], т.е. возникает порочный круг, где воспаление становится причиной дальнейшего повреждения тканей и потери зрения.
Факторы патогенности грибов. Микотоксины, выделяемые грибами, обладают антибактериальным, противовирусным, противоопухолевым и антифагоцитарным действием, угнетают местный иммунный ответ. Многие грибы секретируют протеазы: например, род Candida продуцирует кислые, нейтральные и карбоксильные протеазы, которые повышают способность гриба к инвазии [42]. Лектины в свою очередь угнетают рост клеток роговицы и разрушают клеточный каркас эпителия [43].
Гидрофобин — это нерастворимый протеиновый комплекс на поверхности спор, который наряду с микотоксинами затрудняет фагоцитоз, так как наличие гидрофобина предотвращает распознавание грибов клетками иммунитета [44].
Отдельно стоит отметить способность многих родов грибов к образованию биопленок [45], которые на сегодняшний день выделяют как отдельный патогенетический фактор [46]. Биопленки — это постоянно обновляющееся сообщество микроорганизмов, закрепленных на субстрате и окруженных полимерным матриксом, который защищает их от вредных воздействий [47–49]. Так, грибы рода Fusarium зачастую формируют биопленки на поверхности МКЛ [50], что и обусловливает распространенность фузариозных кератитов при использовании контактной коррекции. Подобная структура биопленок обеспечивает защиту от факторов окружающей среды, повышает устойчивость патогена к иммунной защите и противогрибковым средствам, облегчает адгезию, инвазию и распространение инфекции в тканях хозяина [46]. На примере C. albicans показано, что биопленочные формы подавляют высвобождение нейтрофильных внеклеточных ловушек и противостоят нейтрофильной атаке [51]. Исследования доказали, что биопленки обусловливают повышение минимальной ингибирующей концентрации (МИК) противогрибковых препаратов (иногда МИК превышает таковые для планктонных форм в 100 и более раз) и играют роль в формировании резистентности [45, 52]. Антимикотиков, способных воздействовать на биопленки, немного, и все они индуцируют образование активных форм кислорода (АФК) [50].
Вероятно, именно способность грибов к угнетению иммунного ответа объясняет, почему в некоторых наблюдениях количество воспалительных клеток в роговице обратно пропорционально грибковой обсемененности, а в ходе разрастания гриба воспалительный процесс ослабевает [17, 53]. На фоне столь значимых особенностей патогенеза использование местных кортикостероидов приводит к затяжному течению и присоединению вторичной инфекции в случае хирургического лечения [35].
Факторы защиты макроорганизма. Повышенная экспрессия рецепторов распознавания паттерна в ответ на попадание чужеродного агента приводит к секреции интерлейкинов IL-1b, IL-6, IL-8, IL-17 и IL-23 нейтрофилами [54]. IL-1b способствует образованию АФК, замедляющих рост грибковых гиф. При этом АФК индуцируют продукцию IL-1b в еще большем количестве и могут повреждать окружающие ткани. Замечено, что некоторые грибы при оксидативном стрессе начинают синтезировать антиоксиданты и преодолевают этот защитный механизм [55]. Как следствие, нарастает уже имеющееся воспаление [56].
Доказано, что при инфицировании некоторыми грибами, в частности C. albicans и видами Aspergillus, запускается процесс аутофагии, представляющий собой деградацию органелл и белков в эукариотических клетках и являющийся регулятором внутриклеточного гомеостаза [57, 58]. Аутофагия уменьшает хемотаксис нейтрофилов и повреждающее действие патогена, способствует удалению внутриклеточных патогенов и ослабляет воспалительную реакцию в целом, в связи с чем этому процессу отводится ключевая роль в иммунном ответе [57].
Особенности патогенеза в зависимости от этиологии. Род Fusarium как представитель нитчатых грибов характеризуется «горизонтальным» ростом гиф параллельно коллагеновым волокнам, что приводит к поражению поверхностных слоев роговицы, тогда как для рода Aspergillus и дрожжей Candida более характерен «вертикальный» рост перпендикулярно коллагеновым волокнам, вследствие чего нарушается нормальное расположение волокон коллагена, а возбудитель проникает в глубокие слои стромы [59, 60]. Особенностью Candida считается продукция фосфолипазы А, облегчающей проникновение в ткани, и лизофосфолипазы, защищающей клетки дрожжей от действия других ферментов [61]. Нитчатые грибы размножаются в строме роговицы без высвобождения хемотаксических веществ, что опять же задерживает развитие иммунного ответа. При прогрессировании заболевания грибы проникают и сквозь ранее интактную десцеметову мембрану [42, 62]. Более того, грибковый кератит может возникать вторично по отношению к грибковому эндофтальмиту. В этом случае поражение начинается из заднего сегмента, патоген преодолевает десцеметову мембрану и поражает строму роговицы [63]. Таким образом, «горизонтальный» рост и защита от иммунного ответа при кератите, вызванном нитчатыми грибами, связаны с менее благоприятным исходом, в связи с чем чаще требуется хирургическое лечение [64]. В частности, исследования показывают, что однократное оперативное вмешательство может быть недостаточным при поражении нитчатыми грибами. Описаны случаи лечения язв роговицы, вызванных видами Aspergillus, когда сквозную кератопластику приходилось повторять до 4 раз по причине появления грибковых инфильтратов в кератотрансплантате или возникновения эндофтальмита [65].
Особенности патогенеза являются ключом для своевременной диагностики и идентификации возбудителя, что в дальнейшем способствует назначению адекватной этиотропной терапии в достаточной дозировке.
Диагностика
Установление этиологии кератита является необходимым условием для определения тактики и прогноза лечения, в то время как видовая идентификация конкретного патогена имеет второстепенное значение. Построенное с подобных позиций исследование продемонстрировало, что практикующим офтальмологам удается безошибочно дифференцировать грибковый и бактериальный кератит по фотографиям только в 66% случаев [66]. К причинам поздней диагностики относят отсутствие патогномоничных симптомов, нередко — вялое течение и стертую клиническую картину, способность маскироваться под кератиты другой этиологии. Зачастую грибковый кератит может быть принят пациентом за конъюнктивит, за чем следует самостоятельное лечение с применением антибиотиков и противовоспалительных средств для быстрого купирования симптомов. Даже в странах Африки с лидирующим числом случаев микотических поражений роговицы поступление больных к специалисту откладывается в среднем на 14 дней, а при посещении нескольких медицинских учреждений задержка составляет в среднем 21 день [67]. Промедление снижает шансы на своевременную диагностику и лечение. Так, описан случай тяжелого торпидного течения болезни в Казахском научно-исследовательском институте глазных болезней, куда пациентка поступила через 4 мес после получения травмы хвостом коровы. Несмотря на комплексное лечение, в течение месяца сохранялась угроза перфорации, в исходе сформировалось тотальное помутнение роговицы [68]. Подобные примеры указывают на важность повышения осведомленности пациентов и укрепления их доверия врачам.
Ведущую роль в раннем выявлении грибкового кератита играют настороженность и опыт врача, а также оснащение клиники. На актуальность проблемы указывают работы по созданию и тестированию разнообразных методов диагностики. Острота проблемы в тропических странах привела к созданию экспресс-метода, основанного на использовании складного микроскопа на базе смартфона как альтернативы световому микроскопу в областях с ограниченными ресурсами [69].
Биомикроскопия. Выделяют несколько признаков, по которым можно заподозрить грибковое поражение роговицы при биомикроскопии [70–72]:
облаковидные или творожистые многоочаговые сероватые инфильтраты с перистыми или фестончатыми границами;
сателлитные инфильтраты, расположенные вблизи основного очага и отделенные от него прозрачным участком [42];
кольцевидные инфильтраты;
мицелий-подобные стромальные разрастания;
эндотелиальные бляшки (не визуализируются при выраженной инфильтрации роговицы) [73].
Помимо проявлений, характерных для большинства грибковых кератитов, следует отметить зазубренные или «перистые», нечеткие края у фузариозных язв и приподнятую поверхность очагов аспергиллезного кератита, который чаще сопровождается гипопионом [74]. В случае стромального кератита, вызванного дрожжеподобными грибами, можно увидеть небольшой проминирующий шаровидный инфильтрат [75].Ни один из признаков не является патогномоничным для грибкового кератита, к примеру, кольцевидные инфильтраты характерны и для акантамебного кератита [76–78]. На сегодняшний день ведущими методами диагностики остаются культуральный метод и прямая микроскопия соскоба роговицы с применением красителей.
Культуральный метод. Посев биологического материала производится на питательную среду с целью культивирования микроорганизмов и дальнейшей оценки полученной колонии. Материал для посева может быть взят при соскобе роговицы, биопсии или при сквозной кератопластике. Далее образец засевают на питательную среду, в частности на жидкую глюкозо-пептонную среду Сабуро или кровяной и шоколадный агары, агар с сердечно-мозговой вытяжкой [79]. По особенностям внешнего вида колоний (цвет, форма, консистенция, наличие спор, гиф и псевдогиф) определяют родовую и иногда — видовую принадлежность возбудителя. Метод считается «золотым стандартом» диагностики, достаточно прост и не требует больших затрат, но все же имеет некоторые ограничения: сложность видовой диагностики, поздние сроки получения результатов посева (около недели) [80, 81], зависимость от опыта исследователя, нетипичная морфология некоторых колоний, нехватка знаний о подходящих условиях культивирования, недоступность стромальных слоев при соскобе роговицы в случае глубокого проникновения грибов [82], ложноотрицательные результаты посева в случае недостаточного размера соскоба или прогрессирования деструкции роговицы, влияние на результаты посева предшествующей эмпирической терапии [83]. Так, в одном из исследований у 37% пациентов с грибковым кератитом были получены отрицательные результаты посева и неустановленные лабораторные диагнозы, причиной этому посчитали предшествующую антибиотикотерапию до поступления в больницу [84]. Стоит отметить, что при обнаружении положительной культуры идентифицировать возбудителя удается только в 40–60% случаев [17].
На данный момент рекомендуется проведение повторного посева через шесть дней от начала этиотропной терапии для оценки эффективности лечения и уточнения прогноза [85]. Обнаружено, что при положительном повторном посеве повышается риск перфорации и возрастает необходимость в проведении сквозной кератопластики. Таким образом, посев через шесть дней от начала лечения может помочь скорректировать терапию, избежать критического снижения остроты зрения и оперативного лечения [86].
Прямая микроскопия с окрашиванием. Метод отличается простотой и быстротой. Используют различные способы окраски образца: окрашивание по Граму и по Гимзе, фиксация раствором гидроксида калия, окрашивание лактофенолом хлопковым голубым, реактивом Шиффа, окрашивание по Гомори (метенамином-серебром) [85, 87]. Материалом также могут быть соскоб роговицы, биоптат или фрагмент роговицы, взятый при сквозной кератопластике.
Благодаря окрашиванию при прямой микроскопии удается визуализировать гифы и их взаимное расположение, оценить вид мицелия [87]. Чувствительность метода колеблется в зависимости от способа окрашивания и в среднем достигает 90% [85, 88]. Будучи дешевой, простой и быстрой в исполнении, микроскопия позволяет незамедлительно назначить этиотропную терапию [85]. Как и культуральный метод, микроскопия является основополагающим этапом в диагностике, однако также имеет ряд недостатков. Успех применения данного метода зависит от глубины поражения роговицы, от количества и качества забранного материала, от опыта исследователя. Высока также вероятность неравномерного окрашивания препарата и обнаружения артефактов, кроме того, метод часто безуспешен в отношении рода Candida [85, 87].
Конфокальная микроскопия. Конфокальная микроскопия обеспечивает in vivo визуализацию дрожжевых и плесневых грибов в ткани роговицы. Данный метод имеет преимущества в связи с неинвазивностью и способностью преодолевать многие ограничения классических методик, а его чувствительность варьирует в пределах от 66,7 до 95,0% [89]. Убедительными критериями для подтверждения поражения роговицы мицелиальными грибами при конфокальной микроскопии считаются четко очерченные, ветвящиеся, сильно отражающие нити или гифы диаметром 3–10 мкм, обычно не наблюдаемые по отдельности. В случае дрожжевых грибов визуализируют псевдогифы, представляющие точечные структуры с разрывами или сужениями [89]. Конфокальная микроскопия также позволяет определять плотность гиф, а оценка в динамике помогает прогнозировать ответ на лечение, так как в ходе успешной терапии плотность гиф снижается [90]. Этот метод дает более быстрый, а в ряде исследований — и более точный результат, чем микроскопия мазка и посев. X. Jin с соавт. [73] установили, что диагностика грибкового кератита с помощью конфокальной микроскопии имеет успех в 92,9% случаев, при исследовании мазков — в 71,4%, а при помощи посева — в 42,9% случаев. Результаты конфокальной микроскопии подтверждены микроскопией окрашенной ткани роговицы. В некоторых случаях и посев, и полимеразная цепная реакция (ПЦР) уступают конфокальной микроскопии, и это свидетельствует, что метод может быть использован для ранней экспресс-диагностики [91]. В то же время Z. Ren с соавт. [83] обнаруживали грибковые патогены как с помощью конфокальной микроскопии, так и при исследовании мазка в 77,14% случаев, что указывает на наличие ограничений данного метода диагностики. К лимитирующим факторам относят невозможность видовой идентификации возбудителя, высокую стоимость, недостаточный опыт офтальмологов, проводящих исследование [92, 93], и малый размер образца [94]. Сильно затрудняют процедуру светобоязнь и блефароспазм [95].
Оптическая когерентная томография (ОКТ). С помощью этого метода можно обнаруживать характерные для микотического процесса изменения роговицы. По данным ОКТ, в области инфильтрата роговица утолщена, отмечается гиперрефлективность эпителия и эндотелия по сравнению со стромой. Строма диффузно утолщается, что свидетельствует об отеке, который в свою очередь приводит к изменению контура задней поверхности роговицы. При длительном течении развиваются рубцовые процессы, повышающие рефлективность стромы; пораженная роговица при этом может стать тоньше здоровых участков [20]. Специфическим ОКТ-признаком агрессивных форм грибкового кератита являются ограниченные, разного размера кистозные образования в строме, соответствующие некротизированным тканям [96].
С помощью ОКТ и конфокальной микроскопии более чем в 85% случаев можно визуализировать эндотелиальные бляшки, характерные для грибкового кератита [73] и трудно различимые при осмотре на щелевой лампе, особенно в условиях отека и инфильтрации роговицы [6]. Этот метод — быстрый, неинвазивный и более распространенный, чем конфокальная микроскопия. Признаки поражения роговицы являются только косвенным свидетельством присутствия грибкового патогена, вследствие чего судить о видовой принадлежности не представляется возможным, но стоит заметить, что ОКТ удобна для оценки состояния роговицы в динамике, позволяет отследить изменения по всей толщине роговицы.
Полимеразная цепная реакция. ПЦР-диагностика относится к методам молекулярно-генетической диагностики и не уступает или даже превосходит микроскопию окрашенных препаратов и культуральные методы, обнаруживая фрагменты ДНК грибов даже в случаях с отрицательным посевом [81, 97].
Преимущества ПЦР неоспоримы: получить результаты возможно уже через 4 ч вместо 3–7 дней при культуральных исследованиях; метод обладает высокой чувствительностью, что позволяет обнаружить патоген даже в небольшом соскобе с язвы роговицы или в материале от больных, ранее получавших противогрибковую терапию [81]. Как и другие молекулярно-генетические методы, ПЦР рассчитана на определение видовой принадлежности. Однако ее не рассматривают в качестве метода выбора в силу ограниченной доступности и высокой стоимости [98], более того, велика вероятность ложноположительного результата в связи с тем, что ПЦР обнаруживает и нежизнеспособные организмы [79].
Другие молекулярно-генетические методы. Еще более прогрессивным и точным методом является метагеномное исследование с преимущественной оценкой РНК и возможностью определения видового состава образца. C. Shigeyasu с соавт. [99] представили случай, когда образцы роговицы показывали отрицательные результаты при микробиологическом и гистологическом исследованиях, и лишь при помощи метагеномного анализа удалось обнаружить гены Fusarium solani. В другом исследовании микроскопия окрашенных препаратов показала чувствительность 70%, посев был положительным у 52% пациентов, а метагеномный анализ установил наличие патогена в 74% случаев, и это с учетом факта, что более половины больных уже получали лечение [100]. Данный метод превосходит классические даже при обильной контаминации образца [100].
К молекулярно-генетическим методам также относится масс-спектрометрия, основанная на анализе рибосомальных белков микроорганизма. Масс-спектрометрия с матричной лазерной десорбцией/ионизацией (MALDI-TOF MS) позволяет идентифицировать возбудителя вплоть до вида в течение суток, что является неоспоримым преимуществом [21]. Для анализа используется слеза из пораженного и из здорового глаза для оценки ее белкового состава, так как при грибковых поражениях содержание белков изменяется специфическим образом [96]. Исследования чувствительности MALDI-TOF MS показывают противоречивые результаты, колеблясь в пределах от 51% [21] до 97% [87]. Малодоступность, дороговизна и необходимость постоянно пополнять банк данных протеомов микроорганизмов не позволяют сделать метод основным в диагностике грибкового кератита [101].
Ren с соавт. [83] представили первые результаты применения нового метода секвенирования внутренним транскрибируемым спейсером, или ITS-секвенирования. ITS — некодирующая последовательность ДНК, разделяющая повторяющиеся гены рРНК. Метод не ограничивается средой, временем, активностью грибов и размером образца, а также позволяет получать более полную информацию о микробиоме глаза. ITS-секвенирование показало результат, сравнимый с классическими методами и конфокальной микроскопией. Средние показатели эффективности в сочетании с рядом недостатков ITS-секвенирования, к которым относят зависимость от целостности базы данных, необходимость использования нескольких праймеров из-за их строгой специфичности для отдельных видов грибов, позволяют сделать вывод, что метод представляется необязательным дополнением для идентификации грибковых патогенов при диагностике грибкового кератита [83].
Несмотря на наличие широкого спектра известных диагностических технологий, ни один из методов не удовлетворяет всем требованиям клинической практики (см. таблицу), в связи с этим разработки новых подходов к выявлению грибкового кератита продолжаются [87]. В исследованиях in vivo на мышиной модели аспергиллезного кератита был протестирован неинвазивный зонд, состоящий из противогрибкового препарата в сочетании с флуорофорной меткой. Каспофунгин (CSF), антибиотик класса эхинокандинов, нацелен на специфичный для грибов фермент β-1,3-D-глюкансинтазу, отвечающий за биосинтез грибковой клеточной стенки. Препарат используется в субтерапевтических дозах для местного применения, что не дает измеримых системных концентраций. В качестве метки использовали 7-амино-9H-(1,3-дихлор-9,9-диметилакридин-2-он) — DDAO. Таким образом, связанные с зондом (L-CSF–DDAO) клетки флуоресцируют и могут быть визуализированы в ближней инфракрасной области. По результатам исследования in vitro L-CSF–DDAO легко выявлял элементы гиф Aspergillus spp., в то время как по отдельности CSF и DDAO не вызывали заметной флуоресценции. Анализ in vivo подтвердил способность зонда специфически связываться с грибковыми клетками в инфицированной роговице [102]. Каспофунгин доступен в форме раствора для инфузий и используется для лечения грибковых инфекций (в том числе кератитов), вызванных Candida spp. и Aspergillus spp., особенно резистентных к другим лекарственным средствам. Эффективность в отношении Fusarium spp. ограничена, а значит, возникает вопрос о возможности применения нового метода диагностики в случае фузариозных кератитов.
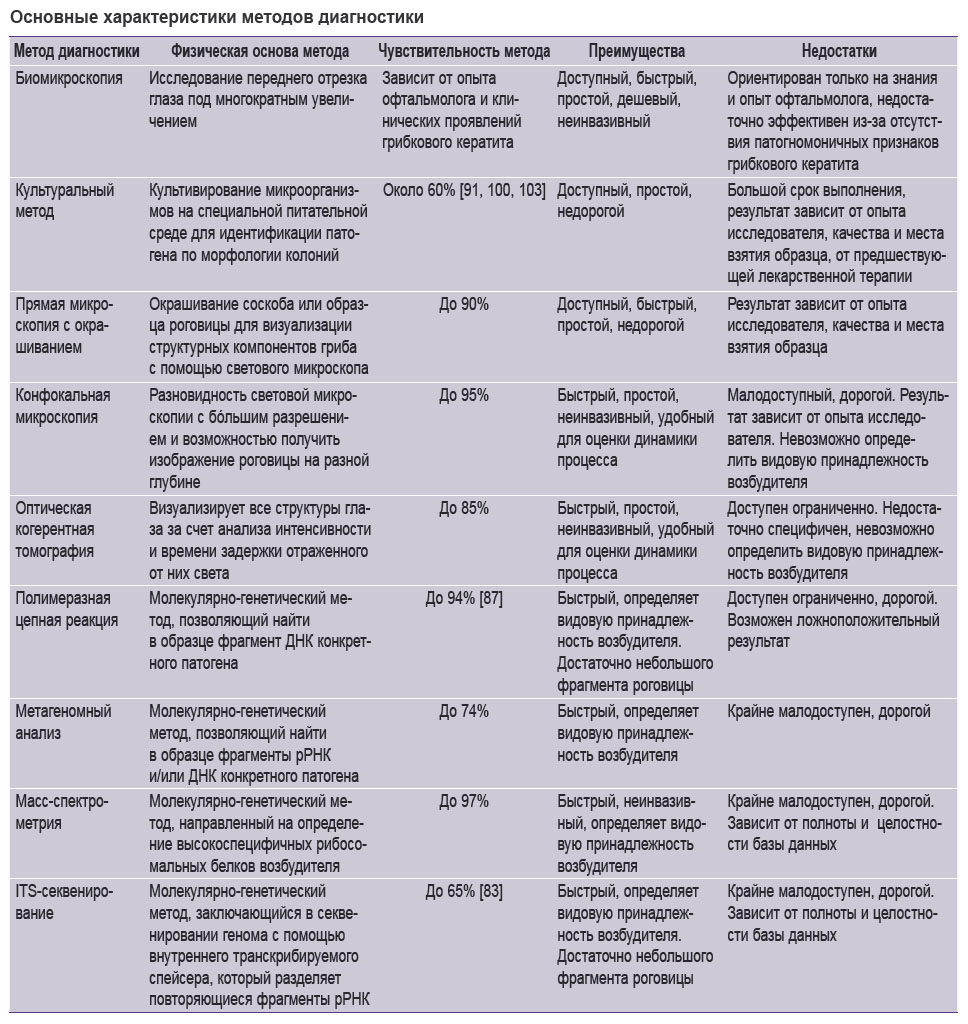
|
Основные характеристики методов диагностики |
Анализ антимикробной чувствительности
Как бы быстро и точно ни был установлен возбудитель, при лечении грибкового кератита специалисту нередко приходится встречаться с препятствием для достижения благоприятного исхода — резистентностью грибов к антимикотикам. В превалирующем большинстве случаев формируется приобретенная резистентность, и в настоящее время она возрастает в связи с неконтролируемым использованием антибиотиков, назначением неадекватной эмпирической терапии. Грибы выработали множество приспособительных механизмов для сопротивления действию противогрибковых препаратов. В частности, они могут создать специальные транспортные системы в мембранах своих клеток для усиления выведения препарата из цитоплазмы или изменить конфигурацию мембраны, чтобы препарат не смог с ней связаться. Для противостояния действию антимикотиков группы полиенов, взаимодействующих с эргостеролом гриба, мицелий синтезирует клеточную стенку со сниженным содержанием эргостерола [104].
Подобные механизмы либо способствуют возникновению полной резистентности, либо приводят к увеличению МИК препаратов, в итоге использование ранее эффективного антимикотика не приводит к значительному улучшению, а микроорганизмы продолжают наращивать резистентность. Все это свидетельствует о необходимости проведения теста на чувствительность к противомикробным препаратам и определения МИК после выявления грибковой этиологии. Описан ряд клинических случаев, в которых подобный анализ имел ключевое значение, поскольку своевременная замена неэффективного антимикотика является залогом успешной профилактики перфорации роговицы [105]. Данные наблюдения напоминают о важности культуральных методов для лечения грибкового кератита и о рисках при назначении эмпирической терапии. Более того, факт нарастающей резистентности говорит о необходимости разработки немедикаментозных методов лечения как альтернативы фармакотерапии.
Заключение
Существующие методы диагностики грибкового кератита позволяют офтальмологам обнаружить то, что незаметно при рутинном осмотре. При этом культуральный метод и прямая микроскопия с окрашиванием как методы «золотого стандарта» зачастую оказываются недостаточными для своевременного обнаружения грибкового кератита, что связано с особенностями патогенеза в каждом отдельном случае. Растущая заболеваемость, медико-социальная и медико-экономическая значимость становятся стимулом для поиска новых методов диагностики. Формулировка требований к ним, выявление преимуществ и недостатков каждого подхода ведет исследователей к понимаю того, каким должен быть новый претендент на звание «золотого стандарта». В последние годы увеличивается частота применения методов ПЦР-диагностики, в некоторых областях медицины она успешно вошла в рутинную практику. На наш взгляд, ПЦР-диагностика является одним из наиболее перспективных методов выявления грибкового кератита, так как результаты можно получить уже через 4 ч, чувствительность метода достигает 94%, а также есть возможность определить вид патогенного гриба. Однако наряду с современными методами диагностики культуральный метод и прямая микроскопия не теряют своей актуальности в связи с их высокой доступностью и простотой.
Вклад авторов: А.В. Ситнова — сбор и анализ материала, написание текста, утверждение версии, подлежащей публикации; С.Н. Светозарский — концепция и дизайн работы, сбор и анализ материала, написание и редактирование текста, утверждение версии, подлежащей публикации.
Финансирование. Работа выполнена при финансовой поддержке Правительства Нижегородской области, в рамках конкурса на право получения гранта Нижегородской области в сфере науки, технологий и техники в 2022 г. (договор №316-06-16-16а/22 от 20.05.2022).
Конфликт интересов отсутствует.
Литература
- Маянский А.Н. Патогенетическая микробиология. Нижний Новгород: Издательство НижГМА; 2006; 520 с.
- Mencl K. Medical mycology — the Cinderella of the microbiology family. Klin Mikrobiol Infekc Lek 2007; 13(4): 135.
- Vallabhaneni S., Mody R.K., Walker T., Chiller T. The global burden of fungal diseases. Infect Dis Clin North Am 2016; 30(1): 1–11, https://doi.org/10.1016/j.idc.2015.10.004.
- Benedict K., Jackson B.R., Chiller T., Beer K.D. Estimation of direct healthcare costs of fungal diseases in the United States. Clin Infect Dis 2019; 68(11): 1791–1797, https://doi.org/10.1093/cid/ciy776.
- Lin I.H., Chang Y.S., Tseng S.H., Huang Y.H. A comparative, retrospective, observational study of the clinical and microbiological profiles of post-penetrating keratoplasty keratitis. Sci Rep 2016; 6: 32751, https://doi.org/10.1038/srep32751.
- Bograd A., Seiler T., Droz S., Zimmerli S., Früh B., Tappeiner C. Bacterial and fungal keratitis: a retrospective analysis at a university hospital in Switzerland. Klin Monatsbl Augenheilkd 2019; 236(4): 358–365, https://doi.org/10.1055/a-0774-7756.
- Bongomin F., Gago S., Oladele R., Denning D. Global and multi-national prevalence of fungal diseases — estimate precision. J Fungi (Basel) 2017; 3(4): 57, https://doi.org/10.3390/jof3040057.
- Brown L., Leck A.K., Gichangi M., Burton M.J., Denning D.W. The global incidence and diagnosis of fungal keratitis. Lancet Infect Dis 2021; 21(3): e49–e57, https://doi.org/10.1016/s1473-3099(20)30448-5.
- Gupta N., Tandon R., Gupta S.K., Sreenivas V., Vashist P. Burden of corneal blindness in India. Indian J Community Med 2013; 38(4): 198–206, https://doi.org/10.4103/0970-0218.120153.
- Ahmadikia K., Aghaei Gharehbolagh S., Fallah B., Naeimi Eshkaleti M., Malekifar P., Rahsepar S., Getso M.I., Sharma S., Mahmoudi S. Distribution, prevalence, and causative agents of fungal keratitis: a systematic review and meta-analysis (1990 to 2020). Front Cell Infect Microbiol 2021; 11: 698780, https://doi.org/10.3389/fcimb.2021.698780.
- Dahlgren M.A., Lingappan A., Wilhelmus K.R. The clinical diagnosis of microbial keratitis. Am J Ophthalmol 2007; 143(6): 940–944.e1, https://doi.org/10.1016/j.ajo.2007.02.030.
- Wong T.Y., Ng T.P., Fong K.S., Tan D.T. Risk factors and clinical outcomes between fungal and bacterial keratitis: a comparative study. CLAO J 1997; 23(4): 275–281.
- Ali Shah S.I., Shah S.A., Rai P., Katpar N.A., Abbasi S.A., Soomro A.A. Visual outcome in patients of keratomycosis, at a tertiary care centre in Larkana, Pakistan. J Pak Med Assoc 2017; 67(7): 1035–1038.
- Обрубов А.С., Слонимский А.Ю. Кератиты и гнойные язвы роговицы при контактной коррекции. Вестник офтальмологии 2018; 134(4): 17–24, https://doi.org/10.17116/oftalma201813404117.
- Zhu Z., Zhang H., Yue J., Liu S., Li Z., Wang L. Antimicrobial efficacy of corneal cross-linking in vitro and in vivo for Fusarium solani: a potential new treatment for fungal keratitis. BMC Ophthalmol 2018; 18(1): 65, https://doi.org/10.1186/s12886-018-0727-0.
- Wang Y., Chen H., Xia T., Huang Y. Characterization of fungal microbiota on normal ocular surface of humans. Clin Microbiol Infect 2020; 26(1): 123.e9–123.e13, https://doi.org/10.1016/j.cmi.2019.05.011.
- Бельская К.И., Обрубов А.С. Патогенез и клинические особенности течения грибковых кератитов (обзор литературы). Офтальмология 2021; 18(1): 12–19, https://doi.org/10.18008/1816-5095-2021-1-12-19.
- Светозарский С.Н., Андреев А.Н., Щербакова С.В., Сметанкин И.Г. Успешное излечение грибкового кератита после сквозной кератопластики. Медицинский вестник Башкортостана 2020; 15(4): 17–20.
- Khater M.M., Shehab N.S., El-Badry A.S. Comparison of mycotic keratitis with nonmycotic keratitis: an epidemiological study. J Ophthalmol 2014; 2014: 254302, https://doi.org/10.1155/2014/254302.
- Скрябина Е.В., Астахов Ю.С., Коненкова Я.С., Касымов Ф.О., Зумбулидзе Н.Г., Варганова Т.С., Петухов В.П., Пиргунова А.А., Масян Я., Климко Н.Н., Богомолова Т.С., Десятик Е.А. Диагностика и лечение грибкового кератита. Часть I. Офтальмологические ведомости 2018; 11(3): 63–73, https://doi.org/10.17816/ov11363-73.
- Rohilla R., Meena S., Mohanty A., Gupta N., Kaistha N., Gupta P., Mangla A., Singh A. Etiological spectrum of infectious keratitis in the era of MALDI-TOF-MS at a tertiary care hospital. J Family Med Prim Care 2020; 9(9): 4576–4581, https://doi.org/10.4103/jfmpc.jfmpc_630_20.
- Ting D.S.J., Galal M., Kulkarni B., Elalfy M.S., Lake D., Hamada S., Said D.G., Dua H.S. Clinical characteristics and outcomes of fungal keratitis in the United Kingdom 2011–2020: a 10-year study. J Fungi (Basel) 2021; 7(11): 966, https://doi.org/10.3390/jof7110966.
- Watson S.L., Cabrera-Aguas M., Keay L., Khoo P., McCall D., Lahra M.M. The clinical and microbiological features and outcomes of fungal keratitis over 9 years in Sydney, Australia. Mycoses 2020; 63(1): 43–51, https://doi.org/10.1111/myc.13009.
- Sharma S., Singh S., Goel S., Farooq U. Role of biofilms in fungal keratitis — an overview. J Bacteriol Mycol Open Access 2017; 5(6): 409–412, https://doi.org/10.15406/jbmoa.2017.05.00157.
- Астахов Ю.С., Скрябина Е.В., Коненкова Я.С., Касымов Ф.О., Богомолова Т.С., Пинегина О.Н. Диагностика и лечение грибковых кератитов. Офтальмологические ведомости 2013; 6(2): 75–80, https://doi.org/10.17816/ov2013275-80.
- Imamura Y., Chandra J., Mukherjee P.K., Lattif A.A., Szczotka-Flynn L.B., Pearlman E., Lass J.H., O’Donnell K., Ghannoum M.A. Fusarium and Candida albicans biofilms on soft contact lenses: model development, influence of lens type, and susceptibility to lens care solutions. Antimicrob Agents Chemother 2008; 52(1): 171–182, https://doi.org/10.1128/aac.00387-07.
- Закирова Г.З. Грибковый кератит, ассоциированный с контактной коррекцией (клиническое наблюдение). Вестник офтальмологии 2021; 137(1): 74–77, https://doi.org/10.17116/oftalma202113701174.
- Светозарский С.Н., Андреев А.Н., Щербакова С.В. Грибковый кератит после сквозной кератопластики. Вестник офтальмологии 2019; 135(4): 98–102, https://doi.org/10.17116/oftalma201913504198.
- Полтанова Т.И., Белоусова Н.Ю. Рецидив грибкового кератита в роговичном трансплантате. Казанский медицинский журнал 2018; 99(1): 148–150, https://doi.org/10.17816/kmj2018-148.
- Fontana L., Moramarco A., Mandarà E., Russello G., Iovieno A. Interface infectious keratitis after anterior and posterior lamellar keratoplasty. Clinical features and treatment strategies. A review. Br J Ophthalmol 2019; 103(3): 307–314, https://doi.org/10.1136/bjophthalmol-2018-312938.
- Gupta G., Feder R.S., Lyon A.T. Fungal keratitis with intracameral extension following penetrating keratoplasty. Cornea 2009; 28(8): 930–932, https://doi.org/10.1097/ico.0b013e31819b3213.
- Augustin V.A., Weller J.M., Kruse F.E., Tourtas T. Fungal interface keratitis after Descemet membrane endothelial keratoplasty. Cornea 2018; 37(11): 1366–1369, https://doi.org/10.1097/ico.0000000000001727.
- Vaidya N.S., Epstein R.H., Majmudar P.A. Fungal infectious interface keratitis presenting 2 years after Descemet membrane endothelial keratoplasty. Cornea 2022; 41(7): 917–920, https://doi.org/10.1097/ico.0000000000002892.
- Ghaffari R., Bonnet C., Yung M., Bostan C., Harissi-Dagher M., Aldave A.J. Infectious keratitis after Boston type 1 keratoprosthesis implantation. Cornea 2021; 40(10): 1298–1308, https://doi.org/10.1097/ico.0000000000002649.
- Soleimani M., Haydar A.A. Fungal keratitis after small incision lenticule extraction (SMILE): a case report and review of the literature. J Ophthal Inflamm Infect 2021; 11(1): 25, https://doi.org/10.1186/s12348-021-00256-0.
- Камилов Х.М., Абдуллаев Ш.Р., Касымова М.С. Особенности клинического течения постравматического грибково-бактериального язвенного кератита. Вісник проблем біології і медицини 2012; 1(3): 59–62.
- Subudhi P., Patro S., Pattanayak S., Agarwal P., Sitaram S., Subudhi B.N.R. Toxic non-inflammatory fungal keratitis. Indian J Ophthalmol 2022; 70(5): 1578–1581, https://doi.org/10.4103/ijo.IJO_2509_21.
- Mills B., Radhakrishnan N., Karthikeyan Rajapandian S.G., Rameshkumar G., Lalitha P., Prajna N.V. The role of fungi in fungal keratitis. Exp Eye Res 2021; 202: 108372, https://doi.org/10.1016/j.exer.2020.108372.
- Cheng M., Lin J., Li C., Zhao W., Yang H., Lv L., Che C. Wedelolactone suppresses IL-1β maturation and neutrophil infiltration in Aspergillus fumigatus keratitis. Int Immunopharmacol 2019; 73: 17–22, https://doi.org/10.1016/j.intimp.2019.04.050.
- Gu L., Lin J., Wang Q., Li C., Peng X., Fan Y., Lu C., Lin H., Niu Y., Zhu G., Zhao G. Dimethyl itaconate protects against fungal keratitis by activating the Nrf2/HO-1 signaling pathway. Immunol Cell Biol 2020; 98(3): 229–241, https://doi.org/10.1111/imcb.12316.
- Liu Y., Li J., Liu Y., Wang P., Jia H. Inhibition of zymosan-induced cytokine and chemokine expression in human corneal fibroblasts by triptolide. Int J Ophthalmol 2016; 9(1): 9–14, https://doi.org/10.18240/ijo.2016.01.02.
- Sudan R., Sharma Y.R. Keratomycosis: clinical diagnosis, medical and surgical treatment. JK Science 2003; 5(1): 3–10.
- Ballal S., Belur S., Laha P., Roy S., Swamy B.M., Inamdar S.R. Mitogenic lectins from Cephalosporium curvulum (CSL) and Aspergillus oryzae (AOL) mediate host–pathogen interactions leading to mycotic keratitis. Mol Cell Biochem 2017; 434(1–2): 209–219, https://doi.org/10.1007/s11010-017-3050-9.
- de Vries O.M.H., Fekkes M.P., Wösten H.A.B., Wessels J.G.H. Insoluble hydrophobin complexes in the walls of Schizophyllum commune and other filamentous fungi. Arch Microbiol 1993; 159(4): 330–335, https://doi.org/10.1007/bf00290915.
- Zhang X., Sun X., Wang Z., Zhang Y., Hou W. Keratitis-associated fungi form biofilms with reduced antifungal drug susceptibility. Invest Ophthalmol Vis Sci 2012; 53(12): 7774–7778, https://doi.org/10.1167/iovs.12-10810.
- Calvillo-Medina R.P., Martínez-Neria M., Mena-Portales J., Barba-Escoto L., Raymundo T., Campos-Guillén J., Jones G.H., Reyes-Grajeda J.P., González-Y-Merchand J.A., Bautista-de Lucio V.M. Identification and biofilm development by a new fungal keratitis aetiologic agent. Mycoses 2019; 62(1): 62–72, https://doi.org/10.1111/myc.12849.
- Чеботарь И.В. Механизмы антибиопленочного иммунитета. Вестник Российской академии медицинских наук 2012; 67(12): 22–29, https://doi.org/10.15690/vramn.v67i12.477.
- Fanning S., Mitchell A.P. Fungal biofilms. PLoS Pathog 2012; 8(4): e1002585, https://doi.org/10.1371/journal.ppat.1002585.
- Delattin N., Cammue B.P.A., Thevissen K. Reactive oxygen species-inducing antifungal agents and their activity against fungal biofilms. Future Med Chem 2014; 6(1): 77–90, https://doi.org/10.4155/fmc.13.189.
- Elder M.J., Matheson M., Stapleton F., Dart J.K. Biofilm formation in infectious crystalline keratopathy due to Candida albicans. Cornea 1996; 15(3): 301–304, https://doi.org/10.1097/00003226-199605000-00012.
- Долгушин И.И., Мезенцева Е.А. Нейтрофильные внеклеточные ловушки в борьбе с биопленкообразующими микроорганизмами: охотники или добыча? Журнал микробиологии, эпидемиологии и иммунобиологии 2020; 97(5): 468–481, https://doi.org/10.36233/0372-9311-2020-97-5-9.
- Валиева Р.И., Лисовская С.А., Маянская К.А., Самигуллин Д.В., Исаева Г.Ш. Особенности антифунгальной терапии при длительном инфекционном процессе: клинический случай грибкового кератита и анализ профиля противогрибковой чувствительности с учетом формирования биопленок. Инфекция и иммунитет 2021; 11(4): 789–797, https://doi.org/10.15789/2220-7619-foa-1495.
- Vemuganti G.K., Garg P., Gopinathan U., Naduvilath T.J., John R.K., Buddi R., Rao G.N. Evaluation of agent and host factors in progression of mycotic keratitis. Ophthalmology 2002; 109(8): 1538–1546, https://doi.org/10.1016/s0161-6420(02)01088-6.
- Niu L., Liu X., Ma Z., Yin Y., Sun L., Yang L., Zheng Y. Fungal keratitis: pathogenesis, diagnosis and prevention. Microb Pathog 2020; 138: 103802, https://doi.org/10.1016/j.micpath.2019.103802.
- Leal S.M. Jr., Vareechon C., Cowden S., Cobb B.A., Latgé J.P., Momany M., Pearlman E. Fungal antioxidant pathways promote survival against neutrophils during infection. J Clin Invest 2012; 122(7): 2482–2498, https://doi.org/10.1172/jci63239.
- Gao X., Zhao G., Li C., Lin J., Jiang N., Wang Q., Hu L., Xu Q., Peng X., He K., Zhu G. LOX-1 and TLR4 affect each other and regulate the generation of ROS in A. fumigatus keratitis. Int Immunopharmacol 2016; 40: 392–399, https://doi.org/10.1016/j.intimp.2016.09.027.
- Li C., Li C., Lin J., Zhao G., Xu Q., Jiang N., Wang Q., Peng X., Zhu G., Jiang J. The role of autophagy in the innate immune response to fungal keratitis caused by Aspergillus fumigatus infection. Invest Ophthalmol Vis Sci 2020; 61(2): 25, https://doi.org/10.1167/iovs.61.2.25.
- Kanayama M., Inoue M., Danzaki K., Hammer G., He Y.W., Shinohara M.L. Autophagy enhances NFκB activity in specific tissue macrophages by sequestering A20 to boost antifungal immunity. Nat Commun 2015; 6: 5779, https://doi.org/10.1038/ncomms6779.
- Xie L., Zhai H., Shi W., Zhao J., Sun S., Zang X. Hyphal growth patterns and recurrence of fungal keratitis after lamellar keratoplasty. Ophthalmology 2008; 115(6): 983–987, https://doi.org/10.1016/j.ophtha.2007.07.034.
- Xie L., Zhong W., Shi W., Sun S. Spectrum of fungal keratitis in north China. Ophthalmology 2006; 113(11): 1943–1948, https://doi.org/10.1016/j.ophtha.2006.05.035.
- Niewerth M., Korting H.C. Phospholipases of Candida albicans. Mycoses 2001; 44(9–10): 361–367, https://doi.org/10.1046/j.1439-0507.2001.00685.x.
- Monte F.Q., Stadtherr N.M. Reflections on mycotic keratitis based on findings from histopathologically examined specimens. Rev Bras Oftalmol 2013; 72(2): 87–94, https://doi.org/10.1590/s0034-72802013000200003.
- Weissgold D.J., Orlin S.E., Sulewski M.E., Frayer W.C., Eagle R.C. Jr. Delayed-onset fungal keratitis after endophthalmitis. Ophthalmology 1998; 105(2): 258–262, https://doi.org/10.1016/s0161-6420(98)92938-4.
- Thomas P.A., Leck A.K., Myatt M. Characteristic clinical features as an aid to the diagnosis of suppurative keratitis caused by filamentous fungi. Br J Ophthalmol 2005; 89(12): 1554–1558, https://doi.org/10.1136/bjo.2005.076315.
- Ковалева Л.А., Кричевская Г.И., Макаров П.В., Петрова А.О., Флора С.В., Зюрняева И.Д., Андрюшин А.Е., Маркелова О.И. Грибковая язва роговицы, осложненная эндофтальмитом: особенности клинико-лабораторной диагностики и тактика лечения. Российский офтальмологический журнал 2022; 15(1): 19–24, https://doi.org/10.21516/2072-0076-2022-15-1-19-24.
- Dalmon C., Porco T.C., Lietman T.M., Prajna N.V., Prajna L., Das M.R., Kumar J.A., Mascarenhas J., Margolis T.P., Whitcher J.P., Jeng B.H., Keenan J.D., Chan M.F., McLeod S.D., Acharya N.R. The clinical differentiation of bacterial and fungal keratitis: a photographic survey. Investig Opthalmol Vis Sci 2012; 53(4): 1787–1791, https://doi.org/10.1167/iovs.11-8478.
- Burton M.J., Pithuwa J., Okello E., Afwamba I., Onyango J.J., Oates F., Chevallier C., Hall A.B. Microbial keratitis in East Africa: why are the outcomes so poor? Ophthalmic Epidemiol 2011; 18(4): 158–163, https://doi.org/10.3109/09286586.2011.595041.
- Ботабекова Т.К., Сулейменов М.С., Исергепова Б.И. Особенности клиники и лечения грибковых поражений роговицы. Точка зрения. Восток-Запад 2016; 1: 133–136.
- Parmar D.P., Rathod J.S., Karkhanawala M.M., Bhole P.K., Rathod D.S. Foldscope: a smartphone based diagnostic tool for fungal keratitis. Indian J Ophthalmol 2021; 69(10): 2836–2840, https://doi.org/10.4103/ijo.ijo_3331_20.
- Майчук Д.Ю., Тарханова А.А., Лошкарева А.О., Дроздков И.А. Определение основных клинических характеристик грибкового кератита на основании опыта ведения пациентов с предоставлением клинического случая. Современные технологии в офтальмологии 2021; 4: 21–24, https://doi.org/10.25276/2312-4911-2021-4-21-24.
- Prajna V.N., Prajna L., Muthiah S. Fungal keratitis: the aravind experience. Indian J Ophthalmol 2017; 65(10): 912–919, https://doi.org/10.4103/ijo.IJO_821_17.
- Bourcier T., Sauer A., Dory A., Denis J., Sabou M. Fungal keratitis. J Fr Ophtalmol 2017; 40(9): e307–e313, https://doi.org/10.1016/j.jfo.2017.08.001.
- Jin X., Jin H., Shi Y., Zhang N., Zhang H. Clinical observation of corneal endothelial plaques with fungal and bacterial keratitis by anterior segment optical coherence tomography and in vivo confocal microscopy. Cornea 2022; 41(11): 1426–1432, https://doi.org/10.1097/ico.0000000000002912.
- Chidambaram J.D., Venkatesh Prajna N., Srikanthi P., Lanjewar S., Shah M., Elakkiya S., Lalitha P., Burton M.J. Epidemiology, risk factors, and clinical outcomes in severe microbial keratitis in South India. Ophthalmic Epidemiol 2018; 25(4): 297–305, https://doi.org/10.1080/09286586.2018.1454964.
- Malhotra S., Sharma S., Kaur N., Hans C. Fungal keratitis — a brief overview. J Ophthalmic Clin Res 2015; 2(3): 18–22, https://doi.org/10.24966/ocr-8887/100018.
- Wallang B.S., Das S., Sharma S., Sahu S.K., Mittal R. Ring infiltrate in staphylococcal keratitis. J Clin Microbiol 2013; 51(1): 354–355, https://doi.org/10.1128/jcm.02191-12.
- Mascarenhas J., Lalitha P., Prajna N.V., Srinivasan M., Das M., D’Silva S.S., Oldenburg C.E., Borkar D.S., Esterberg E.J., Lietman T.M., Keenan J.D. Acanthamoeba, fungal, and bacterial keratitis: a comparison of risk factors and clinical features. Am J Ophthalmol 2014; 157(1): 56–62, https://doi.org/10.1016/j.ajo.2013.08.032.
- Barash A., Chou T.Y. Moraxella atlantae keratitis presenting with an infectious ring ulcer. Am J Ophthalmol Case Rep 2017; 7: 62–65, https://doi.org/10.1016/j.ajoc.2017.06.003.
- Thomas P.A. Fungal infections of the cornea. Eye (Lond) 2003; 17(8): 852–862, https://doi.org/10.1038/sj.eye.6700557.
- Аржиматова Г.Ш., Обрубов А.С. Ургентная кератопластика при грибковых кератитах. Современные технологии в офтальмологии 2021; 4: 43–45, https://doi.org/10.25276/2312-4911-2021-4-43-45.
- Кричевская Г.И., Ковалева Л.А., Зюрняева И.Д., Макаров П.В., Андрюшин А.Е. Эффективность ПЦР-диагностики грибковых кератитов. Офтальмология 2020; 17(4): 824–829, https://doi.org/10.18008/1816-5095-2020-4-824-829.
- Ansari Z., Miller D., Galor A. Current thoughts in fungal keratitis: diagnosis and treatment. Curr Fungal Infect Rep 2013; 7(3): 209–218.
- Ren Z., Liu Q., Wang Y., Dong Y., Huang Y. Diagnostic information profiling and evaluation of causative fungi of fungal keratitis using high-throughput internal transcribed spacer sequencing. Sci Rep 2020; 10(1): 1640, https://doi.org/10.1038/s41598-020-58245-7.
- Deorukhkar S., Katiyar R., Saini S. Epidemiological features and laboratory results of bacterial and fungal keratitis: a five-year study a rural tertiary-care hospital in western Maharashtra, India. Singapore Med J 2012; 53(4): 264–267.
- Raj N., Vanathi M., Ahmed N.H., Gupta N., Lomi N., Tandon R. Recent perspectives in the management of fungal keratitis. J Fungi (Basel) 2021; 7(11): 907, https://doi.org/10.3390/jof7110907.
- Ray K.J., Lalitha P., Prajna N.V., Rajaraman R., Krishnan T., Srinivasan M., Ryg P., McLeod S., Acharya N.R., Lietman T.M., Rose-Nussbaumer J.; Mycotic Ulcer Treatment Trial Group. The utility of repeat culture in fungal corneal ulcer management: a secondary analysis of the MUTT-I randomized clinical trial. Am J Ophthalmol 2017; 178: 157–162, https://doi.org/10.1016/j.ajo.2017.03.032.
- Бельская К.И., Обрубов А.С. Некультуральные методы диагностики грибковых кератитов. Русский медицинский журнал. Клиническая офтальмология 2018; 19(1): 37–41, https://doi.org/10.21689/2311-7729-2018-18-1-37-41.
- Sharma S., Kunimoto D.Y., Gopinathan U., Athmanathan S., Garg P., Rao G.N. Evaluation of corneal scraping smear examination methods in the diagnosis of bacterial and fungal keratitis: a survey of eight years of laboratory experience. Cornea 2002; 21(7): 643–647, https://doi.org/10.1097/00003226-200210000-00002.
- Bakken I.M., Jackson C.J., Utheim T.P., Villani E., Hamrah P., Kheirkhah A., Nielsen E., Hau S., Lagali N.S. The use of in vivo confocal microscopy in fungal keratitis — progress and challenges. Ocul Surf 2022; 24: 103–118, https://doi.org/10.1016/j.jtos.2022.03.002.
- Tabatabaei S.A., Soleimani M., Tabatabaei S.M., Beheshtnejad A.H., Valipour N., Mahmoudi S. The use of in vivo confocal microscopy to track treatment success in fungal keratitis and to differentiate between Fusarium and Aspergillus keratitis. Int Ophthalmol 2020; 40(2): 483–491, https://doi.org/10.1007/s10792-019-01209-2.
- Hoffman J.J., Dart J.K.G., De S.K., Carnt N., Cleary G., Hau S. Comparison of culture, confocal microscopy and PCR in routine hospital use for microbial keratitis diagnosis. Eye (Lond) 2022; 36(11): 2172–2178, https://doi.org/10.1038/s41433-021-01812-7.
- Hau S.C., Dart J.K., Vesaluoma M., Parmar D.N., Claerhout I., Bibi K., Larkin D.F. Diagnostic accuracy of microbial keratitis with in vivo scanning laser confocal microscopy. Br J Ophthalmol 2010; 94(8): 982–987, https://doi.org/10.1136/bjo.2009.175083.
- Kheirkhah A., Syed Z.A., Satitpitakul V., Goyal S., Müller R., Tu E.Y., Dana R. Sensitivity and specificity of laser-scanning in vivo confocal microscopy for filamentous fungal keratitis: role of observer experience. Am J Ophthalmol 2017; 179: 81–89, https://doi.org/10.1016/j.ajo.2017.04.011.
- Wang Y.E., Tepelus T.C., Vickers L.A., Baghdasaryan E., Gui W., Huang P., Irvine J.A., Sadda S., Hsu H.Y., Lee O.L. Role of in vivo confocal microscopy in the diagnosis of infectious keratitis. Int Ophthalmol 2019; 39(12): 2865–2874, https://doi.org/10.1007/s10792-019-01134-4.
- Паштаев Н.П., Куликова И.Л., Шленская О.В., Волкова Л.Н. Конфокальная микроскопия роговицы в кераторефракционной хирургии. Обзор литературы. Вестник российских университетов. Математика 2015; 20(3): 662–666.
- Soliman W., Fathalla A.M., El-Sebaity D.M., Al-Hussaini A.K. Spectral domain anterior segment optical coherence tomography in microbial keratitis. Graefes Arch Clin Exp Ophthalmol 2013; 251(2): 549–553, https://doi.org/10.1007/s00417-012-2086-5.
- Behera H.S., Srigyan D. Evaluation of polymerase chain reaction over routine microbial diagnosis for the diagnosis of fungal keratitis. Optom Vis Sci 2021; 98(3): 280–284, https://doi.org/10.1097/opx.0000000000001652.
- Pouyeh B., Galor A., Miller D., Alfonso E.C. New horizons in one of ophthalmology’s challenges: fungal keratitis. Expert Rev Ophthalmol 2011; 6(5): 529–540, https://doi.org/10.1586/eop.11.58.
- Shigeyasu C., Yamada M., Aoki K., Ishii Y., Tateda K., Yaguchi T., Okajima Y., Hori Y. Metagenomic analysis for detecting Fusarium solani in a case of fungal keratitis. J Infect Chemother 2018; 24(8): 664–668, https://doi.org/10.1016/j.jiac.2017.12.019.
- Lalitha P., Prajna N.V., Sikha M., Gunasekaran R., Hinterwirth A., Worden L., Chen C., Zhong L., Liu Z., Lietman T.M., Seitzman G.D., Doan T. Evaluation of metagenomic deep sequencing as a diagnostic test for infectious keratitis. Ophthalmology 2021; 128(3): 473–475, https://doi.org/10.1016/j.ophtha.2020.07.030.
- Ananthi S., Chitra T., Bini R., Prajna N.V., Lalitha P., Dharmalingam K. Comparative analysis of the tear protein profile in mycotic keratitis patients. Mol Vis 2008; 14: 500–507.
- Lee M.H., Wiedman G., Park S., Mustaev A., Zhao Y., Perlin D.S. A novel, tomographic imaging probe for rapid diagnosis of fungal keratitis. Med Mycol 2018; 56(7): 796–802, https://doi.org/10.1093/mmy/myx125.
- Zhao G., Zhai H., Yuan Q., Sun S., Liu T., Xie L. Rapid and sensitive diagnosis of fungal keratitis with direct PCR without template DNA extraction. Clin Microbiol Infect 2014; 20(10): O776–O782, https://doi.org/10.1111/1469-0691.12571.
- Иванова Л.В., Баранцевич Е.П., Шляхто Е.В. Резистентность грибов-патогенов к антимикотикам (обзор). Проблемы медицинской микологии 2011; 13(1): 14–17.
- Самойлов А.Н., Давлетшина Н.И. Анализ этиологии и антимикробной чувствительности возбудителей грибковых кератитов в серии клинических случаев. Офтальмохирургия 2020; 1: 71–76, https://doi.org/10.25276/0235-4160-2020-1-71-76.










