Идентификация диагностических биомаркеров шизофрении на основе исследования параметров иммунитета и системного воспаления с помощью моделей машинного обучения
В настоящее время показано, что существенную роль в развитии и прогрессировании шизофрении играют нарушения системного иммунитета и иммунных процессов в мозге. Тем не менее лишь единичные работы посвящены изучению возможности использования отдельных параметров иммунитета для объективизации диагноза с помощью машинного обучения. При этом к совокупности данных, полноценно отражающих системные характеристики иммунного статуса (параметры адаптивного иммунитета, уровень маркеров воспаления, содержание основных цитокинов) методы машинного обучения до сих пор не применялись. С учетом комплексного характера нарушений иммунной системы при шизофрении включение широкой панели иммунологических данных в модели машинного обучения перспективно для увеличения точности классификации и выделения параметров, отражающих характерные для большинства больных иммунные расстройства.
Цель настоящей работы — исследование возможности использования иммунологических параметров для объективизации диагноза шизофрении с помощью моделей машинного обучения.
Материалы и методы. Проанализировано 17 иммунологических показателей у 63 больных шизофренией и 36 здоровых добровольцев. Методом иммуноферментного анализа определяли параметры гуморального иммунитета, системный уровень ключевых цитокинов адаптивного иммунитета, противовоспалительных и провоспалительных цитокинов, а также других маркеров воспаления. Использованные методы машинного обучения охватывали основные группы подходов обучения с учителем (supervised learning), такие как линейные модели (logistic regression), квадратичный дискриминантный анализ (quadratic discriminant analysis, QDA), методы опорных векторов (linear SVM, RBF SVM), алгоритм k-ближайших соседей (k-nearest neighbors), гауссовские процессы (gaussian process), наивный байесовский классификатор (naive bayes), деревья решений (decision tree), а также ансамблевые модели (AdaBoost, random forest, XGBoost). Для методов машинного обучения, показавших лучшее качество, проанализирована важность признаков для предсказания с лучшего фолда. Наиболее значимые признаки были отобраны по порогу квантиль 70%.
Результаты. Лучшее качество на тестовой выборке на 10 фолдах продемонстрировала ансамблевая модель AdaBoost с площадью под кривой ошибок (ROC AUC) 0,71±0,15 и средней точностью (ACC) 0,78±0,11. В рамках данного исследования модель AdaBoost показала хорошее качество классификации между больными шизофренией и здоровыми добровольцами (ROC AUC более 0,70) при высокой стабильности результатов (σ менее 0,2). Установлены иммунологические параметры, наиболее значимые для дифференциации между больными и добровольцами без психических заболеваний: уровень ряда маркеров системного воспаления, активации гуморального иммунитета, провоспалительных цитокинов, иммунорегуляторных цитокинов и белков, цитокинов Th1- и Th2-звена иммунитета. Впервые показана возможность различать больных шизофренией и здоровых добровольцев с точностью более 70% с помощью машинного обучения, используя только показатели иммунитета.
Результаты исследования подтверждают высокую значимость иммунной системы в патогенезе шизофрении.
Введение
Шизофрения — тяжелое хроническое психическое заболевание с расстройствами когнитивных функций, эмоциональными и психомоторными нарушениями [1]. При шизофрении наблюдается высокая частота инвалидизации и сокращается продолжительность жизни [2]. Для уменьшения риска неблагоприятного течения заболевания необходимы ранняя диагностика и своевременное назначение терапии. Важное направление исследований для совершенствования диагностики шизофрении — разработка подходов к объективизации диагноза с помощью моделей машинного обучения (machine learning, ML) на основе клинически значимых биомаркеров [3, 4]. Биомаркеры в клинической практике важны для определения нескольких факторов: уточнения диагноза, верификации стадии заболевания, выбора оптимального плана терапии, долгосрочного прогноза заболевания. Однако для большинства найденных к настоящему времени биомаркеров шизофрении их клиническая ценность (определяемая показателями чувствительности, специфичности, прогностической значимости и т.п.) не установлена на требуемом доказательном уровне, в силу чего использование биомаркеров не предусмотрено в существующих клинических рекомендациях [5].
Большой объем, высокая размерность и гетерогенность мультимодальных лабораторных данных затрудняют интеграцию всех доступных модальностей в рамках одного исследования, поэтому в сообществе клиницистов растет интерес к современным подходам объединения гетерогенных данных, к методам ML и глубокого обучения (deep learning, DL) [6].
В настоящее время доказано, что существенную роль в развитии и прогрессировании шизофрении играют нарушения системного иммунитета, а также иммунные процессы в центральной нервной системе (ЦНС) [7–9]. Тем не менее лишь единичные работы посвящены изучению возможности использования отдельных параметров иммунитета для объективизации диагноза шизофрении с помощью методов ML [10]. При этом к совокупности данных, полноценно отражающих системные характеристики иммунного статуса (параметры адаптивного иммунитета, уровень маркеров воспаления, содержание основных цитокинов), методы ML до сих пор не применялись [11–13]. С учетом комплексного характера нарушений иммунной системы при шизофрении включение в модели ML широкой панели иммунологических данных перспективно для увеличения точности классификации заболевания и выделения параметров, изменение которых наиболее характерно для большинства больных. С практической точки зрения результаты анализа данных методом ML могут позволить разработать новые панели маркеров, имеющих диагностическое/прогностическое значение, а также стать основой для создания прототипа системы поддержки принятия врачебных решений на базе отобранных признаков.
Цель настоящей работы — исследование возможности использования иммунологических параметров для объективизации диагноза шизофрении с помощью моделей машинного обучения.
Материалы и методы
Клинические данные, представленные в настоящей работе, являются частью исследовательской программы «Молекулярные и нейрофизиологические маркеры эндогенных заболеваний», проводимой в Психиатрической клинической больнице №1 им. Н.А. Алексеева Департамента здравоохранения Москвы и одобренной Независимым междисциплинарным комитетом по этической экспертизе клинических исследований (протокол №12 от 14.07.2017 г.). Некоторые результаты этого проекта опубликованы ранее [14–16].
Пациенты. Обследовано 63 пациента (36 мужчин и 27 женщин, средний возраст — 29±3 года) из числа госпитализированных в Психиатрическую клиническую больницу №1 им. Н.А. Алексеева с диагнозами расстройств шизофренического спектра (F20 и F25 по МКБ-10). Все испытуемые дали письменное информированное согласие после полного описания процедур исследования согласно Хельсинкской декларации.
Критерии включения: соответствие состояния пациента критериям шизофрении по МКБ-10 и DSM-5 (Диагностическое и статистическое руководство по психическим расстройствам, 5-е издание); критика к болезненному состоянию; сохранение памяти о психотических симптомах; информированное согласие на участие в исследовании.
Критерии исключения: шизоаффективные и аффективные расстройства; органические заболевания головного мозга; тяжелые соматические и/или неврологические состояния, потенциально влияющие на физиологию или структуру мозга; признаки злоупотребления психоактивными веществами; острые хронические соматические и инфекционно-воспалительные заболевания или их обострение.
Группу контроля составили 36 добровольцев, сопоставимых с пациентами по возрасту и полу (21 мужчина и 15 женщин, средний возраст — 30±2 года) и не состоящих с пациентами в родстве. Добровольцы и больные шизофренией были обследованы по единому протоколу.
Дизайн исследования: кросс-секционное, наблюдательное, случай-контроль. Диагностику состояния больных проводили в течение двух дней. Перед взятием биоматериала определяли клиническую картину психоза и уточняли объективные сведения (от родственников и с помощью медицинских карт). За сутки до взятия биоматериала выполняли психометрическую оценку состояния с применением шкалы позитивных и негативных симптомов шизофрении (PANSS) [17] (табл. 1). Клиническое обследование проводили два опытных психиатра с привлечением всех необходимых данных (опрос родственников, анализ медицинских карт, результаты физикальных и лабораторных тестов и т.д.). Психическое состояние на момент сканирования характеризовалось критичностью к перенесенному психозу при сохранении памяти с возможностью изложить субъективный анамнез развития заболевания (с детализацией фабулы бреда и оценкой аффективного состояния в тот период).

|
Таблица 1. Характеристики исследуемых больных шизофренией (n=63) |
Иммунологические исследования. Проводили анализ 17 иммунологических показателей. Они включали параметры гуморального иммунитета (IgA, IgM и IgG); системный уровень ключевых провоспалительных и противовоспалительных цитокинов, а также других маркеров воспаления (С-реактивный белок (CRP), кортизол, циркулирующие иммунные комплексы (ЦИК)); уровень нейротрофического фактора мозгового происхождения (BDNF), определявшийся методом иммуноферментного анализа с использованием наборов реактивов производства ООО «ХЕМА» (Россия), ООО «Цитокин» (Россия), R&D Systems (США).
Статистическая обработка данных. Для статистической обработки результатов применяли программное обеспечение Python 3.9.0 (Python Software Foundation) в виде библиотек NumPy, Pandas, SkLearn, где также были взяты методы ML.
В данном исследовании анализировали количественные непрерывные переменные. Анализ переменных в динамике не проводили, так как исследование носило кросс-секционный характер. Изучали две независимые выборки (больные шизофренией и здоровые добровольцы).
В рамках первичного анализа данных нормальность распределения оценивали по критерию Шапиро–Уилка. Клинические данные представляли в виде средних со стандартным отклонением (M±σ), иммунологические параметры — в виде медиан и 25-го и 75-го процентилей (Me [25; 75]).
Для оценки качества классификации использовали метрики «точность» (accuracy, ACC) и «площадь под кривой ошибок» (area under the ROC curve, ROC AUC). Точность измеряет долю верно предсказанных значений от общего числа ответов, и она выше для моделей, дающих более правильные прогнозы. Однако для наборов данных, где классы представлены неравномерно, точность может быть неоптимальной метрикой. Метрика ROC AUC измеряет площадь под кривой ROC, отображая способность модели различать объекты, принадлежащие к двум классам, при различных порогах классификации. ROC AUC может принимать значения в диапазоне от 0 до 1, причем более высокое значение указывает на лучшую производительность модели. В данном исследовании, поскольку число больных шизофренией и здоровых добровольцев было различным, в качестве основной метрики качества моделей использовали ROC AUC. Пороговым уровнем ROC AUC было значение 0,70, что соответствует хорошему качеству классификации.
Для оценки стабильности полученных моделей по каждой из указанных метрик (ACC и ROC AUC) по всем фолдам рассчитывали стандартное отклонение (σ). Более низкое σ указывает на более стабильную работу модели, при этом малым считается σ менее 0,2, умеренным — от 0,2 до 0,5. В рамках данного исследования стабильными считали модели, имевшие σ ACC и ROC AUC менее 0,2.
Методы машинного обучения. Использованные методы ML охватывали основные группы подходов обучения с учителем (supervised learning), такие как линейные модели (logistic regression), квадратичный дискриминантный анализ (quadratic discriminant analysis, QDA), методы опорных векторов (linear SVM, RBF SVM), алгоритм k-ближайших соседей (k-nearest neighbors), гауссовские процессы (gaussian process), наивный байесовский классификатор (naive bayes), деревья решений (decision tree), а также ансамблевые модели (AdaBoost, random forest, XGBoost). Эти методы охватывают широкий спектр подходов в ML, каждый из которых имеет свои сильные стороны. Рассмотрение различных групп подходов позволило установить, какие из них лучше всего справляются с данной задачей. Говоря более подробно о семействе ансамблевых подходов, следует отметить, что в их основе лежит идея комбинации нескольких классификаторов в один сильный. Например, каждый слабый классификатор в AdaBoost (adaptive boosting) может быть любым алгоритмом обучения (принимающим значения отрицательных и положительных весов). На каждой итерации обучения AdaBoost увеличивает веса неправильно классифицированных примеров, чтобы следующий классификатор был более сфокусирован на тех примерах, на которых предыдущие классификаторы сделали ошибки. После обучения все слабые классификаторы объединяются с использованием взвешивания голосов, где каждому классификатору присваивается вес, основанный на его точности при классификации, что позволяет получить сильный классификатор, представляющий собой ансамбль слабых классификаторов. Когда итоговый классификатор используется для категоризации новых примеров, он учитывает голос всех слабых классификаторов в соответствии с их весами, что позволяет достичь более точной и устойчивой классификации.
Для каждой модели ML можно оценить релевантность или вклад различных признаков относительно предсказания, т.е. количественно оценить важность каждого признака (feature importance) в процессе принятия решения моделью. Важность признака можно рассчитать с использованием различных методов, таких как важность перестановки, важность Джини (Gini impurity) или величина коэффициента важности, который позволяет определить воздействие каждой отдельной переменной на предсказываемую переменную и оценить их роль в моделировании. Результат расчета коэффициентов важности может быть представлен в виде таблицы, позволяющей проанализировать значимость каждой переменной для моделирования. Более высокие значения указывают на бóльшую важность. Хотя важность признаков может дать представление об относительном вкладе каждого из них, данный параметр следует интерпретировать с осторожностью. Это не обязательно подразумевает причинно-следственную связь или прямую связь между признаками. Более того, интерпретация важности функции зависит от конкретной модели и контекста, и ее следует рассматривать наряду с другими мерами оценки и знаниями предметной области для формирования всестороннего понимания. Таким образом, при использовании параметра важности функций можно оценить релевантность функций в модели ML. Данный параметр позволяет обеспечить интерпретируемость, однако его следует использовать как часть более широкого анализа, а не как единственную основу для вынесения выводов.
Процесс обучения и оценки качества моделей проводили при помощи 10-кратной стратифицированной перекрестной проверки (StratifiedKFold). В итоге было создано 10 моделей для каждого метода ML, качество каждой модели определяли на тестовой части (20% данных). Таким образом, мы получили выборку из десяти значений для каждой метрики качества для выбранного набора гиперпараметров. Затем для каждой метрики качества находили среднее и стандартное отклонение. Для методов ML, показавших лучшее качество, была проанализирована важность признаков для предсказания с лучшего фолда. Наиболее значимые признаки были отобраны по порогу квантиль 70%.
Результаты
В ходе экспериментов обнаружено, что лучшее качество на тестовой выборке на 10 фолдах продемонстрировала ансамблевая модель AdaBoost с площадью под кривой ошибок (ROC AUC) 0,71±0,15 и средней точностью (ACC) 0,78±0,11. В рамках данного исследования модель AdaBoost показала хорошее качество классификации между больными шизофренией и здоровыми добровольцами (ROC AUC более 0,70) при высокой стабильности результатов (σ менее 0,2) (табл. 2).
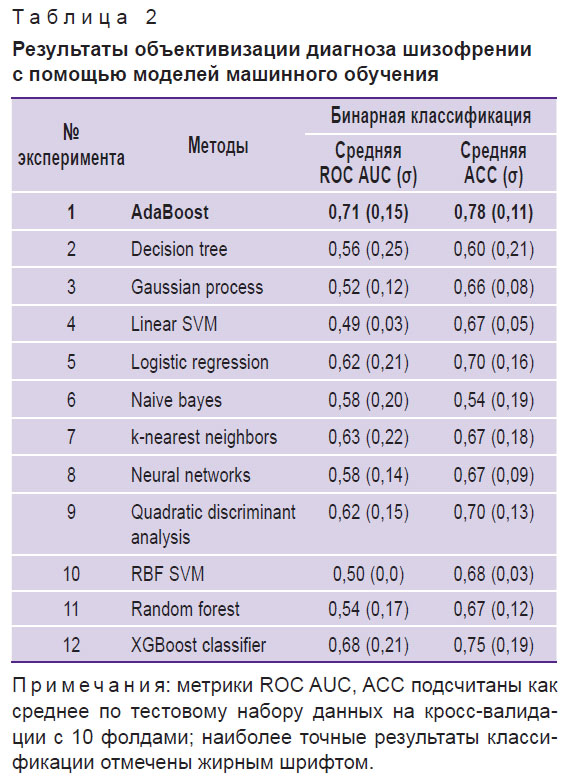
|
Таблица 2. Результаты объективизации диагноза шизофрении с помощью моделей машинного обучения |
В табл. 3 представлены результаты анализа признаков по степени их важности для точности классификации с помощью модели AdaBoost.
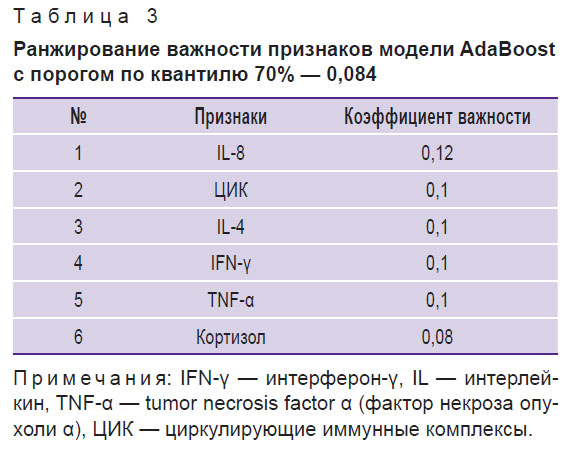
|
Таблица 3. Ранжирование важности признаков модели AdaBoost с порогом по квантилю 70% — 0,084 |
В табл. 4 показано ранжирование признаков по их важности для классификации с помощью модели XGBoost classifier, имевшей вторые по величине ROC AUC и ACC, высокую или умеренную стабильность результатов классификации (ROC AUC — 0,68±0,21; ACC — 0,75±0,19).
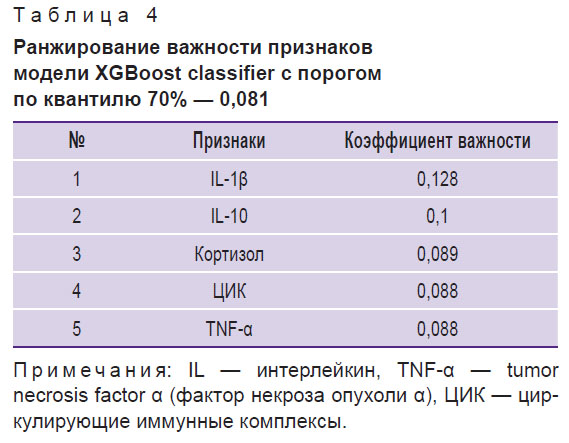
|
Таблица 4. Ранжирование важности признаков модели XGBoost сlassifier с порогом по квантилю 70% — 0,081 |
Для повышения наглядности полученных данных также представлено ранжирование признаков по их важности для классификации с помощью модели логистической регрессии, которая отличается большей простотой и наглядностью по сравнению с AdaBoost и XGBoost сlassifier и имеет третье по величине значение ROC AUC с высокой или умеренной стабильностью результатов (ROC AUC — 0,62±0,21, ACC — 0,70±0,16) (см. табл. 2; табл. 5).
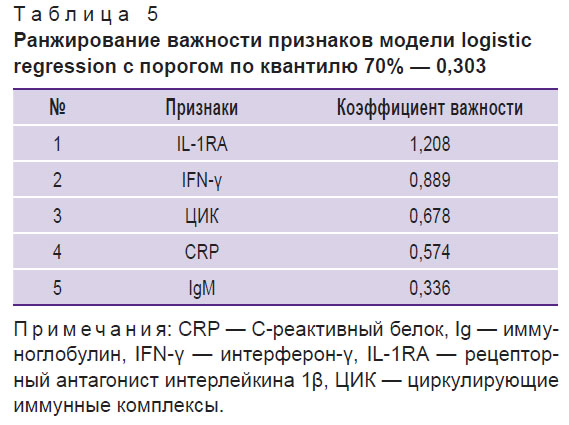
|
Таблица 5. Ранжирование важности признаков модели logistic regression с порогом по квантилю 70% — 0,303 |
Таким образом, ранжирование по коэффициенту важности признаков, релевантных для трех моделей, имевших наибольшую предсказательную силу, позволило установить параметры, наиболее значимые для различения больных шизофренией и здоровых добровольцев.
Обсуждение
В результате данной работы впервые показана возможность диагностировать шизофрению с точностью более 70%, используя модели машинного обучения, построенные на основе совокупности только показателей состояния иммунной системы. Указанный уровень точности подтверждения диагноза был получен, несмотря на то, что работа на данном этапе не предусматривала включения в модели машинного обучения результатов клинического обследования, в отличие, например, от работы [10], где использовались как отдельные иммунологические данные, так и результаты нейропсихологического тестирования.
В результате работы впервые выявлен комплекс параметров естественного и адаптивного иммунитета, наиболее важных для классификации больных и лиц без психических заболеваний: уровень ряда маркеров системного воспаления и активации гуморального иммунитета (CRP, кортизол, ЦИК), провоспалительных цитокинов (IL-1β, IL-8, TNF-α), иммунорегуляторных белков (IL-1RA), цитокинов Th1-звена иммунитета (IFN-γ), цитокинов Th2-звена иммунитета (IL-4) и иммунорегуляторных цитокинов (IL-10).
Обращает на себя внимание важная роль в построенных моделях машинного обучения показателей системного воспаления и уровня провоспалительных цитокинов. Данные литературы и наших исследований подтверждают, что у пациентов с шизофренией выявляются признаки системного воспаления, которые наиболее выражены при первом эпизоде заболевания и при его обострениях. Так, при обострении болезни в крови больных повышаются уровни провоспалительных цитокинов IL-8 и TNF-α, а также белка острой фазы CRP [18–20]. Показано также, что высокий уровень CRP ассоциирован с более тяжелым течением психоза при шизофрении и последующим снижением когнитивных функций [18, 21]. Определенный уровень иммуновоспалительной активации, по нашим данным, сохраняется и в период медикаментозной ремиссии. Однако до сих пор не изучалось применение методов машинного обучения для подтверждения диагноза шизофрении с помощью оценки уровня маркеров системного воспаления [11, 12]. В то же время можно выделить ряд работ, в которых установлены взаимосвязи между уровнем отдельных маркеров системного воспаления и клиническими характеристиками шизофрении, включая выраженность нарушений когнитивных функций (TNF-α, IL-2, IL-6, IL-8, кортизол), нейрокогнитивного дефекта (IL-1β, sIL-1RA, TNF-α), острый или хронический характер течения заболевания (TNF-α, IL-2, IL-6, IL-8, кортизол) [22, 23].
В запуске и поддержании системного воспалительного ответа, пирогенных реакций, а также функциях адаптивного иммунитета важную роль играют IL-1β, IL-8, TNF-α — цитокины врожденного иммунитета [24]. Повышение их уровня в ЦНС, которое может наблюдаться, в частности, при нейроинфекциях, аутоиммунных заболеваниях, психических заболеваниях, оказывает повреждающее действие на нейроны и клетки глии, способствует нейродегенерации (см., например, обзор [25]). Согласно данным метаанализа [18], уровень цитокинов IL-6, TNF-α и рецепторного антагониста IL-1RA при острой шизофрении повышен. При хронической шизофрении в этом же метаанализе показано повышение уровня IL-1β и IL-6. Согласно нашим данным, повышенный уровень IL-8 отмечается у пациентов с шизофренией независимо от выраженности клинической симптоматики [26].
Важным цитокином, активирующим функции CD3+CD4+ T-хелперов 1-го типа, CD3+CD8+ цитотоксических Т-клеток и CD3–CD16+CD56+ NK-клеток, которые обеспечивают противовирусную защиту, а также стимулирующим презентацию антигенов лимфоцитам клетками врожденного иммунитета, является IFN-γ. В условиях воспаления IFN-γ активно продуцируется T-лимфоцитами и NK-клетками. По нашим результатам и по данным литературы, его содержание при шизофрении повышается, отражая комплексную активацию механизмов адаптивного и врожденного иммунитета у больных [26, 27]. В рамках данной работы показано, что IFN-γ является одним из наиболее значимых показателей для подтверждения диагноза шизофрении с помощью моделей машинного обучения.
К числу диагностически значимых маркеров, выявленных в результате данной работы, относятся также иммунологические параметры, отражающие активацию Th2-звена иммунитета и иммунорегуляторных механизмов: уровень цитокина IL-4, иммунорегуляторного белка IL-1RA, а также ЦИК. Согласно литературным данным, активация врожденного иммунного ответа у больных шизофренией сопровождается активацией Th2-звена адаптивного иммунитета. Признаки активации Th2-иммунного ответа при шизофрении включают увеличение уровня цитокинов IL-4 и IL-10 в сыворотке крови, снижение отношения уровней Th1-цитокинов к уровням Th2-цитокинов (IFN-γ/IL-4, IFN-γ/IL-10, IL-2/IL-4, TNF-α/IL-4) [28]. S.M. de Campos-Carli с соавт. [29] обнаружили у больных связь между выраженностью когнитивных нарушений и повышением уровня в крови Th2-цитокина IL-33 [29]. Активация Th2-ответа у пациентов с шизофренией может участвовать в нарушениях обмена нейротрансмиттеров в ЦНС, вовлеченных в патогенез негативной симптоматики при шизофрении [30]. Ранее нами было впервые установлено, что иммунологический профиль, характеризуемый повышением содержания IL-10 при умеренных признаках системного воспаления, ассоциирован у больных шизофренией с наличием выраженных негативных симптомов [26].
Таким образом, выявленный комплекс иммунологических показателей (IL-8, ЦИК, IL-4, IFN-γ, TNF-α, кортизол) является значимым для диагностики шизофрении. Следует отметить, что данные параметры ассоциированы с важными клиническими характеристиками заболевания. Литературные данные указывают на их участие в патогенезе шизофрении.
Определение этих иммуновоспалительных биомаркеров предполагает меньшие временны´е, экономические и организационные затраты, чем нейровизуализация и исследование спинномозговой жидкости. Наша работа показала перспективность использования иммунологических параметров в клинической практике для объективизации диагноза шизофрении.
Заключение
В результате данной работы впервые с помощью методов машинного обучения показана возможность подтверждения диагноза шизофрении с точностью более 70% на основании оценки только параметров системного воспаления, врожденного и адаптивного иммунитета. Результаты являются подтверждением патогенетической значимости состояния иммунной системы и иммуновоспалительного синдрома при шизофрении.
В рамках следующего этапа исследования планируется анализ широкого спектра иммунологических параметров в составе мультимодальных данных с использованием методов машинного обучения для создания интерпретируемых моделей, которые могут быть использованы для выявления клинико-иммунологических вариантов психозов.
Источники финансирования. Работа проведена в рамках выполнения государственного задания НИЦ «Курчатовский Институт» и частично — за счет гранта Российского научного фонда №21-71-10136, https://rscf.ru/project/21-71-10136/.
Конфликт интересов. Конфликт интересов, связанный с данным исследованием, отсутствует.
Литература
- Jääskeläinen E., Juola P., Hirvonen N., McGrath J.J., Saha S., Isohanni M., Veijola J., Miettunen J. A systematic review and meta-analysis of recovery in schizophrenia. Schizophr Bull 2013; 39(6): 1296–1306, https://doi.org/10.1093/schbul/sbs130.
- Nordentoft M., Wahlbeck K., Hällgren J., Westman J., Osby U., Alinaghizadeh H., Gissler M., Laursen T.M. Excess mortality, causes of death and life expectancy in 270,770 patients with recent onset of mental disorders in Denmark, Finland and Sweden. PLoS One 2013; 8(1): e55176, https://doi.org/10.1371/journal.pone.0055176.
- Correll C.U., Galling B., Pawar A., Krivko A., Bonetto C., Ruggeri M., Craig T.J., Nordentoft M., Srihari V.H., Guloksuz S., Hui C.L.M., Chen E.Y.H., Valencia M., Juarez F., Robinson D.G., Schooler N.R., Brunette M.F., Mueser K.T., Rosenheck R.A., Marcy P., Addington J., Estroff S.E., Robinson J., Penn D., Severe J.B., Kane J.M. Comparison of early intervention services vs treatment as usual for early-phase psychosis: a systematic review, meta-analysis, and meta-regression. JAMA Psychiatry 2018; 75(6): 555–565, https://doi.org/10.1001/jamapsychiatry.2018.0623.
- Ferrara M., Guloksuz S., Mathis W.S., Li F., Lin I.H., Syed S., Gallagher K., Shah J., Kline E., Tek C., Keshavan M., Srihari V.H. First help-seeking attempt before and after psychosis onset: measures of delay and aversive pathways to care. Soc Psychiatry Psychiatr Epidemiol 2021; 56(8): 1359–1369, https://doi.org/10.1007/s00127-021-02090-0.
- Mirzakhanian H., Singh F., Cadenhead K.S. Biomarkers in psychosis: an approach to early identification and individualized treatment. Biomark Med 2014; 8(1): 51–57, https://doi.org/10.2217/bmm.13.134.
- Ellis J.K., Walker E.F., Goldsmith D.R. Selective review of neuroimaging findings in youth at clinical high risk for psychosis: on the path to biomarkers for conversion. Front Psychiatry 2020; 11: 567534, https://doi.org/10.3389/fpsyt.2020.567534.
- van Mierlo H.C., Schot A., Boks M.P.M., de Witte L.D. The association between schizophrenia and the immune system: review of the evidence from unbiased ‘omic-studies’. Schizophr Res 2020; 217: 114–123, https://doi.org/10.1016/j.schres.2019.05.028.
- Birnbaum R., Weinberger D.R. A genetics perspective on the role of the (neuro)immune system in schizophrenia. Schizophr Res 2020; 217: 105–113, https://doi.org/10.1016/j.schres.2019.02.005.
- Sun H.L., Bai W., Li X.H., Huang H., Cui X.L., Cheung T., Su Z.H., Yuan Z., Ng C.H., Xiang Y.T. Schizophrenia and inflammation research: a bibliometric analysis. Front Immunol 2022; 13: 907851, https://doi.org/10.3389/fimmu.2022.907851.
- Fernandes B.S., Karmakar C., Tamouza R., Tran T., Yearwood J., Hamdani N., Laouamri H., Richard J.R., Yolken R., Berk M., Venkatesh S., Leboyer M. Precision psychiatry with immunological and cognitive biomarkers: a multi-domain prediction for the diagnosis of bipolar disorder or schizophrenia using machine learning. Transl Psychiatry 2020; 10(1): 162, https://doi.org/10.1038/s41398-020-0836-4.
- Ferrara M., Franchini G., Funaro M., Cutroni M., Valier B., Toffanin T., Palagini L., Zerbinati L., Folesani F., Murri M.B., Caruso R., Grassi L. Machine learning and non-affective psychosis: identification, differential diagnosis, and treatment. Curr Psychiatry Rep 2022; 24(12): 925–936, https://doi.org/10.1007/s11920-022-01399-0.
- Sharaev M.G., Malashenkova I.K., Maslennikova A.V., Zakharova N.V., Bernstein A.V., Burnaev E.V., Mamedova G.S., Krynskiy S.A., Ogurtsov D.P., Kondrateva E.A., Druzhinina P.V., Zubrikhina M.O., Arkhipov A.Yu., Strelets V.B., Ushakov V.L. Diagnosis of schizophrenia based on the data of various modalities: biomarkers and machine learning techniques (review). Sovremennye tehnologii v medicine 2022; 14(5): 53, https://doi.org/10.17691/stm2022.14.5.06.
- Малашенкова И.К., Крынский С.А., Огурцов Д.П., Мамошина М.В., Захарова Н.В., Ушаков В.Л., Величковский Б.М., Дидковский Н.А. Роль иммунной системы в патогенезе шизофрении. Журнал неврологии и психиатрии им. С.С. Корсакова 2018; 118(12): 72–80, https://doi.org/10.17116/jnevro201811812172.
- Corponi F., Zorkina Y., Stahl D., Murru A., Vieta E., Serretti A., Morozova А., Reznik A., Kostyuk G., Chekhonin V.P. Frontal lobes dysfunction across clinical clusters of acute schizophrenia. Rev Psiquiatr Salud Ment 2021, https://doi.org/10.1016/j.rpsm.2021.12.002.
- Morozova A., Zorkina Y., Abramova O., Pavlova O., Pavlov K., Soloveva K., Volkova M., Alekseeva P., Andryshchenko A., Kostyuk G., Gurina O., Chekhonin V. Neurobiological highlights of cognitive impairment in psychiatric disorders. Int J Mol Sci 2022; 23(3): 1217, https://doi.org/10.3390/ijms23031217.
- Kartashov S.I., Vartanov A.V., Zakharova N.V., Arkhipov A.Yu., Strelets V.B., Maslennikova A.V., Ushakov V.L. Tractographic studies in the human brain at the norm and the paranoid schizophrenia. Procedia Comput Sci 2021; 190: 434–438, https://doi.org/10.1016/j.procs.2021.06.051.
- Kay S.R., Fiszbein A., Opler L.A. The positive and negative syndrome scale (PANSS) for schizophrenia. Schizophr Bull 1987; 13(2): 261–276, https://doi.org/10.1093/schbul/13.2.261.
- Goldsmith D.R., Rapaport M.H., Miller B.J. A meta-analysis of blood cytokine network alterations in psychiatric patients: comparisons between schizophrenia, bipolar disorder and depression. Mol Psychiatry. 2016; 21(12): 1696–1709, https://doi.org/10.1038/mp.2016.3.
- Malashenkova I.K., Krynskiy S.A., Ogurtsov D.P., Hailov N.A., Zakharova N.V., Bravve L.V., Kaydan M.A., Chekulaeva E.I., Andreyuk D.S., Ushakov V.L., Didkovsky N.A., Kostyuk G.P. Immunoinflammatory profile in patients with episodic and continuous paranoid schizophrenia. Consortium Psychiatricum 2021; 2(1): 19–31, https://doi.org/10.17816/cp66.
- Ushakov V.L., Malashenkova I.K., Kostyuk G.P., Zakharova N.V., Krynskiy S.A., Kartashov S.I., Ogurtsov D.P., Bravve L.V., Kaydan M.A., Hailov N.A., Chekulaeva E.I., Didkovsky N.A. The relationship between inflammation, cognitive impairments, and neuroimaging data in schizophrenia. Neurosci Behav Physiol 2021; 51(7): 873–881.
- Johnsen E., Fathian F., Kroken R.A., Steen V.M., Jørgensen H.A., Gjestad R., Løberg E.M. The serum level of C-reactive protein (CRP) is associated with cognitive performance in acute phase psychosis. BMC Psychiatry. 2016; 16: 60, https://doi.org/10.1186/s12888-016-0769-x.
- Zhang Q., He H., Cao B., Gao R., Jiang L., Zhang X., Dai J. Analysis of cognitive impairment in schizophrenia based on machine learning: Interaction between psychological stress and immune system. Neurosci Lett 2021; 760: 136084, https://doi.org/10.1016/j.neulet.2021.136084.
- Al-Hakeim H.K., Almulla A.F., Al-Dujaili A.H., Maes M. Construction of a neuro-immune-cognitive pathway-phenotype underpinning the phenome of deficit schizophrenia. Curr Top Med Chem 2020; 20(9): 747–758, https://doi.org/10.2174/1568026620666200128143948.
- Tanaka T., Narazaki M., Kishimoto T. IL-6 in inflammation, immunity, and disease. Cold Spring Harb Perspect Biol 2014; 6(10): a016295, https://doi.org/10.1101/cshperspect.a016295.
- Малашенкова И.К., Крынский С.А., Хайлов Н.А., Казанова Г.В., Величковский Б.Б., Дидковский Н.А. Роль цитокинов в консолидации памяти. Успехи современной биологии 2015; 135(5): 419–436.
- Malashenkova I.K., Ushakov V.L., Zakharova N.V., Krynskiy S.A., Ogurtsov D.P., Hailov N.A., Chekulaeva E.I., Ratushnyy A.Y., Kartashov S.I., Kostyuk G.P., Didkovsky N.A. Neuro-immune aspects of schizophrenia with severe negative symptoms: new diagnostic markers of disease phenotype. Sovremennye tehnologii v medicine 2021; 13(6): 24, https://doi.org/10.17691/stm2021.13.6.03.
- Momtazmanesh S., Zare-Shahabadi A., Rezaei N. Cytokine alterations in schizophrenia: an updated review. Front Psychiatry 2019; 10: 892, https://doi.org/10.3389/fpsyt.2019.00892.
- Chiang S.S.W., Riedel M., Schwarz M., Mueller N. Is T-helper type 2 shift schizophrenia-specific? Primary results from a comparison of related psychiatric disorders and healthy controls. Psychiatry Clin Neurosci 2013; 67(4): 228–236, https://doi.org/10.1111/pcn.12040.
- de Campos-Carli S.M., Miranda A.S., Dias I.C., de Oliveira A., Cruz B.F., Vieira É.L., Rocha N.P., Barbosa I.G., Salgado J.V., Teixeira A.L. Serum levels of interleukin-33 and its soluble form receptor (sST2) are associated with cognitive performance in patients with schizophrenia. Compr Psychiatry 2017; 74: 96–101, https://doi.org/10.1016/j.comppsych.2017.01.008.
- Musso T., Gusella G.L., Brooks A., Longo D.L., Varesio L. Interleukin-4 inhibits indoleamine 2,3-dioxygenase expression in human monocytes. Blood 1994; 83(5): 1408–1411, https://doi.org/10.1182/blood.V83.5.1408.1408.










