Формирование клапана при колостомии с использованием сферических имплантатов на основе никелида титана с заворачиванием и без заворачивания серозно-мышечного слоя кишки
Наложение классической колостомы не позволяет контролировать пассаж кишечного отделяемого. Данный недостаток обусловливает необходимость разработки новых материалов имплантатов и новых способов формирования клапана.
Цель исследования — оценить возможность использования для формирования клапана при колостомии сферических имплантатов на основе никелида титана с заворачиванием и без заворачивания серозно-мышечного слоя кишки.
Материалы и методы. Эксперименты выполнены на 45 крысах-самцах линии Wistar со средней массой тела 587±10 г.Все животные в зависимости от вида оперативного вмешательства были распределены на три группы. В контрольной группе (n=15) выполняли создание классической одноствольной колостомы без применения сферических имплантатов. В 1-й опытной группе (n=15) формировали колостому с применением сферических имплантатов из никелида титана с заворачиванием серозно-мышечного слоя кишки; во 2-й опытной группе (n=15) ту же процедуру выполняли без заворачивания серозно-мышечного слоя. Для оценки клинического состояния животных осуществляли мониторинг динамики массы тела, наблюдали за потреблением корма и воды, за наличием выделений из стомы; регистрировали осложнения. Животных выводили из эксперимента на 7-, 30-, 60-е сутки. Во время некропсии макроскопически оценивали состояние органов брюшной полости, отмечая наличие спаечного процесса. Оценку выраженности воспалительного процесса в области оперативного вмешательства осуществляли с помощью гистологических исследований.
Результаты. Выживаемость животных во всех трех группах составила 100%. В группе с формированием колостомы без заворачивания серозно-мышечного слоя получен хороший эффект регенерации в области стомы, отмечено полное соединение кожного лоскута и стенки кишки. Макроскопически спаечный и воспалительный процессы брюшины в контрольной и двух опытных группах были минимальны.
Заключение. В ходе моделирования колостомы показаны преимущества применения при ее формировании сферических имплантатов из никелида титана без заворачивания серозно-мышечного слоя кишки по сравнению с классическим формированием. При этом заворачивание серозно-мышечного слоя кишки при использовании сферических имплантатов из никелида титана проигрывает классическому формированию колостомы.
Введение
Несмотря на значительный прогресс в хирургической технике, колостомия с формированием одноствольной колостомы в качестве временного или постоянного варианта оперативного вмешательства широко применяется в практике хирургического лечения заболеваний и травм толстой кишки [1–3]. В РФ колоректальный рак является одним из наиболее часто встречаемых онкологических заболеваний. Так, в период с 2011 по 2021 гг. прирост заболеваемости раком ободочной кишки составил 25,3%, а раком прямой кишки — 15,5% [4].
В сложившейся ситуации создание функциональной колостомы с минимальным числом осложнений при хирургическом лечении заболеваний и травм толстой кишки привлекает внимание хирургов. К настоящему времени описано свыше 200 методов колостомии [5], однако ни один из них не отвечает всем необходимым требованиям из-за большого числа осложнений, возникающих в области колостомы как в раннем, так и в позднем послеоперационном периоде. Частота осложнений в области колостомы, по данным разных авторов, колеблется от 6,5 до 90,9% [5]. Помимо наличия осложнений существует проблема обслуживания колостомы, связанная с постоянным функционированием кишечника и, соответственно, выделением содержимого. Например, во время кашля у пациента может неконтролируемо выделиться кишечное содержимое, так как в это время повышается внутрибрюшное давление. Возможны выделения из кишечника во время сна. Обеспечение надежного запирающего эффекта существенно повышает качество жизни.
Таким образом, большое число осложнений в области сформированной колостомы, развивающихся как после неотложных, так и после плановых операций в раннем и позднем послеоперационных периодах, обусловливает актуальность поиска новых способов формирования клапана при колостомии.
Решение данной проблемы стало возможным с использованием материалов на основе никелида титана, которые при температуре тела проявляют сверхэластичные гистерезисные свойства [6]. Высокая стабильность физико-механических характеристик таких сплавов в течение длительного времени и возможность программного управления параметрами формоизменения позволяют создавать имплантаты, которые будут выполнять возложенную на них функциональную задачу и станут неотъемлемой частью структуры организма. Имплантированная в организм конструкция из такого сплава деформируется в соответствии с закономерностями эластичного поведения тканей, обеспечивая гармоничное функционирование всей системы «ткань организма–имплантат» [7].
Ряд отечественных авторов демонстрируют применение конструкций из никелида титана с надежными и стабильными результатами. Авторы [8] использовали пористый никелид титана при лапароскопической герниопластике. Данную методику они предлагают применять в качестве альтернативы существующим методам лапароскопической предбрюшинной герниопластики при паховых грыжах. Для хирургического лечения ректовагинального свища было выполнено наложение компрессионного зажима из никелида титана. Формирование компрессионного шва при помощи никелид-титанового зажима обеспечивает лучшие условия для заживления тканей, менее выраженную и непродолжительную воспалительную реакцию тканей, раннее развитие их репаративной регенерации [9]. В онкологической практике осуществляется эндопротезирование стенок орбиты глаза имплантатами из никелида титана. Наиболее хороших результатов удалось достичь при использовании тонкопрофильных имплантатов с памятью формы, сочетающих в себе выраженную каркасную функцию пористых имплантатов и тонкость тканевых [10]. Авторы утверждают, что применение тонкопрофильных имплантатов сокращает длительность репаративных процессов практически вдвое.
В зарубежной литературе показано широкое применение никелида титана в разных областях медицины, включая ортопедию, сердечно-сосудистую хирургию, ортодонтию и другие медицинские направления [11–14]. L. Sadri с соавт. [15] демонстрируют преимущества использования стентов из никелида титана, конструкция которых образует структурный каркас, позволяющий эластичным свойствам металла укреплять стенку артерий нижних конечностей. M. Ohno с соавт. [16] применяли саморасширяющиеся металлические стенты из никелида титана для лечения злокачественного колоректального стеноза. Авторы исследовали эффективность и безопасность металлических стентов для пожилых людей в паллиативной практике. Однако при анализе отечественной и зарубежной литературы за последние 5 лет не выявлено ни одного упоминания об использовании конструкций из никелида титана для формирования клапана при колостомии, что еще раз подчеркивает актуальность данной темы.
Авторами [17] в эксперименте сплав никелида титана был использован с целью формирования колостомы с удерживающей функцией для обеспечения постоянного функционирования, повышения удобства пользования и уменьшения вероятности осложнений. Был предложен способ формирования искусственного сфинктера, содержащего кольцевой металлический имплантат, устанавливаемый в охват терминального участка кишки. Имплантат выполнен из сверхэластичного никелида титана в виде слоистой цилиндрической втулки с продольным разрезом. Наружные слои имплантата выполнены из пористого материала, промежуточный слой — из сплошного материала, равномерно перфорированного отверстиями. В момент формирования колостомы после подшивания толстой кишки к апоневрозу устройство накладывают в виде манжеты на терминальный участок кишки и погружают в подкожно-жировую клетчатку.
Недостатком данного метода стала жесткость втулки, из-за которой ее деформационные характеристики в значительной степени отличаются от деформационных характеристик окружающих тканей. Это отличие может служить травмирующим фактором и источником дискомфорта пациента. Использование такой формы имплантата не привело к ожидаемому результату и не дошло до клинических испытаний. Для решения данной проблемы авторами предложен способ формирования клапана с использованием сферических имплантатов на основе никелида титана с заворачиванием и без заворачивания серозно-мышечного слоя кишки [18].
Цель исследования — оценить возможность использования для формирования клапана при колостомии сферических имплантатов на основе никелида титана с заворачиванием и без заворачивания серозно-мышечного слоя кишки.
Материалы и методы
Животные. Эксперименты выполнены на 45 крысах-самцах линии Wistar со средней массой тела 587±10 г в соответствии с правилами, принятыми Европейской конвенцией по защите позвоночных животных, используемых для экспериментов или в иных научных целях (1986), а также с правилами «Quality practices in basic biomedical research» — QSBR (2001). Процедуры с животными были рассмотрены и утверждены биоэтическим комитетом Сибирского государственного медицинского университета (протокол №8471 от 09.11.2020 г.). Условия содержания животных соответствовали стандартам, указанным в руководстве «Guide for Care and Use of Laboratory Animals» (2011).
Животные были получены из SPF-вивария Института цитологии и генетики Сибирского отделения РАН (Новосибирск). Клинически они были здоровы, имели ветеринарный сертификат качества и состояния здоровья. В ходе эксперимента животные находились в идентичных условиях.
Распределение животных по группам. Было образовано три группы по 15 особей:
контрольная группа, в которой животным проводили оперативное вмешательство по созданию классической одноствольной колостомы без применения сферических имплантатов;
1-я опытная группа, в которой проводили оперативное вмешательство по формированию колостомы с применением сферических имплантатов из никелида титана с заворачиванием серозно-мышечного слоя ободочной кишки;
2-я опытная группа, в которой проводили оперативное вмешательство по формированию колостомы с применением сферических имплантатов из никелида титана без заворачивания серозно-мышечного слоя ободочной кишки.
Дизайн исследования
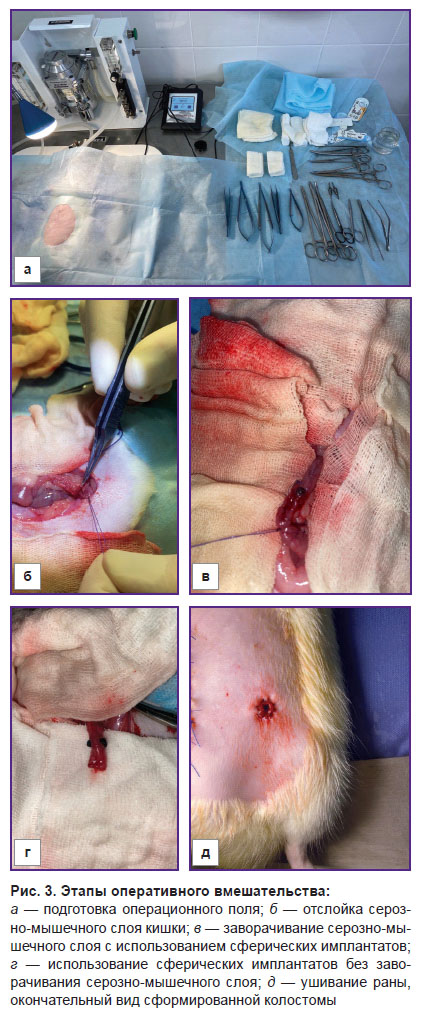
Экспериментальная модель колостомы с использованием никелид-титановых имплантатов. Создание кишечного клапана при колостомии осуществляли путем сужения кишки комбинацией имплантатов на основе сверхэластичного никелида титана (рис. 1, 1).Операцию выполняли путем наложения на кишку симметрично с двух сторон двух имплантатов сферической формы, скатанных из никелид-титановой проволоки (нитей) (рис. 1, а). Диаметр имплантатов выбирали в диапазоне 25–35% диаметра кишки. Имплантаты сводили навстречу друг другу до смыкания просвета (рис. 1, б), после чего стягивали края образовавшихся складок поверх имплантатов и фиксировали в таком положении швами (рис. 1, в). Оптимальное сечение проволоки для создания запорного аппарата установлено в диапазоне 60–100 мкм [18]. Скатанные клубками сферические имплантаты из такой проволоки наиболее близки по своим деформационным свойствам к мягким биологическим тканям кишки. Травматизирующие воздействия отсутствуют, поскольку развитая микропористая поверхность тонкой проволоки интегрируется с окружающими тканями. Более толстая проволока обладает чрезмерной жесткостью, а менее толстая не обеспечивает необходимых каркасных свойств. Функционирование запорного аппарата определяется формированием суженного участка кишки, образованного складками в области размещения имплантатов. Стягивание краев складок при наложении швов производится дозированным усилием до перекрытия просвета.
В соответствии с деформационными характеристиками, свойственными сверхэластичному никелиду титана (рис. 2), его деформация ε с повышением давления σ наблюдается после достижения определенного порога (220–230 МПа). В этот момент сферические имплантаты сминаются, запорный аппарат (клапан) открывается. После отхождения содержимого давление падает и происходит обратная деформация, клапан закрывается [18].
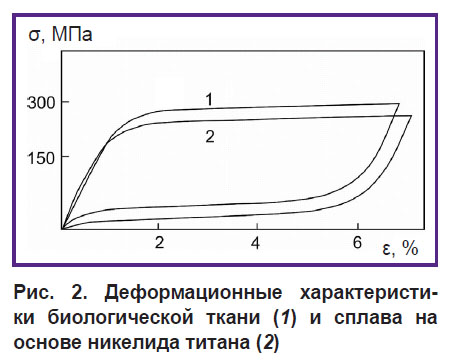 |
Рис. 2. Деформационные характеристики биологической ткани (1) и сплава на основе никелида титана (2) |
Условия проведения. Исследование проводили на базе Центра доклинических исследований ЦНИЛ Сибирского государственного медицинского университета (Томск). В статье представлены данные, полученные с декабря 2020 по март 2023 г.
Хирургическая техника. Оперативные вмешательства выполняли под общей анестезией с использованием ингаляции 1,5% Изофлурана (Karizoo, Испания) для введения в наркоз и поддержания анестезии. Премедикацию проводили подкожным введением 0,1% раствора атропина сульфата (Московский эндокринный завод, Россия) в дозе 0,2 мг/кг. Формирование колостомы осуществляли под шестикратным оптическим увеличением с использованием операционного микроскопа (Carl Zeiss, Германия) и набора микрохирургического инструментария.
Животное укладывали на спину на специальную подогреваемую панель (Kent Scientific Corporation, США). Предварительно удаляли шерсть триммером с передней брюшной стенки и трехкратно обрабатывали операционное поле спиртовым раствором хлоргексидина 0,05% (Тульская фармацевтическая фабрика, Россия) (рис. 3, а).
В стерильных условиях проводили срединную лапаротомию (разрез длиной приблизительно 5 см), ревизию брюшной полости, после чего нисходящий отдел ободочной кишки выводили в рану. Брыжейку рассекали от стенки кишки до корня, кровеносные сосуды перевязывали. У животных контрольной группы выполняли классическое формирование одноствольной колостомы.
В 1-й группе, в которой формирование колостомы происходило с применением сферических имплантатов из никелида титана с заворачиванием серозно-мышечного слоя ободочной кишки, для лучшей ориентировки в тканях на уровне формирования колостомы 0,5% раствором лидокаина («ДАЛЬХИМФАРМ», Россия) с помощью инсулинового шприца и иглы 32 G (SFM Hospital Products, Германия) проводили гидропрепаровку серозно-мышечного слоя.
Имплантаты сводили навстречу друг другу, после чего подтягивали края образовавшихся складок кишки и фиксировали в таком положении отдельными узловыми швами, используя шовный хирургический материал «Пролен 7/0–8/0» (Johnson & Johnson, США). При указанном соотношении диаметра кишки и диаметра имплантатов обеспечивалась непрерывность внешнего профиля запорного аппарата. За счет естественной толщины стенок кишки внутренний профиль сужался до перекрытия просвета и реализации запорного эффекта. Имплантаты помещали поверх серозно-мышечного слоя или дополнительно закатывали вскрытым с дистальной стороны серозно-мышечным слоем в зависимости от варианта исполнения (рис. 3, б–г).
В обеих опытных группах слизисто-подслизистый слой циркулярно перевязывали дистальнее сформированного запорного аппарата на 1 см и отсекали. Дистальную культю ободочной кишки ушивали 3-рядным швом, после чего погружали в брюшную полость.
После этого в левой подвздошной области проводили круглое иссечение кожи и подкожной клетчатки до апоневроза. Соответственно размерам после иссечения выполняли рассечение апоневроза. Волокна мышц брюшной стенки раздвигали тупо, вскрывали брюшину. Затем мобилизовали преколостомический отдел ободочной кишки на протяжении 1,5–2,0 см, сохраняя брыжейку с краевыми кровеносными сосудами. Через выполненный разрез передней брюшной стенки выводили наружу терминальный отдел ободочной кишки со сформированным запорным аппаратом (в случае его исполнения), фиксируя к апоневрозу. Со стороны брюшной полости мобилизованный отдел ободочной кишки дополнительно фиксировали узловым швом к париетальной брюшине левого бокового кармана и завершали формирование колостомы с запорным аппаратом.
По окружности колостомы кожу сшивали с выступающим слизисто-подслизистым слоем отдельными узловыми швами с использованием шовного хирургического материала «Викрил 6-0» (Johnson & Johnson, США). Брюшину и апоневроз ушивали «Этибондом 3-0» (Johnson & Johnson, США) непрерывным швом, затем выполняли наложение отдельных узловых швов на кожу и подкожно-жировую клетчатку, используя шовный хирургический материал «Пролен 4-0» (Johnson & Johnson, США) (рис. 3, д). Поверхность раны обрабатывали антисептиком, животных помещали в индивидуальные клетки.
В послеоперационном периоде (14 сут) каждому животному проводили профилактику инфекционных осложнений энрофлоксацином («Апи-Сан», Москва) в дозе 15 мг/кг массы тела, разведенным в 200 мл питьевой воды, per os. Для анальгезии в первые двое суток после операции животные получали также кетопрофен («ВИК-здоровье животных», Беларусь) в дозировке 5 мг/кг 1 раз в сутки.
Для оценки клинического состояния животных выполняли их взвешивание, обращали внимание на потребление корма, воды, наличие выделений из стомы, регистрировали осложнения.
Животных из каждой группы выводили из эксперимента на 7-е (n=5), 30-е (n=5) и 60-е (n=5) сутки исследования. Эвтаназию проводили путем передозировки ингаляционного наркоза, указанного ранее. После вскрытия брюшной полости макроскопически оценивали состояние внутренних органов, включая наличие или отсутствие спаечного процесса. Затем выполняли забор участка сформированной колостомы с запорным аппаратом для гистологического исследования. Процесс сопровождали фотофиксацией.
В общем виде схема эксперимента выглядела следующим образом (рис. 4).

|
Рис. 4. Схема эксперимента |
Методы исследования. Для оценки динамики массы тела животных взвешивали на 1, 2, 3, 4, 5, 7, 30, 60-е сутки.
Гистологическое исследование. После выполнения некропсии материал помещали в 10% pH-нейтральный раствор формалина. Общая продолжительность фиксации операционного материала не превышала 18–24 ч. Гистологическую проводку материала осуществляли по стандартной методике в автоматическом гистопроцессоре ASP 6025 (Leica Microsystems, Германия) и заливали в парафин. Гистологические срезы толщиной 4–5 мкм получали с парафиновых блоков при помощи санного микротома HM 430 (Thermo Fisher Scientific, Германия). Окрашивание микропрепаратов осуществляли готовым раствором гематоксилина и эозина в аппарате Varistain™ Gemini (Thermo Fisher Scientific, Великобритания).
Морфологическое исследование проводили с помощью светового микроскопа Axio Scope A1 (Carl Zeiss, Германия). Фотографирование гистологических микропрепаратов выполняли с использованием цифровой камеры AxioCam ICc5 (Carl Zeiss, Германия) c программой компьютерного анализа изображений AxioVision 4.6.3 (Carl Zeiss, Германия). Морфологическое исследование включало оценку наличия и выраженности инфильтрации области стомы иммунными клетками воспаления, а также оценку фиброза и некротических изменений. Выраженности изменений (согласно разработанной авторами шкале) присваивали баллы от 0 до 3 (0 — отсутствие воспаления, фиброза и некротических изменений; 1 — слабовыраженные; 2 — умеренно выраженные; 3 — выраженные изменения).
Растровая электронная микроскопия. Интеграция разработанных сферических образцов на основе никелида титана в организм экспериментальных животных исследована методом растровой электронной микроскопии. Работы проводили с помощью растрового электронного микроскопа Quanta 200 3D (FEI Company, США) с использованием режима вторичных электронов и низкого вакуума для исследования биологических объектов. Электронные изображения получали при ускоряющем напряжении 20 кВ, ток электронного пучка — 0,41 пА, давление в рабочей камере — 2,6 МПа.
Статистический анализ. Статистическую обработку данных проводили с помощью программы Statistica 13.0 (StatSoft Inc., США). При оценке динамики массы тела животных проверку на нормальность распределения значений осуществляли с помощью критерия Шапиро–Уилка. Поскольку распределение значений отличалось от нормального, использовали критерий Краскела–Уоллиса. Относительные частоты баллов интенсивности воспалительной реакции оценивали с помощью критерия согласия Пирсона. Различия между экспериментальными группами считали статистически значимыми при p<0,05.
Результаты
Общая продолжительность оперативного вмешательства составляла 90±30мин. Выживаемость животных в ходе эксперимента — 100% (45 крыс).
В ходе наблюдения все животные с первого дня после операции вели активный образ жизни, пили, однако корм в течение первых трех суток потребляли в минимальном объеме (10±5 г), в последующие дни аппетит восстанавливался (до 35±5 г). Отделяемое из стомы у животных контрольной и 1-й опытной групп появлялось на 2-е сутки после операции. Во 2-й опытной группе отделяемое регистрировали уже на 1-е сутки после операции в виде неоформленных каловых масс, отходивших регулярно. Заживление раневых поверхностей кожи происходило на 7-е сутки во всех группах.
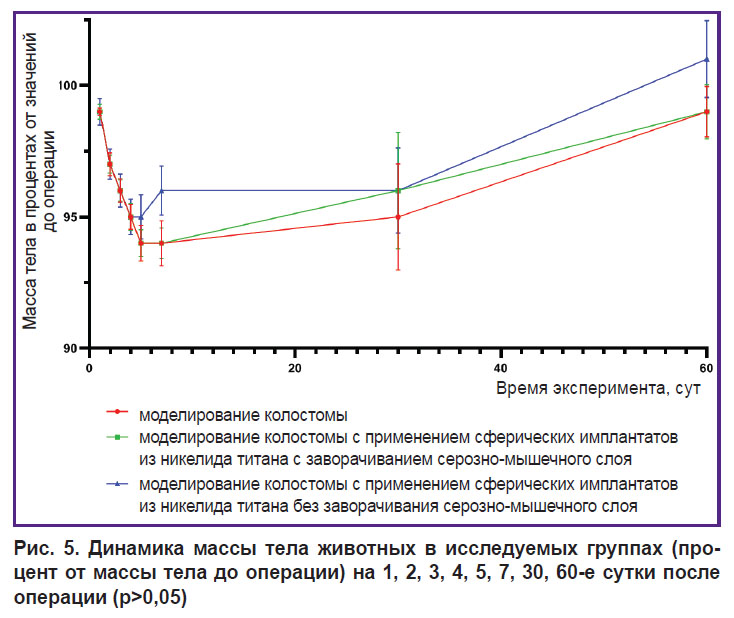
Исследование показало, что моделирование колостомы с применением сферических имплантатов из никелида титана (как с заворачиванием серозно-мышечного слоя ободочной кишки, так и без заворачивания) не приводит к изменениям динамики массы тела животных в сравнении с теми, у которых формировали колостому классическим способом (рис. 5).
|
Рис. 5. Динамика массы тела животных в исследуемых группах (процент от массы тела до операции) на 1, 2, 3, 4, 5, 7, 30, 60-е сутки после операции (p>0,05) |
Обобщенные данные изменения массы тела животных (процент от массы тела до операции) представлены в таблице.

|
Изменения массы тела животных (процент от массы тела до операции), Me [Q1; Q3] |
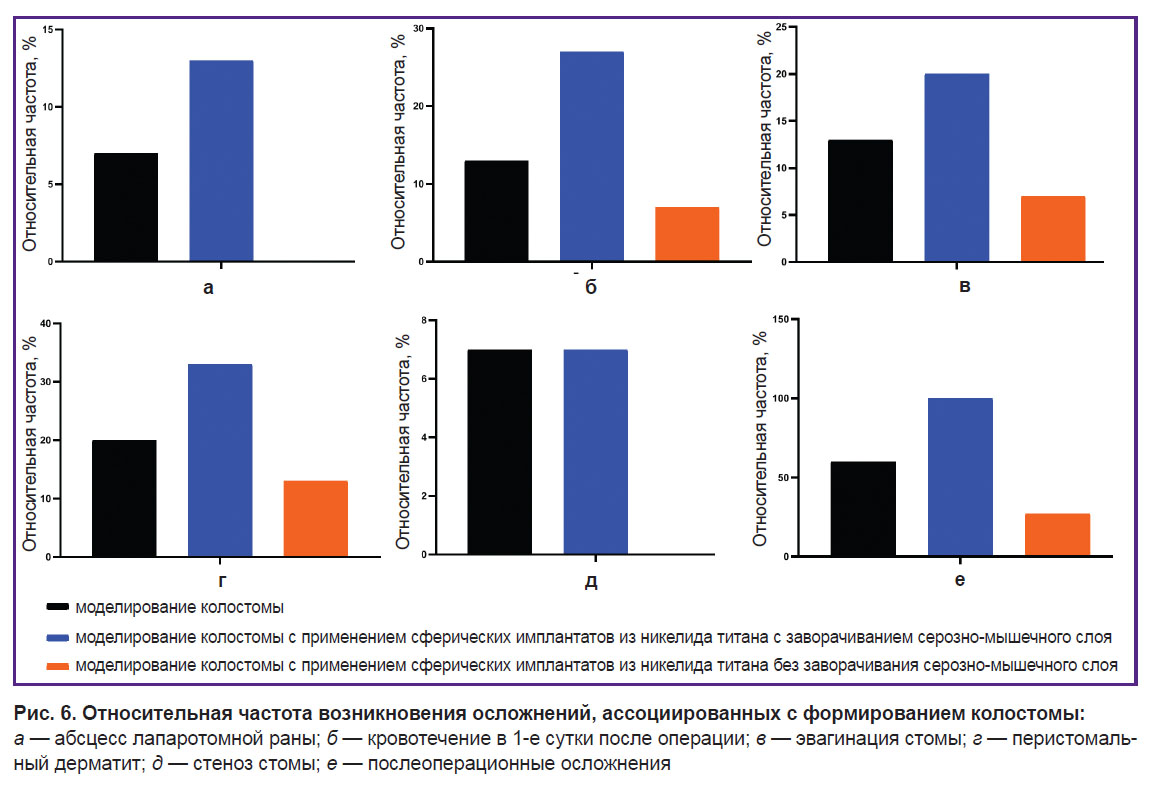
Формирование абсцесса лапаротомной раны возникло в трех случаях (1 — в контрольной группе; 2 — в 1-й группе) на 11-е сутки после операции, что проявлялось выраженной припухлостью в области швов (рис. 6, а). Под общей анестезией 1,5% Изофлурана проводили вскрытие абсцесса, санацию раны водным раствором антисептика и продлевали антибактериальную терапию до 21 сут. Изменением общего соматического состояния данное осложнение не сопровождалось. Оно не связано с применением никелида титана, поскольку развитие абсцесса имело место также в контрольной группе.
Непродолжительное кровотечение у 7 животных всех групп (2 — в контрольной группе; 4 — в 1-й опытной и 1 — во 2-й опытной) возникло на 1-е сутки после операции и прекратилось самостоятельно (рис. 6, б). Эвагинация стомы на 5 мм у двух животных контрольной, у 3 — 1-й опытной и у 1 — 2-й опытной группы отмечена на 60-е сутки; она не сопровождалась нарушением пассажа кишечного содержимого (рис. 6, в). Перистомальный дерматит встречался у 10 крыс (у 3 — в контрольной; у 5 — в 1-й опытной и у 2 — во 2-й опытной группе) на 5-е сутки после операции. Он провоцировался отделяемым по стоме и характеризовался самостоятельным уходом крысы за ним (рис. 6, г). Стеноз стомы регистрировали только у двух особей: у 1 — в контрольной и у 1 — в 1-й опытной группе — на 28-е сутки, что проявлялось скудным выделением из стомы и ухудшением общего состояния (рис. 6, д). Данных животных выводили из эксперимента на 30-е сутки с дальнейшим гистологическим исследованием забранного участка сформированной колостомы.
При проведении некропсии области оперативного вмешательства отмечено, что спаечный процесс и воспалительные проявления брюшины во всех группах были минимальными.
Результаты оценки относительной частоты послеоперационных осложнений при экспериментальном моделировании колостомы с применением сферических имплантатов из никелида титана без заворачивания серозно-мышечного слоя ободочной кишки также свидетельствуют об эффективности данного способа моделирования (рис. 6, е) и необходимости углубленного изучения его с возможной последующей интеграцией в клиническую практику.
Морфологическая картина сформированных колостом во всех группах имела свои особенности.
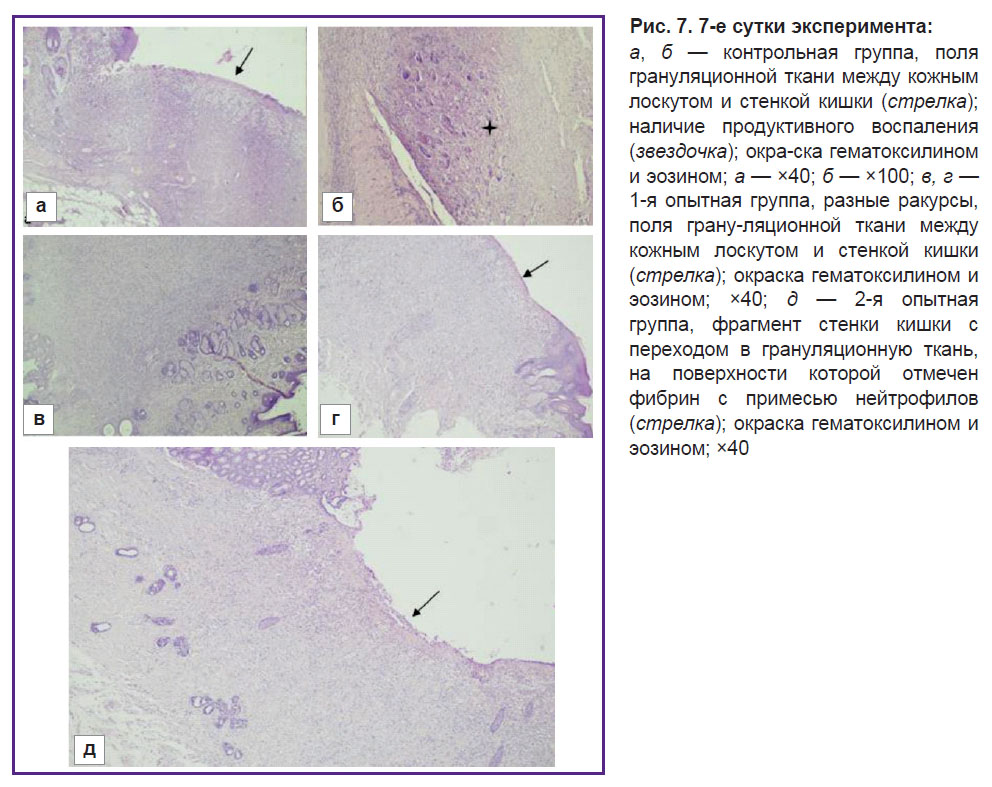
На 7-е сутки в контрольной группе у четырех из пяти животных на границе стенки кишки и кожного лоскута отмечено разрастание грануляционной ткани с признаками острого воспаления в виде некротических изменений и лейкоцитарной инфильтрации с примесью фибрина, а также наличие картины продуктивного воспаления с примесью многоядерных клеток. В образцах отсутствует сочленение стенки кишки и кожного лоскута из-за сохранения полей грануляционной ткани (рис. 7, а, б). У одного животного в группе морфофункциональная картина соответствовала норме.
В 1-й опытной группе у трех из пяти животных на 7-е сутки на границе кожного лоскута и стенки кишки определяются крупные поля грануляционной ткани, капилляров и диффузная лимфоидная выраженная инфильтрация с примесью нейтрофилов. Края слизистой оболочки и кожного лоскута разобщены, разделены грануляционной тканью, на поверхности которой вместо слизистой оболочки располагаются нейтрофилы с примесью нитей фибрина (рис. 7, в, г). У двух животных из данной группы наблюдались признаки выраженного воспаления в виде наличия некротических изменений.
Во 2-й опытной группе у одного животного на 7-е сутки между эпидермисом и стенкой кишки определяется протяженный участок, представленный грануляционной тканью с капиллярами, лимфогистиоцитарной инфильтрацией с примесью эозинофилов. На поверхности дефекта — фибрин и нейтрофилы. На остальном протяжении гистологическое строение кишки сохранено. Слизистая оболочка имеет типичное строение (рис. 7, д). У двух животных наблюдались признаки умеренного воспаления, еще у двух — выраженное воспаление, но без некротических изменений.
На 30-е сутки у трех животных контрольной группы состоятельность колостомы сохранена, отмечается отчетливая граница между эпидермисом и слизистой оболочкой толстой кишки. В дерме отмечаются фиброз с умеренно выраженной лимфогистиоцитарной инфильтрацией с примесью эозинофилов и явления ангиоматоза. Прилежащая к кожному лоскуту стенка кишки имеет слизистую оболочку типичного гистологического строения. На границе с дермой в подслизистом слое наблюдаются явления фиброза. Мышечный слой кишки — без особенностей (рис. 8, а, б). У двух животных прослеживалось выраженное воспаление с диффузной лимфоидной инфильтрацией с примесью нейтрофилов.
В 1-й опытной группе к этому сроку у одного из пяти животных наблюдаются фиброз с умеренно выраженной лимфогистиоцитарной инфильтрацией с примесью эозинофилов и явления ангиоматоза. У четырех особей на границе между кожным лоскутом и слизистой оболочкой определяетсяумеренно выраженная лимфогистиоцитарная инфильтрация с очагами некроза эпидермиса. На границе стомы, как в дерме, так и в стенке кишки, отмечается формирование грануляционной ткани с ангиоматозом с умеренно выраженной инфильтрацией лимфоцитами с примесью макрофагов, эозинофилов и нейтрофилов (рис. 8, в, г).
Во 2-й опытной группе на 30-е сутки у одного животного эпидермис кожи сохранен, отмечается типичное гистологическое строение с явлением паракератоза. В дерме наблюдается выраженный фиброз с умеренно выраженной лимфогистиоцитарной инфильтрацией с примесью эозинофилов и крупных эпителиоидных клеток. В области стомы в стенке кишки определяются фиброз, умеренно выраженная лимфогистиоцитарная инфильтрация с примесью эозинофилов, отмечаются наличие сосудов и умеренно выраженный отек. Мышечный слой кишки — без особенностей. Образец показывает полную состоятельность области анастомоза с картиной хронического неспецифического воспаления слабой степени активности, умеренно выраженного фиброза и ангиоматоза в виде сформированных капилляров (рис. 8, д, е). У трех крыс наблюдаются фиброз с умеренно выраженной лимфогистиоцитарной инфильтрацией с примесью эозинофилов и явления ангиоматоза. У одного животного отмечена картина хронического воспаления высокой степени активности.
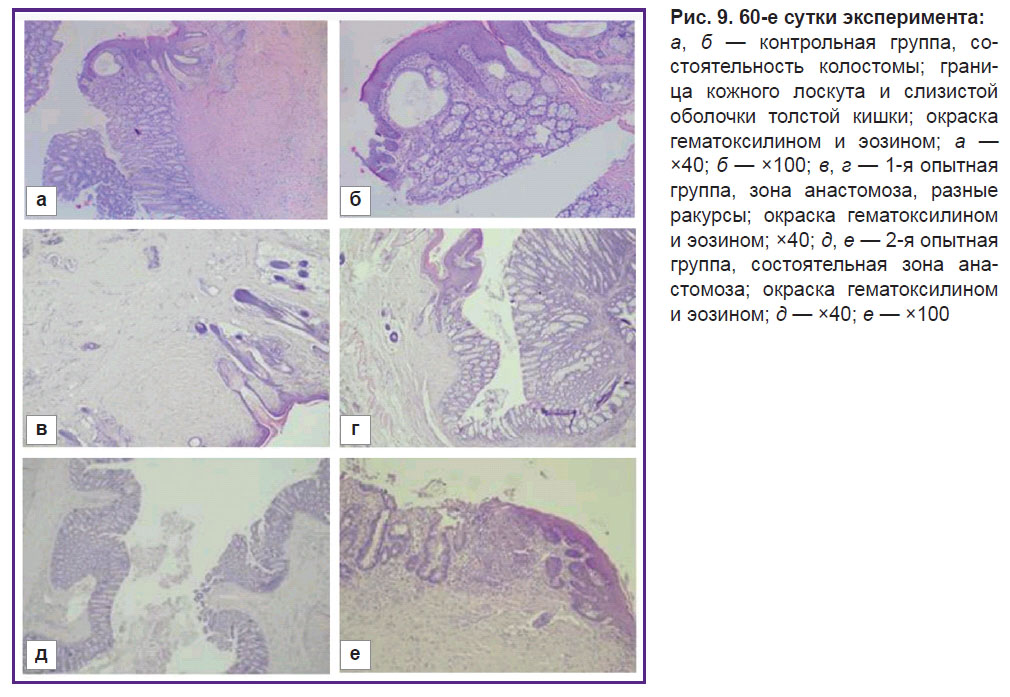
К 60-м суткам в контрольной группе у одного из пяти животных колостомапризнанасостоятельной, отмечаются фиброз стромы и слабо выраженная лимфоидная инфильтрация (рис. 9, а, б). В остальных образцах (n=4) наблюдается картина умеренного и выраженного воспаления.
В 1-й опытной группе к 60-м суткам у двух из пяти животных отмечается состоятельность стомы с адекватными явлениями регенерации, при этом обнаруживается развитие фиброза как в дерме, так и в стенке кишки, со слабо выраженной лимфоидной инфильтрацией стромы. Осложнений со стороны дермы и стенки кишки не встречается (рис. 9, в, г). Остальные образцы (n=3) в области стомы имели картину выраженного фиброза с воспалительной инфильтрацией лимфоцитами.
Во 2-й опытной группе на 60-е сутки у трех животных эпидермис сохранен, имеет типичное гистологическое строение с явлением умеренной гиперплазии. В дерме отмечается выраженный фиброз со слабо выраженной лимфоидной инфильтрацией и слабо выраженным отеком. У прилежащей к кожному лоскуту стенки кишки слизистая оболочка имеет типичное гистологическое строение. Данные образцы показали хороший эффект регенерации в области стомы c уменьшением воспалительной инфильтрации. Отмечено полное соединение кожного лоскута и стенки кишки в области анастомоза (рис. 9, д, е). У двух животных сохранялась умеренно выраженная воспалительная инфильтрация.
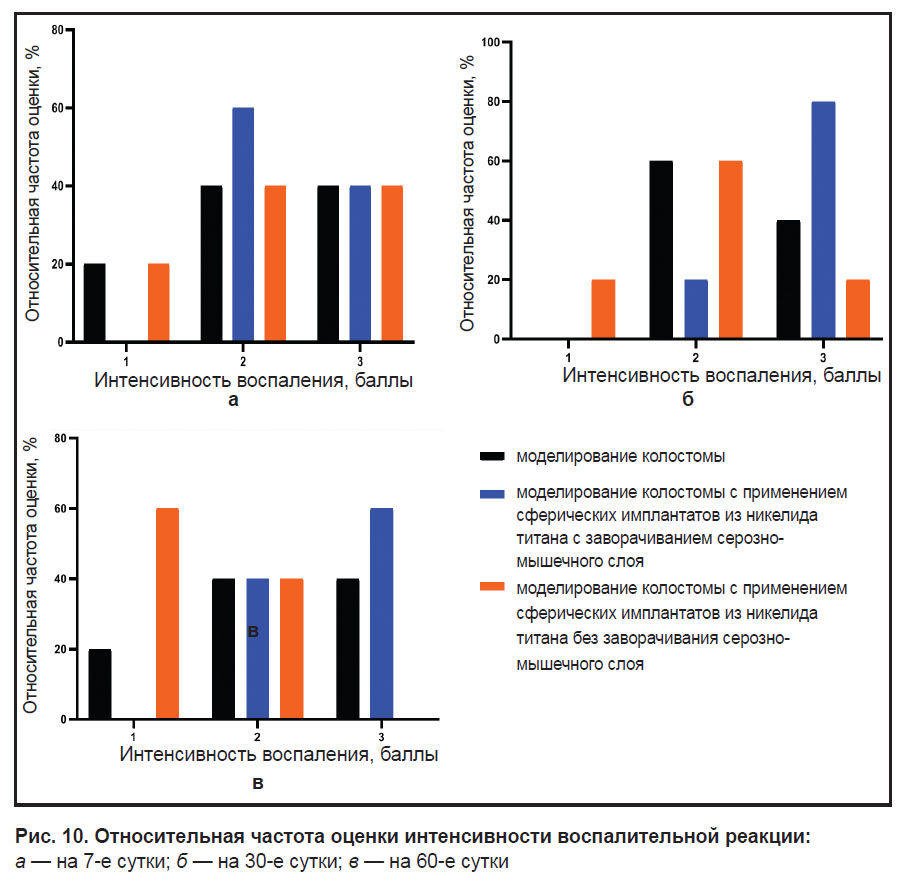
Результаты относительной частоты оценки интенсивности воспалительной реакции в процентах при экспериментальном моделировании колостом с применением сферических имплантатов из никелида титана без заворачивания серозно-мышечного слоя ободочной кишки также служат основанием для углубленного изучения данного способа моделирования колостомы с возможной последующей интеграцией в клиническую практику (рис. 10).
|
Рис. 10. Относительная частота оценки интенсивности воспалительной реакции:
а — на 7-е сутки; б — на 30-е сутки; в — на 60-е сутки |
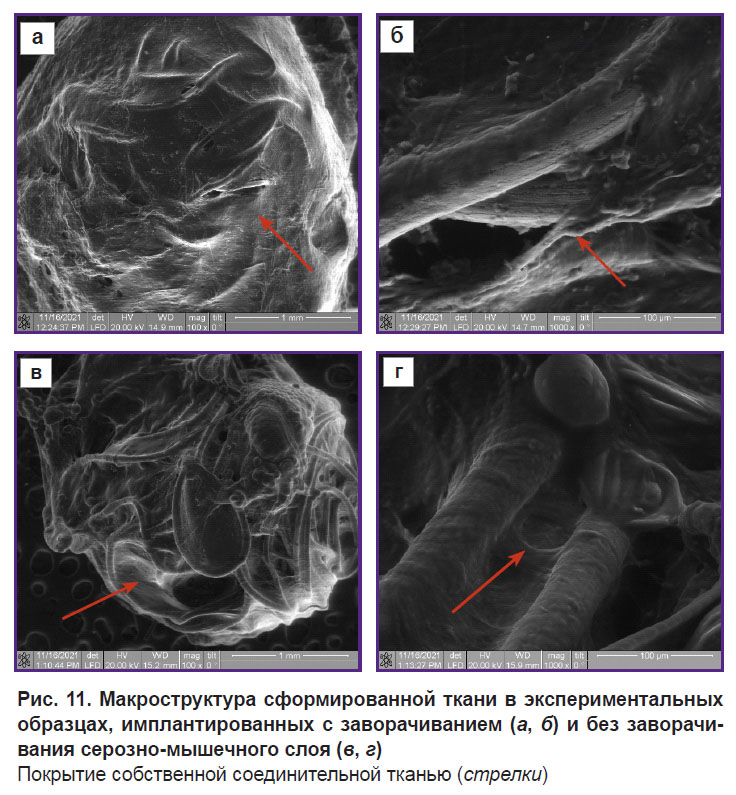
Анализ снимков структуры сферических имплантатов, полученных методом растровой электронной микроскопии, показал высокую интеграционную связь имплантатов с тканями организма животных в обоих случаях — с заворачиванием (рис. 11, а, б) и без заворачивания серозно-мышечного слоя (рис. 11, в, г). В случае без заворачивания сквозь вновь образованную ткань хорошо просматривается развитая структура поверхности имплантата, которая покрыта тканью разной плотности. Все свободное пространство между нитями заполнено. В случае с заворачиванием внешняя сферическая поверхность имплантата покрыта плотной собственной тканью, которая не позволяет определить структуру нитей. Особенность данного случая заключается в том, что объем имплантата частично заполнен новообразованной тканью.
В обоих случаях на поверхности тонких нитей, формирующих сферический имплантат, наблюдали новообразованную ткань, которая обволакивает шероховатую поверхность (рис. 11, б, г). На поверхности отдельных нитей видны клетки — псевдоподии, которые распространяются от одной поверхности к другой, заполняя свободное пространство. Новообразованная ткань между нитями имеет разную плотность в зависимости от расстояния между поверхностями, поскольку заполняется псевдоподиями и межклеточными волокнами. Наблюдаются как плотные участки, которые заполняют свободное пространство между нитями, так и отдельные псевдоподии, соединяющие противоположные поверхности. Кроме того, в некоторых участках имплантата наблюдаются отдельные клетки, которые соединены друг с другом. В свободном пространстве между проволоками встречаются скопления клеток, межклеточные волокна, жгуты из клеточных волокон. Отдельные поверхности нитей внутри имплантата покрыты межклеточным матриксом, в котором заметны контуры псевдоподий. Видно, что произошло формирование элементов соединительной ткани, которая имеет в разных местах шарика разную структуру — от рыхлой до хорошо сформированной ткани. Большое расстояние между нитями затрудняет переход от поверхностного образования ткани к объемному. В местах наиболее близкого расположения нитей свободное пространство заполнено хорошо сформированной соединительной тканью.
Обсуждение
Наличие стомы на передней брюшной стенке, сформированной как после планового оперативного вмешательства, так и в экстренном порядке, радикально меняет образ жизни больного, делает его дефекацию бесконтрольной. Появляются осложнения в трудовой деятельности, сексуальной сфере, ограничения возможности путешествий и активного отдыха, в связи с чем адаптация после операции в 70% случаев протекает через длительную депрессию [19–21]. Отсутствие информации о наличии методов колостомии, которые бы отвечали всем необходимым требованиям лечения, обусловливает необходимость разработки и внедрения в практику новых способов формирования колостомы с резервуарно-удерживающей функцией.
Проведенное экспериментальное исследование показало, что моделирование колостомы с применением сферических имплантатов из никелида титана без заворачивания серозно-мышечного слоя имеет выраженную тенденцию к уменьшению частоты осложнений по сравнению с классическим моделированием (p=0,065). При этом заворачивание серозно-мышечного слоя приводит к статистически значимому увеличению частоты осложнений по сравнению с классическим моделированием колостомы (p=0,006).
Полученные результаты в группе с моделированием колостомы без заворачивания серозно-мышечного слоя дают основание полагать, что для достижения адекватного удерживающего механизма нет необходимости дополнительной травматизации стенки кишки (заворачивание серозно-мышечного слоя).
Применение сферических имплантатов из никелида титана на фоне формирования колостомы без заворачивания серозно-мышечного слоя кишки приводит к уменьшению частоты таких послеоперационных осложнений, как кровотечение на 1-е сутки после операции, абсцесс лапаротомной раны, эвагинация стомы, стеноз стомы, перистомальный дерматит. При этом следует отметить, что во всех экспериментальных группах отсутствовали следующие послеоперационные осложнения: несостоятельность швов в области кожи и слизистой оболочки стомы, расхождение швов с эвентрацией в области лапаротомной раны, некроз стомы, параколостомический свищ, параколостомическая грыжа, перитонит.
Среди основных преимуществ предлагаемого способа в первую очередь стоит выделить положительное влияние на темпы прибавки массы тела у животных и хорошие морфологические особенности регенеративного процесса в зоне сформированной колостомы. Исследование методом растровой электронной микроскопии установило высокую интеграционную связь с тканями организма внутри сферического имплантата и на поверхности.
Эксперименты показали, что сформировавшийся рубцово-проволочный композит склонен к длительному сохранению формы и эластичности, при этом внешнее окружение складок образует трубчатую оболочку, стремящуюся поддерживать внешний контур зоны запорного аппарата.
Заключение
Предлагаемый способ формирования кишечного клапана — использование сферического никелида титана без заворачивания серозно-мышечного слоя кишки при колостомии — позволяет создать надежный механизм регуляции выделения кишечного содержимого.
Местные осложнения в группе по формированию колостомы с заворачиванием серозно-мышечного слоя возникали чаще по сравнению с группой без заворачивания.
Использование для формирования клапана при колостомии имплантатов из сверхэластичного никелида титана в виде сфер, скатанных из проволоки, минимизирует травматичность как в момент операции, так и в процессе жизнедеятельности.
Результаты оценки относительной частоты послеоперационных осложнений, изменения массы тела, интенсивности воспаления в месте формирования колостомы с применением сферических имплантатов из никелида титана без заворачивания серозно-мышечного слоя кишки обусловливают необходимость дальнейшего изучения данного способа с целью использования его в клинической практике.
Финансирование исследования. Работа не финансировалась никакими источниками.
Конфликт интересов отсутствует.
Литература
- Банашкевич З., Явень А., Шевчик М., Чежняковска К. Хирургическое лечение осложнений колостомы. Онкологический журнал 2010; 4(2): 11–17.
- Halemani K., Shashidhara Y.N., D’Souza S.R.B. An evaluative study to assess the effectiveness of a video-assisted teaching module on knowledge and practice regarding home-based colostomy care of children among primary caregivers in selected hospital Lucknow, Uttar Pradesh. Indian J Surg Oncol 2021; 12(1): 146–151, https://doi.org/10.1007/s13193-020-01268-3.
- Abdelmohsen S.A. Effectiveness of structured education on patient’s knowledge and practice regarding colostomy care. Asia Pac J Oncol Nurs 2020; 7(4): 370–374, https://doi.org/10.4103/apjon.apjon_24_20.
- Каприн А.Д., Старинский В.В., Шахзадова А.О. Злокачественные новообразования в России в 2021 году (заболеваемость и смертность). М: МНИОИ им. П.А. Герцена — филиал ФГБУ «НМИЦ радиологии» Минздрава России; 2022; 252 с.
- Алиев С.А., Алиев Э.С. Усовершенствование способов формирования концевой колостомы — реальный путь к профилактике параколостомических осложнений. Вестник хирургии им. И.И. Грекова 2015; 174(4): 117–122.
- Гюнтер В.Э., Ходоренко В.Н., Ясенчук Ю.Ф., Чекалкин Т.Л., Овчаренко В.В., Клопотов А.А., Дамбаев Г.Ц., Сысолятин П.Г., Фомичев Н.Г., Олесова В.Н., Миргазизов М.З., Проскурин А.В., Зиганьшин Р.В., Поленичкин В.К., Матюнин А.Н., Фатюшин М.Ю., Молчанов Н.А., Моногенов А.Н. Никелид титана. Медицинский материал нового поколения. Томск: Изд-во МИЦ; 2006; 296 c.
- Гюнтер В.Э., Ходоренко В.Н. Разработка биосовместимых сверхэластичных материалов и имплантатов с памятью формы на основе никелида титана для создания высокоэффективных медицинских технологий. Вопросы реконструктивной и пластической хирургии 2022; 25(2): 45–56, https://doi.org/10.52581/1814-1471/81/05.
- Меньщиков А.В., Соловьёв М.М., Гидалевич В.Я., Попов А.М., Моминов И.М., Антипина Л.С., Фатюшина А.М. Применение пористого никелида титана при лапароскопической герниопластике. Вопросы реконструктивной и пластической хирургии 2020; 23(1): 113–117.
- Алиев Ф.Ш., Алиев Р.Ф., Ильканич А.Я., Алиев В.Ф., Матвеев И.А. Хирургическое лечение пациентки с двумя ректовагинальными свищами (клиническое наблюдение). Колопроктология 2020; 19(3): 92–96, https://doi.org/10.33878/2073-7556-2020-19-3-92-96.
- Штин В.И., Новиков В.А., Чойнзонов Е.Л., Марченко Е.С., Стахеева М.Н., Кучерова Т.Я., Меньшиков К.Ю., Черемисина О.В., Грибова О.В. Эндопротезирование стенок орбиты имплантатами из никелида титана в онкологической практике: аспекты течения репаративных процессов и возможность управления последними. Вопросы онкологии 2023; 69(2): 259–267, https://doi.org/10.37469/0507-3758-2023-69-2-259-267.
- Alipour S., Taromian F., Ghomi E.R., Zare M., Singh S., Ramakrishna S. Nitinol: from historical milestones to functional properties and biomedical applications. Proc Inst Mech Eng H 2022; 236(11): 1595–1612, https://doi.org/10.1177/09544119221123176.
- Schipper O.N., Ellington J.K. Nitinol compression staples in foot and ankle surgery. Orthop Clin North Am 2019; 50(3): 391–399, https://doi.org/10.1016/j.ocl.2019.02.003.
- Sleiman A., Bejcek C., Nestler A., Revelt N., Thuppal S., Mills A., Gardner M. The history of orthopaedic use of nitinol compression staples. Injury 2023; 54(11): 111036, https://doi.org/10.1016/j.injury.2023.111036.
- Jensen O.T., Jansen C.E., Seo Y., Yellich G. Guided nitinol-retained (Smileloc) single-tooth dental restorations. Oral Maxillofac Surg Clin North Am 2019; 31(3): 437–446, https://doi.org/10.1016/j.coms.2019.03.006.
- Sadri L., Lu E., Baril D.T. Interwoven nitinol stents for the treatment of infrainguinal peripheral arterial disease. J Cardiovasc Surg (Torino) 2023; 64(3): 310–316, https://doi.org/10.23736/s0021-9509.22.12555-3.
- Ohno M., Nishida A., Nishino K., Hirayama H., Takahashi K., Morita Y., Kishi Y., Morita Y., Bamba H., Shiomi H., Imaeda H. Palliative stenting for malignant colorectal stenosis in the elderly. DEN Open 2022; 3(1): e168, https://doi.org/10.1002/deo2.168.
- Якушенко В.К., Гюнтер В.Э., Штофин С.Г., Ходоренко В.Н., Зотов В.А., Мухамедов М.Р. Искусственный сфинктер. Патент РФ 2162308 C1. 2001.
- Дамбаев Г.Ц., Коробейникова В.И., Гюнтер В.Э., Артюхова Н.В., Аникеев С.Г., Ходоренко В.Н., Кафтаранова М.И. Способ формирования кишечного клапана при колостомии. Патент РФ 2779144 С1. 2022.
- Чикинёв Ю.В., Юданов А.В., Задильский Р.П. Качество жизни пациентов с кишечными стомами, сформированными различными способами при экстренных операциях. Медицина и образование в Сибири 2015; 6: 35.
- MacDonald S., Wong L.S., John-Charles R., McKee T., Quasim T., Moug S. The impact of intestinal stoma formation on patient quality of life after emergency surgery — a systematic review. Colorectal Dis 2023; 25(7): 1349–1360, https://doi.org/10.1111/codi.16603.
- Stavropoulou A., Vlamakis D., Kaba E., Kalemikerakis I., Polikandrioti M., Fasoi G., Vasilopoulos G., Kelesi M. “Living with a stoma”: exploring the lived experience of patients with permanent colostomy. Int J Environ Res Public Health 2021; 18(16): 8512, https://doi.org/10.3390/ijerph18168512.