Комплексное исследование взаимодействия золотых наностержней с раковыми клетками
Цель исследования — изучение взаимодействия золотых наностержней, стабилизированных биосовместимыми веществами, с раковыми клетками.
Материалы и методы. В работе использованы золотые наностержни с пиком экстинкции около 808 нм и размером 41×10 нм. Для стабилизации применяли растворы плюроника F127, хитозана и полиэтиленгликоля (ПЭГ). Оптические характеристики растворов исследовали на двухлучевом спектрофотометре. Цитотоксическое действие наночастиц оценивали с помощью МТТ-теста. Взаимодействие наночастиц с эукариотическими клетками изучали методом двухфотонной люминесцентной микроскопии и атомно-силовой микроскопии. Для проведения полуколичественного анализа и исследования внутриклеточного распределения применяли метод трансмиссионной электронной микроскопии.
Результаты. При стабилизации наночастиц плюроником F127, хитозаном и ПЭГ происходит изменение их спектральных характеристик с уширением пика экстинкции и снижением его интенсивности. Все исследуемые растворы наночастиц обладали схожим уровнем цитотоксичности. Обнаруженные в клетках наночастицы были в виде отдельных наночастиц, больших скоплений и агрегатов с преобладанием последних двух фракций. Наиболее эффективно проникали в клетки ПЭГ-стабилизированные (через 1–3 ч) и стабилизированные хитозаном наночастицы (через 6 ч). Показано, что основную роль в интернализации наночастиц играет эндоцитоз.
Заключение. Полученные результаты могут помочь в лучшем понимании процесса взаимодействия наноматериалов с живыми клетками, влияния природы стабилизирующего агента на оптические свойства наночастиц и их цитотоксические эффекты. Кроме того, данные о накоплении наночастиц в клетках будут полезны при разработке методик визуализации и терапии с использованием наноматериалов.
В последние годы наночастицы из различных материалов активно используются во многих областях деятельности человека. В промышленности они нашли применение в качестве каталитических компонентов [1] и сенсоров [2]. Благодаря способности генерировать на поверхности локализованный плазмонный резонанс и связанное с ним резонансное поглощение и рассеяние в широком диапазоне длин волн в области «терапевтического окна прозрачности» биологических тканей [3, 4] наночастицы рассматриваются как агенты для тераностики [5]. Они могут служить в качестве контрастных агентов [6] для лазерной нанохирургии [7] и лечения рака [8], использоваться для направленной и эффективной доставки лекарств [9], а также для управления функциями клеток [10]. Среди огромного множества наночастиц, полученных на сегодняшний день, наибольший интерес вызывают золотые наночастицы, синтезированные в форме стержней.
Однако из литературных данных известно, что наночастицы в форме стержней проникают в клетки хуже, чем сферические. B.D. Chithrani c соавт. [13] показали, что клетки поглощают наностержней в 3–5 раз меньше, чем сферических наночастиц аналогичных размеров. Кроме того, проникновение в клетки коротких наностержней (с соотношением «ширина:длина» 1:1 и 1:3) выше, чем более длинных (1:5). Спектр золотых наностержней имеет два пика плазмонного резонанса. Первый пик расположен вблизи резонанса сферических наночастиц (500–560 нм) и определяется в основном поглощением золота. Второй пик связан с продольным размером наночастиц и легко настраивается осевым отношением в длинноволновой области спектра от 700–1300 нм, т.е. попадает в «терапевтическое окно прозрачности». Доказано, что наночастицы в форме стержней намного лучше конвертируют электромагнитную энергию падающего излучения в тепловую по сравнению с частицами круглой формы [11, 12]. Все сказанное позволяет считать эти наночастицы перспективными агентами для лазерной гипертермии.
Повысить эффективность проникновения в клетки наночастиц можно за счет оптимального стабилизирующего агента. Наночастицы, используемые в биомедицинских исследованиях, стабилизируют различными биосовместимыми веществами для предотвращения агрегации, снижения токсичности и продления времени циркуляции частиц в организме. Наиболее часто используют плюроник, хитозан и полиэтиленгликоль (ПЭГ).
Плюроник F127 представляет собой блок-сополимер, содержащий гидрофильные полиоксиэтиленовые участки и гидрофобный полиоксипропиленовый участок, и имеет среднюю молекулярную массу 13 000 Да. В разбавленных растворах с концентрацией полимера выше критической концентрации мицеллообразования плюроник спонтанно образует мицеллы диаметром 30–50 нм с гидрофобным центральным ядром и гидрофильными остатками, направленными во внешнюю среду [14, 15]. Благодаря своим свойствам плюроник может быть использован для доставки в организм различных лекарств, в том числе противоопухолевых препаратов [16].
Хитозан представляет собой природный полисахарид, продукт частичного дезацетилирования хитина. Хитозан способен усиливать проникновение веществ в ткани, открывая плотные эпителиальные контакты. Также считается, что хитозан увеличивает клеточный и межклеточный транспорт в слизистом эпителии и других тканях [17, 18].
ПЭГ — водорастворимый полимер, который широко используется в биологических исследованиях. Он способен снизить опсонизацию и иммунную реакцию организма на вводимые вещества и продлить время их циркуляции в организме. Свободные цепи полимера стабилизируют наночастицы за счет стерических препятствий образованию агрегатов [19].
Исследование взаимодействия наночастиц с клетками проводят методами высокоразрешающей микроскопии, такими как атомно-силовая микроскопия (АСМ) [20, 21], двухфотонная люминесцентная микроскопия (ДЛМ) [22, 23], трансмиссионная (ТЭМ) и сканирующая электронная микроскопии [13, 24]. Для количественной оценки используют атомно-эмиссионную спектроскопию [25, 26]. АСМ позволяет отслеживать ультраструктурные изменения цитоплазматической мембраны в процессе взаимодействия с наночастицами. Существенным недостатком данного метода является возможность получения информации только с поверхности образца. ДЛМ позволяет достаточно быстро получать изображения живых клеток и не требует специальной подготовки образцов. Однако данный метод не дает возможности визуализировать отдельные наночастицы и их точную локализацию в клетке, кроме того, при получении изображений необходимо контролировать мощность возбуждающего лазера во избежание плавления наночастиц. ТЭМ, с одной стороны, позволяет определить внутриклеточную локализацию наночастиц и сделать полуколичественный анализ их содержания, а с другой — требует длительного времени и специальных навыков при подготовке образцов. Атомно-эмиссионная спектроскопия позволяет определить количество наночастиц, проникших в клетку, но требует специальной подготовки образцов и не дает информации о внутриклеточной локализации наночастиц. Исходя из этого, в своей работе мы использовали АСМ, ДЛМ и ТЭМ.
Цель исследования — изучение взаимодействия золотых наностержней, стабилизированных биосовместимыми веществами, с раковыми клетками.
В процессе работы решались две задачи: исследование влияния стабилизирующих веществ на спектральные характеристики наночастиц и изучение токсического действия наночастиц и динамики проникновения их в клетки методами высокоразрешающей микроскопии.
Материалы и методы
Наночастицы. Использованы коммерческие золотые наностержни размером 41×10 нм (рис. 1, а) с максимумом поглощения на 808 нм (Sigma Aldrich, США) (рис. 1, б). Концентрация наночастиц составляла около 5·1011 частиц/мл. Непосредственно перед проведением исследований наночастицы отмывали от примесей путем центрифугирования 16 000 g в течение 10 мин и ресуспендировали в воде стандарта mili-Q с последующим разбиванием агрегатов в ультразвуковой ванночке. Данную процедуру повторяли 3 раза, затем осадок наночастиц перерастворяли в растворе стабилизирующего вещества. Для стабилизации использовали плюроник F127 с конечной концентрацией в растворе 2%, хитозан — 0,2%, ПЭГ с молекулярной массой 6 и 40 кДа — 3%.
 Рис. 1. Трансмиссионная электронная микроскопия раствора наночастиц (а) и спектр экстинкции исходного раствора наночастиц (б) Рис. 1. Трансмиссионная электронная микроскопия раствора наночастиц (а) и спектр экстинкции исходного раствора наночастиц (б)
|
Спектральные характеристики исходного раствора наночастиц и растворов, стабилизированных исследуемыми веществами, изучали с помощью двухлучевого спектрофотометра Specord 250 (Analytik Jena AG, Германия) в диапазоне длин волн 400–1100 нм.
Культура клеток. Клетки аденокарциномы яичника человека SKOV-3 (ATCC®, HTB-77™) растили одни сутки в культуральных чашках на питательной среде RPMI-1640 («ПанЭко», Россия) c 10% фетальной сывороткой (HyClone, США) при 37°C и 5% СО2. В культуральные чашки диаметром 35 мм добавляли 1011 наночастиц, стабилизированных исследуемыми веществами, и доводили общий объем жидкости до 2 мл. Клетки с наночастицами выдерживали в условиях СО2-инкубатора в течение 1, 3 и 6 ч, после чего проводили троекратную отмывку клеток от несвязавшихся наночастиц PBS-буфером («ПанЭко», Россия). Контролем служили клетки, выдержанные в течение того же времени и в тех же условиях, но без добавления наночастиц золота.
Оценка цитотоксичности. Влияниезолотых наностержней на жизнеспособность клеток определяли с помощью МТТ-теста. Для этого клетки высаживали на 96-луночные культуральные планшеты по 30 тыс. клеток на лунку и через 6 ч добавляли растворы наночастиц. Была исследована цитотоксичность исходного раствора наночастиц, стабилизированных цетилтриметиламмония бромидом (ЦТАБ), а также стабилизированных плюроником F127, хитозаном, ПЭГ 6 и 40 кДа. В лунки планшета вносили по 5·109 и 5·1010 наночастиц и доводили общий объем жидкости в лунке до 200 мкл культуральной средой. Через 24 ч лунки промывали 200 мкл культуральной среды без сыворотки, добавляли 100 мкл МТТ-реактива (0,5 мг/мл) и выдерживали в CO2-инкубаторе в течение часа без крышки. После этого жидкость в лунках заменяли на 100 мкл диметилсульфоксида и регистрировали оптическую плотность на длине волны 570 нм с помощью фотометра для микропланшетов SynergyMx (BioTek, США). Значения оптической плотности усредняли по трем лункам. Жизнеспособность клеток представляли в процентах относительно контрольных, не подвергавшихся воздействию наночастиц.
Атомно-силовая микроскопия. Методом ACM изучено изменение рельефа мембран клеток при взаимодействии с золотыми наностержнями. Для проведения исследования клетки выращивали на 35 мм культуральных чашках в течение 24 ч. Затем добавляли 1011 наночастиц, стабилизированных исследуемыми веществами, и доводили общий объем жидкости до 2 мл. Клетки инкубировали 6 ч в условиях СО2-инкубатора, затем фиксировали 2,5% раствором глютарового альдегида на PBS-буфере, не отмывая от наночастиц.
Исследования поверхности клеток проводили на атомно-силовом микроскопе SOLVER BIO™ (NT-MDT, Россия), использовали зонды DNP (Veeco, США) с радиусом закругления около 50 нм, константой жесткости 0,58 Н/м, резонансной частотой в жидкости около 40 кГц. Кантилевер на специальном держателе опускали в установленную на оптический микроскоп культуральную чашку с клетками. Сканирование проводили со скоростью 0,5–1 линия в секунду, коэффициент отклика обратной связи составлял от 0,5 до 0,9. Значение Set Point поддерживалось в районе 55–60% от начального значения частоты колебаний в зависимости от высоты исследуемых клеток. С помощью метода АСМ проводилась оценка размеров и границ клеток и ядер, а также количества участков, выступающих над поверхностью мембраны. Всего проанализировано 10 полей зрения. На изображениях, представленных в работе, была применена боковая подсветка, которая позволяет более детально различить неровности на поверхности исследуемого образца. Источник света располагался над поверхностью клеток слева.
Двухфотонная люминесцентная микроскопия. Исследование проникновения золотых наночастиц в раковые клетки проведено на установке лазерной сканирующей микроскопии Carl Zeiss LSM 510 META (Германия), оснащенной фемтосекундным Ti:Sa-лазером. Длительность единичного импульса излучения составляет 100 фс, частота следования импульсов — 80 МГц. В выполняемых экспериментах лазерное излучение фокусировалось на объект исследования с помощью иммерсионного масляного объектива с числовой апертурой NA=1,4. Нелинейное возбуждение люминесценции золотых наночастиц осуществлялось на длине волны 810 нм, что соответствует пику коэффициента экстинкции золотых наностержней (см. рис. 1, б). Мощность накачки составляла около 1 мВт. Регистрацию сигнала нелинейной люминесценции золотых наночастиц проводили в диапазоне 501–565 нм, выбранном на основании измерения спектра двухфотонной люминесценции суспензии используемых наночастиц. Для визуализации границ клетки применяли флюоресцентный маркер клеточных мембран CellMask™ (Life Technologies, США), имеющий возбуждение и эмиссию флюоресценции 649 и 666 нм соответственно. Для получения полной информации проводили сканирование образцов по глубине. Стоит отметить, что данный метод не позволяет зафиксировать отдельные наночастицы в связи с их малым размером и низким уровнем сигнала люминесценции. Однако при формировании агломератов наночастиц происходит усиление сигнала люминесценции, который хорошо регистрируется [27]. С помощью метода ДЛМ оценивалась способность наночастиц проникать внутрь клеток в зависимости от типа покрытия.
Трансмиссионная электронная микроскопия. Для ТЭМ-анализа клетки, содержащие наночастицы, и контрольные клетки снимали с культуральных планшетов смесью раствора Версена и трипсина, промывали один раз PBS-буфером и переносили в эппендорфы. Суспензию клеток осаждали центрифугированием в течение 5 мин при 200 g. Осадок из клеток фиксировали 2,5% глютаровым альдегидом на фосфатном буфере (pH=7,4) в течение 24 ч, далее дофиксировали 1% раствором четырехокиси осмия в течение 1–2 ч при температуре +4°С. Обезвоживание образцов проводили в спиртах восходящей концентрации от 50 до 100%, затем в 100% ацетоне. Далее клетки помещали в смесь эпоксидной смолы и чистого ацетона (в соотношении 1:1) на 24 ч при комнатной температуре. Затем образцы заключали в смесь «эпон–аралдит» на 24 ч при 37°C и полимеризовали сутки при 60°С [28]. Ультратонкие срезы (50–70 нм) контрастировали уранилацетатом и исследовали в трансмиссионном электронном микроскопе Morgagni 268D (FEI, США). Визуализацию наночастиц в клетках проводили в 20 полях зрения 40×40 мкм. Методом ТЭМ исследовалось состояние наночастиц, внутриклеточное распределение, а также проводилась их количественная оценка. Результаты представлены в виде суммарного количества наночастиц, обнаруженных в клетках в 20 полях зрения.
Исследование эндоцитоза. Согласно данным работ [29, 30] основную роль в процессе проникновения наночастиц в клетки играют различные механизмы эндоцитоза. Для подтверждения участия эндоцитоза в проникновении наночастиц, стабилизированных исследуемыми веществами, проводили инкубирование клеток с наночастицами при температуре +4°С в течение 3 ч. Поскольку эндоцитоз является энергозависимым процессом, то в условиях пониженной температуры происходит снижение его интенсивности [31]. Наличие наночастиц в клетках подтверждали методами ДЛМ и ТЭМ. Контролем служили клетки, инкубированные с таким же количеством наночастиц в течение 3 ч при 37°С.
Статистическая обработка результатов. Использовано программное обеспечение Statistica 10,0 (StatSoft Inc., США). Статистически значимые различия между контрольными и опытными образцами выявляли с помощью t-теста Стьюдента для независимых выборок. Определяли средние значения измеряемых величин и стандартные отклонения среднего. Статистически значимыми считали различия при уровне значимости р<0,05.
Результаты
Спектральные характеристики наночастиц. При приготовлении растворов золотых наностержней с различными стабилизирующими агентами была выполнена оценка их спектральных характеристик. Исходный раствор наночастиц имел выраженный пик поглощения в области 808 нм. В ходе отмывки наночастиц от раствора ЦТАБ и стабилизации исследуемыми веществами наблюдали уширение пика поглощения и снижение его интенсивности (рис. 2). Установлено, что стабилизация плюроником F127 практически не изменяет спектр наночастиц. При использовании ПЭГ 6 и 40 кДа и хитозана происходят сильное уширение пика и снижение его интенсивности, что говорит об образовании агрегатов наностержней.
 Рис. 2. Спектры экстинкции золотых наностержней, стабилизированных исследуемыми веществами Рис. 2. Спектры экстинкции золотых наностержней, стабилизированных исследуемыми веществами
|
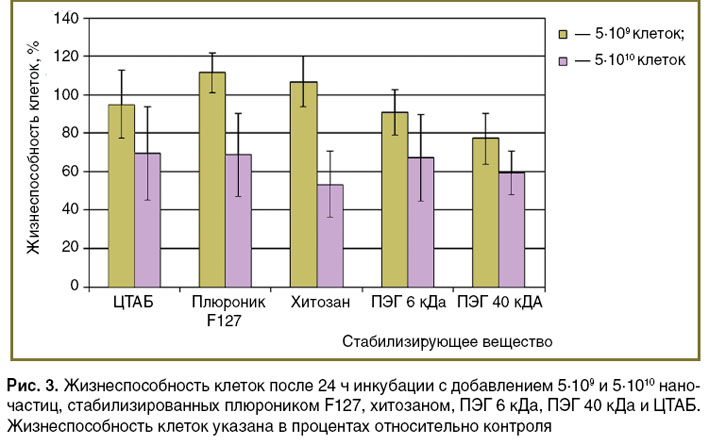
Оценка цитотоксичности наночастиц. Исследована жизнеспособность клеток SKOV-3, которые были подвергнуты воздействию различных концентраций наночастиц, стабилизированных исследуемыми веществами, с помощью МТТ-теста (рис. 3). Диаграмма отчетливо демонстрирует, что уровень цитотоксичности исходного раствора наночастиц, стабилизированных ЦТАБ, сопоставим с таковым для других растворов. Добавление 5·109 наночастиц с ЦТАБ к культуре клеток снижало их жизнеспособность не более чем на 10%, при внесении 5·1010 наночастиц жизнеспособность снижалась до 70%. Наночастицы, стабилизированные другими веществами, также обладали токсическим действием на культуру клеток. Внесение в лунки планшета 5·1010 наночастиц, стабилизированных хитозаном, приводило к гибели 55% клеток, тогда как меньшая концентрация наночастиц не влияла на жизнеспособность. Наименее токсичным оказался раствор наночастиц, стабилизированных плюроником. Гибель клеток не превышала 30% при добавлении 5·1010 наночастиц. Наночастицы, стабилизированные ПЭГ 6 кДа, снижали жизнеспособность клеток на 35% в случае внесения их в количестве 5·1010 наночастиц. Добавление к клеткам 5·109 и 5·1010 наночастиц, стабилизированных ПЭГ 40 кДа, приводило к гибели 20 и 40% клеток соответственно. Таким образом, наиболее подходящими для биологических исследований являются наночастицы, стабилизированные хитозаном или плюроником F127.
Изменение мембран клеток. Исследование контрольных клеток показало, что они имеют округлую форму, с четкой границей клетки на подложке, с гладкой цитоплазматической мембраной (рис. 4, а). После инкубации с наночастицами независимо от типа стабилизирующего вещества клетки незначительно изменяли свою структуру. Они принимали более вытянутую форму, кроме того, границы ядра клетки меньше выделялись на поверхности. Инкубация клеток с наночастицами приводила к незначительному снижению размеров клеток и ядер.
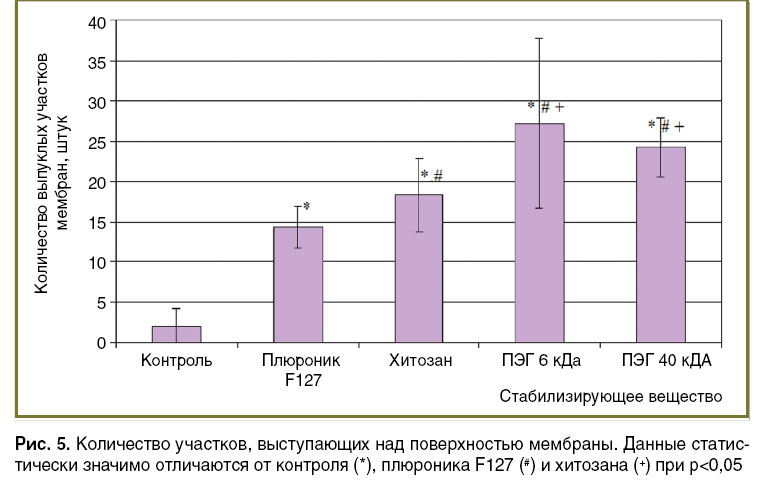
Анализ клеток, не инкубированных с наночастицами, показал, что на мембране клеток присутствует в среднем два участка, выступающих над поверхностью мембраны. В процессе взаимодействия клеток с наночастицами количество таких участков существенно увеличивалось, также появлялись инвагинации мембраны. Размер обнаруженных участков составлял от 100 нм до 5–6 мкм (рис. 4, б). Для наночастиц, стабилизированных ПЭГ 6 и 40 кДа, зафиксировано максимальное количество выступающих участков — 27 и 24 соответственно (рис. 5). Для хитозанстабилизированных наночастиц на мембране обнаружено 18 таких участков. Наименьшее количество (14 участков) выявлено в случае испотльзования наночастиц, стабилизированных плюроником F127.
|
|
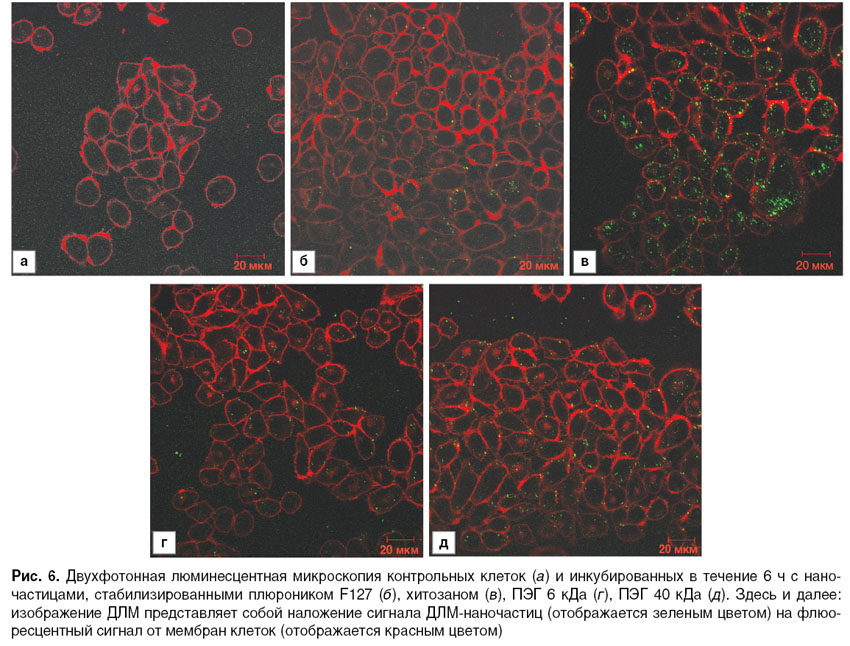
Двухфотонная люминесцентная микроскопия. Методом ДЛМ установлено, что наиболее эффективно в клетки проникали наночастицы, стабилизированные хитозаном (рис. 6). Количество люминесцирующих объектов внутри клеток было наибольшим по сравнению с наночастицами, стабилизированными другими веществами. Наночастицы, стабилизированные ПЭГ 40 кДа, проникали в клетки менее эффективно, чем частицы, стабилизированные хитозаном. Наночастицы, стабилизированные ПЭГ 6 кДа и плюроником F127, проникали в клетки хуже наночастиц, стабилизированных другими веществами. Для них было зафиксировано наименьшее количество люминесцирующих объектов внутри клеток. Для всех исследуемых растворов наностержней можно отметить несколько общих закономерностей. Так, количество люминесцирующих объектов внутри клеток возрастало по мере увеличения времени инкубации. Бóльшая часть наночастиц, проникших в клетки, располагалась в той их части, которая была ближе ко дну культурального планшета.
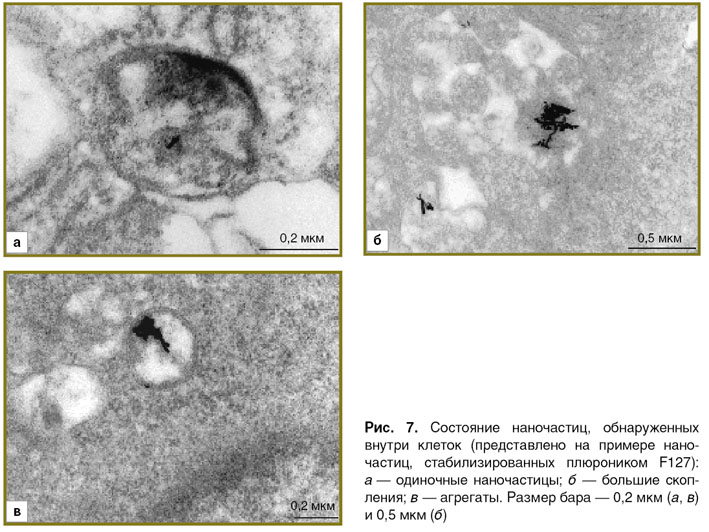
Трансмиссионная электронная микроскопия. На основании микрофотографий, полученных с помощью ТЭМ, обнаруженные в клетках наночастицы были разделены на три категории: одиночные наностержни, большие скопления наночастиц и агрегаты (рис. 7). Большие скопления наночастиц представляют собой группы из большого количества отдельных наностержней, расположенных близко друг к другу. Агрегаты — группа плотно расположенных наночастиц, внутри которой невозможно выделить отдельные наночастицы. Важно отметить, что одиночные наночастицы встречались в клетках намного реже больших скоплений наночастиц или агрегатов. Наночастицы в клетках были обнаружены как в свободной форме, так и окруженные мембранными структурами. Наличие окружающей мембраны особенно характерно для агрегатов и больших скоплений наночастиц.
После 1 ч инкубации количество наночастиц, стабилизированных ПЭГ 6 кДа и ПЭГ 40 кДа, в клетках было больше по сравнению с наночастицами, стабилизированными другими веществами (см. таблицу). Так, было обнаружено 10 больших скоплений наночастиц для ПЭГ 6 кДа и 28 — для ПЭГ 40 кДа. Количество одиночных наностержней и агрегатов также было больше по сравнению с хитозан- и плюроникстабилизированными наночастицами. Увеличение времени инкубирования сопровождалось возрастанием числа одиночных наностержней до 14 для ПЭГ 6 кДа и до 12 — для ПЭГ 40 кДа. Количество агрегатов в клетках также становилось больше.
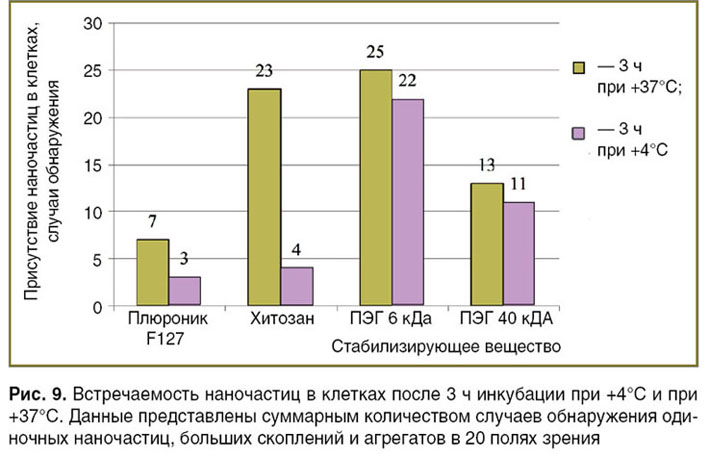
 Встречаемость наночастиц в клетках (данные представлены для 20 полей зрения) Встречаемость наночастиц в клетках (данные представлены для 20 полей зрения)
|
Наночастицы, стабилизированные хитозаном, после 1 ч инкубирования представлены в клетках в основном агрегатами. Через 3 ч количество одиночных наночастиц и больших скоплений не изменилось, а количество агрегатов увеличилось в 2 раза. Увеличение времени до 6 ч сопровождалось еще бόльшим возрастанием количества агрегатов.
Наночастицы, стабилизированные плюроником F127, проникали в клетки в наименьшем количестве. Одиночные наностержни и большие скопления наночастиц обнаружены в единичном количестве даже после 6 ч инкубирования. Количество агрегатов в клетках возрастало с 5 до 18 при увеличении времени взаимодействия с 1 до 6 ч.
Исследование эндоцитоза. С целью подтверждения участия эндоцитоза в проникновении наночастиц в клетки выполнено инкубирование клеток с наночастицами в течение 3 ч при пониженной температуре (+4°С). Проведенное ДЛМ-исследование не выявило люминесцирующих объектов внутри клеток (рис. 8). Данная закономерность была характерна для наночастиц, стабилизированных всеми исследуемыми веществами. Однако методом ТЭМ были обнаружены единичные агрегаты и большие скопления наночастиц, стабилизированных плюроником F127 и хитозаном (рис. 9). ПЭГ-стабилизированные наночастицы показали наибольшую эффективность проникновения в клетки в условиях пониженной температуры. Также важно отметить, что все обнаруженные в клетках агрегаты и большие скопления наночастиц не имели окружающих мембранных структур.
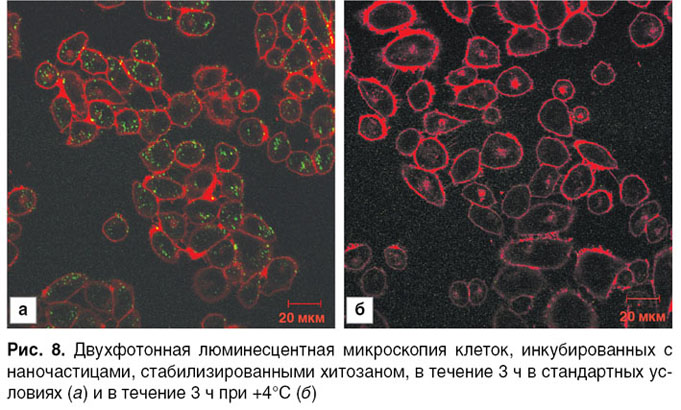
Рис. 8. Двухфотонная люминесцентная микроскопия клеток, инкубированных с наночастицами, стабилизированными хитозаном, в течение 3 ч в стандартных условиях (а) и в течение 3 ч при +4°С (б) |
Обсуждение. Наночастицы, используемые в биомедицинских исследованиях, покрывают или стабилизируют различными агентами. С одной стороны, стабилизирующее вещество должно препятствовать агрегации наночастиц в растворе, с другой, должно минимизировать токсическое действие наночастиц. Кроме того, часто используют вещества, которые обладают спецификой связывания с определенными клетками или облегчают проникновение наночастиц в клетки. Однако при стабилизации наночастиц происходит изменение их спектральных свойств. В работе A. Albanese и W.C. Chan [32] отмечено смещение пика экстинкции наночастиц в длинноволновую область и его уширение в процессе формирования агрегатов. В нашей работе также отмечалось уширение пика экстинкции и его смещение на 30 нм в красную область спектра, что подтверждает агрегацию наночастиц в растворе. Кроме того, отмечалось снижение интенсивности пика, что может быть связано как с уменьшением концентрации наночастиц в растворе (потери при отмывке от ЦТАБ), так и с образованием агрегатов [33]. Образование агрегатов наночастиц, с одной стороны, является негативным, поскольку увеличивается размер наночастиц, что приводит к снижению их способности проникать в клетки [13]. С другой стороны, наночастицы в составе агрегата обладают большей по интенсивности люминесценцией за счет усиления [27]. Этот эффект может быть использован при разработке контрастирующих агентов для оптических методов визуализации на основе плазмонно-резонансных наночастиц.
Согласно данным A.M. Alkilany и соавт. [34], более токсичными для клеток являются свободные молекулы ЦТАБ, чем молекулы, адсорбированные на поверхности наночастиц. Авторы обнаружили, что при воздействии в течение 4 сут на клетки LD50 для свободных молекул ЦТАБ составляет 200 нмоль [34]. В нашем исследовании при добавлении к клеткам 5·1010 и 5·109 наночастиц, стабилизированных ЦТАБ, они подвергались воздействию 270 нмоль и 27 нмоль ЦТАБ соответственно, кроме того, оценку цитотоксичности мы проводили через 24 ч. Вероятно, по этим причинам обнаруженное снижение жизнеспособности составило 30 и 10%. Проверка цитотоксичности наночастиц, стабилизированных другими веществами, не выявила статистически значимых отличий от исходного раствора. Однако в случае ПЭГ-стабилизированных наночастиц жизнеспособность была несколько ниже, что, вероятно, может быть связано с худшим экранированием молекул ЦТАБ, оставшихся на поверхности наночастиц.
Установлено, что плюроник способствует проникновению сравнительно бóльших молекул и бóльших гидрофобных анионов через липидный бислой [35]. Предполагают, что он ускоряет процесс диффузии растворенного вещества в липидный бислой и не влияет на скорость адсорбции/десорбции растворенного вещества на поверхности мембраны [14]. Однако в нашем исследовании наночастицы, стабилизированные плюроником F127, проникали в клетки хуже других. Это может быть связано с тем, что в процессе удаления с поверхности наночастиц молекул ЦТАБ происходит образование агломератов, превышающих по размеру мицеллы плюроника (30–50 нм).
Наночастицы, стабилизированные хитозаном, при длительном периоде взаимодействия с клетками проникали в них более эффективно по сравнению с наночастицами, стабилизированными другими веществами. Полученные данные хорошо согласуются с работами, в которых показано, что хитозан способен увеличивать клеточный транспорт [17]. Кроме того, использование хитозана для стабилизации наночастиц является перспективным, поскольку молекулы хитозана способны открывать плотные контакты, тем самым увеличивая внутритканевой транспорт [18]. C. Manaspon и соавт. [15] отмечают, что клеточное поглощение хитозановых наночастиц, которые не имеют мишени на поверхности, по всей вероятности, опосредовано неспецифическим адсорбционным эндоцитозом. Положительно заряженные наночастицы хитозана могут легко притягиваться к отрицательно заряженным клеточным мембранам и затем проникать в клетки.
Мы обнаружили, что наночастицы, стабилизированные ПЭГ 6 кДа и ПЭГ 40 кДа, хорошо проникали в течение первого часа, однако при увеличении периода инкубации до 6 ч их количество внутри клеток возрастало незначительно. Высокий уровень накопления наночастиц в ранний период может быть связан с тем, что в клетки проникают наночастицы, на поверхности которых молекулы ПЭГ плохо экранируют молекулы ЦТАБ. Последний является катионным детергентом, который увеличивает проницаемость мембран [35]. Подтверждением этого также может служить более высокая гибель клеток при инкубировании с данными наночастицами. Менее активное проникновение в клетки наночастиц при более длительном периоде может быть обусловлено тем, что в растворе остались только хорошо стабилизированные ПЭГ наночастицы. Возможно, такое поведение наночастиц связано с нейтральным зарядом ПЭГ, и, следовательно, наночастицы взаимодействуют с клеточной мембраной не активно. В работе С. Freese и соавт. [25] на клетках первичной культуры эндотелия капилляров кожи человека показано, что менее 2,5% от начальной концентрации наночастиц, покрытых ПЭГ, проникает в клетки. Подобный характер проникновения наблюдался для клеток HeLa и PC-3 [36].
Значительное снижение в клетках количества наночастиц, стабилизированных плюроником F127 и хитозаном, при инкубировании в условиях пониженной температуры подтверждает участие эндоцитоза в процессе проникновения. Накопление в клетках ПЭГ-стабилизированных наночастиц не зависело от температуры и, таким образом, не связано с процессами эндоцитоза. Вероятнее всего, данные наночастицы проникают в клетки за счет неэкранированных молекул ЦТАБ, которые увеличивают проницаемость мембран [35].
Независимо от типа стабилизирующего вещества и времени взаимодействия бóльшая часть наночастиц, обнаруженных в клетках, была представлена большими скоплениями или агрегатами. Вероятнее всего, агрегация происходила в культуральной среде из-за взаимодействия с ее компонентами. A.M. Alkilany и C.J. Murphy [37] показали, что белки из питательной среды адсорбируются на поверхности наночастиц в течение 5 мин, что приводит к изменению заряда наночастиц и их последующей агрегации. Наличие белков на поверхности наночастиц может усиливать проникновение наночастиц в клетки за счет включения рецепторопосредованного эндоцитоза [38]. Однако разные по составу среды будут по-разному влиять на агрегацию наночастиц и их накопление в клетках [37]. Так, C. Fang и соавт. [39] не наблюдали изменения размера наночастиц из оксида железа при добавлении их в фосфатно-солевой буфер, среду DMEM или сыворотку эмбрионов коров. По всей вероятности, большое значение имеют физико-химические особенности вещества, которым стабилизированы наночастицы.
Методом АСМ на поверхности клеток обнаружены выступающие участки через 6 ч взаимодействия с наночастицами. При этом в случае плюроник- и хитозанстабилизированных наночастиц их было меньше по сравнению с ПЭГ-стабилизированными наночастицами. Это может быть связано с тем, что наночастицы, стабилизированные хитозаном и плюроником, взаимодействуют с мембраной и проникают внутрь клеток. Так, в работе R. Guduru [40] показано, что через 3 ч взаимодействия на поверхности клеток наночастиц больше, чем через 6 ч. Снижение количества наночастиц автор связывает с проникновением их внутрь клеток. Большое количество ПЭГ-стабилизированных наночастиц на поверхности клеток может быть обусловлено тем, что молекулы ПЭГ имеют нейтральный заряд и проникают в клетки неактивно. Это также было показано методами ДЛМ и ТЭМ.
Заключение. С точки зрения сохранения оптических свойств наиболее оптимальным стабилизирующим агентом для наночастиц является плюроник. Использование данного агента незначительно изменяет спектр экстинкции раствора золотых наностержней. Плюроникстабилизированные наночастицы также обладают наименее выраженным цитотоксическим эффектом. Все остальные исследованные растворы наночастиц, в том числе и стабилизированные ЦТАБ, отличаются схожим цитотоксическим действием, усиливающимся при возрастании концентрации наночастиц. С точки зрения эффективности проникновения наночастиц в клетки можно выделить два стабилизирующих вещества: хитозан и ПЭГ. Хитозанстабилизированные наночастицы хорошо проникают при длительном периоде инкубирования. Проникновение данных наночастиц связано с процессами эндоцитоза. ПЭГ-стабилизированные наночастицы хорошо проникают в ранние сроки (до 3 ч) инкубирования, в том числе и в условиях пониженной температуры.
Финансирование исследования. Работа выполнена при финансовой поддержке Министерства образования и науки Российской Федерации, договор №11.G34.31.0017, и Российского фонда фундаментальных исследований, гранты №12-02-31514 и №12-02-00914.
Конфликт интересов. У авторов нет конфликта интересов.