Ангиографические варианты коллатерального кровотока и их значение при реканализации хронических окклюзий коронарных артерий
Цель исследования — систематизировать ангиографические варианты коллатерального кровотока в постокклюзионных сегментах коронарных артерий и определить значение каждого из них для достижения успеха при выполнении эндоваскулярной реканализации хронических окклюзий коронарных артерий (ХОКА).
Материалы и методы. В исследование включены 128 пациентов (105 мужчин и 23 женщины), средний возраст которых составил 56,0±0,6 года. За период с 2009 по 2011 г. им в условиях Специализированной кардиохирургической клинической больницы выполнялось эндоваскулярное вмешательство по поводу ХОКА. У всех пациентов диагностирована стабильная стенокардия II–III функционального класса (NYHA). В 39% случаев хронически окклюзирована была передняя нисходящая артерия, в 41% — правая коронарная артерия и в 8% — огибающая артерия, во всех остальных случаях это были боковые ветви. Средний возраст окклюзии — 41,0±4,3 мес (от 3 мес до 20 лет). Протяженность окклюзий составляла от 4 до 50 мм. В 47% случаев это были легкие, в 32% — средней сложности, а в 21% — сложные и очень сложные окклюзии по шкале J-CTO. Всем пациентам выполнялась реканализация ХОКА с применением эндоваскулярных антеградных методик.
Результаты. На основании анализа данных селективной коронарографии больных с ХОКА были выделены ангиографические варианты коллатерального кровотока в постокклюзионных сегментах коронарных артерий. Установлена достоверная зависимость успеха реканализации от типа коллатерального кровотока в постокклюзионных сегментах. Так, при кровотоке типа RAI-III и RAI-Iа успех вмешательства достигается чаще, чем в остальных случаях. Наличие коллатерального кровотока RAI-Ib в меньшей степени приводит к положительному результату при антеградной механической реканализации.
Заключение. Разработанная классификация ангиографических типов коллатерального кровотока RAI может быть рекомендована как вариант систематизации ангиографических проявлений коллатерального кровотока, что имеет большое практическое значение, позволяя оценить распространенность поражения и выбрать тактику интервенционной коррекции.
Атеросклеротическое поражение коронарных артерий является основным морфологическим субстратом, определяющим развитие ишемической болезни сердца, которая занимает лидирующую позицию среди основных причин смерти в мире [1]. Золотым стандартом диагностики атеросклеротического поражения коронарных артерий остается селективная коронарография (СКГ) [2]. Благодаря развитию эндоваскулярной технологии стало возможным лечение гемодинамически значимого проявления атеросклероза с минимальной агрессией для организма пациента и достижением оптимального клинического результата. За последнее десятилетие предложено большое количество инструментов, методик, позволяющих выполнять вмешательства на коронарных артериях с максимальной степенью проявления атеросклероза [3–5].
Хронические окклюзии коронарных артерий (ХОКА) принято считать поражениями, наиболее сложными для интервенционной коррекции [6]. Это атеросклеротическое поражение коронарной артерии с полным перекрытием ее просвета более 3 мес и с формированием коллатерального кровотока дистальнее поражения [3].
Частота встречаемости ХОКА, по данным СКГ, составляет 20–30% [7].
Реканализация ХОКА является физиологически обоснованной операцией, так как обеспечивает адекватное кровоснабжение заинтересованного участка миокарда, улучшает сократительную способность и электрическую активность сердца, положительно влияет на его ремоделирование [4, 8]. Однако выполнение эндоваскулярной коррекции таких окклюзий сопряжено с высоким риском интраоперационных осложнений [9]. Эффективность, а также безопасность вмешательства зависят от многих факторов и во многом определяются качеством визуализации заинтересованной артерии [10].
Сложность предстоящей реканализации ХОКА можно определить по шкале J-CTO, где учитываются тип культи, наличие кальциноза, извитости в области окклюзии, протяженность поражения, предшествующие вмешательства. Максимальной сложностью обладают ХОКА, набравшие по шкале J-CTO 5 баллов [11].
Необходимый уровень визуализации постокклюзионных сегментов на этапе диагностики и во время лечебных вмешательств обеспечивает коллатеральный кровоток. Степень развитости коллатералей, а также методы контрастирования коронарных артерий определяют качество заполнения сегментов артерии дистальнее окклюзии. При выраженном коллатеральном кровотоке можно проследить постокклюзионные сегменты на всем протяжении, измерить длину и этажность поражения. Данная информация дает возможность спланировать коррекцию поражения, делает вмешательство более эффективным и безопасным [12–14]. Отсутствие визуализации сегментов артерии дистальнее окклюзии увеличивает риск проведения коронарного проводника вне просвета сосуда, что приводит к механической перфорации артерии и возможному развитию тампонады сердца [14].
Понятие коллатерального кровотока в большой степени синонимично понятию ретроградного кровотока, так как заполнение постокклюзионных сегментов осуществляется противонаправленно антеградному. Коллатеральный коронарный кровоток можно подразделить на внутри- и межсистемный, что зависит от донора коллатералей [15].
В случае отсутствия оптимального контрастирования целевой артерии через внутрисистемные коллатерали возможно применение методики контрлатерального и билатерального введения контрастного вещества в коронарный бассейн, что позволяет улучшить качество визуализации за счет использования межсистемных коллатералей [5, 14].
На настоящий момент в общедоступных источниках нет классификаций коллатерального кровотока, позволяющих определить тип ангиографической визуализации постокклюзионных сегментов артерии. Существующая классификация Rentrop и Cohen систематизирует варианты развитости самих коллатералей, но не обобщает информацию о заполнении артерии реципиента [16]. Подобную информацию об антеградном кровотоке в случае возникновения тромбоза артерии дает шкала TIMI, но ее описательную характеристику из-за отсутствия в ней информации о коллатеральном кровотоке и ином определяющем патоморфологическом субстрате нельзя экстраполировать на постокклюзионные сегменты хронически окклюзированных артерий [17].
Близкой по описательной картине является классификация коллатерального кровотока B. Meier (1989 г.), но в ней отсутствует систематизация вариантов контрастирования постокклюзионных сегментов относительно дистальной капсулы, хотя данная информация имеет большое практическое значение при выполнении эндоваскулярной реканализации ХОКА.
Учитывая потребность в подобной классификации на этапах диагностики и лечения, мы решили предложить свой вариант систематизации ангиографических проявлений коллатерального кровотока.
Цель исследования — систематизировать ангиографические варианты коллатерального кровотока в постокклюзионных сегментах коронарных артерий и определить значение каждого варианта для достижения успеха при выполнении эндоваскулярной реканализации хронических окклюзий коронарных артерий.
Материалы и методы. В исследование были включены 128 пациентов (105 мужчин и 23 женщины), которым за период с 2009 по 2011 г. в условиях Специализированной кардиохирургической клинической больницы Н. Новгорода выполнялось эндоваскулярное вмешательство по поводу ХОКА. Средний возраст пациентов составлял 56,0±0,6 года. У всех была диагностирована стабильная стенокардия II–III функционального класса (NYHA). 33 пациента (25%) перенесли неQ-инфаркт миокарда, у 70 (55%) обнаружены рубцовые изменения миокарда, а у 25 (20%) в анамнезе и по данным неинвазивных методов обследования необратимых изменений миокарда не отмечено. Среди сопутствующих заболеваний в 15 случаях (12%) наблюдался сахарный диабет и в 111 (87%) — артериальная гипертензия. Исходная фракция выброса левого желудочка составляла в среднем 54,8±0,7%. В 48 случаях (38%) отмечалось нарушение сегментарной сократимости сердца: у 31 (24%) — гипокинезия, у 15 (12%) — акинезия, у 2 (2%) — дискинезия. При СКГ у 87 пациентов (68%) определялось многососудистое поражение коронарных артерий, а у 41 больного (32%) поражение было однососудистым. В 39% случаев хронически окклюзирована была передняя нисходящая артерия (ПНА), в 41% — правая коронарная артерия (ПКА) и в 8% — огибающая артерия, во всех остальных случаях это были диагональная ветвь, ветвь тупого края, задняя нисходящая артерия, задняя боковая ветвь. Средний возраст окклюзии составлял 41,0±4,3 мес (от 3 мес до 20 лет), протяженность — от 4 до 50 мм.
Исследование проведено в соответствии с Хельсинкской декларацией (принятой в июне 1964 г. (Хельсинки, Финляндия) и пересмотренной в октябре 2000 г. (Эдинбург, Шотландия)) и одобрено Этическим комитетом НижГМА. От каждого пациента получено информированное согласие.
Всем больным выполняли эндоваскулярное вмешательство с целью реканализации ХОКА. Сложность поражения оценивали по шкале J-CTO. В 47% случаев это были легкие, в 32% — средней сложности, а в 21% — сложные и очень сложные окклюзии.
Интервенционное вмешательство осуществляли в рентгеноперационной, оснащенной цифровым ангиографическим аппаратом Siemens Axiom Artis (Siemens, Германия). Доступ выполняли по методике Сельдингера под местной анестезией через общую бедренную артерию с одной из сторон. Проводили неполную гепаринизацию пациента. Использовали направляющие катетеры JL, EBU, JR, JRSH, AR в зависимости от целевой артерии. У всех пациентов применяли варианты антеградных методик реканализации ХОКА.
Вмешательство начинали с использования гидрофильного проводника с последующей его заменой на более жесткий при отсутствии положительного результата. При проведении коронарного проводника через область окклюзии определяли его вне- или внутрипросветное расположение по прямым ангиографическим признакам. В случае отсутствия оптимальной визуализации постокклюзионных сегментов через внутрисистемные коллатерали выполняли катетеризацию контрлатеральной коронарной артерии. Для этого осуществляли доступ по методике Сельдингера через «свободную» от направляющего катетера общую бедренную артерию. Выполняли билатеральное контрастирование, позволяющее достоверно подтвердить нахождение проводника вне или в просвете сосуда. Регистрация изображения осуществлялась в нескольких проекциях, оптимально подходящих для визуализации целевой артерии. Достоверным внутрипросветным расположением коронарного проводника в постокклюзионных сегментах заинтересованной артерии считалось ангиографическое подтверждение как минимум в двух проекциях. В некоторых случаях использовали ротационную ангиографию, позволяющую уточнить расположение проводника.
На следующем этапе выполняли баллонную ангиопластику пораженного сегмента с дальнейшей ангиографической оценкой полученного результата. В случае восстановления антеградного кровотока по целевой артерии проводили полную гепаринизацию пациента. По показаниям имплантировали стенты с достижением оптимального ангиографического результата.
Вмешательство считали успешным при достижении антеградного кровотока TIMI III по заинтересованной артерии, отсутствии резидуального стеноза в области вмешательства, отсутствии угрожающих диссекций, тромбозов и компрометации кровотока по ветвям целевой артерии.
Результаты ангиографии в формате DICOM (Digital Imaging and Communication in Medicine) были проанализированы с помощью программы Syngo fast View.
Полученные данные обрабатывали с использованием надстройки «пакет анализа» Microsoft Excel 2010. Взаимосвязь параметров изучали при помощи непараметрического метода корреляционного анализа Спирмена. Различия считались статистически значимыми при p<0,05 по t-критерию Стьюдента.
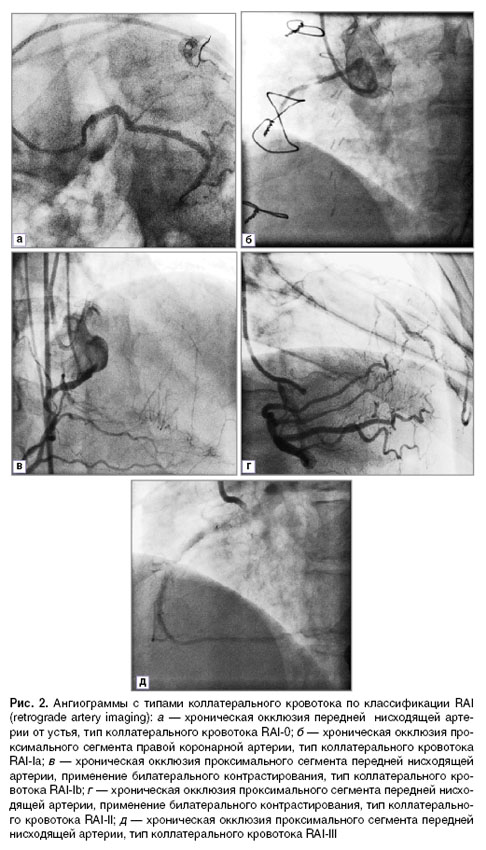
Результаты и обсуждение. После анализа исходных данных СКГ у каждого из пациентов отобраны оптимальные варианты ретроградного контрастирования постокклюзионных сегментов. Распределение по типам коллатерального кровотока проведено на основе двух параметров: по качеству заполнения целевой артерии дистальнее поражения за счет внутри- и межсистемных коллатералей, а также по отношению коллатерального кровотока к сегменту артерии, прилежащему к дистальной капсуле окклюзирующего субстрата. Для обозначения понятия ретроградного контрастирования артерий предложено название RAI (retrograde artery imaging) и определены значения в баллах от 0 до III, характеризующие повышение качества визуализации постокклюзионных сегментов. Тип кровотока RAI-I решено подразделить на два варианта — RAI-Ia и RAI-Ib — в зависимости от наличия или отсутствия визуализации сегмента артерии, прилежащего к окклюзирующему субстрату (рис. 1, 2):
RAI-0 — отсутствие визуализации артерии «реципиента» (рис. 2, а);
RAI-Ia — заполнение фрагментов артерии, в том числе прилежащих к дистальной капсуле окклюзирующего субстрата (рис. 2, б);
RAI-Ib — фрагментарное заполнение постокклюзионных сегментов артерии без визуализации сегмента, прилежащего к дистальной капсуле (рис. 2, в);
RAI-II — постокклюзионные сегменты прослеживаются на большом протяжении, но без визуализации сегмента, прилежащего к дистальной капсуле (рис. 2, г);
RAI-III — тугое коллатеральное заполнение постокклюзионных сегментов артерии от дистальной капсулы до терминальных ветвей (рис. 2, д).
Распределение вариантов коллатерального кровотока в анализируемой группе пациентов было следующим (рис. 3).
 Рис. 3. Распределение ангиографических типов коллатерального кровотока RAI у пациентов с хроническими окклюзиями коронарных артерий Рис. 3. Распределение ангиографических типов коллатерального кровотока RAI у пациентов с хроническими окклюзиями коронарных артерий
|
Анализ зависимости успехов реканализации от типа коллатерального кровотока в постокклюзионных сегментах позволил выявить их тесную взаимосвязь: при кровотоке типов RAI-IIIи RAI-Iа успех был достигаем чаще, чем в остальных случаях. Наличие коллатерального кровотока типов RAI-II и RAI-Ib в меньшей степени приводило к положительному результату при проведении антеградной механической реканализации (рис. 4).
 Рис. 4. Зависимость успеха реканализации от типа коллатерального кровотока; * — р<0,005 Рис. 4. Зависимость успеха реканализации от типа коллатерального кровотока; * — р<0,005
|
При типах коллатерального кровотока RAI-0 и RAI-Ib отмечено большее относительное количество интраоперационных осложнений, а также большее время флюороскопии и большее количество стентов, потребовавшихся для достижения оптимального результата (табл. 1, 2).
 Таблица 1. Достижение успеха при реканализации хронических окклюзий коллатерального кровотока в зависимости от типа ретроградного контрастирования (варианта коллатерального кровотока) Таблица 1. Достижение успеха при реканализации хронических окклюзий коллатерального кровотока в зависимости от типа ретроградного контрастирования (варианта коллатерального кровотока)
|
 Таблица 2. Попытки реканализации хронических окклюзий коллатерального кровотока в зависимости от типа ретроградного контрастирования (варианта коллатерального кровотока) Таблица 2. Попытки реканализации хронических окклюзий коллатерального кровотока в зависимости от типа ретроградного контрастирования (варианта коллатерального кровотока)
|
Успешная реканализация выполнена в 97 случаях (76%). Применение билатерального контрастирования потребовалось у 34 пациентов (27%), что было связано с отсутствием оптимального контрастирования постокклюзионных сегментов артерии через внутрисистемные коллатерали.
Вмешательство пришлось прекратить, не достигнув положительного результата, в 31 случае (24%), что было обусловлено высоким риском перфорации артерии, а также превышением допустимого объема используемого контрастного вещества и дозы ионизирующего излучения.
В 13 случаях отмечены интраоперационные осложнения. У 6 пациентов во время попытки реканализации развилась продольная диссекция ствола левой коронарной артерии с компрометацией кровотока дистальнее вмешательства, что потребовало дополнительной имплантации стентов. В двух случаях возникла перфорация целевой артерии, которую удалось устранить консервативно. Необходимо отметить две тампонады сердца, потребовавших пункции и дренирования перикарда. Отмечено одно осложнение доступа в виде ложной аневризмы, потребовавшей дополнительного оперативного вмешательства. Среди осложнений также были зафиксированы два интраоперационных инфаркта миокарда, один из которых привел к неуправляемому падению гемодинамики и смерти больного на операционном столе.
С помощью методов оптимизации визуализации постокклюзионных сегментов, например билатерального контрастирования, можно предупредить перфорацию артерии с последующим развитием тампонады сердца, однако при его использовании возрастает риск осложнений доступа, а наличие дополнительного катетера на фоне неполной гепаринизации может приводить к повышению риска тромбоэмболии коронарного русла. Все остальные осложнения являются неспецифическими и не зависят от выбранной тактики контрастирования коронарного бассейна.
Оптимальный результат, достигнутый в 97 случаях, потребовал в среднем 21,0±1,4 мин флюороскопии, 341,0±11,5 мл контрастного вещества и имплантации 1,7±0,1 стента на каждого пациента, что соответствует хорошему уровню эндоваскулярного лечения ХОКА.
Таким образом, типы коллатерального кровотока RAI-Ia и RAI-III являются оптимальными во время выполнения реканализации ХОКА, они позволяют подтвердить внутрипросветное расположение коронарного проводника и безопасно выполнить катетерную баллонную ангиопластику и последующее стентирование заинтересованного сегмента артерии. Определение истинной длины окклюзии возможно также при достижении коллатерального кровотока типа RAI-Ia и RAI-III, что важно при планировании коррекции поражения и определении количества имплантируемых стентов с лекарственным покрытием в случае возникновения продольной диссекции целевой артерии.
В случае ретроградного кровотока типа RAI-0, RAI-Ib и RAI-II за счет внутрисистемных коллатералей можно оптимизировать качество визуализации постокклюзионных сегментов целевой артерии путем использования билатерального контрастирования.
При агрессивной реканализации ХОКА стоит учитывать риски возникновения жизнеугрожающих осложнений, контролировать гемодинамику пациента, при необходимости выполнять интраоперационное эхоКГ-исследование.
Интервенционная коррекция ХОКА является относительно безопасным и физиологически обоснованным вмешательством. При повышении мастерства оператора, использовании современного специализированного инструментария и соблюдении техники вмешательств возможно выполнение успешных реканализаций более чем в 80% случаев. Тщательное планирование и оптимизацию визуализации целевого коронарного бассейна может обеспечить оценка типа коллатерального кровотока по классификации RAI. Знание особенностей кровотока в каждом конкретном случае уменьшает риски вмешательства, делает результат более предсказуемым.
Заключение. Разработанная классификация ретроградного кровотока RAI, предназначенная для оптимизации визуализации постокклюзионных сегментов, играет важную роль в оценке возможного успеха реканализации ХОКА и может быть предложена как вариант систематизации ангиографических проявлений коллатерального кровотока. Она позволяет оценить качество визуализации, определить распространенность поражения и выбрать тактику интервенционной коррекции.
Финансирование исследования и конфликт интересов. Исследование не финансировалось какими-либо источниками, и конфликты интересов, связанные с данным исследованием, отсутствуют.