Основы создания биосовместимых и биостойких полимерных имплантатов (обзор)
Изложены основные теоретические аспекты изготовления биосовместимых и биостойких имплантатов. Обзор отражает главным образом опыт исследований нашей группы. Продемонстрировано, что под биосовместимыми имплантатами следует понимать не только те, которые не отторгаются организмом, но и те, которые дополнительно не капсулируются в организме. Изготовление их должно происходить по одностадийной схеме методом фронтальной фотополимеризации с предельно малой глубиной фронта реакции, чтобы исключить дефектообразование в полимере. Кроме того, требуется дополнительная операция, приводящая к гибели в полимере концевых свободных макрорадикалов и лабильных продуктов. Для изготовления имплантатов используют фотополимеризующиеся композиции, приводящие к образованию гидрофобных пространственно-сшитых полимеров, в которых время корреляции вращательного движения парамагнитного зонда 2,2,6,6-тетраметил-4-оксипиперидин-1-оксила приблизительно равно 6·10–10 с. Выполнение этих условий предполагает использование способных к полимеризации по радикальному механизму композиций на основе олигомеров (олигоэфирметакрилатов, олигокарбонатметакрилатов, олигоуренатметакрилатов и др.). Не подходят для изготовления биосовместимых и биостойких имплантатов композиции, в которых время корреляции используемого зонда как меньше, так и значительно больше указанного значения. При выполнении этих условий от свойств применяемых олигомер-мономерных смесей больше зависят физико-механические свойства имплантатов, чем их биосовместимость и биостойкость. Отсутствие капсулирования имплантатов определяется составом исходной композиции, естественно, при условии, что указанные выше требования выполнены. В биостойких и биосовместимых имплантатах полимер может быть только оптически прозрачным, но обратное не обязательно.
Полимерные имплантаты находят все более широкое применение в медицине. Сейчас невозможно представить офтальмохирургию без интраокулярных линз [1–30], склероплантов [31–36], интрастромальных и внутрикапсульных колец [37–53], глаукоматозных дренажей и шунтов [54–64]; нейрохирургию — без твердых мозговых оболочек [65–73]; ненатяжную пластику в хирургии грыж брюшной стенки — без специальных полимерных сеток [74–87]; челюстно-лицевую хирургию, ортопедическую хирургию, нейрохирургию — без специальных полимерных пластин, восстанавливающих или заменяющих кость [88–96], и т.д. Использование полимеров в медицине могло бы быть еще более широким, если бы в полной мере была решена проблема их биосовместимости и биостойкости.
Полимеры, применяемые в медицине, можно разделить на две большие группы: биодеградируемые (рассасывающиеся) и нерассасывающиеся [97–103]. Биодеградируемые полимеры по определению не могут быть биостойкими — при их деструкции, скорее всего, образуются низкомолекулярные соединения, которые организм принимает за «свои»: они участвуют в метаболических процессах или есть механизм их выведения. Например, для производства некоторых имплантатов используют полимолочную кислоту, при гидролизе которой образуется молочная кислота, представляющая собой естественный метаболит цикла Кребса [101]. Для создания биодеградируемых имплантатов широкое применение находят полимеры как выделенные из растений и животных, так и синтетические, например полиэфиры цианакриловой и гидроксикарбоновых кислот и многие другие [101]. Имплантаты из этих полимеров вполне могут быть биосовместимыми, но не биостойкими. В нашем обзоре основное внимание уделено созданию имплантатов, из которых не должно быть никаких выделений (биостабильных). Конечно, мы не можем игнорировать биодеградируемые полимеры. И те, и другие хороши для решения своих задач: для изготовления шовных нитей, скорее всего, лучше подходят биодеградируемые полимеры, например на основе полигликолевой кислоты [101], тогда как при изготовлении интраокулярных линз (ИОЛ) применение таких полимеров исключено. Для производства этих изделий лучше использовать биостабильные полимеры [104].
При получении имплантатов следует учитывать не только тип полимера, из которого они должны быть выполнены, но также и способ их изготовления. Полимерные имплантаты, как правило, представляют собой разнообразные 3D-конструкции, имеющие различную архитектуру и морфологию. Например, ИОЛ часто представляют собой двояковыпуклые линзы с опорными элементами (гаптикой), выполненные из оптически-прозрачного полимера [8, 11, 13, 17–20, 28]; твердые мозговые оболочки — разного рода мембраны или пленки, несущие на себе различной геометрии рельефные рисунки [68, 69, 73]; глаукоматозные микрошунты и дренажи — пористые или перфорированные пленки, различного рода трубки, другие допустимые конструкции, предназначенные для отвода глазной жидкости из задней камеры в кровеносные сосуды [54–63, 105], и т.д.
Известны две принципиально разные схемы изготовления полимерных имплантатов: традиционная двухстадийная, когда сначала синтезируют полимер, а затем из него формируют всеми возможными способами полимерное изделие, и одностадийная, когда одновременно (во время одной стадии) синтезируют и полимер, и изделие [104, 106]. По традиционной двухстадийной схеме при формировании изделий широко используют термопрессование, литье под давлением, механическую обработку, электроспиннинг [107–112], формирование на фильерах полимерных нитей и волокон и плетение из них изделий [113, 114], вымывание различных кристаллов из наполненных ими полимеров [115], сверхкритические флюидные технологии [116–122] и т.п.
В обзоре преимущественно рассмотрена одностадийная схема получения полимерных имплантатов. В какой-то степени это обусловлено тем, что изготовление по данной схеме практически не отражено в литературе. Такое отношение объясняется тем, что до последнего времени доминирует отрицательное отношение к одностадийной схеме изготовления полимерных изделий. Она считается малоперспективной, фактически не пригодной при получении прецизионных и оптически-прозрачных полимерных изделий. Основными непреодолимыми препятствиями при получении таких изделий по одностадийной схеме считают усадку реакционной среды и тепловыделение при любом методе синтеза полимеров. Такие явления имеют к изготовлению полимерных изделий по этой схеме самое непосредственное отношение, поскольку одностадийная схема предполагает использование не полимеров, а мономеров определенного типа. От усадки реакционной массы и тепловыделения при полимеризации практически всех мономеров нельзя избавиться, однако есть возможность проводить формирование полимерных изделий так, чтобы исключить отрицательное действие этих явлений на качество получаемых изделий. Основные требования к мономерам и условиям синтеза фактически не полимеров, а полимерных изделий рассмотрены ниже.
Далеко не случайно при изготовлении изделий по одностадийной схеме для инициирования реакции полимеризации используют свет. Потоком света можно управлять, его можно направить на те участки, где должен образоваться полимер, и наоборот, предпринять все усилия, чтобы он не проникал туда, где полимер должен отсутствовать. На современном этапе одностадийная схема изготовления полимерных изделий непосредственно связана с фотохимией, фотополимеризацией, фотолитографией, однако управление темновыми реакциями в пространстве пока не представляется возможным. В связи с этим для данного промежутка времени характерна разработка различных способов изготовления полимерных имплантатов методами фотолитографии. модификация этих способов направлена на получение трехмерных изделий, а не плоских (двумерных) [123–125]. Маловероятно, что будет создан один, универсальный способ изготовления полимерных имплантатов по одностадийной схеме. Он должен учитывать, что архитектура имплантатов и их геометрические размеры будут сильно отличаться в зависимости от того, в какие ткани они должны имплантироваться и какое пространство занимать. Создание способов изготовления имплантатов разных форм и размеров по одностадийной схеме, где свет становится основным «инструментом», находится только в начале пути. Не исключено, что в будущем при изготовлении имплантатов будут применять не только свет, но и другие виды излучения (рентгеновское, электронное и др.).
Развитие тканевой инженерии, предполагающей использование заданной формы полимерных каркасов (скаффолдов), способных играть роль зародышей образования новой ткани вместо поврежденной или неправильно функционирующей, предъявляет ряд новых требований к имплантатам. Теперь только их архитектуру и отсутствие каких-либо выделений из них нельзя считать достаточными требованиями. Имплантаты не только не должны отторгаться организмом, но и не должны изолироваться от окружающих тканей. Можно сказать, что тканевая инженерия существенно меняет понятие биосовместимости [101, 126]. Имплантаты (каркасы) должны достаточно прочно присоединять биологические клетки строго определенного типа (т.е. обладать довольно высокой адгезией), не должны препятствовать их делению (размножению) и, наоборот, должны препятствовать присоединению и размножению клеток других типов (т.е. стимулировать селективно рост только заданных тканей) [126].
Есть две точки зрения на то, какие свойства необходимы для скаффолдов: культивирование клеток может происходить in vitro (вне организма) и только потом имплантироваться в поврежденные ткани [127, 128], или сразу такие каркасы должны внедряться в организм, где они станут выступать в качестве зародыша роста и развития утраченной ткани. Полагаем, что первая точка зрения не лишена недостатков. Главный вопрос в том, как быть с основной реакцией любого организма на временное или постоянное проникновение всякого инородного предмета в его ткани, приводящей к образованию соединительной ткани вокруг этого предмета или раны (капсулированию). Конечно, капсулирование не приводит к отторжению имплантатов, но может вызвать нежелательное изолирование их от окружающей среды. Такое изолирование, в частности, происходит в случае имплантации глаукоматозных дренажей и приводит к прекращению выполнения предназначенной им функции [129]. Капсулирование сводит на нет все предполагаемые положительные эффекты от внедрения таких имплантатов. В связи с этим возникает вопрос: какими свойствами должен обладать имплантат, чтобы организм не воспринимал его как инородное тело? Ответ не может быть получен без знаний механизма присоединения клеток к имплантатам.
Обычно считают, что адгезия клеток к имплантатам определяется либо электростатическими, либо какими-то специфическими взаимодействиями, в случае которых для сцепления есть специальные фрагменты, подходящие друг к другу как ключ к замку [101, 130]. Можно допустить, что в случае специфических взаимодействий присоединение клеток к имплантату опредяляется возможностью образования водородных связей. Реализации специфических взаимодействий достигают тем, что на поверхности полимерных каркасов иммобилизуют биологически активные молекулы и присоединяют к ним пептиды [101, 102]. Наличие электростатических взаимодействий может быть объяснено тем, что на клеточных мембранах есть так называемый потенциал покоя — разность потенциалов между протоплазмой клетки и ее внешней средой. Разность потенциалов происходит из-за того, что проницаемость клеточных мембран различна для разных ионов и существует активный транспорт через нее избранных ионов, в результате чего на внутренней поверхности мембраны сконцентрирован отрицательный заряд, а на внешней — положительный. Это позволяет допустить, что присоединение клетки к имплантату будет происходить, если поверхность последнего заряжена положительно. При таких механизмах присоединения клеток к имплантатам вполне реален их рост и превращение в ткани in vitro, но маловероятно, что такое возможно in vivo. Эти механизмы не решают проблемы капсулирования.
Показанные механизмы сцепления клеток с имплантатами не единственны. Сцепление возможно и по типу образования биологических мембран. Основу всех биологических мембран (матрикса) составляет двойной слой из липидов, обычно фосфолипидов. Молекулы фосфолипидов имеют гидрофильную головку и гидрофобные концы (линейные цепочки, состоящие из 8–18 фрагментов СН2). С термодинамической точки зрения в воде энергетически наиболее выгодным состоянием этих молекул будет такое, когда они образуют двойной слой, в котором гидрофобные концы находятся в центральной зоне и направлены друг к другу, а гидрофильные головки располагаются на периферии слоя и обращены к окружающей среде (воде). Такая структура характерна только в водных растворах. В неполярных растворителях все наоборот — тоже двойной слой, но внутри гидрофильные концы, а гидрофобные — на периферии. Это свидетельствует о том, что при образовании каких-либо структур важно не столько наличие взаимодействий, а общее значение энергии конкретной системы в заданной среде — нельзя игнорировать окружающую среду. В связи с этим следует ожидать присоединения клеток к тем имплантатам, на поверхности которых есть слой из предельных углеводородов той же длины, что и в биомембранах (на поверхности скаффолда должен быть разновысотный «лес», построенный из предельных линейных углеводородов). Если такие скаффолды разместить в водных питательных средах или в тканях живого организма, то на их поверхности сначала будут адсорбироваться липиды с образованием структуры, соответствующей матриксу мембраны, а затем слой белков, к которому и становится возможным прикрепление клеток.
Нужно сказать, что эти представления согласуются с экспериментом [131]. К каркасам, изготовленным по одностадийной схеме, довольно прочно прикрепляются прогениторные клетки, они способствуют их дифференцировке, стимулируют рост (в итоге образуется нервная ткань, способная к выполнению предназначенных ей функций). Полимерные имплантаты (каркасы) с такими свойствами препятствуют и капсулированию — состояние мозга крысы после введения туда такого имплантата сохранялось неизменным в течение года. Это также легко объяснить. Биологические молекулы в основном должны находиться не в свободном состоянии, а в связанном — входящими в состав каких-либо стуктур, например биомембран. Можно предположить, что образование соединительной ткани вызывают некоторые молекулы, находящиеся в свободном состоянии (скорее всего, они сигнализируют о необходимости образования соединительной ткани). Проникновение чужеродного предмета в ткани всегда связано с разрушением клеток и появлением биомолекул в свободном состоянии. К выключению сигнализации о проникновении в организм чужеродного предмета приводит обратный процесс — переход молекул из свободного состояния в связанное. Такой процесс должен происходить при имплантации указанных выше имплантатов за счет адгезии к поверхности сначала липидов, потом белков, а далее и других молекул.
Имплантаты с указанными выше свойствами в организме приобретают почти такое же покрытие, что и у окружающих их клеток. По химическому составу такие покрытия могут не отличаться от биомембран, но между внутренней и внешней сторонами поверхности имплантата отсутствует потенциал покоя, характерный для «живых» клеток. Пока это все, что можно сделать. Воспроизвести активный транспорт ионов пока нет возможностей. Однако есть уверенность в том, что потенциал покоя не способствует адгезии клеток к имплантату в той степени, как указано в работе [101]. Наиболее верный путь к созданию биостабильных имплантатов, по нашему мнению, — это тот, который указан в работе [131].
Полагаем, что вышеизложенного достаточно, чтобы сделать вывод о перспективности одностадийных процессов при формировании имплантатов. С помощью литографических методов возможно изготовление имплантатов не только любой сложности, но и с размерами, характерными для клеточных образований. Примером этому может служить микроэлектроника, существование которой трудно представить без литографических процессов. Эти процессы найдут еще более широкое применение при изготовлении полимерных имплантатов, если будут учтены основные закономерности фотополимеризации олигомеров и мономеров, рассмотренные ниже.
Считаем, что создание биосовместимых и биостойких имплантатов невозможно без учета явлений остановки химических реакций и нивелировки реакционной способности, возникающих при переходах от низковязких сред к высоковязким [132–135], и достижения равновесной плотности упаковки макромолекул в имплантатах. Теория этих явлений изложена в работе [134]. Суть теории заключается в том, что эффективные константы скоростей бимолекулярных реакций в конденсированных средах равны произведениям констант скоростей реакций k1 на величины клеточного эффекта Ркл, при этом механизм таких реакций описывается одной из двух схем:

В ходе реакции реагенты сначала попадают в пределы одной клетки, из которой через активированное состояние переходят в сторону образования конечных продуктов. Нижняя схема отличается от верхней только тем, что переход из активированного состояния в сторону продуктов реакции происходит не в результате процесса, характеризуемого константой скорости реакции k3, а в результате диффузионного движения (обозначено двойной стрелкой), характеризуемого коэффициентом диффузии D. Это различие имеет принципиальное значение. Дело в том, что плотность распределения вероятностей обнаружения продуктов реакции в первом случае определяется показательной функцией следующего типа (корректно только для процессов Пуассона):

тогда как во втором — из решений уравнения Фоккера–Планка (не соответствуют требованиям, предъявляемым к процессам Пуассона). Наиболее простым вариантом представления плотности распределения вероятностей обнаружения продуктов реакции в данном случае является функция [136]:

где z — расстояние, которое должны преодолеть реагенты в сторону конечных продуктов реакции, чтобы выйти из клетки. Использование обыкновенных дифференциальных уравнений (в кинетике — закона действия масс) возможно только при описании процессов Пуассона. В связи с этим величины клеточного эффекта (Ркл.эф) для приведенных выше схем определим следующими интегралами [137–140]:


|
где |
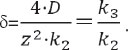
|
Представленные кривые плотности распределения вероятностей, определяемые уравнениями (1) и (2), а также зависимости величины клеточного эффекта от параметра δ, определяемые уравнениями (3) и (4), показывают (рис. 1), насколько сильно они могут отличаться друг от друга при смене одной плотности распределения вероятностей на другую. Легко представить, что будет происходить при уменьшении параметра δ. Уменьшение его при постоянной температуре может быть обусловлено увеличением вязкости среды либо увеличением молекулярных размеров и структуры реагентов. При больших значениях δ величины клеточного эффекта определяются верхней кривой (этого требует классическая кинетическая теория), при малых значениях — нижней кривой. В окрестности каких-то значений δ должен происходить переход с верхней кривой на нижнюю. На рис. 1 представлена также предполагаемая зависимость величины клеточного эффекта от параметра δ. Поскольку наблюдаемые константы скоростей химических реакций равны произведениям k1·Ркл.эф(δ), то такие переходы должны сопровождаться резким замедлением хода реакций (кажущейся остановкой реакции). Перенос реакций из низковязких сред в высоковязкие (точнее, при уменьшении подвижности реагентов) должен приводить к падениям скоростей химических реакций, равным отклонениям одной кривой зависимости Ркл.эф(δ) от другой [134]. Можно сказать, что данный подход снимает противоречия между химической кинетикой и той, которая имеет место в живых системах. В живых системах химические процессы проходят в изотермических условиях, в связи с чем по существу химическая кинетика не может предложить способы управления этими реакциями. Совсем иначе обстоит дело в случае применения уравнения (4) и кривых, представленных на рис. 1, которые декларируют зависимость констант скоростей реакций от подвижности реагентов, без чего, в частности, нельзя обойтись при анализе факторов, влияющих на скорости химических реакций в биологических системах. Явление нивелировки реакционной способности следует связать с тем, что с увеличением вязкости среды в первую очередь останавливаются быстропротекающие реакции, а потом — более медленные, но переходы к диффузионным движениям в случае быстрых реакций происходят при меньших значениях параметра δ, чем в случае медленных реакций. Последнее, в частности, следует из того, что явление нивелировки реакционной способности в высоковязких средах предполагает приблизительное равенство произведения k1·Pкл.эф(δ) (чем больше k1, тем меньше Ркл.эф).
Теперь следует сказать, что должно происходить при получении полимеров методом радикальной полимеризации. Отличительной особенностью реакции полимеризации от многих других является рост вязкости среды по мере хода реакции (увеличения степени конверсии мономера). Поскольку самой быстрой стадией в реакции полимеризации по радикальному механизму являются реакции обрыва цепи, то остановка именно этих реакций и должна происходить в первую очередь. Остановка этой стадии должна приводить по существу к безобрывной полимеризации, результатом которой должно стать прекращение гибели концевых макрорадикалов в результате реакций рекомбинации и диспропорционирования. Дальнейшее увеличение вязкости реакционной среды неизбежно должно приводить и к остановке реакций роста цепи полимеризации — это проявляется в том, что часть мономера остается неизрасходованной (свободной). В ряде случаев можно уменьшить содержание в полимере свободного мономера, вводя дополнительные операции — нагрев полимера после полимеризации (уменьшение вязкости среды за счет увеличения температуры) или временное введение в полимер инертного растворителя (уменьшение вязкости среды за счет пластификации) [141]. Такие методы хорошо известны, и нет смысла их далее рассматривать.
Определим следствия этих явлений применительно к реакциям полимеризации, которые должны выполняться при любых условиях. Известно, что скорость реакции полимеризации (Vпол) равна [142]

где vi и  — скорость инициирования и средняя длина кинетической цепи полимеризации. Если реакция полимеризации проходит в стационарном режиме (как правило, считают, что именно этот режим и характерен для полимеризации по радикальному механизму), то справедливы соотношения [143, 144]:
— скорость инициирования и средняя длина кинетической цепи полимеризации. Если реакция полимеризации проходит в стационарном режиме (как правило, считают, что именно этот режим и характерен для полимеризации по радикальному механизму), то справедливы соотношения [143, 144]:

где kp и k0 — константы скоростей реакций роста и обрыва цепей полимеризации (предполагают, что скорость образования свободных радикалов в стационарном режиме равна скорости гибели макрорадикалов в результате реакций рекомбинации и диспропорционирования).
Используя соотношения (1)–(6), приходим к следующим следствиям:
1) действие факторов, приводящих к уменьшению подвижности реагентов, в первую очередь должно вызывать остановку реакций обрыва цепи полимеризации (k0≈0), что неизбежно должно приводить к аномально большой скорости полимеризации (Vпол≈∞ при неизменном значении kp);
2) дальнейшее уменьшение подвижности реагентов должно приводить к уменьшению величины kp (остановке реакций роста цепи полимеризации и уменьшению скорости полимеризации), но при этом скорость полимеризации должна быть пропорциональна скорости инициирования цепи полимеризации в первой степени, а не в степени, равной 1/2 (средняя длина кинетической цепи полимеризации не зависит от скорости инициирования);
3) изменение констант скоростей реакций k0 и kp от подвижности соответствующих реагентов происходит по типу критических явлений, положение которых зависит только от параметра δ.
Проявление этих следствий можно рассматривать как указание на протекание безобрывной радикальной полимеризации. О возможности протекания безобрывной полимеризации прежде всего свидетельствует так называемый гель-эффект (эффект Тромсдорфа, который приводит к увеличению скорости полимеризации при больших степенях конверсии мономера — не менее чем на два порядка по сравнению с первоначальной, что согласуется с остановкой реакций обрыва цепи полимеризации в результате реакций рекомбинации и диспропорционирования) [143, 144]. Он наблюдается при полимеризации почти всех низковязких мономеров (метилметакрилат, бутилметакрилат, метакриловая кислота и др.). При полимеризации этих мономеров всегда происходит самоускорение реакции в конце хода реакции (при достижении определенной вязкости). Кинетические кривые фотополимеризации в случае таких мономеров состоят из четырех участков: индукционного периода; стационарного режима протекания реакции — здесь выполняются закономерности, описываемые уравнениями (6); безобрывной полимеризации — отсутствие обрыва цепи в результате реакций рекомбинации и диспропорционирования не исключает обрыв цепи в результате других реакций, например «захвата» свободных радикалов образующимся полимером; завершающей стадии (рис. 2).
 Рис. 2. Типичная кинетическая кривая зависимости степени полимеризации низковязких мономеров от времени Рис. 2. Типичная кинетическая кривая зависимости степени полимеризации низковязких мономеров от времени
|
Одно из основных допущений связано с тем, что следствие 3 допускает приготовление композиций с такой исходной вязкостью; при их полимеризации отсутствует стационарный режим протекания реакции, соответственно и самоускорение в конце хода реакции — безобрывная полимеризация начинается сразу после завершения индукционного периода (рис. 3). В случае этих композиций скорость полимеризации должна быть аномально большой (полимеризацию можно провести в течение нескольких минут и даже секунд, а не в течение многих часов) и линейно зависеть от скорости инициирования цепи полимеризации. Такие композиции были получены при замене низковязких мономеров на олигомеры (различные олигоэфирметакрилаты, олигокарбонатметакрилаты, олигоуретанметакрилаты и другие, представленные в работах [145, 146]). Поэтому на сформулированный в работе [147] вопрос, почему эти олигомеры полимеризуются с аномально высокой скоростью, несмотря на то, что их реакционная способность не больше, чем у обычных мономеров, с точки зрения изложенного выше ответом будет служить — это протекание реакции по безобрывному механизму (следствие остановки реакций обрыва цепи полимеризации). Необходимо учесть, что безобрывный механизм полимеризации предполагает образование концевых макрорадикалов в полимере. Это не единственный их механизм образования. Индукционный период связан с наличием в реакционной смеси высокоэффективного ингибитора радикальной полимеризации. Доказано, что существует так называемая псевдоживая радикальная полимеризация [144, 148]. Ее происхождение связывают с тем, что комплекс концевого макрорадикала с ингибитором неустойчив и способен к распаду:
П–Инг→П•+Инг•,
причем обратим внимание — с образованием концевого свободного макрорадикала. Образование концевых макрорадикалов также может происходить при резании полимеров [149, 150], что неизбежно в ходе изготовления полимерных имплантатов по двухстадийной схеме.
 Рис. 3. Идеальная кинетическая кривая зависимости степени полимеризации мономеров от времени для реализации фронтальной фотополимеризации Рис. 3. Идеальная кинетическая кривая зависимости степени полимеризации мономеров от времени для реализации фронтальной фотополимеризации
|
Приведем некоторые результаты наших исследований, которые иллюстрируют основные особенности проявления указанных выше следствий. Все полимеры и изделия из полимеров получали фотополимеризацией. Использование фотополимеризации оправдано следующим: 1) процесс можно проводить при любой температуре при условиях, приближенных к изотермическим; 2) скорость инициирования полимеризации в данном случае равна произведению ελ·С0·Е0, что допускает ее изменение путем варьирования интенсивности света (Е0) (С0 и ελ — концентрация и молекулярный коэффициент поглощения света при длине волны λ фотоинициатора в композиции); 3)изменение скорости инициирования не затрагивает изменений констант скоростей реакций роста и обрыва цепи полимеризации. Во всех композициях в качестве фотоинициатора использовали 4,4-диметилфенилацетофенон.
При фотополимеризации олигокарбонатметакрилата марки ОКМ-2 (скорость полимеризации пропорциональна интенсивности света в первой степени) образуется твердый полимер с температурой стеклования около 90°С, в котором сохраняются концевые макрорадикалы при комнатной температуре в течение ~10 сут, спектр электронно-парамагнитного резонанса (ЭПР) которых показан на рис. 4 (типичен для всех концевых макрорадикалов метакрилового ряда [149, 150]). Это свидетельствует о том, что есть композиции, при полимеризации которых образование свободных радикалов происходит, а гибели их нет. Можно сказать, что эти данные свидетельствуют о ходе безобрывной полимеризации.
 Рис. 4. Спектр электронно-парамагнитного резонанса типичных концевых макрорадикалов при полимеризации олигокарбонатметакрилата марки ОКМ-2 Рис. 4. Спектр электронно-парамагнитного резонанса типичных концевых макрорадикалов при полимеризации олигокарбонатметакрилата марки ОКМ-2
|
Однако есть и композиции, в которых протекание безобрывной полимеризации не так очевидно. Это касается композиций, описанных в [151, 152], которые используют при получении упруго-эластичных интраокулярных линз (температура стеклования полимеров в случае этих композиций — не выше минус 40°С). После полимеризации этих композиций не удалось методом ЭПР зарегистрировать свободные радикалы. Мы не думаем, что это противоречит предположению о безобрывной полимеризации. Основные следствия выполняются — имеем аномально большую скорость полимеризации, которая пропорциональна интенсивности света в первой степени. В этих композициях, по всей видимости, отсутствует гибель макрорадикалов в результате реакций рекомбинации и диспропорционирования, но сохраняется их гибель в результате более медленных реакций, которые конкурируют с реакциями обрыва цепи полимеризации (термоокислительная деструкция, миграция свободной валентности и другие). Это вероятно, поскольку в случае данных имплантатов жесткость полимеров значительно меньше, чем в случае имплантатов из ОКМ-2.
На рис. 5 приведена типичная зависимость скорости полимеризации олигоэфиракрилата марки ТГМ-3 в «матричном» полимере (сополимере бутилметакрилат–метакриловая кислота, состав которого указан в [153, 154]) от времени корреляции вращательного движения парамагнитного зонда (ПЗ). В качестве ПЗ использовали 2,2,6,6-тетраметил-4-оксипиперидин-1-оксил, разной подвижности реагентов в этих композициях достигали путем изменения содержания в них «матричного» полимера. Эта кривая имеет максимум при временах корреляции, приблизительно равных 6·10–10 с. Наличие максимума соответствует приведенным выше следствиям — в первую очередь останавливаются реакции обрыва цепи, а только потом реакции их роста.
 Рис. 5. Зависимость скорости полимеризации (Vпол) олигоэфиракрилата марки ТГМ-3 в «матричном» полимере от времени корреляции ( Рис. 5. Зависимость скорости полимеризации (Vпол) олигоэфиракрилата марки ТГМ-3 в «матричном» полимере от времени корреляции ( k·10–10) вращательного движения парамагнитного зонда k·10–10) вращательного движения парамагнитного зонда
|
Если в композициях с «матричным» полимером на кривых зависимости скорости полимеризации от времени корреляции ПЗ есть довольно острый максимум, то в композициях без «матричного» полимера максимум значительно шире (приготовляли разные по составу композиции, в которых времена корреляции ПЗ указаны на рис. 6). В олигомер-мономерных смесях скорость полимеризации также возрастает с увеличением вязкости (времени корреляции ПЗ), но достигает максимальных значений при временах корреляции ПЗ, равных не 6·10–10 с, а 0,5·10–10 с) (см. рис. 6).
 Рис. 6. Зависимость скорости полимеризации Vпол от времени корреляции ( Рис. 6. Зависимость скорости полимеризации Vпол от времени корреляции ( k·10–10) в жидких фотополимеризующихся композициях, составленных из различных олигомеров k·10–10) в жидких фотополимеризующихся композициях, составленных из различных олигомеров
|
Закономерно возникает вопрос, чем обусловлены столь большие отличия в кривых зависимости скорости полимеризации от подвижности реагентов в композициях с «матричным» полимером и без него? Если в композициях нет «матричного» полимера и время корреляции меньше 6·10–10 с, то полимеризация олигомеров идет преимущественно по микрогетерогенному механизму — сначала образуются «зерна» из полимера, а далее происходят их рост и слияние [146]. Образование «зерен» обусловлено тем, что олигомеры имеют две или более двойные связи, приводящие к образованию пространственно-сшитого полимера, который теряет способность растворяться в исходной смеси. Образование таких «зерен» означает не что иное, как локальное увеличение вязкости в реакционной среде, что неизбежно должно приводить в свою очередь к локальному изменению скорости полимеризации в этих областях. Предполагаем, что на поверхности «зерен» возникает слой, в котором вязкость такова, что полимеризация может проходить с аномально большой скоростью. Разумно также предположить, что время корреляции ПЗ в таком слое равно 6·10–10 с (будем думать, что скорость полимеризации и подвижность реагентов в «зернах» зависят от удаленности их от центров, причем если подвижность реагентов монотонно падает при приближении к центрам, то зависимость скорости полимеризации от удаленности, так же, как и на рис. 5, имеет максимум). При временах, бόльших этого времени, идет гомогенная полимеризация [154]. По существу в олигомер-мономерных смесях идет срыв к полимеризации по микрогетерогенному механизму. Понятно, чтобы этот срыв происходил, необходима диффузия компонентов в смеси с достаточно большой скоростью. «Матричный» полимер в композициях выступает в роли своеобразного препятствия для диффузии реагентов в смеси.
Все это свидетельствует о том, что наибольшей скорости полимеризации можно достичь только при использовании композиций, в которых время корреляции ПЗ не менее 6·10–10 с, но в них неизбежно образование концевых радикалов. В тех системах, в которых затруднительна их регистрация методом ЭПР, следует считать, что эти радикалы без сомнения образуются, но успевают прореагировать и привести к образованию каких-то лабильных продуктов, а не рекомбинировать друг с другом. Наличие свободных радикалов и лабильных продуктов в полимере приводит к токсичности, связанной с выделением низкомолекулярных веществ в окружающие ткани. Полагаем, что в таких системах основным процессом является растворение полимеров без стадии набухания (по неизвестному ранее механизму), обусловленное одновременным протеканием на границе раздела полимер–среда двух процессов — деполимеризации и полимеризации (рис. 7). Для хода этих процессов требуется наличие концевых макрорадикалов в полимере и свободных радикалов в среде. Свободные радикалы в окружающей полимер среде могут появляться в результате реакций подходящих соединений со свободными радикалами и лабильными продуктами в полимере. Заметим, что такой ход реакции разрешен с точки зрения термодинамики. Из вышеописанного однозначно следует, что наличие в полимерах свободных радикалов и лабильных продуктов может привести к токсическим реакциям.
 Рис. 7. Схема предполагаемого механизма растворения полимеров в биологически активных жидкостях Рис. 7. Схема предполагаемого механизма растворения полимеров в биологически активных жидкостях
|
Для исключения свободных радикалов и лабильных продуктов в имплантатах необходимо ввести дополнительную стадию их обработки. С этой целью рекомендуем использовать растворители, которые являются донорами водорода (содержащие третичный атом водорода — ДН, например изопропиловый спирт; они могут играть роль передатчиков цепи полимеризации, но не ингибиторов реакции полимеризации, чтобы исключить образование лабильных продуктов — ПХ). Суть дополнительной стадии состоит в проведении следующих реакций:
П•+ДН→ПН+Д•;
П•+Д•→П–Д;
ПХ+ДН→ПН+Х+Д•;
Д•+Д•→Д–Д
Эти реакции проводят в газовой или жидких фазах при температуре кипения растворителя. Низкомолекулярные продукты Х и Д–Д выводят из имплантатов, например путем экстрагирования. Следует отметить, что проведение такой стадии не вызывает каких-либо затруднений в случае пространственно-сшитых полимеров и позволяет практически полностью исключить выделение низкомолекулярных соединений из имплантатов (см. таблицу).
 Оптическая плотность водного экстракта, приготовленного путем выдержки имплантатов в дистиллированной воде при температуре 37°С в течение 72 ч из расчета 10 мг/мл Оптическая плотность водного экстракта, приготовленного путем выдержки имплантатов в дистиллированной воде при температуре 37°С в течение 72 ч из расчета 10 мг/мл
|
Имплантаты, в которых молекулы полимера не образуют пространственно-сшитую структуру, могут частично растворяться при проведении указанной процедуры, что в итоге может приводить к запрету их использования.
Введение указанной выше стадии на какое-то время устраняет выделение веществ из имплантатов, но не решает вопроса их биостойкости. Понятно, что какие-то соединения из окружающей среды могут диффундировать в имплантаты и приводить к разрушению полимера, в связи с чем требуется если не полностью устранить это разрушение, то резко замедлить процесс. Теоретически такое возможно при использовании гидрофобных полимеров (исключающих набухание имплантатов в водных растворах). Существует две равноценные теории, которые определяют коэффициенты диффузии соединений в средах — через энергетические параметры и величину свободного объема [155]:

где D — коэффициент диффузии; Vf — свободный объем; Vf+V — объем реакционной среды; ЕD — энергия активации диффузионного движения; D0 — предэкспоненциальный множитель; f — доля свободного объема; В — константа; R — газовая постоянная; Т — температура.
Обычно учитывают первое равенство, а не второе, но, к сожалению, первое равенство непосредственно не позволяет указать пути к решению поставленной проблемы. Из второго равенства однозначно следует, что решение существует, если изготовить полимеры, в которых доля свободного объема близка к нулю (f≈0), по крайней мере, формально набухание в воде приводит к увеличению f, что позволяет однозначно отдать предпочтение гидрофобным полимерам, а не гидрофильным. Это тем более вероятно, что уменьшение D должно привести к уменьшению параметра δ и, в конечном счете, к остановке почти всех реакций в полимере. В связи с этим возникает основной вопрос: каким должен быть способ изготовления имплантатов, чтобы в полимере была минимально возможная доля свободного объема?
Протекание реакции полимеризации приводит не только к образованию полимера, но и к образованию тепла и свободного объема:
n·M→Mn + «тепло» + «свободный объем».
Выделение тепла вызывает увеличение температуры среды и, соответственно, рост «беспорядка». Это условие предполагает проведение реакции полимеризации при возможно низких температурах, что оправдывает, в частности, переход к фотополимеризации. Свободный объем выделяется (образуется) при каждом акте присоединения мономера (олигомера) к макрорадикалу в виде квазичастиц с нулевой плотностью, которые являются основной причиной образования различного рода пустот в полимере, микрообластей с пониженной плотностью упаковки полимера и других дефектов. Разрушение полимеров начинается с дефектов [149], что делает необходимым исключение их образования в имплантатах в результате выделения свободного объема. Можно только гадать, какими бы свойствами обладал полимер, если бы в нем не было дефектов?
У квазичастиц свободного объема есть две возможности: либо в результате диффузии выйти к поверхности реакционной среды и исчезнуть (привести к усадке среды), либо остаться в полимере. В полимере они могут агрегироваться в дефекты, например путем их слияния. Времена выхода квазичастиц к поверхности реакционной среды в результате диффузии пропорциональны ее линейным размерам в квадрате, в связи с чем выход всех квазичастиц из реакционной среды возможен только в случае бесконечно тонких слоев. Этот вывод был реализован при создании метода фронтальной фотополимеризации с предельно малой глубиной фронта реакции [105, 125, 156–158]. В отличие от известных методов проведения фронтальной фотополимеризации в этом случае конверсионный фронт распространяется не вдоль прохождения лучей света [125], а перпендикулярно им. В случае известных способов проведения фронтальной фотополимеризации исключено, что глубина фронта реакции может быть столь малой, чтобы все частицы свободного объема покинули полимер.
Суть нашего метода проведения фотополимеризации заключается в следующем (рис. 8). Есть две волны: световая (задающая) и полимеризации. Образец с композицией входит в зону реакции с некоторой постоянной скоростью ω. Распределение освещенности должно быть таким, чтобы переход от освещенности, равной нулю, к максимальной происходил в зоне (слое) с минимально возможной толщиной. Этого, в частности, можно достигнуть путем погружения образцов из воздуха в жидкость, имеющую больший показатель преломления по сравнению с воздухом (использование явления полного внутреннего отражения). Условия подбирают так, чтобы указанные две волны двигались синхронно. Понятно, что для фронтальной фотополимеризации применяют только те композиции, в которых полимеризация происходит с аномально высокой скоростью, т.е. в которых остановлены только реакции обрыва цепи полимеризации. Возможны и другие варианты реализации метода фронтальной фотополимеризации с предельно малой шириной фронта реакции. В работах [156–158], в частности, указаны методы, в которых световой поток движется относительно композиции, а не наоборот, однако суть методов остается неизменной. Метод фронтальной фотополимеризации нашел применение при изготовлении интраокулярных линз [156, 157] и других оптически-прозрачных изделий (без дефектов) [159–163]. Инициирование светом полимеризации в этом методе оправдано кроме всего прочего и тем, что реакцию становится возможным проводить при комнатных и более низких температурах.
 Рис. 8. Схема реализации процессов фронтальной фотополимеризации с бесконечно малым фронтом реакции Рис. 8. Схема реализации процессов фронтальной фотополимеризации с бесконечно малым фронтом реакции
|
Образование дефектов в результате агрегирования квазичастиц свободного объема нельзя считать единственной причиной дефектообразования. Мы уже отмечали выше, что при временах корреляции ПЗ, меньших 6·10–10 с, в композициях без «матричного» полимера идет микрогетерогенная полимеризация, естественно, что при этом исключено образование оптически-прозрачных полимеров (в которых бы не было дефектов). Вывод только один — нужно исключить применение при фронтальной фотополимеризации композиций, в которых время корреляции ПЗ меньше указанного значения. Есть и другие причины наличия дефектов в полимерах. Прежде всего, это чистота исходных мономеров и олигомеров, в которых должно быть исключено присутствие всякого рода включений. Это вопрос синтеза мономеров и олигомеров, который в данной работе не рассматривается.
Может сложиться впечатление, что метод фронтальной фотополимеризации с предельно малой глубиной реакции является единственно возможным способом получения полимеров с наименьшим количеством дефектов. В ряде случаев биосовместимые и биостойкие полимерные имплантаты можно получить методами как контактной, так и проекционной фотолитографий. При получении имплантатов этими методами могут быть использованы слои с довольно большой толщиной (практически до 1 мм). Чем больше толщина слоя, тем меньше должна быть скорость образования квазичастиц свободного объема в смеси (скорость полимеризации). Снижения скорости этого процесса можно достичь использованием приемов, связанных с уменьшением интенсивности света или концентрации фотоинициатора, уменьшением реакционной способности макрорадикалов, но не увеличением вязкости сверх указанного выше значения. Отметим, что уменьшения реакционной способности макрорадикалов можно достичь путем введения в композицию специальных добавок, образующих комплексы с концевыми группами макрорадикалов. Действенность указанных приемов не вызывает сомнений, но суть их остается той же самой — создание условий, при которых все квазичастицы свободного объема успевают выйти из зоны реакции до окончательного формирования полимера.
Особый случай возникает тогда, когда скорость образования полимера много больше скорости выхода квазичастиц из слоя и их слияния, приводящего к образованию дефектов. Это случается, в частности, при экспонировании слоев светом с интенсивностью большей некоторой предельной величины. При достаточно высоких значениях вязкости композиций слияние квазичастиц, также как и всех химических реакций, может останавливаться. Остановка этого процесса способна привести в будущем к неожиданным эффектам. Это связано с тем, что отсутствие слияния квазичастиц приводит к образованию полимера, который может казаться оптически прозрачным (размеры квазичастиц столь малы, что они не рассеивают свет — закон Релея), но он далек от равновесного состояния (отсутствует как выход квазичастиц из слоя, так и их слияние в слое). Совершенно очевидно, что полимер с такими свойствами будет стремиться к равновесному состоянию. Этот процесс может идти даже в течение многих лет. В случае интраокулярных линз это иногда приводит к так называемой вторичной катаракте (когда интраокулярные линзы, как и родные хрусталики, мутнеют) [10, 12, 14, 16]. Стремление полимера к равновесному состоянию закономерно. Ход этого процесса можно ускорить действием на полимеры излучения от фемтосекундного лазера (с точки зрения законов фотохимии здесь доминируют не электронные переходы, а переходы по колебательным уровням). Действие этого излучения почти на все полимеры приводит к образованию треков (следов в виде линий, где проходил луч света от лазера). Образование треков мы связываем с переходом полимера в местах прохождения луча к равновесному состоянию. Это не лишено оснований, поскольку образование треков отсутствует в полимерах, полученных методом фронтальной фотополимеризации с предельно малой глубиной фронта реакции (такой способ позволяет получать полимеры, для которых характерна равновесная плотность упаковки).
Заключение. В данном обзоре мы изложили основные теоретические аспекты, которые стали руководством при создании технологий изготовления многих полимерных имплантатов по одностадийной схеме [151, 152, 156–158, 164–169]. Эти полимерные имплантаты выпускаются уже более 15 лет и широко используются в медицине не только в нашей стране. Они оказались очень надежными, совместимыми с биологическими тканями, и есть основания говорить, что обладают высокой стойкостью. Фактически при изготовлении полимерных имплантатов, обладающих биосовместимостью и биостойкостью, используют два основных приема: метод фронтальной фотополимеризации с предельно малой глубиной фронта реакции и операцию, приводящую в полимере к гибели концевых макрорадикалов и лабильных продуктов. Для этого применяют композиции, полимеризация которых приводит к образованию гидрофобных пространственно-сшитых полимеров, а время корреляции вращательного движения парамагнитного зонда в них приблизительно равно 6·10–10 с. Cоздание имплантатов, не приводящих к капсулированию, предполагает использование композиций, в которых есть мономеры метакрилового ряда, заместители в которых представляют собой линейные предельные углеводороды с длиной цепочки от 8 до 18 атомов углерода, но время корреляции парамагнитного зонда в них должно равняться указанному выше значению. К этому нельзя прийти без учета явлений остановки химических реакций и нивелировки реакционной способности, а также принятия отличного от традиционного метода описания хода химических реакций в условиях, где есть ограничения на молекулярную подвижность реагентов. Хотелось бы также отметить, что в биостойких и биосовместимых имплантатах полимер может быть только оптически прозрачным, но обратное может быть не верно.
Финансирование. Исследование профинансировано ООО «Репер-НН».
Конфликт интересов. Авторы статьи являются сотрудниками ООО «Репер-НН». ООО «Репер-НН» не оказывало влияния на сбор и анализ данных, подготовку рукописи и решение о публикации.
Литература
- Buckhurst P.J., Naroo S.A., Shah S. Advanced intraocular lens designs. European Ophthalmic Review 2010; 4(1): 82–87.
- Richter-Mueksch S., Kahraman G., Amon M., Schild-Burggasser G., Schauersberger J., Abela-Formanek C. Uveal and capsular biocompatibility after implantation of sharp-edged hydrophilic acrylic, hydrophobic acrylic, and silicone intraocular lenses in eyes with pseudoexfoliation syndrome. J Cataract Refract Surg 2007; 33(8): 1414–1418.
- Поздеева Н.А., Паштаев Н.П. Искусственная иридохрусталиковая диафрагма в хирургическом лечении аниридии. Чебоксары; 2012; 160 c.
- Поздеева Н.А. Новая модель иcкуccтвенной иридохруcталиковой диафрагмы для коррекции больших дефектов радужной оболочки. Вестник офтальмологии 2013; 129(6): 38–44.
- Iskakov I., Egorova E., Koronkevich V., Lenkova G., Korolkov V., Treushnikov V. Novel diffractive-refractive bifocal IOL: optical properties and earliest clinical results. In: XXIV Congress of the ESCRS (European Society of Cataract and Refractive Surgeons). London; 2006; p. 217.
- Паштаев Н.П., Пивоваров Н.Н., Треушников В.М. и др. Новая модель диафрагмирующей эластичной ИОЛ. В кн.: Современные технологии катарактальной и рефракционной хирургии — 2011. М; 2011; с. 196–200.
- Малюгин Б.Э. Хирургия катаракты и интраокулярная коррекция на современном этапе развития офтальмохирургии. Вестник офтальмологии 2014; 130(6): 80–88.
- Трубилин В.Н., Темиров Н.Н. Коррекция афакии различного генеза мультифокальными интраокуляриыми линзами с асимметричной ротационной оптикой. Катарактальная и рефракционная хирургия 2014; 4: 20–25.
- Алтынбаева Г.Р. Особенности выбора мультифокальных интраокулярных линз в хирургии катаракты. Автореф. дис. ... канд. мед. наук. Красноярск; 2012.
- Mencucci R., Favuzza E., Boccalini C., Gicquel J.J., Raimondi L. Square-edge intraocular lenses and epithelial lens cell proliferation: implications on posterior capsule opacification in an in vitro model. BMC Ophthalmol 2015; 15: 5, http://dx.doi.org/10.1186/1471-2415-15-5.
- Menapace R., Findl O., Kriechbaum K., Leydolt-Koeppl Ch. Accommodating intraocular lenses: a critical review of present and future concepts. Graefes Arch Clin Exp Ophthalmol 2007; 245(4): 473–489, http://dx.doi.org/10.1007/s00417-006-0391-6.
- Gutierrez L.G., Rodriguez P., Garcia D.A. Intraoperative opacification of a hydrophilic acrylic with hydrophobic surface IOL with spontaneous resolution in 24 hours. J Refract Surg 2013; 29(5): 360–362, http://dx.doi.org/10.3928/1081597X-20130313-03.
- Соболев Н.П., Малюгин Б.Э., Покровский Д.Ф., Патахова Х.М. Опыт клинического применения переднекамерной факичной ИОЛ AcrySof Cachet для хирургической коррекции миопии высокой степени. Офтальмохирургия 2013; 4: 20–24.
- Vasavada A.R., Raj S.M., Shah A., Shah G., Vasavada V., Vasavada V. Comparison of posterior capsule opacification with hydrophobic acrylic and hydrophilic acrylic intraocular lenses. J Cataract Refract Surg 2011; 37(6): 1050–1059, http://dx.doi.org/10.1016/j.jcrs.2010.12.060.
- Maurino V., Allan B.D., Rubin G.S., Bunce C., Xing W., Findl O.; Moorfields IOL Study Group. Quality of vision after bilateral multifocal intraocular lens implantation: a randomized trial — AT LISA 809M versus AcrySof ReSTOR SN6AD1. Ophthalmology 2015; 122(4): 700–710.
- Nixon D.R., Woodcock M.G. Pattern of posterior capsule opacification models 2 years postoperatively with 2 single-piece acrylic intraocular lenses. J Cataract Refract Surg 2010; 36(6): 929–934, http://dx.doi.org/10.1016/j.jcrs.2009.12.040.
- Малюгин Б.Э., Тахтаев Ю.В., Морозова Т.А., Поздеева Н.А. Результаты мультицентровых исследований имплантации мультифокальной градиентной ИОЛ третьего поколения (Градиол-3). Офтальмохирургия 2012; 2: 36–41.
- Паштаев Н.П., Батьков Е.Н. Результаты имплантации новой модели заднекамерной эластичной ИОЛ при недостаточной капсульной поддержке. Офтальмохирургия 2009; 5: 34–39.
- Кузнецов С.Л., Узунян Д.Г., Захидов А.Б. Новиков С.В., Селифанов Ю.В. ИОЛ с «торсионной» гаптикой. Клинические результаты изучения объемозамещающей модели. Офтальмохирургия 2010; 2: 24–29.
- Hengerer F.H., Artal P., Kohnen T., Conrad-Hengerer I. Initial clinical results of a new telescopic IOL implanted in patients with dry age-related macular degeneration. J Refract Surg 2015 Mar; 31(3): 158–162, http://dx.doi.org/10.3928/1081597X-20150220-03.
- Calladine D., Evans J.R., Shah S., Leyland M. Мultifocal versus monofocal intraocular lenses after cataract extraction. Sao Paulo Med J 2015; 133(1): 68, http://dx.doi.org/10.1590/1516-3180.20151331T2.
- Kohnen T., Fabian E., Gerl R., Hunold W., Hütz W., Strobel J., Hoyer H., Mester U. Optic edge design as long-term factor for posterior capsular opacification rates. Ophthalmology 2008; 115(8): 1308–1314, http://dx.doi.org/10.1016/j.ophtha.2008.01.002.
- Малюгин Б.Э., Терещенко А.В, Белый Ю.А., Демьянченко С.К., Фадеева Т.В., Исаев М.А. Сравнительный анализ клинической эффективности имплантации сферических и асферических ИОЛ. Офтальмохирургия 2011; 3: 27–31.
- Dawes L.J., Illingworth C.D., Wormstone I. A fully human in vitro capsular bag model to permit intraocular lens evaluation. Invest Ophthalmol Vis Sci 2012; 53(1): 23–29, http://dx.doi.org/10.1167/iovs.11-8851.
- Cleary G., Spalton D.J., Zhang J.J., Marshall J. In vitro lens capsule model for investigation of posterior capsule opacification. J Cataract Refract Surg 2010; 36(8): 1249–1252, http://dx.doi.org/10.1016/j.jcrs.2010.05.006.
- Ness P.J., Werner L., Maddula S., Davis D., Zaugg B., Stringham J., Burrow M., Yeh O. Pathology of 219 human cadaver eyes with 1-piece or 3-piece hydrophobic acrylic intraocular lenses: capsular bag opacification and sites of square-edged barrier breach. J Cataract Refract Surg 2011; 37(5): 923–930, http://dx.doi.org/10.1016/j.jcrs.2010.11.036.
- Roshdy M.M., Riad R.F., Morkos F.F., Hassouna A.K., Wahba S.S. Effect of a single-piece aspheric hydrophobic acrylic intraocular lens design on centration and rotation. J Cataract Refract Surg 2013; 39(3): 408–413, http://dx.doi.org/10.1016/j.jcrs.2012.09.020.
- Ghoreishi M., Agherian R., Peyman A.R., Feshareki H., Mohammadinia M. Flexible toric iris claw phakic intraocular lens implantation for myopia and astigmatism. J Ophthalmic Vis Res 2014; 9(2): 174–180.
- Nixon D.R., Apple D.J. Evaluation of lens epithelial cell migration in vivo at the haptic-optic junction of a one-piece hydrophobic acrylic intraocular lens. Am J Ophthalmol 2006; 142(4): 557–562, http://dx.doi.org/10.1016/j.ajo.2006.05.049.
- Raj S.M., Vasavada A.R., Kaid J.S., Vasavada V.A., Vasavada V.A. Post-operative capsular pacification. Nepal J Ophthalmol 2009; 1(1): 43–59, http://dx.doi.org/10.3126/nepjoph.v1i1.3673.
- Гущина М.Б., Треушников В.В., Сорокина О.В. Склероплантат для реконструктивной склеропластики при патологических состояниях склеры. RU патент 2460497. 2010.
- Анисимова С.Ю., Анисимов С.И., Дроздова Г.А., Ларионов Е.В., Озорнина О.С. Pезультаты применения склеропластического материала на основе ксеноколлагена при лечении прогрессирующей близорукости. Российская педиатрическая офтальмология 2009; 3: 35–38.
- Иомдина Е.Н. Биомеханика склеральной оболочки глаза при миопии: диагностика нарушений и их экспериментальная коррекция. Автореф. дис. … докт. биол. наук. М; 2000.
- Rada J.A., Shelton S., Norton T.T. The sclera and myopia. Exp Eye Res 2006; 82(2): 185–210, http://dx.doi.org/10.1016/j.exer.2005.08.009.
- Кузнецова М.В. Причины развития близорукости и ее лечение. М: МЕДпресс-информ; 2005; 176 с.
- Филатова Г.П. Имплантация биологических материалов при склероукрепляющих операциях (экспериментально-клиническое исследование). Автореф. дис. … канд. мед. наук. М; 2009.
- Нероев В.В., Тарутта Е.П., Оганесян О.Г., Пенкина А.В., Ханджян А.Т., Милаш С.В. Оценка влияния имплантации интрастромальных роговичных сегментов (Ferrara ring) на параметры передней и задней кривизны роговицы с помощью шеймпфлюг-анализатора Galilei G2. Новое в офтальмологии 2014; 2: 60–62.
- Lam K., Rootman D.B., Lichtinger A., Rootman D.S. Post-LASIK ectasia treated with intrastromal corneal ring segments and corneal crosslinking. Digit J Ophthalmol 2013; 19(1): 1–5.
- Jadidi K., Mosavi S.A., Nejat F., Naderi M., Janani L., Serahati S. Intrastromal corrneal ring segment implantation (keraring 355°) in patients with central keratoconus: 6-month follow-up. J Ophthalmol 2015; 2015: 916385, http://dx.doi.org/10.1155/2015/916385.
- Weber C.H., Cionni R.J. All about capsular tension rings. Curr Opin Ophthalmol 2015; 26(1): 10–15, http://dx.doi.org/10.1097/ICU.0000000000000118.
- Wilkie D.A., Stone Hoy S., Gemensky-Metzler A., Colitz C.M. Safety study of capsular tension ring use in canine phacoemulsification and IOL implantation. Vet Ophthalmol 2014, http://dx.doi.org/10.1111/vop.12232. [Epub ahead of print].
- Biró Z., Szabó I., Pámer Z. Combined cataract surgery on a Marfan-syndrome patient (case report). Oftalmologia 2014; 58(2): 30–33.
- Rodrigo B.J., Paulina L.L., Francesc Mde R., Eduardo T.T., Alejandro N. Intraocular lens subluxation in Marfan syndrome. Open Ophthalmol J 2014; 8: 48–50, http://dx.doi.org/10.2174/1874364101408010048.
- Кузнецов С.Л. Влияние внутрикапсульного стабилизирующего кольца на положение интраокулярных линз с плоскостной гаптикой (предварительное сообщение). В кн.: Ерошевские чтения: труды Всероссийской конференции. Самара; 2007; с. 226–229.
- Кузнецов С.Л. Результаты изучения эндокапсулярных корреляций при имплантации внутрикапсульных колец и ИОЛ с плоскостной гаптикой в эксперименте. В кн.: Современные технологии хирургии катаракты: материалы 5-й Международной научно-практической конференции. М; 2004; с. 188–193.
- Кузнецов С.Л. Результаты имплантации внутрикапсульных колец из полипропиленовых нитей в качестве средства дополнительной фиксации ИОЛ с плоскостной гаптикой в эксперименте. В кн.: Глаукома и другие проблемы офтальмологии: сборник научных трудов, посвященный 15-летию Тамбовского филиала ГУ МНТК «МГ» им. академика С.Н. Федорова. Тамбов; 2005; с. 221–227.
- Fankhauser F. Microincision IOL outcomes positive after a year. EuroTimes 2006; 11(9): 9.
- Kuznetsov S.L. Results of experimental study of endocapsular correlations of various intracapsular ring models and plate-haptic IOLs. In: XXIV Congress of the ESCRS: abstracts. London; 2006; p. 229.
- Burger J., Kreutzer T., Alge C.S., Strauss R.W., Eibl K., Haritoglou C., Neubauer A.S., Kampik A., Priglinger S.G. Capsular tension ring-based in vitro capsule opacification model. J Cataract Refract Surg 2008; 34(7): 1167–1172, http://dx.doi.org/10.1016/j.jcrs.2008.03.040.
- Егорова Е.В., Бетке А.В., Безбородов В.Г. Математическое моделирование в решении проблемы некоторых отдаленных последствий хирургии катаракты. Офтальмохирургия 2014; 3: 13–18.
- Гринев А.Г., Свиридова М.Б., Жеребцова О.М., Долгополова М.С. Клинические случаи факоэмульсификации катаракты при сочетании узкого зрачка, большого твердого ядра и подвывиха хрусталика. Уральский медицинский журнал 2013; 9: 103–105.
- Иошин И.Э. Внутрикапсульное кольцо в хирургии катаракты при подвывихе хрусталика (опыт 15 лет имплантации). Вестник офтальмологии 2012; 128(2): 45–49.
- Малюгин Б.Э. Кольцо Малюгина. Новое в офтальмологии 2013; 4: 59–61.
- Низов А.В., Степанов А.В. Эффективность клапана Ahmed при посттравматической глаукоме. Катарактальная и рефракционная хирургия 2011; 11(4): 52–54.
- Терещенко А.В., Молоткова И.А. Белый Ю.А., Ерохина Е.В. Модификация современной микроинвазивной непроникающей хирургии глаукомы с применением Т-образного дренажа. Офтальмохирургия 2011; 2: 38–42.
- Galassi F., Giambene B. Deep sclerectomy with SkGel implant: 5-year results. J Glaucoma 2008; 17(1): 52–56, http://dx.doi.org/10.1097/IJG.0b013e3180d0a885.
- Бикбов М.М., Бабушкин А.Э., Чайка О.В., Оренбуркина О.И., Матюхина Е.Н. Результаты хирургического лечения рефрактерной глаукомы с применением фистулизирующих операций и дренажа Ahmed Вестник офтальмологии 2014; 130(2): 8–11.
- Винод К., Фролов М.А., Божок Е.В., Душина Г.Н. Опыт применения металлического дренажа собственной конструкции в хирургии глаукомы. Новое в офтальмологии 2012; 4: 43–45.
- Figus M., Lazzeri S., Fogagnolo P., Iester M., Martinelli P., Nardi M. Supraciliary shunt in refractory glaucoma. Br J Ophthalmol 2011; 95(111): 1537–1541, http://dx.doi.org/10.1136/bjophthalmol-2011-300308.
- Рязанцева Т.В., Кравец Л.И. Эксплантодренаж с наноструктурированной поверхностью для хирургии рефрактерной глаукомы. Бюллетень сибирской медицины 2012; 11(1): 71–76.
- Поздеева Н.А., Горбунова Н.Ю., Паштаев Н.П. Эффективность клапанных дренажных устройств при вторичной глаукоме у пациентов с искусственной иридохрусталиковой диафрагмой. Вестник офтальмологии 2011; 127(4): 41–45.
- Евстигнеева Ю.В. Коллагенодренирование в хирургии рефрактерной глаукомы. Вестник офтальмологии 2011; 127(1): 36–38.
- Тахчиди Х.П., Чеглаков В.Ю. Дренажи в хирургии рефрактерной глаукомы. Рефракционная хирургия и офтальмология 2009; 3: 11–15.
- Быков В.П., Кваша О.И., Нероев В.В., Белёвцева Т.А. Хирургическое лечение глаукомы путем микродренирования. Обзор литературы. Русский медицинский журнал 2009; 3: 113–116.
- Wang H., Dong H., Kang C.G., Lin C., Ye X., Zhao Y.L. Preliminary exploration of the development of a collagenous artificial dura mater for sustained antibiotic release. Chin Med J (Engl) 2013; 126(17): 3329–3333.
- Lv C., Zhou Z., Song Y., Liu L., Liu H., Gong Q., Li T., Zeng J., Tu C., Pei F. Novel biodegradable lamina for lamina repair and reconstruction. Spine J 2013; 13(12): 1912–1920, http://dx.doi.org/10.1016/j.spinee.2013.06.055.
- Bai W., Wang X., Yuan W., Wang H., Wang Z. Application of PLGA/type I collagen/chitosan artificial composite dura mater in the treatment of dural injury. J Mater Sci Mater Med 2013; 24(9): 2247–2254, http://dx.doi.org/10.1007/s10856-013-4964-8.
- Тихомиров С.Е., Цыбусов С.Н., Кравец Л.Я., Фраерман А.П., Балмасов А.А. Пластика дефектов свода черепа и твердой мозговой оболочки новым полимерным материалом Реперен. Современные технологии в медицине 2010; 2: 6–11.
- Шестериков А.А., Лалов Ю.В., Фомин П.А., Успенский И.В. Герметизация дна турецкого седла синтетическим имплантатом «Реперен-ST» при комбинированном лечении опухолей хиазмально-селлярной области. Современные технологии в медицине 2011; 1: 6–10.
- Иванов С.Ю., Зайцев А.Б., Ямуркова Н.Ф., Мигура С.А., Губова В.М., Янцен И.Е., Акулов М.М., Мураев А.А. Исследование барьерной функции коллагеновой мембраны «Остеопласт» при заживлении костных дефектов в эксперименте. Современные технологии в медицине 2011; 3: 35–38.
- Matsumoto Y., Aikawa H., Tsutsumi M., Narita S., Yoshida H., Etou H., Sakamoto K., Kazekawa K. Histological examination of expanded polytetrafluoroethylene artificial dura mater at 14 years after craniotomy: case report. Neurol Med Chir (Tokyo) 2013; 53(1): 43–46, http://dx.doi.org/10.2176/nmc.53.43.
- Успенский И.В., Треушников В.В., Сорокина О.В., Тихомиров С.Е., Фраерман А.П., Кравец Л.Я. Имплантат для пластики дефектов твердой мозговой оболочки. RU патент 2436596. 2009.
- Matsumoto Y., Aikawa H., Tsutsumi M., Narita S., Yoshida H., Etou H., Sakamoto K., Kazekawa K. Histological examination of expanded polytetrafluoroethylene artificial dura mater at 14 years after craniotomy: case report. Neurol Med Chir (Tokyo) 2013; 53(1): 43–46, http://dx.doi.org/10.2176/nmc.53.43.
- Christoffersen M.W., Brandt E., Helgstrand F., Westen M., Rosenberg J., Kehlet H., Strandfelt P., Bisgaard T. Recurrence rate after absorbable tack fixation of mesh in laparoscopic incisional hernia repair. Br J Surg 2015; 102(5): 541–547, http://dx.doi.org/10.1002/bjs.9750.
- Li J., Ji Z., Zhang W., Li L. The comparison of lightweight mesh and standard mesh in incisional hernia repair with the open sublay technique: the results of a meta-analysis. Surg Laparosc Endosc Percutan Tech 2015; 25(3): 238–244, http://dx.doi.org/10.1097/SLE.0000000000000144.
- Паршиков В.В., Медведев А.П., Самсонов А.А., Романов Р.В., Самсонов А.В., Градусов В.П., Петров В.В., Ходак В.А., Бабурин А.Б. Ненатяжная пластика в хирургии грыж брюшной стенки. Вестник хирургии им. И.И. Грекова 2010; 169(5): 74–79.
- Ходак В.А., Петров В.В., Дворников А.В., Миронов А.А., Бабурин А.Б., Паршиков В.В., Цыбусов С.Н. Возможности и преимущества бесшовной пластики брюшной стенки с применением различных синтетических эндопротезов. Современные технологии в медицине 2012; 2: 31–36.
- Седов В.М., Гостевской А.А., Тарбаев С.Д., Горелов А.С., Чулховин А.Б., Нутфуллина Г.М., Жуковский В.А. Сетчатые имплантаты из поливинилиденфторида в лечении грыж брюшной стенки. Вестник хирургии им. И.И. Грекова 2008; 167(2): 16–21.
- Rehman S., Khan S., Pervaiz A., Perry E.P. Recurrence of inguinal herniae following removal of infected prosthetic meshes: a review of the literature. Hernia 2012; 16(2): 123–126, http://dx.doi.org/10.1007/s10029-011-0873-2.
- Федоров И.В. Протезы в хирургии грыж: столетняя эволюция. Новый хирургический архив 2002; 4(1).
- Berthet J.P., Canaud L., D’Annoville T. Titanium plates and Dualmesh: a modern combination for reconstructing very large chest wall defects. Ann Thorac Surg 2011; 91(6): 1709–1716, http://dx.doi.org/10.1016/j.athoracsur.2011.02.014.
- Жуковский В.А. Полимерные эндопротезы для герниопластики. СПб: Эскулап; 2011; 104 с.
- Аверьянов М.Ю., Гаар Е.В., Горохов В.Н. Сравнительный анализ применения ненатяжных и традиционных способов герниопластики при грыжах живота различной локализации. Современные технологии в медицине 2011; 3: 39–43.
- Kouhia S., Vironen J., Hakala T., Paajanen H. Open mesh repair for inguinal hernia is safer than laparoscopic repair or open non-mesh repair: a nationwide registry study of complications. World J Surg 2015, http://dx.doi.org/10.1007/s00268-015-3028-2. [Epub ahead of print].
- Descloux A., Pohle S., Nocito A., Keerl A. Hybrid NOTES transvaginal intraperitoneal onlay mesh in abdominal wall hernias: an alternative to traditional laparoscopic procedures. Surg Endosc 2015, http://dx.doi.org/10.1007/s00464-015-4141-x. [Epub ahead of print].
- Kathju S., Nistico L., Melton-Kreft R., Lasko L.A., Stoodley P. Direct demonstration of bacterial biofilms on prosthetic mesh after ventral herniorrhaphy. Surg Infect (Larchmt) 2015; 16(1): 45–53, http://dx.doi.org/10.1089/sur.2014.026.
- Christmas A.B., Honaker D. Incarcerated massive sliding hernia treated with bladder resection and mesh repair. Am Surg 2015; 81(3): 123–124.
- Salokorpi N., Sinikumpu J.J., Iber T., Zibo H.N., Areda T., Ylikontiola L., Sándor G.K., Serlo W. Frontal cranial modeling using endocranial resorbable plate fixation in 27 consecutive plagiocephaly and trigonocephaly patients. Childs Nerv Syst 2015, http://dx.doi.org/10.1007/s00381-015-2657-y. [Epub ahead of print].
- Liebelt B.D., Huang M., Baskin D.S. Sellar floor reconstruction with the Medpor® implant versus autologous bone following transnasal transsphenoidal surgery: outcome in 200 consecutive cases. World Neurosurg 2015, http://dx.doi.org/10.1016/j.wneu.2015.02.025. [Epub ahead of print].
- Дурново Е.А., Хомутинникова Н.Е., Мишина Н.В., Трофимов А.О. Особенности реконструкции стенок орбиты при лечении травматических повреждений лицевого скелета. Медицинский альманах 2013; 5: 159–161.
- Piitulainen J.M., Kauko T., Aitasalo K.M., Vuorinen V., Vallittu P.K., Posti J.P. Outcomes of cranioplasty with synthetic materials and autologous bone grafts. World Neurosurg 2015; 83(5): 708–714, http://dx.doi.org/10.1016/j.wneu.2015.01.014.
- Chaya A., Yoshizawa S., Verdelis K., Myers N., Costello B.J., Chou D.T., Pal S., Maiti S., Kumta P.N., Sfeir C. In vivo study of magnesium plate and screw degradation and bone fracture healing. Acta Biomater 2015; 18: 262–269, http://dx.doi.org/10.1016/j.actbio.2015.02.010.
- Kutikov A.B., Skelly J.D., Ayers D.C., Song J. Templated repair of long bone defects in rats with bioactive spiral-wrapped electrospun amphiphilic polymer/hydroxyapatite scaffolds. ACS Appl Mater Interfaces 2015; 7(8): 4890–4901, http://dx.doi.org/10.1021/am508984y.
- Lu T., Wen J., Qian S., Cao H., Ning C., Pan X., Jiang X., Liu X., Chu P.K. Enhanced osteointegration on tantalum-implanted polyetheretherketone surface with bone-like elastic modulus. Biomaterials 2015; 51: 173–183, http://dx.doi.org/10.1016/j.biomaterials.2015.02.018.
- Kim I.G., Hwang M.P., Du P., Ko J., Ha C.W., Do S.H., Park K. Bioactive cell-derived matrices combined with polymer mesh scaffold for osteogenesis and bone healing. Biomaterials 2015; 50: 75–86, http://dx.doi.org/10.1016/j.biomaterials.2015.01.054.
- Hinderer S., Shena N., Ringuette L.J., Hansmann J., Reinhardt D.P., Brucker S.Y., Davis E.C., Schenke-Layland K. In vitro elastogenesis: instructing human vascular smooth muscle cells to generate an elastic fiber-containing extracellular matrix scaffold. Biomed Mater 2015; 10(3), http://dx.doi.org/10.1088/1748-6041/10/3/034102.
- Orłowska J., Kurczewska U., Derwińska K., Orłowski W., Orszulak-Michalak D. The use of biodegradable polymers in design of cellular scaffolds. Postepy Hig Med Dosw (Online) 2015 Mar; 69: 294–301, http://dx.doi.org/10.5604/17322693.1142717.
- Биосовместимые материалы. Под ред. Севастьянова В.И., Кирпичникова М.П. М: Мед. информационное агентство; 2011; 540 с.
- Гумаргалиева К.З., Заиков Г.Е., Моисеев Ю.В. Макрокинетические аспекты биосовместимости и биодеградируемости полимеров. Успехи химии 1994; 63(10): 905–921.
- Хенч Л., Джонс Д. Биоматериалы, искусственные органы и инжиниринг тканей. Серия «Мир биологии и медицины». М: Техносфера; 2007; 304 с.
- Korzhikov V.A., Vlakh E.G., Tennikova T.B. Polymers in orthopedic surgery and tissue engineering: from engineering materials to smart biofunctionalization of a surface. Polymer Science Series A 2012; 54(8): 1203–1221, http://dx.doi.org/10.1134/s0965545x12070036.
- Rikli D.A., Curtis R., Schilling C., Goldhahn J. Потенциал использования биодеградируемых пластин и винтов в лечении переломов дистальной части лучевой кости. Margo Anterior 2002; 4: 1–4.
- Vallet-Regi M., Colilla M., González B. Medical applications of organic-inorganic hybrid materials within the field of silica-based bioceramics. Chem Soc Rev 2011; 40(2): 596–607, http://dx.doi.org/10.1039/c0cs00025f.
- Треушников В.М. Основные принципы создания биосовместимых имплантатов. Нижегородские ведомости медицины 2007; 6: 46–55.
- Valuev L.I., Davydov D.V., Sytov G.A., Valuev I.L. Hydrogel ophthalmic implants. Polymer Science Series A 2014; 56(6): 786–788, http://dx.doi.org/10.1134/S0965545X1406011X.
- Treushnikov V.M., Viktorova A. Basic principles of biocompatible implant manufacturing. In: International Symposium “New polymers and radioprotectors for biology and medicine”. Yerevan, Armenia, 8–10 October, 2007.
- Duan Yuan-yuan, Jia Jun, Wang Shao-hai, Yan Wei, Jun Lei, Wang Zhong-yi. Preparation of PLGA electrospun nanofibers for tissue engineering applications. Journal of US-China Medical Science 2007; 4(1, Serial 26): 41–44.
- Ito Y., Hasuda H., Kamitakahara M., Ohtsuki C., Tanihara M., Kang I.K., Kwon O.H. A composite of hydroxyapatite with electrospun biodegradable nanofibers as tissue engineering. J Biosci Bioeng 2005; 100(1): 43–49, http://dx.doi.org/10.1263/jbb.100.43.
- Li M., Mondrinos M.J., Gandhi M.R., Ko F.K., Weiss A.S., Lelkes P.I. Electrospun protein fibers as matrices for tissue engineering. Biomaterials 2005; 26(30): 5999–6008, http://dx.doi.org/10.1016/j.biomaterials.2005.03.030.
- Василец В.Н., Казбанов И.В., Ефимов А.Е., Севастьянов В.И. Разработка новых методов формирования имплантационных материалов с использованием технологий электроспиннинга и биопринтирования. Вестник трансплантологии и искусственных органов 2009; 11(2): 47–53.
- Севастьянов В.И. Биоматериалы, системы доставки лекарственных веществ и биоинженерия. Вестник трансплантологии и искусственных органов 2009; 11(3): 69–80.
- Sevastianov V.I., Vasilets V.N., Agapov I.I. Biopolymer implants for high-technology assistance in the field of replacement and regenerative medicine. Rare Metals 2009; 28: 84–86.
- Баженов С.Л., Берлин А.А., Кульков А.А., Ошмян В.Г. Полимерные композиционные материалы. Прочность и технологии. М: Интеллект; 2009; 352 с.
- Перепелкин К.Е. Армирующие волокна и волокнистые полимерные композиты. М: Научные основы и технологии; 2009; 658 с.
- Золотарева Н.В., Семенов В.В., Мяков В.Н., Куликова Т.И., Арапова А.В., Фаерман В.И., Горшков О.Н., Касаткин А.П., Котомина В.Е., Круглов А.В., Трушин В.Н., Треушников В.В., Треушников В.М. Формирование микроканалов в термоотверждаемом силиконовом каучуке с помощью нитевидных кристаллов п-аминобензойной кислоты. Известия Aкадемии наук. Серия химическая 2015; 1: 189–195.
- Wu Y., Dudek S.T., Bamgbade B.A., McHugh M.A. High-pressure phase behavior of boltorn hyperbranched polymers in supercritical fluids. Fluid Phase Equilibria 2014; 382: 180–186, http://dx.doi.org/10.1016/j.fluid.2014.09.010.
- Попов В.К., Краснов А.П., Воложин А.И., Хоудл С.М. Новые биоактивные композиты для регенерации костных тканей. Перспективные материалы 2004; 4: 49–57.
- Миронова Л.А. Акриловый базис с добавлением Кальция-Макг. Российская стоматология 2013; 1: 25–27.
- Ткаченко В.М. Разработка остеоинтегративного геля гиалуроновая кислота гидроксиаппатит с бактерицидными свойствами. В кн.: Болезни цивилизации в аспекте учения В.И. Вернадского: материалы 3-й Международной конференции. М; 2005; с. 317.
- Antonov E.N., Bagratashvili V.N., Whitaker M.J., Barry J.J., Shakesheff K.M., Konovalov A.N., Popov V.K., Howdle S.M. Three-dimensional bioactive and biodegradable scaffolds fabricated by laser sintering. Adv Mat 2005; 17(3): 327–330, http://dx.doi.org/10.1002/adma.200400838.
- Antonov E.N., Bagratashvili V.N., Howdle S.M., Konovalov A.N., Popov V.K., Panchenko V.Ya. Fabrication of polymer scaffolds for tissue engineering using surface selective laser sintering. Laser Physics 2006; 16(5): 774–787, http://dx.doi.org/10.1134/s1054660x06050070.
- Kanczler J.M., Mirmalek-Sani S.H., Hanley N.A., Ivanov A.L., Barry J.J., Upton C., Shakesheff K.M., Howdle S.M., Antonov E.N., Bagratashvili V.N., Popov V.K., Oreffo R.O. Biocompatibility and osteogenic potential of human fetal femur-derived cells on surface selective laser sintered scaffolds. Acta Biomaterialia 2009; 5(6): 2063–2071, http://dx.doi.org/10.1016/j.actbio.2009.03.010.
- Панченко В.Я. Лазерно-информационные технологии: состояние дел, проекты. В кн.: Пути ученого. Е.П. Велихов. Под ред. Смирнова В.П. М: Изд-во НИЦ «Курчатовский институт»; 2007; с. 293–295.
- Варадан В., Виной К., Джозе К. Мир электроники ВЧ МЭМС и их применение. М: Техносфера; 2004; 528 с.
- Чесноков С.А. Полимеризация мономеров (мет)акрилового ряда под действием видимого света, инициируемая о-хинонами. Автореф. дис. …. докт. хим. наук. Н. Новгород; 2014.
- Owen S.C., Shoichet M.S. Design of three-dimensional biomimetic scaffolds. J Biomed Mater Res A 2010; 94(4): 1321–1331, http://dx.doi.org/10.1002/jbm.a.32834.
- Everland H., Samuelsen P., Vange J., Clausen C., Gallego M.R. Compositions and methods for augmentation and regeneration of living tissue in a subject. US patent 8,877,246. 2010.
- Baer Hans U. Matrix and implant for tissue engineering. WO 2014202199. 2014.
- Rosbach J., Choritz L., Pfeiffer N., Thieme H. Clinical results of encapsulated bleb removal after Ahmed glaucoma valve implants. Dert Ophthalmologe 2013; 110(8): 722–727, http://dx.doi.org/10.1007/s00347-013-2836-8.
- Влах Е.Г., Коржиков В.А., Тенникова Т.Б. Твердофазные системы биологического распознавания на основе макропористых полимерных монолитов. Известия Академии наук. Серия химическая 2012; 5: 931–956.
- Мухина И.В., Цыбусов С.Н., Ведунова М.В., Трифонова А.С., Треушников В.М., Колмогоров Ю.Н., Треушников В.В., Сорокина О.В. Матрица для клеточной трансплантологии. RU патент 2521194. 2014.
- Шляпинтох Е.Я. Фотохимические превращения и стабилизация полимеров. М: Химия; 1979; 344 с.
- Эмануэль Н.М., Бучаченко А.Л. Химическая физика молекулярного разрушения и стабилизации полимеров. М: Наука; 1988; 366 с.
- Treushnikov V.M., Chesnokov S.A. Single-stage processes of polymer products photochemical synthesis with optical accuracy. Journal of Photochemistry and Photobiology A: Chemistry 2008; 196: 201–209, http://dx.doi.org/10.1016/j.jphotochem.2007.07.030.
- Chesnokov S.A., Chechet Yu.V., Cherkasov V.K., Mamysheva O.N., Treushnikov V.M. General conditions and experimental design of sustained frontal photopolymerization in photopolymerizable liquid compositions. Polymer Science. Series A 2008; 50(3): 291–298, http://dx.doi.org/10.1134/s0965545x08030073.
- Феллер В. Введение в теорию вероятностей и ее приложения. Т. 1. М: Мир; 1967; 498 с.
- Треушников В.М., Пятыгин С.С., Опритов В.А. Интерпретация «критических» явлений в работе мембранно-связанных ферментных систем на основе модели континуальной диффузии. Биологические мембраны 1991; 8(10): 1093–1098.
- Treushnikov V.M., Pyatygin S.S., Opritov V.A. Application of the continual diffusion model for analysis of the principles of enzymatic reaction rate regulation under membrane conditions. Membrane and Cell Biology 1995; 8(4): 435–446.
- Пятыгин С.С., Треушников В.М., Опритов В.А., Крауз В.О. Феномен отрицательной температурной зависимости адаптивной реполяризации клеток высшего растения при охлаждении. Физиология растений 1996; 43(1): 80–86.
- Треушников В.М., Пятыгин С.С., Опритов В.А., Орлова О.В. Феномен отрицательной температурной зависимости ферментативных реакций и его функциональная роль. Вестник Нижегородского университета им. Н.И. Лобачевского. Серия Биология 2001; 1(2): 198–207.
- Треушников В.М., Померанцева Л.Л., Зеленцова Н.В., Олейник А.В. О возможных путях превращений квазиустойчивых радикальных центров, образующихся при фотолизе ароматических азидов в полимерных матрицах. Высокомолекулярные соединения. Серия Б 1983; 25(5): 327–331.
- Семенов Н.Н. Цепные реакции. М: Наука; 1986; 535 с.
- Гладышев Г.П., Попов В.А. Радикальная полимеризация при глубоких степенях превращения. М: Наука; 1974; 243 с.
- Семчиков Ю.Д. Высокомолекулярные соединения. М: Академия; 2008; 367 с.
- Берлин А.А., Кефели Т.Я., Королев Г.В. Полиэфиракрилаты. М: Наука;1967; 374 с.
- Берлин А.А., Королев Г.В., Кефели Т.Я., Севергин Я.М. Акриловые олигомеры и материалы на их основе. М: Химия; 1983; 238 с.
- Королев Г.В., Могилевич М.М., Ильин А.А. Ассоциация жидких органических соединений. М: Мир; 2002; 264 с.
- Grishin D.F., Semyonycheva L.L. Problems of control of the reactivity of macroradicals and the growth of polymer chains. Russian Chemical Reviews 2001; 70(5): 425–447, http://dx.doi.org/10.1070/RC2001v070n05ABEH000635.
- Кауш Г. Разрушение полимеров. М: Мир; 1981; 440 с.
- Butyagin P.Yu., Dubinskaya A.M., Radtsig V.A. Electron spin resonance spectra, conformation, and chemical properties of free radicals in solid polymers. Russian Chemical Reviews 1969; 38(4): 290–305, http://dx.doi.org/10.1070/RC1969v038n04ABEH001742.
- Федоров С.Н., Линник Л.Ф., Треушников В.М., Викторова Е.А. Эластичный искусственный хрусталик и способ его изготовления. RU патент 2074673. 1995.
- Федоров С.Н., Линник Л.Ф., Треушников В.М., Викторова Е.А., Караваев А.А. Эластичный искусственный хрусталик глаза. RU патент 2129880. 1999.
- Треушников В.М., Зуева Т.А., Есин С.А., Олейник А.В. Журнал научной и прикладной фотографии и кинематографии 1990; 34(3): 167–172.
- Треушников В.М., Есин С.А., Зуева Т.А., Семчиков Ю.Д., Князева Т.Е., Янин А.М., Семенова О.М. Кинетические особенности радикальной полимеризации в тонких слоях фотополимеризующихся композиций. Высокомолекулярные соединения. Серия А 1995; 37(12): 1191–1197.
- Френкель Я.И. Кинетическая теория жидкости. М: Наука; 1975; 592 с.
- Федоров С.Н., Линник Л.Ф., Треушников В.М., Викторова Е.А., Караваев А.А. Способ изготовления эластичных искусственных хрусталиков глаза. RU патент 2129846. 1999.
- Треушников В.М., Викторова Е.А. Способ изготовления эластичных искусственных хрусталиков глаза. RU патент 2198630. 2003.
- Треушников В.М., Викторова Е.А. Способ изготовления искусственных хрусталиков глаза. RU патент 2234417. 2004.
- Klapshina L.G., Douglas W.E., Grigoryev I.S., Korytin A.I., Lavrentiev S.A., Lopatin M.A., et al. Novel metal-template assembled highly-functionalized cyanoporphyrazine ytterbium and vanadium complexes for potential photonic and optoelectronic applications. J Mater Chem 2009; 19(22): 3668–3676, http://dx.doi.org/10.1039/b821667c.
- Domrachev G.A., Semenov V.V., Klapshina L.G., Baten’Kin M.A., Arapova A.V., Kirillov A.I., Lopatin M.A., Obyedkov A.M., Zolotareva N.V., Gorshkov O.N., Kasatkin A.P., Mikhailov A.N., Antonov I.N., Sidorenko K.V., Treushnikov V.M., Treushnikov V.V. The light-emitting and optical properties of high-optical-quality organic glasses doped with europium tris(benzoyltrifluoroacetonate). Nanotechnologies in Russia 2009; 4(3–4): 225–236, http://dx.doi.org/10.1134/s1995078009030100.
- Semenov V.V., Zolotareva N.V., Lopatin M.A., Faerman V.I., Domrachev G.A., Gorshkov O.N., Kasatkin A.P., Skamnitskii D.V., Shenina M.E., Kruglov A.V., Treushnikov V.M., Treushnikov V.V. Spectral and optical properties of high-optical-quality organic glasses under prolonged ultraviolet irradiation. Polymer Science. Series A 2010; 52(6): 599–609, http://dx.doi.org/10.1134/s0965545x10060052.
- Grigoryev I.S., Klapshina L.G., Lermontova S.A., Semenov V.V., Treushnikov V.M., Treushnikov V.V., Bushuk B.A., Clement S., Douglas W.E. Efficient luminescent solar concentrators based on defectless organic glasses containing novel ytterbium cyanoporphyrazine complex. Nanotechnologies in Russia 2012; 7(9–10): 492–498, http://dx.doi.org/10.1134/s1995078012050059.
- Molodnyakov S.P., Treushnikov V.V., Treushnikov V.M., Gorshkov O.N., Kasatkin A.P., Shenina M.E., Shushunov A.N., Kruglov A.V., Semenov V.V. Polymeric waveguides based on photopolymerizing methacrylate compositions. Russian Journal of Applied Chemistry 2014; 87(3): 331–335, http://dx.doi.org/10.1134/S1070427214030148.
- Паштаев Н.П., Поздеева H.A., Старостина О.В., Морозова В.H. Иридохрусталиковая диафрагма и способ ее изготовления. RU патент 2526245. 2013.
- Цыбусов С.Н., Дурново Е.А., Хомутинникова Н.Е., Треушников В.М., Викторова Е.А., Треушников В.В., Сорокина О.В. Матрица для регенерации мягких тканей. RU патент 2526182. 2013.
- Паштаев Н.П., Пивоваров Н.Н., Паштаев А.Н., Суркова Е.Н., Треушников В.М., Старостина О.В. Эластичная интраокулярная линза. RU патент 2485916. 2011.
- Гущина М.Б., Треушников В.В. Имплантат орбитальный. RU патент 2504348. 2011.
- Абелевич А.И., Овчинников Е.А., Треушников В.М., Треушников В.В., Сорокина О.В. Эндопротез для лечения параколостомических грыж. RU патент 2503430. 2012.
- Хомутинникова Н.Е., Дурново Е.А., Треушников В.М., Треушников В.В., Сорокина О.В. Имплантат для пластики посттравматических дефектов и деформаций дна и стенок глазницы. RU патент 2487726. 2011.











