Дифференциальная экспрессия генов и активация сигнальных путей в радиорезистентных и радиочувствительных раковых клеточных линиях
Цель исследования — изучить дифференциальную экспрессию генов и активацию сигнальных путей в радиорезистентных и радиочувствительных раковых клеточных линиях.
Материалы и методы. Использованы радиорезистентная раковая клеточная линия хронического миелолейкоза К562 и радиочувствительные раковые клеточные линии HCT-116р53 (+/+), НСТ-116р53 (–/–), Me45. Анализ транскриптома выполняли с применением гибридизационных ДНК-чипов высокой плотности Affymetrix серии HGU133А. Биоинформационный анализ проводили с использованием оригинальной программы Gene Selector. Исследование сетей белковых взаимодействий выполняли с помощью онлайн-системы STRING. Для ранжирования генов по сигнальным путям использовали программу PANTHER и базу данных QIAGEN SABiosciences. Количественную активацию сигнальных путей рассчитывали с помощью биоинформационного алгоритма OncoFinder.
Результаты. Выявлено 4 гена: DAAM1, IFNAR2, PALLD, STK17A, экспрессия которых при лучевых воздействиях увеличивается в радиорезистентной клеточной линии и снижается в радиочувствительных клеточных линиях. С использованием программы PANTHER были найдены три сигнальных пути — Wnt signaling pathway, Interferon signaling pathway, p53 signaling pathway, в которых задействованы эти гены и которые являются общими для исследуемых клеточных линий. Установлена значительная разница в активации найденных путей в радиорезистентной и радиочувствительных клеточных линиях.
Заключение. На основе анализа сетей молекулярных взаимодействий и активации сигнальных путей выявлено, что наибольшие отличия между радиорезистентной и радиочувствительной клеточными линиями наблюдаются в активности сигнальных путей Interferon signaling pathway и p53 signaling pathway. Экспрессия гена ТР53 не связана с активностью сигнального пути p53 signaling pathway. Сопоставление изменений экспрессии генов и активации сигнальных путей позволяет предложить в качестве индикаторов радиорезистентности при радиационном излучении экспрессию генов DAAM1, IFNAR2, PALLD.
Устойчивость злокачественных опухолей к лучевой терапии остается одной из важных проблем, которая стоит перед клинической и экспериментальной онкологией. В дополнение к тому, что некоторым опухолевым клеткам изначально свойственна пониженная чувствительность к ионизирующему излучению, они также могут приобретать ее в процессе терапии [1]. Данный факт объясняется тем, что после лучевого воздействия раковые клетки способны переживать повреждение ДНК [2]. Это приводит к увеличению их выживаемости, что служит причиной бесконечного роста раковой опухоли и клинического прогрессирования заболевания. Кроме того, ситуацию осложняет генетическая нестабильность опухолевых клеток, для которой характерен высокий уровень спонтанных мутаций. Таким образом, дальнейшее проведение радиотерапии не только не вызывает улучшение состояния больных злокачественными новообразованиями, но и способно привести к тяжелым последствиям, увеличивая негативное влияние на общее состояние пациента и его качество жизни. Данная ситуация обусловливает поиск новых путей для совершенствования радиационной терапии — преодоления радиорезистентности раковых клеток.
Радиорезистентность раковых клеток главным образом зависит от правильности функционирования внутриклеточных сигнальных путей [3]. Изменение одного компонента сигнального пути, например сверхэкспрессия гена, способно нарушить функционирование всей системы клетки. Например, рецептор ЕrbВ-2, входящий в семейство рецептора эпидермального фактора роста EGFR, является одним из рецепторов, которые наиболее часто экспрессируются на поверхности раковых клеток эпителия бронхов. Для гена EGFR рецептор ЕrbВ-2 выступает в качестве корецептора в момент формирования димерного комплекса и впоследствии аутофосфорилирования, но лиганд для него еще не определен [4]. Обнаружено, что в злокачественных новообразованиях человека для гена EGFR характерна сверхэкспрессия. Как отмечается в разных исследованиях [5–7], существует связь между экспрессией гена EGFR и устойчивостью раковых клеток к радиотерапии. В работах [5–7] показано, что раковые клетки предстательной железы (DU145 и PC-3) экспрессируют ген EGFR. Кроме того, в преклинических исследованиях найдена взаимосвязь экспрессии гена EGFR с пролиферацией, ангиогенезом, миграцией опухолевых клеток и с радиорезистентностью опухоли [8, 9]. Информация об активации сигнальных путей и их компонентов в ответ на радиотерапию позволит прогнозировать исходы лечения онкологических заболеваний и получить метод подавления механизмов радиорезистентности раковых клеток. Наиболее полную картину о механизмах активации внутриклеточных сигнальных путей дают методы полнотранскриптомного анализа [10]. В настоящей работе использовали транскриптомный анализ радиорезистентных и радиочувствительных клеточных линий с целью выявления дифференциально-экспрессирующихся генов и исследования дифференциальной активности сигнальных путей.
Цель исследования — изучить дифференциальную экспрессию генов и активацию сигнальных путей в радиорезистентных и радиочувствительных раковых клеточных линиях.
Материалы и методы
Клеточные культуры. В экспериментах использовали: радиорезистентную суспензионную линию человеческих эритролейкемических лимфобластоидных клеток К562; радиочувствительную клеточную линию рака прямой кишки человека HCT-116p53 (+/+) с нормальным геном ТР53; радиочувствительную клеточную линию рака прямой кишки человека HCT-116p53 (–/–) с мутантным геном ТР53; радиочувствительную клеточную линию меланомы человека МЕ45. Клеточные линии получены из American Type Culture Collection (ATCC).
Клетки культивировали при стандартных условиях: в СO2-инкубаторе МСО-18AIC СО2 (Helicon, Япония) при температуре 37°С, в атмосфере 5% СО2 и 98% влажности. Для культивирования клеточной линии К562 использовали среду RPMI-1640, которая содержит L-глутамин с 10% эмбриональной бычьей сыворотки и 5 мкг/мл гентамицина. Для культивирования клеточных линий HCT-116p53 (+/+), HCT-116p53 (–/–), Me45 использовали среду DMEM/F12, которая также содержит L-глутамин с 10% эмбриональной бычьей сыворотки и 5 мкг/мл гентамицина.
Дизайн эксперимента. Облучение клеточных линий производилось в логарифмической фазе роста. Клетки однократно облучали рентгеновским излучением, генерируемым терапевтическим акселератором Clinac 600 (Varian Medical Systems, США) при комнатной температуре, в дозе 4 Гр [11, 12]. Мощность дозы излучения составляла 0,03 Гр/с при фокусном расстоянии 104 см. Высота водяного столба над клетками составляла 1 см. Клетки облучались в 24-луночных планшетах (объем лунки — 2,5 мл). Анализ экспрессии генов выполняли через 1, 12 и 24 ч после облучения.
Анализ экспрессии генов. РНК выделяли из 3·106 клеток с использованием набора для выделения РНК в соответствии с инструкцией производителя. Целостность выделенной РНК проверяли с помощью биоанализатора Agilent 2100 (Agilent Technologies, США). Библиотеку клонированных ДНК готовили с использованием набора GeneChip Expression 3'-Amplification One-Cycle cDNA Synthesis Kit (Affymetrix, США). Мечение биотином антисмысловых библиотек клонированных РНК (кРНК) и очистка были проведены с использованием набора GeneChip Expression 3'-Amplification Reagentsfor IVT Labeling в соответствии с протоколом производителя. Количество полученных РНК и ДНК оценивали с помощью спектрофотометра NanoDrop (Thermo Scientific, США). Фрагментацию кРНК проводили при 94°C в термоциклере в течение 35 мин. Синтезированные биотинилированные кРНК вначале гибридизировали с контрольной матрицей Test-3 с целью оценки качества полученных кРНК. Если это качество соответствовало расчетному, тогда проводили гибридизацию с матрицей HGU133А. Матрицу окрашивали стрептовидин-фикоэритрином. Окрашенную матрицу отмывали от несвязавшегося белка и сканировали на сканере GeneArray G2500A (Hewlett Packard, США).
Биоинформационный анализ. Отбор генов, чья экспрессия изменялась по отношению к контролю на протяжении всего эксперимента, и поиск общих генов в радиорезистентной и радиочувствительной клеточных линиях проводили с использованием оригинальной программы Gene Selector (программу можно получить у авторов статьи), достоверность отличий задавалась на уровне p≤0,05.
Сеть молекулярных взаимодействий строилась с помощью онлайн-системы STRING (Search Tool for the Retrieval of Interacting Genes/Proteins). Данные предоставляются на основе четырех источников: Genomic Context, High-throughput Experiments, (Conserved) Coexpression, Previous Knowledge.
Определение сигнальных путей, к которым относятся отобранные гены, проводилось с использованием программы PANTHER и базы данных QIAGEN SABiosciences.
Количественную активацию сигнальных путей, на которую оказывают влияние отобранные гены, рассчитывали с помощью методики OncoFinder [13]. Степень активации сигнальных путей измеряли в условных единицах.
Результаты. В результате проведения статистической обработки данных экспрессии генов в клеточной линии К562 отобрано 109 генов, у которых экспрессия увеличивалась на протяжении всего эксперимента (см. таблицу).
 Гены, отобранные по заданным критериям в четырех раковых клеточных линиях Гены, отобранные по заданным критериям в четырех раковых клеточных линиях
|
В радиочувствительных раковых клеточных линиях с нормальным геном TP53 HCT-116p53 (+/+) и мутантным геном TP53 HCT-116p53 (–/–) выделили по 231 гену, а в раковой клеточной линии Me45 — 63 гена, чья экспрессия снижалась после 1, 12 и 24 ч эксперимента.
Программа автоматического подбора генов с заданным уровнем достоверности и экспрессии Gene Selector отобрала для используемых раковых клеточных линий четырех общих гена: DAAM1, IFNAR2, PALLD, STK17A, экспрессия которых увеличивается в радиорезистентной клеточной линии и снижается — в радиочувствительных.
Отобранные гены загружались в онлайн-систему STRING для выявления сетей молекулярных взаимодействий (рис. 1).
 Рис. 1. Сети молекулярных взаимодействий генов DAAM1 (а), IFNAR2 (б), PALLD (в), STK17A (г) Рис. 1. Сети молекулярных взаимодействий генов DAAM1 (а), IFNAR2 (б), PALLD (в), STK17A (г)
|
Установлено, что ген DAAM1 непосредственно взаимодействует с генами FNBP1, TRIP10, ARHGAP1, DVL1, DVL2, DVL3, PTBP2, RHOA, SRRM4, через которые осуществляется связь с генами ARHGDIA, BAIAP2, CDC42, PAK1, PAK2, PARD6A, PTBP2, TNK2, TRIP10, WAS, WASL. Ген IFNAR2 взаимодействует с генами TYK2, GNB2L1, IFNA8, STAT1, IFNW1, STAT2, JAK1, IFNAR1, JAK2, STAT3, IFNA5, через которые он оказывает влияние на гены IL2RB, IRS1, EGFR, IFNGR1, IRF1, EP300, CREBBP, IRF9. Ген PALLD взаимодействует с генами TGFB1, EPS8, AKT1, ACTN1, LPP, ACTN2, SRC, EZR. При изучении влияния гена STK17A обнаружена сеть молекулярных взаимодействий, где он не оказывает прямого влияния на другие гены. Данный факт можно объяснить тем, что этот ген недостаточно изучен и программа STRING содержит мало информации о его функциональной связи с другими генами.
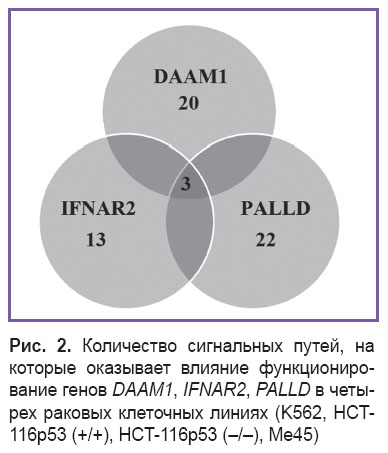
Экспрессия отдельных генов склонна к очень широким колебаниям и не всегда может являться признаком патологического процесса в отличие от активности целого сигнального пути. Поэтому отобранные гены DAAM1, IFNAR2, PALLD загружались в базу данных PANTHER, которая содержала информацию о том, в каких внутриклеточных сигнальных путях они функционируют (рис. 2).
| Рис. 2. Количество сигнальных путей, на которые оказывает влияние функционирование генов DAAM1, IFNAR2, PALLD в четырех раковых клеточных линиях (K562, HCT-116p53 (+/+), HCT-116p53 (–/–), Me45) |
На основе полученной информации были найдены три сигнальных пути (см. рис. 2), которые являются общими для радиорезистентной и радиочувствительных раковых клеточных линий: Wnt signaling pathway, Interferon signaling pathway, p53 signaling pathway. С помощью метода OncoFinder была рассчитана их активация в клеточных линиях, на которые непосредственно влияют гены DAAM1, IFNAR2, PALLD и STK17A (рис. 3).
На графиках, отражающих влияние ионизирующего излучения в дозе 4 Гр на активацию сигнального пути Wnt signaling pathway в четырех раковых клеточных линиях (рис. 3, а), видно, что активация в линиях HCT-116p53 (+/+), HCT-116p53 (–/–) и Me45 до 12 ч снижается, а после наблюдается ее рост. В линиях HCT-116p53 (+/+) и HCT-116p53 (–/–) значения активации после 24 ч значительно ниже, чем в линии Me45. В радиорезистентной раковой клеточной линии K562 активация этого сигнального путиснижается на протяжении всего эксперимента.
Графики, отражающие влияние ионизирующего излучения в дозе 4 Гр на активацию Interferon signaling pathway (рис. 3, б), показывают, что, несмотря на схожий характер активации в клеточных линиях К562, HCT-116p53 (–/–), HCT-116p53 (+/+), ее значения в этих линиях заметно отличаются. Наибольшего значения активация Interferon signaling pathway достигает в радиорезистентной раковой клеточной линии после 24 ч, а в радиочувствительных клеточных линиях относительно низкие ее значения сохраняются до конца эксперимента.
Как видно из рисунка, активация пути p53 signaling pathway в радиорезистентной и радиочувствительных клеточных линиях также отличается (рис. 3, в). В HCT-116p53 (+/+) и HCT-116p53 (–/–) она достигает своего максимального значения после 12 ч с начала эксперимента, а к 24 ч наблюдается ее спад. В клеточных линиях K562 и Me45 активация одинаково снижается, но после 12 ч в K562 она начинает расти, тогда как в Me45, напротив, продолжает снижаться.
Обсуждение. Важную роль в формировании ответа опухолевых клеток на ионизирующее облучение играют внутриклеточные сигнальные пути, которые включают в себя большое количество белков, например р53, фосфолипазу δ1, протеинкиназу С, кластерин и др. [14]. Однако не существует общего мнения о том, какие именно сигнальные пути участвуют в формировании низкой радиочувствительности раковых клеток. Наши исследования показали, что гены DAAM1, IFNAR2, PALLD, STK17A радиорезистентной клеточной линии К562 характеризуются избыточной экспрессией в отличие от генов радиочувствительных клеточных линий. Ген DAAM1 входит в семейство белков форминов. Его функция заключается в регуляции роста клеток, а также он участвует в образовании и удлинении новых нитей актина. Ранее уже было показано [15], что некоторые актинсвязывающие белки, например кофилин-1 (CFL1), значительно активируются в радиорезистентной астроцитоме.
Ген IFNAR2 стимулирует связывание и активацию рецептора Janus протеинкиназ, который фосфорилирует несколько белков (например, STAT и STAT1). Сигнальные пути фосфатидилинозитол-3-киназы (PI3K), протеинкиназы В (Akt), янус-киназы (JAK), активатор транскрипции (STAT) способны блокировать апоптоз, что делает опухолевые клетки устойчивыми к радиотерапии [16, 17]. S.O. Rahaman с соавт. в своих исследованиях продемонстрировали, что ингибирование сигнального пути STAT3 приводит к усиленному апоптозу и ингибированию пролиферации в злокачественной глиоме [18].
Ген PALLD принимает участие в организации цитоскелета клетки, играет важную роль в формировании морфологии, подвижности и адгезии клеток. Адгезия с внеклеточным матриксом в нормальных и опухолевых клеточных линиях способствует формированию устойчивости к ионизирующему излучению [19–21].
Ген STK17A входит в состав DAP-киназ и индуцирует апоптоз. Выступает в качестве регулятора активных форм кислорода в клетке, увеличение которых способно привести к адаптивным изменениям и может играть центральную роль в формировании радиорезистентности опухолевых клеток [22].
Таким образом, гены DAAM1, IFNAR2, PALLD и STK17A вовлечены в процесс формирования радиорезистентности и могут быть использованы в качестве мишени для повышения радиочувствительности опухолевых клеток.
Все указанные гены в радиорезистентной клеточной линии характеризуются сверхэкспрессией. Но в формировании резистентности необходимо учитывать не только экспрессию отдельных генов, но и активацию сигнальных путей, участниками которых они являются. Мы определили общие сигнальные пути для клеточных линий K562, HCT-116p53 (+/+), HCT-116p53 (–/–), Me45, в которых принимают участие гены DAAM1, IFNAR2, PALLD и STK17A (см. рис. 2).
В радиорезистентной клеточной линии К562 активация сигнальных путей Wnt signaling pathway, Interferon signaling pathway и p53 signaling pathway значительно отличалась от их активации в радиочувствительных клеточных линиях (см. рис. 3, б).
Ранее было продемонстрировано [23], что Interferon signaling pathway активирован в радиорезистентных раковых клетках. Ключевым белком этого сигнального пути является белок, кодируемый геном STAT1. Белок IFNAR2 физически взаимодействует с белком STAT1. J.F. Zhan с соавт. показали, что сверхэкспрессия STAT1 способствует формированию радиорезистентности клеток рака молочной железы [24]. M. Fryknäs с соавт. доказали, что клетки миеломы с гиперэкспрессией STAT1 более радиорезистентны, чем клетки с низким уровнем экспрессии этого белка [25]. В наших экспериментах увеличение экспрессии гена STAT1 наблюдалось во всех клеточных линиях на протяжении всего эксперимента, тогда как сверхэкспрессия гена IFNAR2 на протяжении всего эксперимента отмечалась только в радиорезистентной клеточной линии К562. Таким образом, экспрессия гена IFNAR2 может служить показателем радиорезистентности.
Многие злокачественные опухоли человека содержат мутации в гене р53, и большинство из них имеют генетические повреждения в сигнальном пути p53 signaling pathway [26]. Например, увеальная меланома иногда имеет мутации в гене р53, которые препятствуют нормальному функционированию p53 signaling pathway [27–29]. В связи с этим увеальная меланома способна приобретать низкую радиочувствительность. В наших экспериментах мы использовали две клеточные линии с мутантным геном ТР53: это радиочувствительная клеточная линия HCT-116p53 (–/–) и радиорезистентная клеточная линия К562. В обеих линиях белок р53 не активен. Несмотря на это, активация сигнального пути p53 signaling pathway в этих клеточных линиях различна. В линии К562 радиационное облучение не влияет на активность этого пути на всем протяжении эксперимента (см. рис. 3, в). В радиочувствительной клеточной линии HCT-116p53 (–/–) активность p53 signaling pathway через 1 ч остается неизменной, а через 12 и 24 ч увеличивается, хотя сохраняется на несколько более низком уровне, чем в изогенной клеточной линии HCT-116p53 (+/+) с геном ТР53 дикого типа. Данные наших экспериментов демонстрируют, что величина экспрессии гена ТР53 не связана с активностью сигнального пути p53 signaling pathway.
Заключение. Впервые продемонстрировано, что гены DAAM1, IFNAR2, PALLD и STK17A связаны с феноменом радиорезистентности раковых клеток. Наибольшие отличия между радиорезистентной и радиочувствительными клеточными линиями наблюдаются в активности сигнальных путей Interferon signaling pathway и p53 signaling pathway. Величина экспрессии гена ТР53 не связана с активностью сигнального пути p53 signaling pathway.
Финансирование исследования. Работа выполнена при поддержке Министерства образования и науки РФ в рамках государственного задания 6.1617.2014/K и конкурса «Участник молодежного научно-инновационного конкурса» («УМНИК») №2994ГУ1/2014.
Конфликт интересов. У авторов нет конфликта интересов.
Литература
- Зинченко В.А., Чащина Л.И. Возможные механизмы устойчивости опухолевых клеток к лучевой и химиотерапии. Biopolym Cell 2005; 21(6): 473–484.
- Tang H.L., Tang H.M., Mak K.H., Hu S., Wang S.S., Wong K.M., Wong C.S., Wu H.Y., Law H.T., Liu K., Talbot C.C. Jr., Lau W.K., Montell D.J., Fung M.C. Cell survival, DNA damage, and oncogenic transformation after a transient and reversible apoptotic response. Mol Biol Cell 2012; 23(12): 2240–2252, http://dx.doi.org/10.1091/mbc.E11-11-0926.
- Panganiban R.-A.M., Snow A.L., Day R.M. Mechanisms of radiation toxicity in transformed and non-transformed cells. Int J Mol Sci2013; 14(8): 15931–15958, http://dx.doi.org/10.3390/ijms140815931.
- Тихомирова А.В., Ягудина Р.И. Фармакоэкономический анализ прямых медицинских затрат при лечении метастатического колоректального рака режимами XELOX или FOLFOX4 в сочетании с бевацизумабом или без него в качестве терапии первой линии. Фармакоэкономика 2010; 2: 22–27.
- Chinnaiyan P., Varambally S., Tomlins S.A., Ray S., Huang S., Chinnaiyan A.M., Harari P.M. Enhancing the antitumor activity of ErbB blockade with histone deacetylase (HDAC) inhibition. Int J Cancer 2006; 118(4): 1041–1050, http://dx.doi.org/10.1002/ijc.21465.
- Corvò R., Pastrone I., Scolaro T., Marcenaro M., Berretta L., Chiara S. Radiotherapy and oral capecitabine in the preoperative treatment of patients with rectal cancer: rationale, preliminary results and perspectives. Tumor 2003; 89(4): 361–367.
- El Sheikh S.S., Domin J., Abel P., Stamp G., Lalani El-N. Phosphorylation of both EGFR and ErbB2 is a reliable predictor of prostate cancer cell proliferation in response to EGF. Neoplasia 2004; 6(6): 846–853, http://dx.doi.org/10.1593/neo.04379.
- Milas L., Fan Z., Andratschke N.H., Ang K.K. Epidermal growth factor receptor and tumor response to radiation: in vivo preclinical studies. Int J Radiat Oncol Biol Phys 2004; 58(3): 966–971, http://dx.doi.org/10.1016/j.ijrobp.2003.08.035.
- Nasu S., Ang K.K., Fan Z., Milas L. C225 antiepidermal growth factor receptor antibody enhances tumor radiocurability. Int J Radiat Oncol Biol Phys 2001; 51(2): 474–477, http://dx.doi.org/10.1016/S0360-3016(01)01671-6.
- Lezhnina K., Kovalchuk O., Zhavoronkov A.A., Korzinkin M.B., Zabolotneva A.A., Shegay P.V., Sokov D.G., Gaifullin N.M., Rusakov I.G., Aliper A.M., Roumiantsev S.A., Alekseev B.Y., Borisov N.M., Buzdin A.A. Novel robust biomarkers for human bladder cancer based on activation of intracellular signaling pathways. Oncotarget 2014; 5(19): 9022–9032, http://dx.doi.org/10.18632/oncotarget.2493.
- Saenko Y.V., Shutov A.M., Rastorgueva E.V., Maslakova A.G. The role of mitochondria in the development of radiation-induced oxidative stress in K562 leukemia cells. Bull Exp Biol Med 2013; 154(5): 631–634, http://dx.doi.org/10.1007/s10517-013-2017-4.
- Spary L.K., Al-Taei S., Salimu J., Cook A.D., Ager A., Watson H.A., Clayton A., Staffurth J., Mason M.D., Tabi Z. Enhancement of T cell responses as a result of synergy between lower doses of radiation and T cell stimulation. J Immunol 2014; 192(7): 3101–3110, http://dx.doi.org/10.4049/jimmunol.1302736.
- Buzdin A.A., Zhavoronkov A.A., Korzinkin M.B., Venkova L.S., Zenin A.A., Smirnov P.Y., Borisov N.M. Oncofinder, a new method for the analysis of intracellular signaling pathway activation using transcriptomic data. Front Genet 2014; 5: 55, http://dx.doi.org/10.3389/fgene.2014.00055.
- Matsumoto H., Hamada N., Takahashi A., Kobayashi Y., Ohnishi T. Vanguards of paradigm shift in radiation biology: radiation-induced adaptive and bystander responses. J Radiat Res 2007; 48(2): 97–106, http://dx.doi.org/10.1269/jrr.06090.
- Yan H., Yang K., Xiao H., Zou Y.J., Zhang W.B., Liu H.Y. Over-expression of cofilin-1 and phosphoglycerate kinase 1 in astrocytomas involved in pathogenesis of radioresistance. CNS Neurosci Ther 2012; 18(9): 729–736, http://dx.doi.org/10.1111/j.1755-5949.2012.00353.x.
- Toker A., Yoeli-Lerner M. Akt signaling and cancer: surviving but not moving on. Cancer Res 2006; 66(8): 3963–3966, http://dx.doi.org/10.1158/0008-5472.CAN-06-0743.
- Hodge D.R., Hurt E.M., Farrar W.L. The role of IL-6 and STAT3 in inflammation and cancer. Eur J Cancer 2005; 41(16): 2502–2512, http://dx.doi.org/10.1016/j.ejca.2005.08.016.
- Rahaman S.O., Harbor P.C., Chernova O., Barnett G.H., Vogelbaum M.A., Haque S.J. Inhibition of constitutively active STAT3 suppresses proliferation and induces apoptosis in glioblastoma multiforme cells. Oncogene 2002; 21(55): 8404–8413, http://dx.doi.org/10.1038/sj.onc.1206047.
- Hehlgans S., Haase M., Cordes N. Signalling via integrins: implications for cell survival and anticancer strategies. Biochim Biophys Acta2007; 1775(1): 163–180, http://dx.doi.org/10.1016/j.bbcan.2006.09.001.
- Eke I., Sandfort V., Storch K., Baumann M., Röper B., Cordes N. Pharmacological inhibition of EGFR tyrosine kinase affects ILK-mediated cellular radiosensitization in vitro. Int J Radiati Biol 2007; 83(11–12): 793–802, http://dx.doi.org/10.1080/09553000701727549.
- Park C.C., Zhang H., Pallavicini M., Gray J.W., Baehner F., Park C.J., Bissell M.J. Beta1 integrin inhibitory antibody induces apoptosis of breast cancer cells, inhibits growth, and distinguishes malignant from normal phenotype in three dimensional cultures and in vivo. Cancer Res2006; 66(3): 1526–1535, http://dx.doi.org/10.1158/0008-5472.CAN-05-3071.
- Shi X., Zhang Y., Zheng J., Pan J. Reactive oxygen species in cancer stem cells. Antioxid Redox Signal 2012; 16(11): 1215–1228, http://dx.doi.org/10.1089/ars.2012.4529.
- Woodward W.A., Chen M.S., Behbod F., Alfaro M.P., Buchholz T.A., Rosen J.M. WNT/beta — catenin mediates radiation resistance of mouse mammary progenitor cells. Proc Natl Acad Sci USA 2007; 104(2): 618–623, http://dx.doi.org/10.1073/pnas.0606599104.
- Zhan J.F., Chen L.H., Yuan Y.W., Xie G.Z., Sun A.M., Liu Y., Chen Z.X. STAT1 promotes radioresistance of CD44(+)/CD24(–/low) cells in breast cancer. Exp Biol Med (Maywood) 2011; 236(4): 418–22, http://dx.doi.org/10.1258/ebm.2011.010287.
- Fryknäs M., Dhar S., Oberg F., Rickardson L., Rydåker M., Göransson H., Gustafsson M., Pettersson U., Nygren P., Larsson R., Isaksson A. STAT1 signaling is associated with acquired crossresistance to doxorubicin and radiation in myeloma cell lines. Int J Cancer 2007; 120(1): 189–195, http://dx.doi.org/10.1002/ijc.22291.
- Sherr C.J. Principles of tumor suppression. Cell 2004; 116(2): 235–246, http://dx.doi.org/10.1016/S0092-8674(03)01075-4.
- Brantley M.A. Jr., Harbour J.W. Deregulation of the Rb and p53 pathways in uveal melanoma. Am J Pathol 2000; 157(6): 1795–1801, http://dx.doi.org/10.1016/S0002-9440(10)64817-1.
- Chana J.S., Wilson G.D., Cree I.A., Alexander R.A., Myatt N., Neale M., Foss A.J., Hungerford J.L. c-myc, p53, and Bcl-2 expression and clinical outcome in uveal melanoma. Br J Ophthalmol 1999; 83(1): 110–114, http://dx.doi.org/10.1136/bjo.83.1.110.
- Kishore K., Ghazvini S., Char D.H., Kroll S., Selle J. p53 gene and cell cycling in uveal melanoma. Am J Ophthal 1996; 121(5): 561–567, http://dx.doi.org/10.1016/s0002-9394(14)75431-5.