Ex vivo визуализация глиальных опухолей головного мозга человека с помощью кросс-поляризационной оптической когерентной томографии: первые результаты
Оптическая когерентная томография (ОКТ) становится перспективным методом оптической диагностики в нейроонкологии. В настоящей работе представлены первые результаты исследования глиальных опухолей человека различной степени злокачественности методом кросс-поляризационной ОКТ (КП ОКТ), позволяющим регистрировать изменения рассеяния и поляризации света при прохождении через ткань и получать более широкий спектр информации о структуре опухоли по сравнению с традиционной ОКТ.
Цель исследования — оценить возможности метода КП ОКТ в визуализации глиальных опухолей головного мозга человека с разной степенью злокачественности.
Материалы и методы. Исследование проведено на материале операционных биопсий (ex vivo образцы) от 18 пациентов с глиальными опухолями головного мозга разной степени злокачественности. На разработанном в Институте прикладной физики РАН (Нижний Новгород) скоростном спектральном КП ОКТ-устройстве было проанализировано 79 образцов ткани и получено 361 КП ОКТ-изображение.
Полученные КП ОКТ-изображения сопоставляли с данными гистологического исследования. Плоскость КП ОКТ-сканирования эквидистантно совпадала с плоскостью гистологического среза.
Результаты. Установлена связь характера КП ОКТ-изображений ткани мозга и глиальных опухолей с их морфологической структурой. Проведена сравнительная оценка ОКТ-сигнала от глиальных опухолей различной степени злокачественности и от неизмененной мозговой ткани.
Заключение. Морфологические особенности белого вещества головного мозга и глиом различной степени злокачественности могут быть дифференцированы на КП ОКТ-изображениях по таким характеристикам ОКТ-сигнала, как его уровень, однородность и характер затухания.
Метод оптической когерентной томографии (ОКТ) является новой развивающейся технологией с возможностью получения двух- и трехмерных изображений структуры тканей в режиме реального времени на глубинах до 1–2 мм с микронным разрешением. Технология основана на низкокогерентной интерферометрии в ближнем инфракрасном диапазоне длин волн (700–1300 нм). Получаемые изображения формируются на основе когерентного анализа поля обратно рассеянной зондирующей волны и характеризуют эффективность рассеяния на оптических неоднородностях биоткани, обусловленную составом и строением ее отдельных структур [1, 2]. Широко изучаются возможности клинического применения ОКТ при патологии различных органов и систем, включая сетчатку, желудочно-кишечный тракт, коронарные сосуды, молочную железу, кожу, головной мозг [3–6]. В последнее время значительно возрос интерес к использованию ОКТ как метода интраоперационной диагностики в хирургии глиальных опухолей головного мозга [7–9]. Глиальные опухоли образуются из клеток белого вещества головного мозга и характеризуются инфильтративным ростом. Необходимость определения гра-
ниц опухолевого роста и объема радикального удаления глиом обусловлена тем, что размер опухолевой резекции достоверно коррелирует с продолжительностью жизни пациентов [10–12]. В ряде исследований ex vivo и in vivo уже показана способность ОКТ дифференцировать границы опухолевого роста с проведением как качественной, так и количественной оценки получаемого сигнала [7–9, 13].
Для применения метода в клинической практике разработаны технологические решения интраоперационного использования ОКТ, например ОКТ в составе микроскопа для микронейрохирургии [14–16]. Стоит, однако, отметить, что мозговая ткань на традиционных ОКТ-изображениях выглядит бесструктурно. Для повышения информативности метода разработаны его поляризационные модификации, которые регистрируют эффекты изменения плоскости поляризации света при прохождении через ткань, обусловленные взаимодействием с анизотропными структурами исследуемых объектов. Основанная на эффекте двулучепреломления среды поляризационно-чувствительная ОКТ (ПЧ ОКТ) позволяет дифференцировать элементы ткани, которые слабо визуализируются или не визуализируются на традиционных ОКТ-изображениях. Это прежде всего структуры с продольным масштабом, много большим поперечного, такие как коллагеновые и мышечные волокна [17–19]. Показана также возможность методов ПЧ ОКТ и поляризационно-чувствительной оптической когерентной микроскопии визуализировать миелинизированные нервные волокна и их ориентацию в составе трактов белого вещества головного мозга [20, 21]. В настоящей работе впервые для исследования мозга человека использована модификация ПЧ ОКТ — кросс-поляризационная ОКТ (КП ОКТ), примененная нашей группой ранее при оценке различных тканей человека [22–24].
Материалы и методы. Исследование проведено на материале операционных биопсий (ex vivo образцы) от 18 пациентов с глиальными опухолями головного мозга разной степени злокачественности: Grade I — 2, Grade II — 3, Grade III — 3, Grade IV — 10 пациентов (см. таблицу, рис. 1, а). Доступ к новообразованиям осуществляли с учетом расположения функционально значимых зон головного мозга, использовали безрамочную нейронавигацию и интраоперационный нейромониторинг. Удаление опухоли выполняли с применением микрохирургической техники под операционным микроскопом. В области доступа к опухолевому очагу перифокальную зону опухоли (край опухолевой резекции — рис. 1, б; область зеленого пунктира на МРТ-изображении), подлежащую коагуляции, аккуратно выделяли и забирали при помощи опухолевого пинцета. В процессе удаления опухоли производили аналогичный забор участков в центре и по периферии опухоли (рис. 1, б; области красного и фиолетового пунктиров на МРТ-изображении соответственно). Материал биопсий помещали в тампоны, смоченные физиологическим раствором, и доставляли на исследование в течение 2 ч. В послеоперационном периоде ни у одного из пациентов не отмечено нарастания функционального дефицита. На проведение экспериментальных исследований на ex vivo образцах человека получено разрешение Этического комитета ПФМИЦ Минздрава России.
 Характеристика пациентов Характеристика пациентов
|
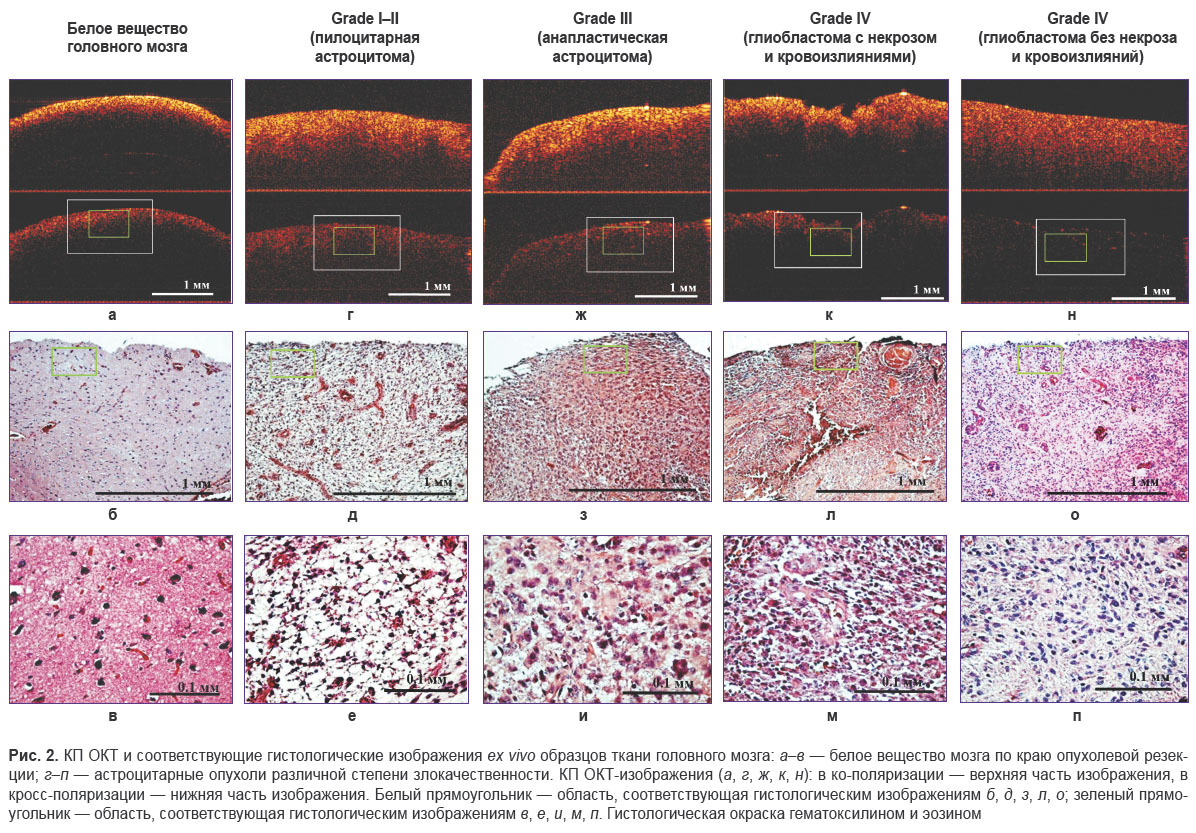
Кросс-поляризационная ОКТ. Исследования были выполнены на скоростном ОКТ-устройстве с использованием спектрального принципа приема сигнала, разработанном в Институте прикладной физики РАН (Нижний Новгород) [25, 26]. Оптическая схема скоростного варианта ОКТ-прибора представляет собой систему с общим оптическим путем для опорной и сигнальной волн (common path) и имеет два канала детектирования сигнала: один регистрирует обратно-рассеянный свет, который после обратного рассеяния в ткани сохранил исходное состояние поляризации (ко-поляризация), а другой демонстрирует ортогональную поляризацию (кросс-поляризация). Таким образом, получаемое КП ОКТ-изображение включает в себя верхнюю часть — ко-поляризацию и нижнюю часть — кросс-поляризацию (рис. 2, а, г, ж, к, н). КП ОКТ-устройство с рабочей длиной волны 1310 нм имеет следующие характеристики: мощность излучения на объекте ~20 мВт, разрешение по глубине (в воздухе) ~10 мкм, поперечное разрешение ~15 мкм, глубина сканирования в воздухе ~1,7 мм, скорость сканирования — 20 000 А-сканов/с, частота получения B-сканов для каждой пары изображений размером 4×2 мм — 40 кадров/с. Более подробное описание системы, включая оптическую схему и способ получения кросс-поляризационных изображений, было опубликовано ранее [24, 26, 27]. Скоростное спектральное КП ОКТ-устройство оснащено торцевым волоконно-оптическим зондом с внешним диаметром объектива 8 мм, который подводится бесконтактно к исследуемой поверхности ткани (рис. 1, г). Всего было проанализировано 79 образцов и получено 361 КП ОКТ-изображение (см. рис. 1, а).
Отметим, что представленное в данной работе КП ОКТ-устройство может быть использовано в клинической практике. Во-первых, система получения изображения компактна, имеет волоконную систему доставки сигнала к объекту; она может применяться в условиях операционной и, в том числе, интегрирована в операционный микроскоп; во-вторых, разработанная система формирует и демонстрирует КП ОКТ-изображения в режиме реального времени, что чрезвычайно важно для клинических интраоперационных исследований.
Гистологическое исследование. После получения КП ОКТ-изображений нервной ткани на образце гистологической тушью отмечали область сканирования, затем образец фиксировали в 10% формалине в течение 48 ч и из отмеченной области делали серийные гистологические срезы. Таким образом, плоскость КП ОКТ-сканирования эквидистантно совпадала с плоскостью гистологического среза. Серийные срезы окрашивали гематоксилином и эозином и рассматривали в проходящем свете с помощью микроскопа Leica DM2500, оснащенного цифровой камерой DFC 245C (Leica Microsystems, Германия).
Для всех полученных гистологических срезов были описаны особенности строения ткани и выделены следующие группы: 1-я группа — край опухолевой резекции (белое вещество головного мозга); 2-я группа — глиомы низкой степени злокачественности (Grade I–II); 3-я группа — анапластическая астроцитома (Grade III); 4-я группа — глиобластома с наличием очагов некроза (Grade IV) и 5-я группа — глиобластома без очагов некроза (Grade IV).
Результаты и обсуждение. Неизмененные ткани и опухоли головного мозга характеризуются существенно различающимися оптическими свойствами: как разной степенью поглощения и рассеяния света в тканях, так и различными поляризационными свойствами [28]. Для любой опухолевой ткани характерны существенные изменения клеточных структур: ядерный полиморфизм и повышение ядерно-цитоплазматического отношения [29]. Все это меняет характеристики рассеяния ткани [28]. По всей видимости, в случае глиальных опухолей головного мозга особенности формирования ОКТ-сигнала обусловлены двумя факторами [9]: 1) возрастание клеточной плотности и увеличение ядерно-цитоплазматического отношения способствуют повышению рассеивающих свойств ткани; 2) деградация миелина белого вещества головного мозга вследствие инфильтративного роста опухоли приводит к снижению уровня рассеяния света в ткани. Последнее утверждение делается на основании исследований, показавших, что при инфильтративном росте опухолевые клетки разрушают структуру миелина и сокращают его образование [30–32].
В данной работе впервые исследовано изменение пространственной и структурной организации волокнистых структур (в том числе и миелинизированных нервных волокон) при глиальных опухолях головного мозга методом КП ОКТ. Добавление кросс-поляризационного изображения к традиционному позволяет регистрировать эффекты изменения плоскости поляризации света (двулучепреломления и кросс-рассеяния) при прохождении через ткань, обусловленные взаимодействием с анизотропными структурами исследуемых объектов.
Анализ ех vivo образцов белого вещества по краю опухолевой резекции показал, что КП ОКТ-изображение в ко- и кросс-поляризациях (рис. 2, а; верхняя и нижняя части изображения соответственно) имеет вид полосы с высоким уровнем ОКТ-сигнала на поверхности и его равномерным уменьшением с глубиной. Затухание сигнала наблюдается на глубине порядка 250–300 мкм. В данной области белое вещество не претерпевает серьезных морфологических изменений (за исключением отека ткани) и характеризуется равномерным соотношением и плотным расположением миелинизированных нервных волокон и клеток глии (рис. 2, б, в). Это объясняет наличие высокоинтенсивного гомогенного и быстро затухающего ОКТ-сигнала в ко- и кросс-поляризациях, при этом наличие интенсивного гомогенного ОКТ-сигнала в кросс-поляризации указывает на способность неизмененных нервных волокон к кросс-рассеянию.
Глиомы низкой степени злокачественности (Grade I–II) имеют астроцитарное происхождение, их слабый инфильтративный рост сопровождается незначительным нарушением микроархитектоники окружающего белого вещества. Эти опухоли характеризуются умеренным повышением плотности расположения опухолевых астроцитов (рис. 2, д, е) [33]. На соответствующем КП ОКТ-изображении наблюдается высокий, но по сравнению с белым веществом менее интенсивный и более гетерогенный сигнал обратного рассеяния с медленным неравномерным затуханием в среднем на глубине порядка 500–600 мкм (рис. 2, г). Гетерогенность сигнала обусловлена структурной дезорганизацией ткани с полным или частичным разрушением и расслоением элементов нейропиля (скопления отростков нервных клеток), хаотичным расположением опухолевых клеток с увеличенными гиперхроматичными ядрами неправильной формы, наличием в ряде случаев кист и кальцинатов. В глиомах низкой степени злокачественности при гистологическом исследовании еще можно обнаружить миелинизированные аксоны [33], однако в процессе прогрессирования опухолевого роста происходит деградация миелина. На наш взгляд, именно это снижает уровень сигнала в ко- и кросс-поляризациях и обеспечивает его неоднородность по сравнению с неизмененным белым веществом. Сигнал в кросс-поляризации, по всей видимости, появляется за счет кросс-рассеяния на многочисленных клеточных отростках, формирующих матрикс опухоли (рис. 2, г; нижняя часть изображения). Это соответствует представлению о «фибриллярной» структуре всех диффузных астроцитом (включая глиобластому), матрикс которых образован длинными отростками опухолевых клеток [33]. Элементы опухолевой ткани расположены рыхло, что связано в первую очередь с наличием периваскулярного и перицеллюлярного отеков, поэтому ОКТ-сигнал характеризуется низкой скоростью затухания в ко- и кросс-поляризациях. Степень выраженности отека существенно влияет на рассеивающие свойства мозговой ткани: по мере нарастания отека коэффициент рассеяния снижается [34], что на КП ОКТ-изображениях проявляется снижением интенсивности и скорости затухания сигнала.
Анапластическая астроцитома (Grade III) относится к опухолям высокой степени злокачественности и характеризуется увеличением количества опухолевых клеток с высокой степенью ядерной атипии и полиморфизма (рис. 2, з, и). Пространственное разрешение ОКТ не позволяет напрямую выявить вышеуказанные признаки. Это объясняет отсутствие отчетливых различий между ОКТ-сигналом на изображениях пилоцитарной астроцитомы (Grade I–II) и анапластической астроцитомы (Grade III) и позволяет сохранить для этой формы астроцитомы те же КП ОКТ-критерии дифференциальной диагностики с неизмененным белым веществом по краю опухолевой резекции, которые мы сформулировали для Grade I–II. Есть надежда, что количественный анализ изображений, который будет применен в наших дальнейших исследованиях, позволит обнаружить такие дифференциальные признаки.
Глиобластома (Grade IV) является самой злокачественной опухолью астроцитарного ряда. Помимо характерных для анапластической астроцитомы гистопатологических признаков она отличается от других глиом еще наличием микроваскулярной пролиферации, участков кровоизлияний и некроза (рис. 2, л). Специфическим патоморфологическим признаком глиобластомы являются псевдопалисады, представляющие собой скопление опухолевых клеток вокруг некротического центра [35]. Данные структурные особенности опухоли обеспечивают характерные для глиобластомы признаки на КП ОКТ-изображении (рис. 2, к). КП ОКТ-сигнал имеет выраженную гетерогенность с чередованием участков высокой и низкой интенсивности, за формирование которых отвечают соответственно участки повышенной клеточной плотности и некротических изменений (рис. 2, м). Также обращает на себя внимание выраженная неоднородность затухания ОКТ-сигнала в глубину (по поперечной координате), что может говорить о разной плотности расположения структурных элементов в ткани и выраженности отека. В областях выраженного отека сигнал затухает медленней, в участках с менее выраженным отеком затухание происходит быстрее.
Ряд глиобластом имел структуру, близкую к анапластической астроцитоме, с высокой клеточной плотностью на фоне выраженного отека и без наличия в ткани очагов некрозов и кровоизлияний (рис. 2, о, п). Эти формы были проанализированы отдельно. Соответствующие КП ОКТ-изображения в ко-поляризации в данном случае характеризовались гомогенным сигналом обратного рассеяния умеренной интенсивности с медленным равномерным затуханием в глубину и едва заметным сигналом в кросс-поляризации (рис. 2, н; верхняя и нижняя части изображения соответственно). Низкий уровень сигнала в кросс-поляризации, по всей видимости, связан с отсутствием упорядоченных структур, имеющих форму волокон. В работах других авторов подобный морфологический тип глиобластом не рассматривается.
В настоящее время основным ОКТ-критерием дифференциальной диагностики неизмененного белого вещества и астроцитом на основании визуальной оценки ОКТ-изображений является степень неоднородности сигнала обратного рассеяния [7, 8]. Проведенный нами анализ с использованием КП ОКТ позволяет утверждать, что характер затухания ОКТ-сигнала также является информативным признаком. Возможность анализировать уровень сигнала в кросс-поляризации заметно повышает информативность метода. Нами установлена отчетливая закономерность — неизмененное белое вещество мозга характеризуется высоким уровнем сигнала в кросс-поляризации; специфичным для любой диффузной астроцитомы является низкий уровень кросс-поляризационного обратного рассеяния.
При сравнении КП ОКТ-изображений астроцитом по мере возрастания степени злокачественности (Grade I → Grade IV) можно говорить о тенденции к увеличению гетерогенности сигнала в обеих поляризациях и о снижении уровня сигнала в кросс-поляризации. Причиной может служить увеличение клеточной плотности и смещение соотношения волокнистого и клеточного компонентов опухоли в сторону последнего.
Дальнейшее развитие метода ОКТ связано с разработкой способов количественной обработки сигнала. Наиболее информативным в этом отношении является определение коэффициентов рассеяния неизмененной мозговой ткани и опухоли [8, 9]. Именно в этом направлении развиваются исследования и нашей группы.
Заключение. Гистологические особенности белого вещества и глиом различной степени злокачественности могут быть дифференцированы на КП ОКТ-изображениях по таким характеристикам ОКТ-сигнала, как уровень, однородность и характер затухания в ко- и кросс-поляризациях.
Пространственного разрешения ОКТ (порядка 10 мкм по глубине и 15 мкм по поперечной координате) достаточно, чтобы отличить диагностически значимые изменения микроструктур ткани мозга: различную плотность/соотношение клеточных и волокнистых структур в ткани, наличие участков некрозов и кровоизлияний, а также присутствие миелиновых волокон в ткани головного мозга. Высокая неоднородность по поперечной координате ОКТ-сигнала или почти полное его отсутствие в кросс-поляризации — прямой признак глиобластом высокой степени злокачественности.
Таким образом, КП ОКТ представляется перспективным методом интраоперационной диагностики в нейрохирургии, который может существенно расширить представления нейрохирурга о структурных особенностях удаляемой опухоли в режиме реального времени.
Финансирование исследования. Работа выполнена при финансовой поддержке гранта Российского научного фонда №16-15-10391. Использовано скоростное спектральное КП ОКТ-устройство, разработанное и сконструированное в рамках гранта Правительства Российской Федерации, Министерства образования и науки Российской Федерации, договор №14.B25.31.0015, РФФИ №16-32-60178 мол_а_дк.
Конфликт интересов. У авторов нет конфликта интересов.
Литература
- Huang D., Swanson E.A., Lin C.P., Schuman J.S., Stinson W.G., Chang W., Hee M.R., Flotte T., Gregory K., Puliafito C.A., Fujimoto J.G. Optical coherence tomography. Science 1991; 254(5035): 1178–1181, https://doi.org/10.1126/science.1957169.
- Fercher A.F., Hitzenberger C.K., Kamp G., El-Zaiat S.Y. Measurement of intraocular distances by backscattering spectral interferometry. Optics Communications 1995; 117(1–2): 43–48, https://doi.org/10.1016/0030-4018(95)00119-s .
- Su M.I., Chen C.Y., Yeh H.I., Wang K.T. Concise review of optical coherence tomography in clinical practice. Acta Cardiol Sin 2016; 32(4): 381–386.
- Osiac E., Bălşeanu T.A., Cătălin B., Mogoantă L., Gheonea C., Dinescu S.N., Albu C.V., Cotoi B.V., Tica O.S., Sfredel V. Optical coherence tomography as a promising imaging tool for brain investigations. Rom J Morphol Embryol 2014; 55(2 Suppl): 507–512.
- Murthy R.K., Haji S., Sambhav K., Grover S., Chalam K.V. Clinical applications of spectral domain optical coherence tomography in retinal diseases. Biomed J 2016; 39(2): 107–120, https://doi.org/10.1016/j.bj.2016.04.003.
- Zhang Y., Chen Y., Yu Y., Xue X., Tuchin V.V., Zhu D. Visible and near-infrared spectroscopy for distinguishing malignant tumor tissue from benign tumor and normal breast tissues in vitro. J Biomed Opt 2013; 18(7): 077003, https://doi.org/10.1117 /1.jbo.18.7.077003.
- Böhringer H.J., Boller D., Leppert J., Knopp U., Lankenau E., Reusche E., Hüttmann G., Giese A. Time-domain and spectral-domain optical coherence tomography in the analysis of brain tumor tissue. Lasers Surg Med 2006; 38(6): 588–597, https://doi.org/10.1002/lsm.20353.
- Böhringer H.J., Lankenau E., Stellmacher F., Reusche E., Hüttmann G., Giese A. Imaging of human brain tumor tissue by near-infrared laser coherence tomography. Acta Neurochir (Wien) 2009; 151(5): 507–517, https://doi.org/10.1007/s00701-009-0248-y.
- Kut C., Chaichana K.L., Xi J., Raza S.M., Ye X., McVeigh E.R., Rodriguez F.J., Quiñones-Hinojosa A., Li X. Detection of human brain cancer infiltration ex vivo and in vivo using quantitative optical coherence tomography. Science Translational Medicine 2015; 7: 292ra100, https://doi.org/10.1126/scitranslmed.3010611.
- Sanai N., Berger M.S. Glioma extent of resection and its impact on patient outcome. Neurosurgery 2008; 62(4): 753–764, https://doi.org/10.1227/01.neu.0000318159.21731.cf .
- Sanai N., Polley M.Y., McDermott M.W., Parsa A.T., Berger M.S. An extent of resection threshold for newly diagnosed glioblastomas. J Neurosurg 2011; 115(1): 3–8, https://doi.org/10.3171/2011.2.jns10998.
- Анохина Ю.Е., Гайдар Б.В., Мартынов Б.В., Свистов Д.В., Папаян Г.В., Григорьевский Д.И. Прогностическая значимость объема хирургического вмешательства в условиях применения интраоперационной флуоресцентной диагностики у пациентов со злокачественными глиомами головного мозга. Вестник российской военно-медицинской академии 2014; 1(45): 19–24.
- Bizheva K., Unterhuber A., Hermann B., Povazay B., Sattmann H., Fercher A.F., Drexler W., Preusser M., Budka H., Stingl A., Le T. Imaging ex vivo healthy and pathological human brain tissue with ultra-high-resolution optical coherence tomography. J Biomed Opt 2005; 10(1): 11006, https://doi.org/10.1117/1.1851513.
- Kantelhardt S.R., Finke M., Schweikard A., Giese A. Evaluation of a completely robotized neurosurgical operating microscope. Neurosurgery 2013; 72: A19–A26, https://doi.org/10.1227/NEU.0b013e31827235f8.
- Finke M., Kantelhardt S., Schlaefer A., Bruder R., Lankenau E., Giese A., Schweikard A. Automatic scanning of large tissue areas in neurosurgery using optical coherence tomography. Int J Med Robot 2012; 8(3): 327–336, https://doi.org/10.1002/rcs.1425.
- Lankenau E., Klinger D., Winter C., Malik A., Müller H.H., Oelckers S., Pau H.-W., Just T., Hüttmann G. Combining optical coherence tomography (OCT) with an operating microscope. In: Advances in medical engineering. Vol 114. Springer Berlin Heidelberg; 2007; p. 343–348, https://doi.org/10.1007/978-3-540-68764-1_57.
- Nakaji H., Kouyama N., Muragaki Y., Kawakami Y., Iseki H. Localization of nerve fiber bundles by polarization-sensitive optical coherence tomography. J Neurosci Methods 2008; 174(1): 82–90, https://doi.org/10.1016/j.jneumeth.2008.07.004.
- de Boer J.F., Srinivas S.M., Park B.H., Pham T.H., Zhongping C., Milner T.E., Nelson J.S. Polarization effects in optical coherence tomography of various biological tissues. IEEE J Sel Top Quantum Electron 1999; 5(4): 1200–1204, https://doi.org/10.1109/2944.796347.
- Kuranov R., Sapozhnikova V., Turchin I., Zagainova E., Gelikonov V., Kamensky V., Snopova L., Prodanetz N. Complementary use of cross-polarization and standard OCT for differential diagnosis of pathological tissues. Opt Express 2002; 10(15): 707–713, https://doi.org/10.1364/oe.10.000707.
- Chen W., Wang D., Du X., He Y., Chen S., Shao Q., Ma C., Huang B., Chen A., Zhao P., Qu X., Li X. Glioma cells escaped from cytotoxicity of temozolomide and vincristine by communicating with human astrocytes. Med Oncol 2015; 32(3): 43, https://doi.org/10.1007/s12032-015-0487-0.
- Wang H., Akkin T., Magnain C., Wang R., Dubb J., Kostis W.J., Yaseen M.A., Cramer A., Sakadžić S., Boas D. Polarization sensitive optical coherence microscopy for brain imaging. Opt Lett 2016; 41(10): 2213–2216, https://doi.org/10.1364/ol.41.002213.
- Gladkova N., Kiseleva E., Robakidze N., Balalaeva I., Karabut M., Gubarkova E., Feldchtein F. Evaluation of oral mucosa collagen condition with cross-polarization optical coherence tomography. J Biophotonics 2013; 6(4): 321–329, https://doi.org/10.1002/jbio.201200059.
- Gladkova N., Kiseleva E., Streltsova O., Prodanets N., Snopova L., Karabut M., Gubarkova E., Zagaynova E. Combined use of fluorescence cystoscopy and cross-polarization OCT for diagnosis of bladder cancer and correlation with immunohistochemical markers. J Biophotonics 2013; 6(9): 687–698. https://doi.org/10.1002/jbio.201200105.
- Gubarkova E.V., Dudenkova V.V., Feldchtein F.I., Timofeeva L.B., Kiseleva E.B., Kuznetsov S.S., Shakhov B.E., Moiseev A.A., Gelikonov V.M., Gelikonov G.V., Vitkin A., Gladkova N.D. Multi-modal optical imaging characterization of atherosclerotic plaques. J Biophotonics 2015, https://doi.org/10.1002/jbio.201500223.
- Gelikonov V.M., Gelikonov G.V., Shilyagin P.A. Linear-wavenumber spectrometer for high-speed spectral-domain optical coherence tomography. Optics and Spectroscopy 2009; 106(3): 459–465, https://doi.org/10.1134/s0030400x09030242.
- Moiseev A.A., Gelikonov G.V., Terpelov D.A., Shilyagin P.A., Gelikonov V.M. Noniterative method of reconstruction optical coherence tomography images with improved lateral resolution in semitransparent media. Laser Physics Letters 2013; 10(12): 125601, https://doi.org/10.1088/1612-2011/10/12/125601.
- Yashin К.S., Karabut M.M., Fedoseeva V.V., Khalansky A.S., Matveev L.A., Elagin V.V., Kuznetsov S.S., Kiseleva E.B., Kravets L.Y., Medyanik I.А., Gladkova N.D. Multimodal optical coherence tomography in visualization of brain tissue structure at glioblastoma (experimental study). Sovremennye tehnologii v medicine 2016; 8(1): 73–81. https://doi.org/10.17691/stm2016.8.1.10.
- Тучин В.В. Лазеры и волоконная оптика в биомедицинских исследованиях. М: ФИЗМАТЛИТ; 2010; 488 c.
- Angiogenesis. In: Brain tumor pathology: current diagnostic hotspots and pitfalls. Springer Netherlands; 2006; p. 189–198, https://doi.org/10.1007/1-4020-3998-0_15.
- Bevilacqua F., Piguet D., Marquet P., Gross J.D., Tromberg B.J., Depeursinge C. In vivo local determination of tissue optical properties: applications to human brain. Appl Opt 1999; 38(22): 4939–4950, https://doi.org/10.1364/ao.38.004939.
- Amberger V.R., Hensel T., Ogata N., Schwab M.E. Spreading and migration of human glioma and rat C6 cells on central nervous system myelin in vitro is correlated with tumor malignancy and involves a metalloproteolytic activity. Cancer Res 1998; 58(1): 149–158.
- Alaminos M., Dávalos V., Ropero S., Setién F., Paz M.F., Herranz M., Fraga M.F., Mora J., Cheung N.K., Gerald W.L., Esteller M. EMP3, a myelin-related gene located in the critical 19q13.3 region, is epigenetically silenced and exhibits features of a candidate tumor suppressor in glioma and neuroblastoma. Cancer Res 2005; 65(7): 2565–2571, https://doi.org/10.1158/0008-5472.can-04-4283.
- Brat D.J., Perry A. Astrocytic and oligodendroglial tumor. In: Practical surgical neuropathology. New York: Churchill Livingstone; 2010; p. 63–102, https://doi.org/10.1016/b978-0-443-06982-6.00005-5.
- Rodriguez C.L., Szu J.I., Eberle M.M., Wang Y., Hsu M.S., Binder D.K., Park B.H. Decreased light attenuation in cerebral cortex during cerebral edema detected using optical coherence tomography. Neurophotonics 2014; 1(2): 025004, https://doi.org/10.1117/1.NPh.1.2.025004.
- Miller C.R., Perry A. Glioblastoma. Arch Pathol Lab Med 2007; 131(3): 397–406.