Определение диапазона неинвазивного воздействия фемтосекундными лазерными импульсами ближнего инфракрасного спектра для нанохирургии ооцитов млекопитающих
Цель исследования — определить интервал неинвазивного воздействия фемтосекундных лазерных импульсов ближнего инфракрасного диапазона для внутриклеточной нанохирургии ооцитов млекопитающих и оценить способность ооцитов к дальнейшему развитию in vitro в зависимости от энергии импульса и суммарной дозы падающего излучения.
Материалы и методы. В работе использовали преовуляторные ооциты мыши на стадии зародышевого пузырька. Воздействие осуществляли излучением фемтосекундного лазера с длиной волны 780 нм в двух режимах: 1) одиночный импульс длительностью 30 фс, энергия импульса — 100 нДж; 2) цуги фемтосекундных импульсов длительностью 100 фс, частота следования импульсов — 80 МГц (время между импульсами — 12,5 нс), энергия импульса — 0,5–2 нДж, длительность всего цуга составляла от 15 до 60 мс. Излучение фокусировали объективом микроскопа ×60 с числовой апертурой 0,7. Ооциты культивировали до стадии метафазы второго деления мейоза, достижение этой стадии использовали в качестве показателя инвазивности воздействия. Данную стадию определяли по образованию направительного тельца и метафазной пластинки.
Результаты. Определен порог инвазивности для режима облучения одиночными фемтосекундными импульсами. В режиме работы 30 фс, 100 нДж происходит разрыв цитоплазматической мембраны и разрушение клетки.
Воздействие на цитоплазму и ядро ооцитов цугами фемтосекундных импульсов не приводит к повреждению образцов. Измерена частота образования парогазовых пузырьков после воздействия лазерным излучением на цитоплазму и хроматин ядра. Энергия импульса 1 нДж является порогом образования пузырьков в цитоплазме, 2 нДж — в ядре. Воздействие в режиме фемтосекундных импульсов длительностью 100 фс с частотой повторения 80 МГц в исследованном диапазоне энергий импульса и длительностей цуга не влияет на способность ооцитов к развитию до стадии метафазы II.
Заключение. В диапазоне энергии импульса, не более чем в два раза превышающей энергию порога образования парогазовых пузырьков, и суммарной экспозиции воздействия фемтосекундная лазерная нанохирургия может рассматриваться как малоинвазивный метод внутриклеточной хирургии.
Нанохирургические операции клеток и эмбрионов с использованием фемтосекундных лазеров с длиной волны генерации в ближнем инфракрасном диапазоне — актуальное направление современной биофотоники. Ближний инфракрасный диапазон находится в области прозрачности биоткани: его не поглощает ни вода, ни органические вещества клетки (белки, липиды, нуклеиновые кислоты, углеводы) [1]. Высокая локализация воздействия фемтосекундного импульса в области перетяжки лазерного пучка (в объеме порядка десяти фемтолитров) позволяет проводить операции внутри клетки/эмбриона на отдельных органеллах, не затрагивая окружающую среду клетки и не повреждая внешнюю мембрану [1–3]. Нелинейно-оптическое поглощение энергии лазерного импульса веществом клетки достигается при относительно низких энергиях фемтосекундного импульса, так как высокая плотность мощности света, необходимая для нелинейно-оптического взаимодействия, обеспечивается за счет малой длительности импульса и острой фокусировки объективом микроскопа. Низкая энергия импульса позволяет избежать значительного теплового стресса. Таким образом, сфокусированный фемтосекундный лазер может использоваться как уникальный скальпель, позволяющий с субмикронной точностью проводить операции внутри клетки/эмбриона, не повреждая при этом внешних мембран объекта [1–4].
Поглощение энергии фемтосекундного лазерного импульса сопровождается ионизацией и диссоциацией молекул вещества клетки, что может вызывать образование токсичных для клетки продуктов [4]. Также поглощение фемтосекундного лазерного импульса приводит к генерации в веществе акустических или ударных волн, распространяющихся из области перетяжки лазерного пучка, которые могут вызывать кавитацию — образование полых пузырьков в жидкой среде. При высокой интенсивности лазерного излучения на частоте 80 МГц в фокальной области может происходить сильный нагрев жидкости, приводящий к ее кипению и образованию парогазовых пузырьков. Свыше определенного уровня энергии лазерного импульса данные процессы могут приводить к повреждениям структуры клетки. Влияние таких неблагоприятных факторов на жизнедеятельность и способность к развитию клетки или эмбриона мало изучено.
Цель исследования — определить интервал неинвазивного воздействия фемтосекундных лазерных импульсов ближнего инфракрасного диапазона, остросфокусированных в цитоплазму или в хроматин зародышевого пузырька ооцитов млекопитающих,оценить способность ооцитов к дальнейшему развитию in vitro в зависимости от энергии импульса и суммарной дозы падающего излучения.
Материалы и методы. В качестве модельной системы служат преовуляторные ооциты мыши, выделенные на стадии зародышевого пузырька.
Подготовка ооцитов. Для получения ооцитов использовали самок мышей гибридной линии F1 (CBA/C57Bl) в возрасте от 1,5 до 2,5 мес. Протокол выделения ооцитов описан в работе [3].
Работа проведена в полном соответствии с этическими принципами, установленными Европейской конвенцией по защите позвоночных животных, используемых для экспериментальных и других научных целей (принятой в Страсбурге 18.03.1986 г. и подтвержденной в Страсбурге 15.06.2006 г.), и одобрена Этическим комитетом Института химической физики им. Н.Н. Семенова Российской академии наук.
Очищенные от кумулюсных клеток ооциты помещали в каплю среды М2 (M7167; Sigma-Aldrich, США) объемом 50 мкл на покровном стекле. Также готовилась контрольная группа ооцитов (без лазерного воздействия). Время, затрачиваемое на манипуляции с образцом при облучении лазером, не превышало 1 мин. После проведения манипуляций ооциты отмывали в среде М2, культивировали в CO2-инкубаторе (5% СО2, 37оС) в среде для in vitro созревания. Среду готовили на основе среды DMEM (C420; «ПанЭко», Россия), добавляя туда 15% фетальной бычьей сыворотки (I31966-021; Gibco, США), антибиотик гентамицин (G1272; Sigma-Aldrich, США) в концентрации 1,5 МЕ/мл и гормон PMSG — 1 МЕ/мл (A036A02; Intervet, Германия) [5]. Наблюдение за развитием проводили на следующий день, через 18 ч после операции.
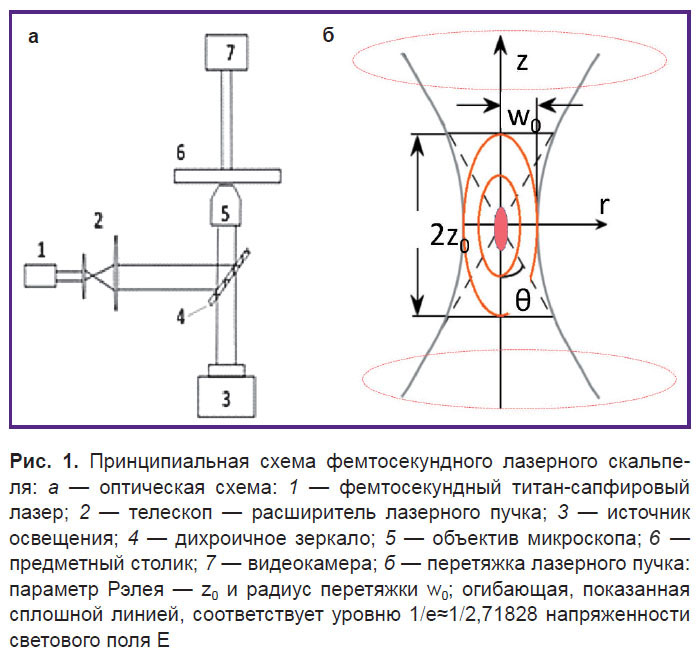
Схема установки. Воздействие осуществляли излучением фемтосекундного лазера с длиной волны 780 нм в двух режимах: 1) одиночный импульс длительностью 30 фс, энергия импульса 100 нДж; 2) цуги фемтосекундных импульсов длительностью 100 фс, частота следования импульсов — 80 МГц (время между импульсами — 12,5 нс), энергия импульса — 0,5–2 нДж; длительность всего цуга составляла от 15 до 60 мс. Принципиальная схема фемтосекундного лазерного скальпеля представлена на рис. 1. Подробно схема установки описана ранее [3].
Излучение лазера фокусировали объективом ×60 с числовой апертурой NA=0,7. Параметры пятна в фокальной плоскости: перетяжка лазерного пучка w0=0,61l/NA=0,68 мкм; параметр Рэлея z0=kw20/2=1,86 мкм (k=2p/l0 — волновое число). Энергию лазерных импульсов варьировали с помощью поляризационного аттенюатора. Дозу излучения лазера 80 МГц меняли путем изменения длительности цуга импульсов при открывании механического прерывателя лазерного пучка. Излучение фемтосекундного лазера фокусировали либо в случайно выбранную точку цитоплазмы, либо в область хроматина в зародышевом пузырьке (ядре). На каждую пару параметров воздействия (длительность цуга импульсов и энергия одного импульса) приходилось по 10 ооцитов. Лазерное воздействие на объект повторяли пятикратно, таким образом, на 10 образцов приходилось 50 цугов импульсов, а суммарная экспозиция воздействия равнялась 5 цугам. При повторном воздействии пятно фокусировки перемещали по цитоплазме или ядру ооцита случайным образом. Изменение морфологии объекта после лазерного воздействия регистрировали в формате видеофайла с помощью камеры DCC1545M (Thorlabs, США).
Локализация флюоресценции. Выделение полярных телец, свидетельствующих о завершении созревания ооцита, и образование метафазных пластинок выявляли методами светлого поля и флюоресцентной микроскопии. Ооциты окрашивали флюоресцентным красителем Hoechst 33342 (B2261; Sigma-Aldrich, США), который связывается с ДНК. Изображения получали при помощи микроскопа «Биомед 4 ПР ЛЮМ» («Биомед», Россия) и камеры Ximea xiD MD061CU-SY (Ximea, Словакия).
Статистическая обработка данных. Для оценки достоверности различия между опытными и контрольной группами использовали точный критерий Фишера, который наилучшим образом подходит для небольших выборок и не приближенно оценивает вероятность, а точно ее рассчитывает.
Результаты. При воздействии лазерным импульсом на ядро (рис. 2) или цитоплазму (рис. 3) могут образовываться парогазовые и кавитационные пузырьки. Образование пузырька носит случайный характер. Частота образования пузырька как функция энергии импульса и длительности цуга импульсов при использовании лазера с частотой следования импульсов 80 МГц представлена в табл. 1. Различные области ооцита — ядро и цитоплазма — обладают различным порогом образования парогазового пузырька. Было подсчитано, сколько парогазовых пузырьков образуется на эти 50 цугов импульсов при воздействии в ядро и цитоплазму. Оказалось, что в цитоплазме при тех же параметрах воздействия вероятность образования парогазовых пузырьков существенно выше.
| Рис. 3. Кадры из видеозаписей с образованием парогазовых пузырьков при фокусировке лазера в цитоплазму: А1 — энергия импульса 0,5 нДж, длительность цуга импульсов 15 мс; А2 — 0,5 нДж, 30 мс; А3 — 0,5 нДж, 60 мс; Б1 — 1 нДж, 15 мс; Б2 — 1 нДж, 30 мс; Б3 — 1 нДж, 60 мс; В1 — 2 нДж, 15 мс; В2 — 2 нДж, 30 мс; В3 — 2 нДж, 60 мс |
|
|
Воздействие на цитоплазму или ядро одиночным импульсом более 100 нДж приводит к генерации скачка давления в центре лазерной перетяжки, волна давления достигает плазматической мембраны клетки и разрывает ее. Наблюдается вытекание цитоплазмы (рис. 4). Разрыв мембраны, индуцированный интенсивным лазерным импульсом внутри ооцита, приводит к гибели клетки и далее рассматриваться не будет.
После фемтосекундного лазерного воздействия цугами импульсов 80 МГц ооциты способны к развитию in vitro до стадии метафазы II. Образование полярного тельца регистрировали через 18 ч культивирования. Критерием достижения стадии метафазы II являлись отделение полярного тельца и образование метафазной пластинки, присутствие которых регистрировали по флюоресценции красителя Hoechst 33342 (рис. 5). В каждой группе производили подсчет ооцитов, достигших стадии метафазы II (табл. 2). Точный тест Фишера не обнаружил статистически значимого различия значений между опытными и контрольной группами в способности к достижению метафазы II (р=0,05).
|
|
| Таблица 2. Развитие преовуляторных ооцитов до стадии метафазы II после фемтосекундного лазерного воздействия в различные области клетки: ядро и цитоплазму |
Обсуждение. Парогазовый пузырек образуется в области фокусировки лазерного пятна внутри ооцита, т.е. в области максимальной интенсивности лазерного излучения. Отсутствие выраженной зависимости вероятности образования пузырька от длительности цуга импульсов при постоянной энергии импульса указывает на то, что при действии последовательности импульсов накопление центров окраски, способных поглощать излучение на длине волны 780 нм, несущественно в условиях проведенных опытов [1–4]. Исходя из данных табл. 1, порог образования пузырьков (вероятность события близка к 50%) в цитоплазме ниже, чем в ядре. В цитоплазме порог образования пузырька близок к энергии импульса 1 нДж, в ядре этот порог близок к 2 нДж. Понижение порога может быть обусловлено либо более низким потенциалом ионизации вещества цитоплазмы, либо высокой концентрацией различных органелл в цитоплазме.
Органеллы цитоплазмы можно рассматривать как диэлектрические шарики с диаметром от 1 до 5 мкм в воде. В ближнем поле органелл происходит усиление интенсивности электромагнитного поля лазерного импульса. Используя нашу методику расчета интенсивности напряженности поля [6, 7], получили оценку коэффициента усиления интенсивности поля, который оказался близок 5, а размер зоны ближнего поля — менее 0,5 мкм. Усиление интенсивности в ближнем поле органелл может способствовать пробою цитоплазмы сфокусированным лазерным импульсом с образованием пузырька. При энергиях фемтосекундного импульса от 0,5 до 2 нДж интенсивность лазерного света в перетяжке составляет от 3,4∙1011 до 13,6∙1011 Вт/см2 соответственно. Порог образования пузырьков в цитоплазме близок к плотности мощности 6∙1011 Вт/см2. Порог пробоя воды фемтосекундным импульсом лежит в диапазоне от 6,6 до 9,0∙1012 Вт/см2 [8], т.е. на порядок выше, чем наблюдается в данной работе.
Длина волны 780 нм, которая используется в нашей работе, находится в области прозрачности биологической ткани, линейное поглощение ооцитом света в этом диапазоне пренебрежимо мало [1–4]. Поглощение энергии фемтосекундных импульсов, приводящее к образованию кавитационного пузырька, обусловлено нелинейными оптическими эффектами. В области пузырька может происходить фотоионизация вещества ооцита и образование плазмы низкой плотности [4]. При ионизации органических молекул ооцита должны образовываться радикалы и электроны. Эти промежуточные вещества реагируют с кислородом, и конечным продуктом являются молекулы активных форм кислорода (АФК) [1, 4].
Образование молекул АФК происходит в объеме ионизации, который соответствует объему перетяжки лазерного пучка, и оценивается как 5,4∙10–12 см3. Объем ооцита при диаметре 70 мкм составляет примерно 1,8∙10–7 см3, концентрация ионизированных молекул в объеме перетяжки — 1020 см–3. Чтобы подсчитать среднюю концентрацию АФК после единичного импульса по ооциту, нужно объем перетяжки умножить на концентрацию ионов в перетяжке и поделить на объем ооцита. Таким образом, средняя концентрация АФК на ооцит получается 1,6∙10–6 М. Отсутствие достоверного различия между опытными и контрольной группами в способности к достижению метафазы II (р>0,05) после лазерного воздействия указывает на то, что образование молекул АФК после пятикратного воздействия на ооцит не понижает его способности к созреванию до метафазы II.
Таким образом, фемтосекундное лазерное излучение ближнего инфракрасного диапазона 780 нм в окне прозрачности биологической ткани позволяет проводить микрохирургические операции внутри ооцита без разрушения цитоплазматической мембраны и блестящей оболочки. Разрезание материала клетки фемтосекундным лазером с частотой следования импульсов 80 МГц сопровождается образованием кавитационных и парогазовых пузырьков. Порог образования пузырьков при фокусировке в цитоплазму близок 6∙1011 Вт/см2, при фокусировке в хроматин ядра — приблизительно в два раза выше. Воздействие на материал клетки цугами импульсов длительностью до 60 мс с энергией импульса ниже порога образования пузырька не связано с формированием центров окраски в клетке. Проведение операций в таких условиях не сказывается на развитии ооцита до стадии метафазы II.
Заключение. Определен интервал неинвазивного воздействия фемтосекундных лазерных импульсов ближнего инфракрасного диапазона. Использование одиночных фемтосекундных импульсов исследуемой энергии приводит к разрушению образца. Воздействие цугами фемтосекундных импульсов не влияет на целостность ооцитов и способность к дальнейшему развитию in vitro. В исследованном диапазоне энергии импульса и суммарной экспозиции воздействия фемтосекундная лазерная нанохирургия может рассматриваться как малоинвазивный метод внутриклеточной хирургии.
Финансирование исследования. Работа поддержана субсидией Министерства образования и науки, соглашение 14.604.21.0058 (уникальный номер-идентификатор RFMEFI60414X0058).
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Литература
- Надточенко В.А., Мельников М.Я. Лазерная нанохирургия клеток и эмбрионов. В кн.: Синтез, строение и свойства металл/полупроводник содержащих наноструктурированных композитов. Под ред. Трахтенберг Л.И., Мельникова М.Я. M: Техносфера; 2016; с. 441–473.
- Nuzzo V., Maxwell I., Chung S., Mazur E., Heisterkamp A. Subcellular surgery and nanoneurosurgery using femtosecond laser pulses. In: Biophotonics: spectroscopy, imaging, sensing, and manipulation. DiBartolo B., Collins J. (editors). Springer; 2011; p. 203–218, https://doi.org/10.1007/978-90-481-9977-8_9.
- Osychenko A.A., Zalesskii A.D., Krivokharchenko A.S., Zhakhbazyan A.K., Ryabova A.V., Nadtochenko V.A. Fusion of blastomeres in mouse embryos under the action of femtosecond laser radiation.
Efficiency of blastocyst formation and embryo development. Quantum Electronics 2015; 45(5): 498–502, https://doi.org/10.1070/qe2015v045n05abeh015767. - Vogel A., Noack J., Hüttman G., Paltauf G. Mechanisms of femtosecond laser nanosurgery of cells and tissues. Applied Physics B 2005; 81(8): 1015–1047, https://doi.org/10.1007/s00340-005-2036-6.
- Shishova K.V., Khodarovich Y.M., Lavrentyeva E.A., Zatsepina O.V. High-resolution microscopy of active ribosomal genes and key members of the rRNA processing machinery inside nucleolus-like bodies of
fully-grown mouse oocytes. Experimental Cell Research 2015; 337(2): 208–218, https://doi.org/10.1016/j.yexcr.2015.07.024. - Shakhov A.M., Astafiev A.A., Plutenko D.O., Sarkisov O.M., Shushin A.I., Nadtochenko V.A. Femtosecond optical
trap-assisted nanopatterning through microspheres by a singleTi:Sapphire oscillator. The Journal of Physical Chemistry C 2015; 119(22): 12562–12571, https://doi.org/10.1021/acs.jpcc.5b00478. - Astaf’ev A.A., Shakhov A.M., Sarkisov O.M., Nadtochenko V.A. Microstructuring of polymer films by femtosecond pulses through optically trapped polystyrene microspheres. Quantum Electronics 2013; 43(4): 361–364, https://doi.org/10.1070/qe2013v043n04abeh015114.
Sarpe C., Köhler J., Winkler T., Wollenhaupt M., Baumert T. Real-time observation of transient electron density in water irradiated with tailored femtosecond laser pulses. New Journal of Physics 2012; 14(7): 075021, https://doi.org/10.1088/1367-2630/14/7/075021.