Разработка молекулярно-генетического компонента микробиологического мониторинга внутрибольничных острых кишечных инфекций вирусной этиологии
Цель исследования — повышение эффективности микробиологического мониторинга путем его оптимизации и разработки молекулярно-генетического компонента на основании комплексного многолетнего наблюдения за внутрибольничными острыми кишечными инфекциями вирусной этиологии.
Материалы и методы. В рамках эпидемиологического надзора за внутрибольничными инфекциями вирусной этиологии в детском стационаре была внедрена синдромальная диагностика случаев острых кишечных инфекций — выявление и обследование пациентов с признаками дисфункции желудочно-кишечного тракта, не связанной с основным заболеванием. Выявление и дифференциацию ДНК (РНК) острых кишечных инфекций вирусной этиологии проводили методом ПЦР-диагностики. G[P]-типирование ротавирусов осуществляли методом ОТ-ПЦР с помощью различных праймеров. Генотипирование кишечных вирусов методом секвенирования выполняли путем определения соответствующих нуклеотидных последовательностей фрагментов кДНК для ротавирусов, норовирусов и астровирусов с использованием генетического анализатора Beckman Coulter. Нуклеотидные последовательности фрагментов кДНК анализировали с применением пакета программ BLAST для идентификации близкородственных штаммов и онлайн-сервиса для автоматического генотипирования норовирусов. Выравнивание нуклеотидных последовательностей и филогенетический анализ осуществляли с помощью программного обеспечения MEGA. Полученные в данном исследовании последовательности фрагментов генома представлены в международной базе данных GenBank.
Результаты. Разработан молекулярно-генетический компонент микробиологического мониторинга острых кишечных инфекций вирусной этиологии, включающий в себя не только диагностику кишечных возбудителей методом ПЦР, но и дальнейшее проведение различных видов генотипирования, а также филогенетический анализ для определения генетических характеристик возбудителей.
Актуальность изучения различных аспектов проблемы острых кишечных инфекций (ОКИ) вирусной этиологии определяется широким повсеместным их распространением, полиэтиологичностью, разнообразием путей и факторов передачи, выраженной сезонностью, сохраняющейся тенденцией к росту заболеваемости, принимающей нередко групповой и вспышечный характер, особенно среди детского населения [1–6]. Вспышки ОКИ вирусной этиологии могут регистрироваться также в условиях различных медицинских учреждений как инфекционного, так и неинфекционного профиля [1, 3, 7, 8]. Такая ситуация требует проведения эффективного эпидемиологического расследования с целью выявления взаимосвязи различных заболеваний, определения источника возбудителя инфекции, путей передачи и, что особенно важно, установления наличия или отсутствия внутрибольничных случаев инфекций, связанных с оказанием медицинской помощи (ИСМП).
Существующая в России система эпидемиологического надзора за ОКИ вирусной этиологии позволяет оценивать эпидемиологическую обстановку, а также научно обосновывать, планировать и корректировать меры контроля. Данная система является открытой и развивающейся структурой, что обеспечивает возможность введения новых параметров и компонентов, тем самым совершенствуя ее. Особенно это актуально в связи с развитием молекулярно-генетических методов исследований.
Существующий молекулярно-биологический компонент микробиологического мониторинга ОКИ вирусной этиологии в полной мере не раскрывает применение различных видов генотипирования, филогенетического анализа для определения генетических характеристик возбудителей и, соответственно, не обеспечивает определения условий возникновения инфекций в медицинском учреждении.
Цель исследования — повышение эффективности микробиологического мониторинга путем его оптимизации и разработки молекулярно-генетического компонента на основании комплексного многолетнего наблюдения за внутрибольничными острыми кишечными инфекциями вирусной этиологии.
Материалы и методы. Клинической базой исследования являлась многопрофильная Нижегородская областная детская клиническая больница. На первом этапе работы в рамках эпидемиологического надзора за внутрибольничными инфекциями вирусной этиологии в данном неинфекционном детском стационаре была внедрена синдромальная диагностика случаев ОКИ по разработанному алгоритму, который включал выявление и обследование на широкий спектр возбудителей ОКИ всех пациентов с признаками дисфункции желудочно-кишечного тракта, не связанной с основным заболеванием. Кроме этого, обследовались лица, контактировавшие с пациентами с указанным синдромом или с подтвержденным диагнозом ОКИ. В рамках микробиологического мониторинга осуществляли исследование смывов с объектов окружающей (внешней) среды отделений, где были случаи ОКИ.
На базе проблемной научной лаборатории ПЦР-исследований НИИ профилактической медицины Нижегородской государственной медицинской академии методом ПЦР в режиме реального времени проведено дифференциальное выявление с анализом их ДНК (РНК) ротавирусов группы А, норовирусов, астровирусов, энтеровирусов и аденовирусов группы F с использованием набора «АмплиСенс® ОКИ скрин-FL» (ЦНИИЭМ, Москва). За период 2013–2014 гг. исследовано 178 образцов фекалий и 23 смыва окружающей среды стационара. Выполнено 1038 исследований.
Работа проведена в соответствии с Хельсинкской декларацией, принятой в июне 1964 г. (Хельсинки, Финляндия) и пересмотренной в октябре 2000 г. (Эдинбург, Шотландия), и одобрена Этическим комитетом Нижегородской государственной медицинской академии. От родителей пациентов получено информированное согласие.
На втором этапе работы выполнено генотипирование 132 обнаруженных возбудителей вирусных ОКИ. Исследование проводили в лаборатории молекулярной эпидемиологии вирусных инфекций Нижегородского научно-исследовательского института эпидемиологии и микробиологии им. академика И.Н. Блохиной (Н. Новгород). G[P]-типирование ротавирусов осуществляли методом ОТ-ПЦР с помощью праймеров для идентификации типов G1, G2, G3, G4, G9 и P[4], P[6], P[8], P[9] [9]. Генотипирование кишечных вирусов методом секвенирования проводили путем определения соответствующих нуклеотидных последовательностей фрагментов кДНК ротавирусов, норовирусов и астровирусов с использованием генетического анализатора Beckman Coulter (Beckman Coulter, США) [10–13]. Анализ нуклеотидных последовательностей выполняли с применением пакета программ BLAST для идентификации близкородственных штаммов и онлайн-сервиса для автоматического генотипирования норовирусов Norovirus Genotyping Tool Version 1.0.
На третьем этапе работы на основе выровненных нуклеотидных последовательностей осуществляли филогенетический анализ с помощью программного обеспечения MEGA. Для сравнения использовали нуклеотидные последовательности генома кишечных вирусов, имеющиеся в международной базе данных GenBank (США). Филограммы были построены методом присоединения соседей (neighbor-joining method) на основе двупараметрической модели Kimura. Достоверность топологии филограмм оценивали с помощью бутстреп-анализа с использованием 1000 случайных выборок. Полученные в данном исследовании последовательности фрагментов генома представлены в международной базе данных GenBank под номерами KP208780, KP208781 (астровирусы), KP208782–KP208785, KR020053 (норовирусы), KR020054 (ротавирусы). Результаты работы подвергали статистической обработке по общепринятой методике методами вариационной статистики [14].
На завершающем этапе были проведены эпидемиологическая диагностика эпидемической обстановки в детском многопрофильном стационаре на основе данных расследования случаев инфекции, микробиологического мониторинга, включая молекулярно-генетические исследования, и сопоставление полученных результатов с данными эпидемиологического надзора за ОКИ вирусной этиологии на территории региона.
Результаты и обсуждение. На первом этапе исследования установлено, что среди обследованных пациентов с синдромом дисфункции желудочно-кишечного тракта, не связанной с основным заболеванием, вирусы кишечной группы обнаружены в 43,8% случаев (95% ДИ 40,1–47,5) [4]. Среди лиц, инфицированных кишечными вирусами, моноинфекция выявлена у 72% пациентов, микст-инфекция — у 28% (p=0,007). В вирусных ассоциациях преобладали ротавирусная и норовирусная инфекции (92,1%). Таким образом, в условиях детского клинического стационара вирусная ОКИ встречалась почти у каждого второго ребенка, имеющего признаки дисфункции желудочно-кишечного тракта, не связанной с основным заболеванием.
При анализе ОКИ по этиологическому фактору в 2013 г. установлено преобладание норовирусной инфекции — 73,2% (95% ДИ 69,9–76,5) обследованных с моноинфекцией (p=0,045). Ротавирусная инфекция занимала второе место, и ее удельный вес составлял 23,2% (95% ДИ 20,0–26,4). Астровирусная и аденовирусная инфекции составляли по 1,8% (95% ДИ 0,9–2,7) случаев (рис. 1).

|
Рис. 1. Этиологическая структура острой кишечной инфекции вирусной этиологии у пациентов детского многопрофильного неинфекционного стационара |
С целью выявления масштаба контаминации кишечными вирусами помещений клиники проведено исследование объектов буфета, палат для пациентов, медицинского поста, санитарной комнаты и туалетов, входящих в состав одного из отделений стационара. Отобраны смывы с выключателей, ручек дверей, поверхностей столов, тумбочек, кроватей. Кишечные вирусы обнаружены в 47,8% (95% ДИ 37,4–58,2) смывов: 39,1% смывов взяты в больничных палатах и 8,7% — в туалетах. В 39,1% образцов (95% ДИ 24,4–53,8) выявлено наличие моноинфекции: норовирусы составили 26,1%, а ротавирусы — 13,0%. Очевидно, что при наличии устойчивости кишечных вирусов в окружающей среде контаминированные объекты могут явиться одним из постоянно действующих факторов передачи ОКИ в условиях стационара. Данный факт требует коррекции профилактических и противоэпидемических мероприятий, а также осуществления мониторинга окружающей среды стационара на контаминацию вирусами.
На следующем этапе работы был проведен филогенетический анализ установленных нуклеотидных последовательностей фрагментов генома кишечных вирусов.
Генотипирование ротавирусов методами ОТ-ПЦР и секвенирования выявило наличие генотипов G4P[8] в 30,0% и G1P[8] — в 70,0% случаев. В период проведения данного исследования на территории Н. Новгорода встречались ротавирусы вида А, относящиеся к пяти G-типам (G1, G2, G3, G4, G9) и четырем Р-типам (Р[4], Р[6], Р[8], Р[9]). Доминирующим был генотип G4P[8] — 40,3%. Данные о циркуляции кишечных вирусов на территории Н. Новгорода позволяют предположить, что случаи регистрации ротавирусов генотипа G4P[8] у пациентов обусловлены неоднократным заносом в стационар.
Ротавирус генотипа G1P[8] выявлен у 70% пациентов стационара. Филогенетический анализ показал инфицирование одним вариантом ротавируса, относящимся к линии G1-I. Гомология составляла 99,9–100% (рис. 2). На территории Н. Новгорода он выявлялся в 12,1% случаев [15], но циркулировали в основном представители линии G1-II. Результаты, полученные в нашем исследовании, свидетельствуют об устойчивой циркуляции во внутрибольничных условиях ротавируса генотипа G1-I.
Таким образом, по данными эпидемиологического расследования случаев инфекций, изучения генетической характеристики возбудителей, а также сопоставления с информацией о циркуляции кишечных вирусов на территории города установлено, что в условиях стационара у пациентов с ротавирусной инфекций 6 случаев можно классифицировать как занос инфекции, а 14 случаев отнести к ИСМП.
Генотипирование норовирусов выявило преобладание геногруппы GII. На генотипы норовируса GII.1 и GII.4 приходилось по 44,4% (95% ДИ 27,8–61,0), а на GII.3 — 11,1%. Обнаруженные норовирусы генотипа GII.1 были идентичны между собой по исследуемому участку генома и сходны с единственным изолятом норовируса данного генотипа, выявленным в период с 2006 по 2012 г. при спорадической заболеваемости на территории Н. Новгорода, а также с норовирусом, вызвавшим вспышку ОКИ в одном из учебных заведений города в сентябре 2012 г. (гомология — 99,9%) [5]. Выявленные в данном исследовании случаи явились результатом внутрибольничной передачи норовирусной инфекции после заноса возбудителя, циркулировавшего на территории.
Норовирусы GII.4 относились к геноварианту Sydney_2012, который был впервые обнаружен в Австралии в марте 2012 г. и в 2012–2013 гг. получил эпидемическое распространение в мире [16]. Однако, относясь к одному геноварианту, выявленные в данной работе изоляты GII.4 Sydney_2012 существенно отличались друг от друга по исследуемому участку генома (дивергенция составила 0,7–2,4%) и входили в отдельные кластеры при филогенетическом анализе нуклеотидных последовательностей (рис. 3). В связи с этим анализируемые случаи можно считать результатом независимых заносов норовируса GII.4 в медицинскую организацию, кроме того, требуются дополнительные исследования. Однако нельзя полностью исключить, что наблюдаемая дивергенция явилась результатом циркуляции в закрытом пространстве стационара.
Последовательность норовируса GII.3 при филогенетическом анализе отнесена к линии D по классификации J.E. Mahar c соавт. [17].
При генотипировании астровирусов установлено, что один изолят относится к генотипу 1, линии 1а, сублинии 1а-2010. Данный генотип является наиболее распространенным и обладает высоким уровнем генетической гетерогенности [6, 15]. Другой изолят относится к астровирусам генотипа 2, генетической линии 2с, которые характеризуются низкой циркуляцией в мире [6, 18] (рис. 4).
Принадлежность астровирусов, выявленных в двух эпизодах инфекции в стационаре, к различным генотипам в совокупности с данными эпидемиологического расследования позволяет квалифицировать их как случаи независимого заноса в стационар.
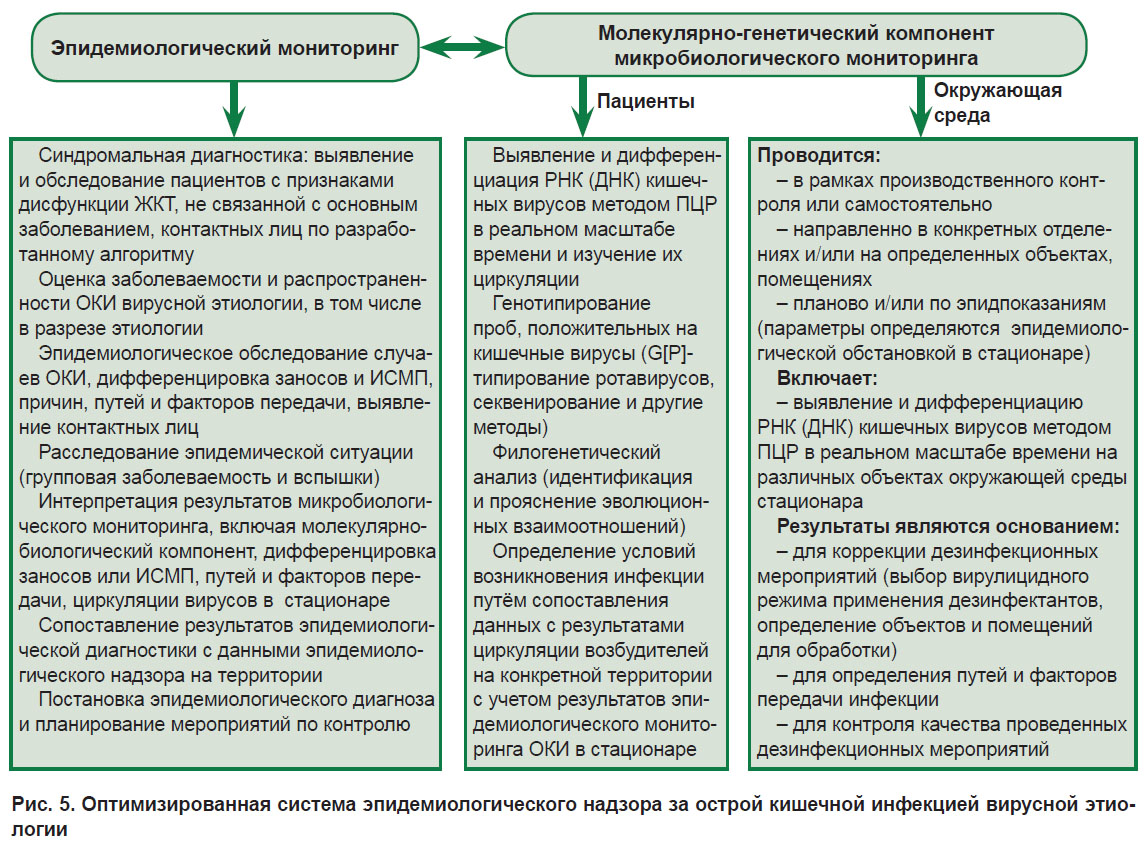
Полученные в данном исследовании результаты явились основанием для оптимизации компонентов системы эпидемиологического надзора за кишечными инфекциями вирусной этиологии в РФ, а именно эпидемиологического мониторинга. С учетом внедрения новых молекулярно-генетических технологий при осуществлении научного исследования особое внимание было уделено именно совершенствованию микробиологического компонента эпидемиологического надзора за ОКИ (рис. 5).
|
Рис. 5. Оптимизированная система эпидемиологического надзора за острой кишечной инфекцией вирусной этиологии |
Эпидемиологический мониторинг, направленный на эпидемиологическую диагностику ОКИ вирусной этиологии в детском многопрофильном неинфекционном стационаре, по нашему мнению, должен включать следующие компоненты:
1) синдромальную диагностику — выявление и обследование пациентов с признаками дисфункции желудочно-кишечного тракта, не связанной с основным заболеванием, а также контактирующих с ними лиц (другие пациенты, ухаживающие лица, медицинский персонал) по разработанному алгоритму;
2) оценку заболеваемости и распространенности ОКИ вирусной этиологии, в том числе и в разрезе этиологии;
3) эпидемиологическое обследование случаев ОКИ в стационаре с анализом условий возникновения инфекции (заносы или ИСМП), причин и условий, способствовавших их возникновению и распространению, а также путей и факторов передачи, контактных лиц;
4) расследование эпидемической ситуации (групповая заболеваемость и вспышки);
5) интерпретацию результатов микробиологического мониторинга, включая молекулярно-биологический компонент, уточнение условий возникновения случаев инфекции (занос или ИСМП), путей и факторов передачи возбудителя инфекции, особенностей циркуляции возбудителей в медицинской организации;
6) сопоставление результатов эпидемиологической диагностики с результатами эпидемиологического надзора на территории;
7) постановку эпидемиологического диагноза и планирование мероприятий по контролю распространения ОКИ.
Молекулярно-генетический компонент микробиологического мониторинга должен включать обследование пациентов и исследование внешней среды:
1) обследование пациентов:
— выявление и дифференциация РНК (ДНК) кишечных вирусов методом ПЦР в реальном масштабе времени и изучение их циркуляции;
— генотипирование положительных проб на кишечные вирусы (G[P]-типирование ротавирусов, секвенирование и другие методы);
— филогенетический анализ (идентификация и прояснение эволюционных взаимоотношений);
— определение условий возникновения инфекции путем сопоставления данных с результатами циркуляции возбудителей на конкретной территории (область, округ и т.д.) с учетом результатов эпидемиологического мониторинга ОКИ в медицинском учреждении;
2) исследование окружающей среды:
— выявление и дифференциация РНК (ДНК) кишечных вирусов методом ПЦР в реальном масштабе времени на различных объектах окружающей среды лечебно-профилактического учреждения.
Конкретные параметры исследования внешней среды в молекулярно-генетическом компоненте микробиологического мониторинга должны определяться эпидемиологической обстановкой в медицинском учреждении. Так, исследования внешней среды могут проводиться как в плановом порядке, так и по эпидемическим показаниям, осуществляться в комплексе с бактериологическими исследованиями в рамках производственного контроля или отдельно, быть направленными на конкретные отделения или на помещения и объекты внешней среды. Объем мероприятий, объекты исследования, а также режимы мониторинга выбираются в зависимости от эпидемиологической ситуации в медицинском учреждении.
Результаты исследования внешней среды на контаминацию кишечными вирусами являются основанием для коррекции дезинфекционных мероприятий: выбор вирулицидного режима применения дезинфицирующих средств, определение объектов и помещений для обработки. Кроме того, эти данные необходимы для выявления путей и факторов передачи инфекции.
Использовать результаты ПЦР-исследований внешней среды для контроля качества проведенных дезинфекционных мероприятий следует с осторожностью.
Выполнение исследований по идентификации кишечных вирусов методом ПЦР должно проводиться силами лабораторной службы медицинского учреждения. Осуществление генотипирования, а также филогенетический анализ и сопоставление результатов необходимо проводить на базе референс-центров (референс-лабораторий) по мониторингу за кишечными инфекциями и ИСМП или других научно-исследовательских организаций.
Таким образом, оптимизация эпидемиологического надзора за вирусными кишечными инфекциями путем модернизации молекулярно-генетического мониторинга позволяет значительно повысить эффективность выявления заболеваемости, контаминации окружающей среды, а также на основании генетических характеристик возбудителей и сопоставления данных о циркуляции кишечных вирусов на территории провести успешную дифференцировку случаев по условиям ее возникновения.
Заключение. С целью оптимизации микробиологического мониторинга острых кишечных инфекций разработан молекулярно-генетический компонент вирусной этиологии, включающий в себя не только диагностику кишечных возбудителей методом ПЦР, но и дальнейшее проведение различных видов генотипирования, а также осуществление филогенетического анализа для определения генетических характеристик возбудителей.
Финансирование исследования и конфликт интересов. Исследование не финансировалось какими-либо источниками, и конфликты интересов, связанные с данным исследованием, отсутствуют.
Литература
- Епифанова Н.В., Новикова Н.А., Ефимов Е.И., Парфенова О.В., Луковникова Л.Б., Фомина С.Г. Молекулярно-генетическая характеристика астровирусов, циркулирующих в Нижнем Новгороде. Журнал микробиологии, эпидемиологии и иммунобиологии 2012; 6: 32–36.
- Епифанова Н.В., Луковникова Л.Б., Новикова Н.А., Парфенова О.В., Фомина С.Г. Эпидемические варианты норовирусов генотипа GII.4 в Нижнем Новгороде в 2006–2012 гг. Журнал микробиологии, эпидемиологии и иммунобиологии 2014; 2: 64–72.
- Епифанова Н.В., Луковникова Л.Б., Голицына Л.Н., Фомина С.Г., Зверев В.В., Пономарёва Н.В., Парфенова О.В., Новиков Д.В., Волкова М.А., Новикова Н.А. Этиологическая структура вирусных кишечных инфекций у детей в Нижнем Новгороде. Медицинский альманах 2010; 2(11): 233–236.
- Сергеева А.В., Послова Л.Ю., Ковалишена О.В., Благонравова А.С., Епифанова Н.В., Сашина Т.А., Морозова О.В., Новикова Н.А. Молекулярно-генетический мониторинг острых кишечных инфекций вирусной этиологии в детском многопрофильном стационаре. Инфекция и иммунитет 2015; 5(3): 243–252.
- Kageyama T., Kojima S., Shinohara M., Uchida K., Fukushi S., Hoshino F.B., Takeda N., Katayama K. Broadly reactive and highly sensitive assay for Norwalk-like viruses based on real-time quantitative reverse transcription-PCR. J Clin Microbiol 2003; 41(4): 1548–1557, https://doi.org/10.1128/jcm.41.4.1548-1557.2003.
- Noel J.S., Lee T.W., Kurtz J.B., Glass R.I., Monroe S.S. Typing of human astroviruses from clinical isolates by enzyme immunoassay and nucleotide sequencing. J Clin Microbiol 1995; 33(4): 797–801.
- Zhirakovskaya E.V., Tikunov A.Y., Kurilshchikov A.M., Tikunova N.V., Aksanova R.K., Sokolov S.N., Netesov S.V., Gorbunova M.G. Genetic diversity of group a rotavirus isolates found in Western Siberia in 2007–2011. Molecular Genetics, Microbiology and Virology 2012; 27(4): 174–183, https://doi.org/10.3103/s0891416812040076.
- Жираковская Е.В., Тикунов А.Ю., Курильщиков А.М., Дёмина А.В., Покровская И.В., Шеронова О.Б., Позднякова Л.Л., Нетёсова С.В., Тикунова Н.В. Этиологическая структура острых кишечных инфекций у взрослых в Новосибирске. Инфекционные болезни 2013; 11(2): 31–37.
- Новикова Н.А., Епифанова Н.В., Федорова О.Ф. G[P]-генотипирование ротавирусов с использованием полимеразной цепной реакции. Н. Новгород; 2007.
- Новокшонов А.А., Соколова Н.В., Сахарова А.А., Бережкова Т.В. Клиническая эффективность нового энтеросорбента в комплексной терапии острых кишечных инфекций вирусной этиологии у детей. Лечащий врач 2009; 7: 78–81.
- Bull R.A., Tu E.T.V., McIver C.J., Rawlinson W.D., White P.A. Emergence of a new norovirus genotype II.4 variant associated with global outbreaks of gastroenteritis. J Clin Microbiol 2006; 44(2): 327–333, https://doi.org/10.1128/jcm.44.2.327-333.2006.
- De Grazia S., Platia M.A., Rotolo V., Colomba C., Martella V., Giammanco G.M. Surveillance of human astrovirus circulation in Italy 2002–2005: emergence of lineage 2c strains. Clin Microbiol Infect 2011; 17(1): 97–101, https://doi.org/10.1111/j.1469-0691.2010.03207.x.
- DiStefano D.J., Kraiouchkine N., Mallette L., Maliga M., Kulnis G., Keller P.M., Clark H.F., Shaw A.R. Novel rotavirus VP7 typing assay using a one-step reverse transcriptase PCR protocol and product sequencing and utility of the assay for epidemiological studies and strain characterization, including serotype subgroup analysis. J Clin Microbiol 2005; 43(12): 5876–5880, https://doi.org/10.1128/jcm.43.12.5876-5880.2005.
- Юнкеров В.И., Григорьев С.Г. Математико-статистическая обработка данных медицинских исследований. СПб: ВМедА; 2002; 266 с.
- Glass R.I., Bresee J., Jiang B., Gentsch J., Ando T., Fankhauser R., Noel J., Parashar U., Rosen B., Monroe S.S. Gastroenteritis viruses: an overview. Novartis Found Symp 2001; 238: 5–25, https://doi.org/10.1002/0470846534.ch2.
- Kambhampati A., Koopmans M., Lopman B.A. Burden of norovirus in healthcare facilities and strategies for outbreak control. J Hosp Infect 2015; 89(4): 296–301, https://doi.org/10.1016/j.jhin.2015.01.011.
- Mahar J.E., Bok K., Green K.Y., Kirkwood C.D. The importance of intergenic recombination in norovirus GII.3 evolution. J Virol 2013; 87(7): 3687–3698, https://doi.org/10.1128/jvi.03056-12.
- Tamura K., Stecher G., Peterson D., Filipski A., Kumar S. MEGA6: molecular evolutionary genetics analysis version 6.0. Mol Biol Evol 2013; 30(12): 2725–2729, https://doi.org/10.1093/molbev/mst197.













