Ультразвуковая эластография сдвиговой волной в оценке состояния почечного трансплантата
Цель исследования — оценить возможности ультразвуковой эластографии сдвиговой волной при оценке степени фиброза почечного трансплантата на сроках от 1 года до 3 лет и более.
Материалы и методы. С 09.02.2015 по 25.05.2017 г. выполнено 80 УЗИ почечных трансплантатов у 44 пациентов, средний возраст которых — 34,8±8,9 года (от 17 до 52 лет). УЗИ проводили на аппарате Aixplorer (Super Sonic Imagine S.A., Aixen-Provence, Франция) с применением конвексного датчика с диапазоном частот 1–6 МГц. Пациенты были разделены на две группы: 1-я группа (n=12) — пациенты со стабильной функцией почечного трансплантата, 2-я группа (n=32) — пациенты с отклонениями в клинико-лабораторных показателях (повышением уровня креатинина в сыворотке крови), с рецидивом гломерулонефрита и другими осложнениями.
Результаты. В 1-й группе (n=12, средний возраст — 36,6±2,1 года) средние значения размеров трансплантата были следующие: длина — 120,4±9,7 мм; ширина — 48,8±5,5 мм; толщина паренхимы — 14,8±2,1 мм. Во 2-й группе (n=32, средний возраст — 42,9±2,4 года) размеры пересаженной почки составили: длина — 116,8±7,9 мм; ширина — 49,1±4,4 мм; толщина паренхимы — 15,4±2,3 мм. Средний показатель индекса резистентности на междолевых артериях в 1-й группе равнялся 0,69±0,09; во 2-й группе — 0,72±0,03 (p=0,673). На дуговых артериях индекс резистентности в 1-й группе составил 0,62±0,08; во 2-й группе — 0,73±0,01. Показатели жесткости паренхимы почечного трансплантата при ультразвуковой эластографии сдвиговой волной на различных участках в 1-й группе составили 26,14±1,50 кПа; во 2-й группе — 28,75±0,76 кПа (p=0,0099). Уровень креатинина у пациентов 1-й группы равнялся 143,3±11,9 мкмоль/л; 2-й группы — 161,8±9,0 мкмоль/л (p=0,268). Коэффициент корреляции показателей креатинина и жесткости паренхимы r в 1-й группе равен 0,452; во II группе r=0,375 — статистически значим.
Заключение. На основании данных статистической обработки результатов установлена диагностическая значимость ультразвуковой эластографии сдвиговой волной в оценке состояния трансплантированной почки в ранние и отдаленные сроки наблюдения.
Ультразвуковое исследование играет важную роль в дифференциальной диагностике как хирургических, так и нехирургических осложнений после трансплантации почки, клинические проявления которых могут быть схожи. Так, дисфункция трансплантата может являться следствием и острого отторжения, и мочевого затека, а лихорадка и болезненное увеличение трансплантата — проявлением как раневой инфекции, так и отторжения.
Принципиальный алгоритм диагностики послеоперационных нарушений функции трансплантата требует в первую очередь исключить урологические и сосудистые причины, а затем проводить дифференциальную диагностику между другими состояниями, например между отторжением и нефротоксичностью [1].
В мировой практике ультразвуковое исследование, включающее в себя серошкальное сканирование (В-режим), цветовое и спектральное доплеровское картирование, считается одним из ведущих методов инструментальной диагностики и мониторирования при трансплантации почки [2].
В настоящее время все большее клиническое значение приобретает ультразвуковая эластография — метод качественного и количественного анализа упругих свойств тканей. В зависимости от способа расчета модуля упругости Юнга ультразвуковую эластографию подразделяют на компрессионную и эластографию сдвиговой волной [3, 4]. Скорость распространения сдвиговых волн определяется модулем сдвига G, который прямо пропорционален модулю Юнга — Е. Измерив скорость распространения сдвиговой волны, можно получить количественную оценку модуля Юнга и, следовательно, количественно характеризовать жесткость ткани. Это существенное преимущество ультразвуковой эластографии сдвиговой волной (УЭСВ) по сравнению с другими методами эластографии [5, 6].
Первоначально УЭСВ применялась в диагностике заболеваний печени. По мере совершенствования технологии ее стали использовать для диагностики патологии молочной железы, рака предстательной железы, рака яичников, воспалительных изменений, метастазов печени, метастатического поражения лимфатических узлов шеи, рака щитовидной железы и т.д. [7, 8]. УЭСВ хорошо зарекомендовала себя при оценке фиброза печени. В настоящей работе данный метод применили для оценки степени выраженности фиброза в паренхиме почечного трансплантата.
Цель исследования — оценить возможности ультразвуковой эластографии сдвиговой волной при оценке степени фиброза почечного трансплантата на сроках от 1 года до 3 лет и более.
Материалы и методы. С 09.02.2015 по 25.05.2017 г. в отделении пересадки почки Республиканской клинической больницы Министества здравоохранения Республики Татарстан (Казань) выполнено 80 УЗИ почечных трансплантатов у 44 пациентов, средний возраст — 34,8±8,9 года (от 17 до 52 лет). УЗИ проводили на аппарате Aixplorer (Super Sonic Imagine S.A., Aixen-Provence, Франция) с применением конвексного датчика с диапазоном частот 1–6 МГц.
Исследование соответствует Хельсинкской декларации, принятой в июне 1964 г. (Хельсинки, Финляндия) и пересмотренной в октябре 2000 г. (Эдинбург, Шотландия), и одобрено Этическим комитетом Республиканской клинической больницы. От каждого пациента получено информированное согласие.
УЗИ трансплантата почки проводили методом УЭСВ, а также использовали стандартные режимы сканирования:
1) серошкальное сканирование: оценка состояния и топометрия трансплантата (размеры трансплантата, толщина коркового слоя, величина чашечно-лоханочной системы и т.д.), оценка состояния околопочечного пространства;
2) цветовое доплеровское картирование скорости и энергии кровотока;
3) спектральное доплеровское исследование.
Обязательным условием при проведении УЭСВ почечного трансплантата являлось отсутствие компрессии.
Определяли индексы резистентности в дуговых и междолевых артериях, где на ранних сроках видны гемодинамические изменения почечного трансплантата. С помощью УЭСВ оценивали среднюю жесткость паренхимы на верхнем и нижнем полюсе, латеральном и медиальном крае трансплантата (до 10 точек в одной плоскости). Функциональное состояние почки оценивали по уровню креатинина в плазме крови.
Пациенты на сроках пересадки от 1 года до 3 лет и более были разделены на две группы: 1-я группа (n=12) — пациенты со стабильной функцией почечного трансплантата, 2-я группа (n=32) — пациенты с отклонениями в клинико-лабораторных показателях (повышением уровня креатинина в сыворотке крови), с рецидивом гломерулонефрита и другими осложнениями. Распределение обследованных больных в зависимости от характера основного заболевания, вызвавшего хроническую почечную недостаточность, представлено в табл. 1. Чаще всего они страдали хроническим гломерулонефритом, другие заболевания почек встречались существенно реже.

|
Таблица 1. Распределение обследованных больных в зависимости от основного заболевания, вызвавшего хроническую почечную недостаточность, абс. число/% |
Статистическую обработку результатов выполняли с использованием пакета программ SPSS (v. 18.0). Нормальность распределения количественных показателей оценивали по критерию Колмогорова–Смирнова. Сравнение средних значений показателей в группах проводили с помощью критерия Стьюдента. Данные представлены в виде M±m, где M — среднее арифметическое значение, m — стандартная ошибка среднего. Для оценки связи между количественными показателями применяли коэффициент корреляции Пирсона. Качественные показатели сравнивали с использованием критерия χ2 и точного критерия Фишера. Различия считали статистически значимыми при p<0,05.
Результаты. Наиболее частой причиной дисфункции трансплантата, выявляемой на поздних сроках после операции, является хроническая трансплантационная нефропатия [1]. В нашем исследовании ее частота составила 77,3%, другие причины дисфункции наблюдались значительно реже (табл. 2).

|
Таблица 2. Распределение обследованных больных в зависимости от дисфункции почечного трансплантата, абс. число/% |
При оценке состояния трансплантата определяли контур почки, однородность и эхогенность паренхимы, состояние почечного синуса, чашечно-лоханочной системы и мочеточника.
При топометрии устанавливали размеры почечного трансплантата. В 1-й группе (n=12; средний возраст — 36,6±2,1 года) средние значения размеров трансплантата были следующие: длина — 120,4±9,7 мм; ширина — 48,8±5,5 мм; толщина паренхимы — 14,8±2,1 мм. Во 2-й группе (n=32, средний возраст — 42,9±2,4 года) размеры пересаженной почки составили: длина — 116,8±7,9 мм; ширина — 49,1±4,4 мм; толщина паренхимы — 15,4±2,3 мм.
Оценку состояния околопочечного пространства сводили к поиску свободной жидкости вокруг трансплантата, которая может наблюдаться при образовании гематом, урином и лимфоцеле.
При цветовом доплеровском картировании в каждом сегменте четко визуализировались несколько междолевых и дуговых артерий с хорошо выраженным систолическим и диастолическим кровотоком на протяжении всего сердечного цикла. Средний показатель индекса резистентности на междолевых артериях в 1-й группе составил 0,69±0,09; во 2-й группе — 0,72±0,03 (p=0,673). На дуговых артериях индекс резистентности в 1-й группе равнялся 0,62±0,08; во 2-й группе — 0,73±0,01.
Показатели жесткости паренхимы почечного трансплантата при УЭСВ на различных участках в 1-й группе составили 26,14±1,50 кПа; во 2-й группе — 28,75±0,76 кПа (p=0,0099). Уровень креатинина у пациентов 1-й группы — 143,3±11,9 мкмоль/л; у пациентов 2-й группы — 161,8±9,0 мкмоль/л (p=0,268). Коэффициент корреляции показателей креатинина и жесткости паренхимы r в 1-й группе был равен 0,452, во 2-й группе r=0,375 — статистически значим.
На рис. 1 и 2 представлены результаты исследования почечного трансплантата в режиме ультразвуковой доплерографии и УЭСВ в 1-й группе. Показатели УЭСВ коррелируют с клинико-лабораторными показателями почечного трансплантата.
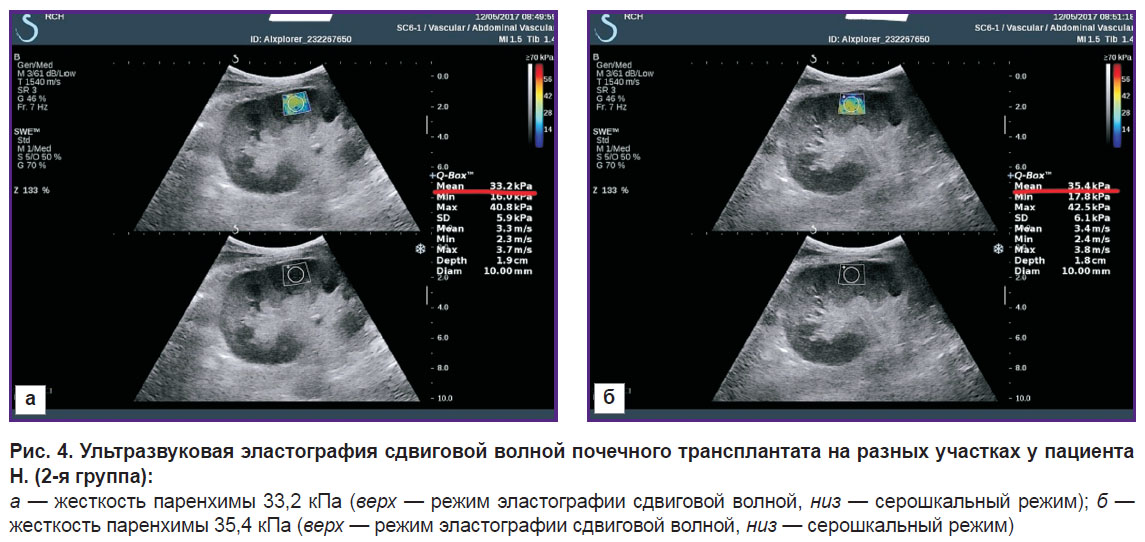
Внутриорганная гемодинамика в почечных трансплантатах на отдаленных сроках пересадки, с отклонениями в клинико-лабораторных показателях (повышением уровня креатинина в сыворотке крови), характеризовалась снижением кровотока по междолевым и дуговым артериям, высоким индексом резистентности, увеличением жесткости паренхимы. На рисунках 3 и 4 представлены ультразвуковые исследования почечного трансплантата в режиме доплерографии и УЭСВ у пациентов 2-й группы. Зависимость уровня креатинина в сыворотке крови и показателей жесткости паренхимы почечного трансплантата во 2-й группе показана на рис. 5.
|
Рис. 4. Ультразвуковая эластография сдвиговой волной почечного трансплантата на разных участках у пациента Н. (2-я группа): а — жесткость паренхимы 33,2 кПа (верх — режим эластографии сдвиговой волной, низ — серошкальный режим); б — жесткость паренхимы 35,4 кПа (верх — режим эластографии сдвиговой волной, низ — серошкальный режим) |
Выявлена статистически значимая разница жесткости паренхимы почечного трансплантата в обеих группах (р<0,05).
Таким образом, динамический контроль за состоянием внутрипочечной гемодинамики, осуществляемый с помощью цветовой и спектральной доплерографии, режима УЭСВ, в комплексе с клинико-лабораторными показателями позволяет выявить дисфункцию трансплантата почки на начальном этапе ее проявления. УЭСВ может служить дополнительным вспомогательным методом для диагностики степени фиброза почечного трансплантата на сроках пересадки от 1 года до 3 лет и более.
Заключение. На основании данных статистической обработки результатов установлена диагностическая значимость ультразвуковой эластографии сдвиговой волной в оценке состояния трансплантированной почки в ранние и отдаленные сроки наблюдения.
Несомненным преимуществом ультразвуковой эластографии сдвиговой волной является неинвазивность проведения данного метода, достоверность результатов, возможность получения абсолютных цифровых значений жесткости в нормальной и измененной ткани почечного трансплантата, которые коррелируются с клинико-лабораторными показателями.
Финансирование исследования и конфликт интересов. Исследование не финансировалось какими-либо источниками, и конфликты интересов, связанные с данным исследованием, отсутствуют.
Литература
- Общероссийская общественная организация трансплантологов «Российское трансплантологическое общество». Трансплантация почки. Национальные клинические рекомендации. М: Медицина, 2013.
- Chow L., Sommer F.G., Huang J., Li K.C.P. Power Doppler imaging and resistance index measurement in the evaluation of acute renal transplant rejection. J Clin Ultrasound 2001; 29(9): 483–90, https://doi.org/10.1002/jcu.10010.
- Осипов Л.В. Технологии эластографии в ультразвуковой диагностике. Обзор. Медицинский алфавит. Диагностическая радиология и онкотерапия 2013; 3–4(23): 5–21.
- Тухбатуллин М.Г., Галеева З.М., Бастракова А.Е. Ультразвуковая эластография. Эхография в диагностике заболеваний внутренних и поверхностно расположенных органов. Казань: «Медицинская книга», 2016; с. 119–130.
- Бастракова А.Е., Галеева З.М., Тухбатуллин М.Г. Возможности комплексной эхографии в ранней диагностике стеатоза печени. Практическая медицина 2016; 2(94): 48–50.
- Зыкин Б.И., Постнова Н.А., Медведев М.Е. Эластография: анатомия метода. Променева діагностика, променева терапія 2012; 2–3: 107–113.
- Зубарев А.Р., Федорова В.Н., Демидова А.К., Рычкова И.В., Саломатина Е.П., Кульченко Н.Г. Ультразвуковая эластография как новая ступень в дифференциальной диагностике узловых образований щитовидной железы: обзор литературы и предварительные клинические данные. Медицинская визуализация 2010; 1: 11–16.
- Тухбатуллин М.Г, Емелькина Л.А. Возможности комплексной эхографии в диагностике активности хронических гепатитов. Медицинская визуализация 2007; 6: 97–101.