Новый подход к выбору метода респираторной поддержки в пульмонологии
Цель исследования — оценить эффективность нового подхода к выбору метода респираторной поддержки при лечении тяжелой внебольничной пневмонии, осложненной острой дыхательной недостаточностью, который основан на анализе кислотно-щелочного и газового состава артериальной крови.
Материалы и методы. Для определения гипоксемии использовали общепринятую пульсоксиметрию (SрО2) (кардиомонитор GOLDWAY G40) и проводили анализ кислотно-щелочного и газового состава артериальной крови (аппаратом EasyStat). Выполняли три вида респираторной поддержки: 1) кислородотерапия (О2-терапия) с помощью кислородной ротоносовой маски; 2) неинвазивная вентиляция легких (аппаратами VENTIlogic 2 и BiPAP Vision); 3) искусственная вентиляция легких (аппаратом Engstrom Carestation).
Работа проводилась последовательно в два этапа. На первом этапе выбор метода респираторной поддержки проводили по результатам пульсоксиметрии (SрО2). На втором этапе метод респираторной поддержки выбирали на основании показателей кислотно-щелочного и газового состава артериальной крови (рО2, pH, рCО2). Критерием эффективности лечения считали восстановление показателей пульсоксиметрии, кислотно-щелочного и газового состава артериальной крови, наличие клинической положительной динамики.
Результаты. Сравнительный анализ результатов используемых методик позволил разработать алгоритм выбора метода респираторной поддержки при тяжелой внебольничной пневмонии на основании кислотно-щелочного и газового состава артериальной крови при показателях пульсоксиметрии 91,0±1,8%. При поступлении пациента в ОРИТ кислородотерапия назначается при показателях рН≥7,3; рO2>60 мм рт. ст.; рСО2≤45 мм рт. ст.; неинвазивная вентиляция легких — при рН<7,3; рO2≤60 мм рт. ст.; рСО2≤45 мм рт. ст.; искусственная вентиляция легких — при показателях рН<7,3; рO2<60 мм рт. ст.; рСО2>45 мм рт. ст. Выбор респираторной поддержки по кислотно-щелочному и газовому составу крови без учета показателей пульсоксиметрии позволил повысить эффективность лечения, сократить сроки пребывания в ОРИТ в 1,5 раза, летальность — в 4,3 раза.
Введение
Основным направлением интенсивной терапии острой дыхательной недостаточности (ОДН) в отделении реанимации и интенсивной терапии (ОРИТ) пульмонологического профиля помимо медикаментозного лечения является респираторная поддержка, включающая в себя О2-терапию через ротоносовую маску; неинвазивную искусственную вентиляцию легких (НИВЛ), позволяющую создавать положительное давление в дыхательных путях; искусственную вентиляцию легких (ИВЛ) [1–3]. В первые часы поступления больного с ОДН в отделение реанимации остро стоит вопрос выбора метода респираторной поддержки. Основными показателями для такого выбора чаще всего являются показатель пульсоксиметрии (SрО2) и общее состояние пациента [4–6].
С учетом того, что основные нарушения в организме при формировании ОДН в случае тяжелой внебольничной пневмонии, определяющие тяжесть состояния больного, обусловлены изменением газообмена, мы посчитали целесообразным рассмотреть в качестве показания для выбора метода респираторной поддержки при поступлении в ОРИТ значения кислотно-щелочного (КЩС) и газового состава артериальной крови пациента [5–7].
Цель исследования — разработать алгоритм (критерии) выбора оптимального метода проведения респираторной поддержки при лечении тяжелой внебольничной пневмонии, осложненной острой дыхательной недостаточностью, в отделении реанимации пульмонологического профиля.
Материалы и методы
Проведен сравнительный анализ результатов применения двух подходов к определению тактики лечения пациентов с ОДН: общепринятого — по показателю пульсоксиметрии (SрО2) и предлагаемого авторами — по КЩС и газовому составу артериальной крови. Реализация идеи проводилась на базе Самарской городской больницы №4 в два этапа.
На первом этапе мы выполняли наблюдение и оценку результатов лечения у 350 пациентов с тяжелой внебольничной пневмонией, осложненной ОДН. Показатель SpO2 составлял 91,0±0,8%. Всем при поступлении назначалась О2-терапия с помощью ротоносовой маски. При ухудшении общего состояния больного, которое проявлялось нарастанием работы дыхания с увеличением частоты дыхательных движений более 30 в минуту, пациенты переводились на НИВЛ. При неэффективности НИВЛ, снижении SpO2 (<90%), изменениях в неврологическом статусе (кома, психомоторное возбуждение), гемодинамических нарушениях больные переводились на ИВЛ.
Всем пациентам во время респираторной поддержки определяли КЩС и газовый состав артериальной крови. При анализе эффективности лечения учитывались показатели КЩС и газового состава артериальной крови, при которых назначалась НИВЛ, значения SpO2 оставались 91,0±0,8%.
На втором этапе 350 пациентам с тяжелой внебольничной пневмонией, поступившим в ОРИТ, метод респираторной поддержки назначался по определенным показателям КЩС и газового состава артериальной крови. Таким образом, в зависимости от применяемого алгоритма выбора метода были сформированы две группы по 350 человек:
1-я группа — выбор метода респираторной поддержки проводили по показателям пульсоксиметрии (SpO2);
2-я группа — выбор метода респираторной поддержки проводили по показателям КЩС и газового состава артериальной крови (рО2, pH, рCО2).
Статистическую оценку эффективности методов респираторной поддержки в группах больных выполняли с помощью таблиц сопряженности на основе расчета критериев Пирсона (χ2), позволяющих судить о случайности (неслучайности) распределения в таблицах взаимной сопряженности.
Критериями для госпитализации в ОРИТ служили следующие клинические и лабораторно-инструментальные признаки: наличие на рентгенограммах признаков инфекции нижних дыхательных путей с двусторонним поражением легочной ткани; быстрое развитие клинической картины заболевания; прогрессирование острой дыхательной недостаточности и альвеолярного отека легких, тяжелой гипоксемии и/или гиперкапнии, энцефалопатии на ранней стадии, тахикардии, гипертермии и артериальной гипотензии [7–11].
Критериями исключения из исследования служили: возраст более 60 лет; инфаркт миокарда и острая коронарная патология; отек легких вследствие левожелудочковой недостаточности; развитие острой дыхательной недостаточности на фоне хронических системных заболеваний; сопутствующая хирургическая патология и травматические сосудистые поражения головного мозга.
Группы были презентативны для проведения сравнительного анализа, так как достоверных отличий между ними не было. Были рассчитаны основные описательные статистики для анализируемых показателей (среднее значение, дисперсия, стандартное отклонение, коэффициент вариации, стандартная ошибка), что подтвердило отсутствие статистически значимых различий в показателях обеих групп (см. таблицу).

|
Сравнительная статистическая оценка групп пациентов |
Тяжесть внебольничной пневмонии оценивали в соответствии с клиническими рекомендациями [1, 3].
Для определения гипоксемии основными методами были выбраны общепринятая пульсоксиметрия (кардиомонитор GOLDWAY G40; Philips, Нидерланды) и анализ КЩС и газового состава артериальной крови — рО2, pH, рCО2 (аппарат EasyStat; Medica Corp., США). Обследование выполняли непосредственно в ОРИТ, показатели оценивали сразу при поступлении больного в ОРИТ, а контрольные измерения проводили каждый час. Медикаментозное лечение всех пациентов при поступлении в ОРИТ было одинаково и соответствовало стандартам, что позволило исключить данный фактор при оценке эффективности предлагаемого алгоритма выбора метода респираторной поддержки.
Использовались три вида респираторной поддержки: 1) О2-терапия с помощью кислородной ротоносовой маски; 2) НИВЛ аппаратами VENTIlogic 2 (Weinmann, Германия) и BiPAP Vision (RESPIRONICS Inc., Великобритания); 3) ИВЛ аппаратом Engstrom Carestation (General Electric Healthcare, США). Критерием эффективности считали наличие положительной клинической динамики, восстановление показателей пульсоксиметрии, КЩС и газового состава артериальной крови.
Данное исследование было одобрено Этическим комитетом Самарского государственного медицинского университета и соответствует требованиям Хельсинкской декларации (2013). Все пациенты дали письменное информированное согласие для научного анализа их данных.
Управление данными и анализ данных проводили с использованием статистического пакета IBM SPSS Advanced Statistics 24,0.
Результаты и обсуждение
В первой части исследования (1-я группа) всем пациентам при поступлении в ОРИТ с SpO2≥90% респираторная поддержка проводилась поэтапно — с поочередным использованием всех трех методов. Сначала назначали О2-терапию через ротоносовую маску с расходным мешком со скоростью потока кислородно-воздушной смеси 10–15 л/мин. При SрO2≤90% на фоне О2-терапии назначали НИВЛ аппаратом VENTIlogic 2. При неэффективности НИВЛ, дальнейшем снижении SрO2, нарастании одышки, изменениях в неврологическом статусе, гипертермии, гемодинамических нарушениях больные переводились на ИВЛ аппаратом Engstrom Carestation.
Эффективность респираторной поддержки оценивали по повышению SрO2, снижению частоты дыхательных движений, по стабилизации показателей гемодинамики, отсутствию постгипоксической энцефалопатии и гипертермии во время динамического наблюдения.
При проведении О2-терапии положительная динамика наблюдалась в 80 из 350 случаев (23%), (χ2эмп=116,92 при p=0,00000, χ2=3,841 при числе степеней свободы f=1). Эти пациенты были оставлены на О2-терапии на протяжении 3 сут, затем в стабильном состоянии переведены в отделение пульмонологии на долечивание.
У 270 пациентов (77%) продолжалось нарастание клинических признаков гипоксии, одышки, отмечались участие в механике дыхания межреберной мускулатуры, ажитация или, наоборот, заторможенность. Продолжалось снижение сатурации (SрO2≤90%), КЩС и газового состава артериальной крови (pH≤7,3; pO2≤60 мм рт. ст.; рCO2≥45 мм рт. ст.). Все эти пациенты были переведены на НИВЛ. Среди них положительная динамика в течение часа отмечалась у 115 из 270 человек (42,6%) (χ2эмп=73,99 при p=0,00000), их общее состояние стабилизировалось, SрO2стала более 91%, уменьшилась одышка, не нарастала неврологическая симптоматика. При определении газового состава крови также наблюдалась положительная динамика: pH>7,3; рO2>60 мм рт. ст.; рCO2≤45 мм рт. ст. Пациенты находились на НИВЛ около 2–3 дней, при стабилизации гемодинамических показателей и положительной динамике рентгенологической картины были переведены на О2-терапию. Средний койко-день нахождения в ОРИТ пациентов с положительной динамикой (n=115) составил 7,0±0,7 сут, все они были переведены на долечивание в пульмонологическое отделение.
Отсутствие эффекта — продолжающееся снижение SрO2 до уровня <90% — было нами оценено как неэффективность метода НИВЛ у 155 из 270 пациентов (57,4%). КЩС и газовый состав крови при этом у них составлял: pH<7,3; рO2<60 мм рт. ст.; рCO2>45 мм рт. ст. Все пациенты были переведены на продленную ИВЛ, через три дня им была выполнена трахеостомия, интенсивная терапия в ОРИТ была направлена на профилактику нозокомиальной инфекции и включала в себя смену антибиотикотерапии, энтеральное и парентеральное питание, иммунокоррекцию, адъювантную терапию. Положительная динамика была отмечена у 83 из 155 пациентов (53,5%) (χ2эмп=9,96 при p=0,0016). На 10–12-е сутки им была проведена деканюляция с дальнейшим переводом на самостоятельное дыхание и направлением в пульмонологическое отделение. Средний койко-день в ОРИТ для этих пациентов составил 15,0±2,3 сут.
Из числа пациентов 1-й группы, переведенных на ИВЛ, умерло 72 человека (46,5%) (χ2эмп=40,76 при p=0,00000). Летальность в группе составила 20%. Анализ результатов лечения показал, что назначаемая О2-терапия с учетом показателей SpO2 была эффективна лишь в 22,9% случаев.
В связи с этим нами был разработан алгоритм выбора респираторной поддержки независимо от показателей сатурации. Данный алгоритм мы применили на втором этапе (2-я группа) нашего исследования при лечении 350 пациентов.
Сразу при поступлении в ОРИТ определяется газовый состав артериальной крови. При показателях рН≥7,3; pO2>60 мм рт. ст.; рСО2≤45 мм рт. ст. назначается О2-терапия с оценкой эффективности через 1 ч. При рН<7,3; pO2≤60 мм рт. ст.; рСО2≥45 мм рт. ст., несмотря на стабильное состояние больного, назначается НИВЛ с оценкой эффективности через 1 ч. При рН<7,3; pO2<60 мм рт. ст.; рСО2>45 мм рт. ст. через 1 ч НИВЛ, не дожидаясь изменений в неврологическом статусе и гемодинамических показателях, пациента переводят на ИВЛ.
Кислородотерапия во 2-й группе проводилась только 49 из 350 пациентов (14%) (χ2эмп=40,76 при p=0,00000). В течение часа у всех отмечена хорошая динамика, увеличение и стабилизация показателя КЩС и газового состава артериальной крови, в смене респираторной поддержки они не нуждались и на 2-е сутки все были переведены в пульмонологическое отделение на долечивание. Средний койко-день в ОРИТ среди них составил 2,0±0,4 сут. Методика в этом случае оказалась эффективной в 100% назначений.
Показатели рН<7,3; pO2≤60 мм рт. ст.; рСО2≥45 мм рт. ст. были отмечены у 301 пациента (86%), им сразу была начата НИВЛ аппаратом VENTIlogic 2 в режимах CPAP и ST с концентрацией кислорода во вдыхаемой смеси FiO2 — 50%. Давление вдоха EPAP — от 10 до 23 см вод. ст., давление выдоха IPAP — от 6 до 10 см вод. ст. Соотношение вдох:выдох (Insp:Exsp) — 1:2 или 1:1. Через 1 ч наблюдения у 234 из 301 человека (77,7%) состояние стабилизировалось, перестали нарастать симптомы ОДН, отмечалась положительная динамика КЩС и газового состава артериальной крови (χ2эмп=73,99 при p=0,00000), все больные были оставлены на НИВЛ для дальнейшего лечения. При стабилизации показателей: рН≥7,3; pO2>60 мм рт. ст.; рСО2≤45 мм рт. ст. (в среднем через 2 сут) больных отлучали от респиратора и переводили на О2-терапию. Метод респираторной поддержки оценивали как эффективный, поскольку пациенты переводились в профильное отделение с улучшением. Средний койко-день в ОРИТ составил 3,0±0,9 сут. Неэффективность НИВЛ отмечена у 67 из 301 человека (22,3%).
Пациенты, у которых НИВЛ оценена как неэффективная (n=67), были переведены на ИВЛ аппаратом Engstrom Carestation в режиме вентиляции PSV — вентиляция с поддержкой давлением, с положительным давлением в конце выдоха РЕЕР — 10–16 мм вод. ст., с концентрацией кислорода во вдыхаемой смеси FiO2 — 40–60%. Частота дыхательных движений — 16–20 в минуту. Через 1 ч наблюдения за ними у 51 из 67 человек (76%) отмечена положительная динамика (χ2эмп=9,96 при p=0,0016). Пациенты оставались на ИВЛ и в среднем на 3-и сутки переводились на вспомогательные режимы вентиляции. Перевод на самостоятельное дыхание выполняли на 7–9-е сутки. При поступлении в профильное отделение кислородозависимость у данных пациентов была в пределах нормы. Средний койко-день пациентов с положительной динамикой в ОРИТ составил 10,0±2,3 сут.
На данном этапе исследования умерло 16 пациентов, переведенных на ИВЛ (χ2эмп=40,76 при p=0,00000). Летальность составила 4,5%.
Сравнительная оценка результатов применяемых методов респираторной поддержки показала бóльшую эффективность во 2-й группе (рис. 1).
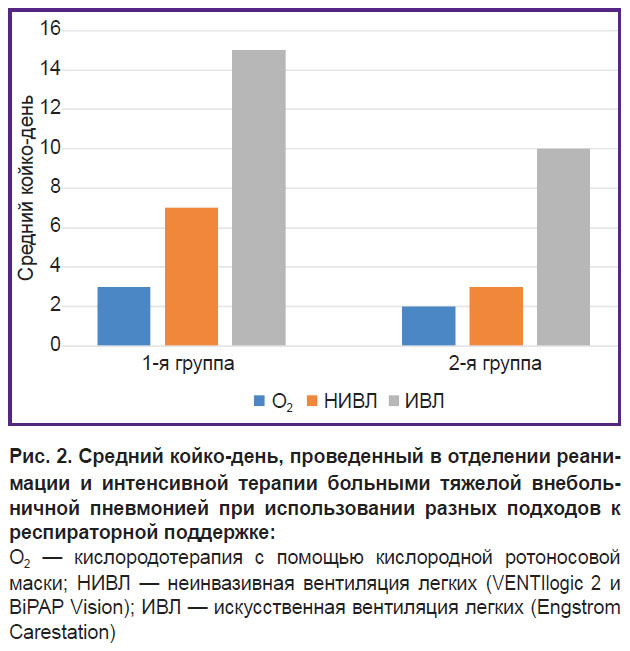
Средний койко-день, проведенный в ОРИТ, во 2-й группе меньше, чем в первой, при всех видах используемой респираторной поддержки (рис. 2).
|
Рис. 2. Средний койко-день, проведенный в отделении реанимации и интенсивной терапии больными тяжелой внебольничной пневмонией при использовании разных подходов к респираторной поддержке: O2 — кислородотерапия с помощью кислородной ротоносовой маски; НИВЛ — неинвазивная вентиляция легких (VENTIlogic 2 и BiPAP Vision); ИВЛ — искусственная вентиляция легких (Engstrom Carestation) |
Таким образом, у всех пациентов с тяжелой внебольничной пневмонией, осложненной ОДН, в определении тактики интенсивной терапии более значимы показатели КЩС и газового состава артериальной крови (pH, рО2, рCО2) независимо от показателей пульсоксиметрии.
Заключение
Выбор респираторной поддержки на основании кислотно-щелочного и газового состава артериальной крови при интенсивной терапии больных тяжелой внебольничной пневмонией при поступлении в отделение реанимации и интенсивной терапии позволяет оптимизировать лечение. Предложен следующий алгоритм выбора: при pH=7,3; рO2 — 80–100 мм рт. ст.; рCО2 — от 35 до 40 мм рт. ст. назначается кислородотерапия с помощью ротоносовой маски с резервуаром; при pH=7,20–7,27; рО2 — от 60 до 80 мм рт. ст.; рCО2 — от 45 до 50 мм рт. ст. — неинвазивная искусственная вентиляция легких через ротоносовую маску; при показателях рН<7,3; pO2<60 мм рт. ст.; рСО2>45 мм рт. ст. при поступлении в отделение реанимации и интенсивной терапии или на фоне проводимой неинвазивной вентиляции легких в течении часа больные переводятся на искусственную вентиляцию легких.
Проведение интенсивной терапии с помощью метода респираторной поддержки, выбранного в первый час госпитализации на основании кислотно-щелочного и газового состава артериальной крови, способствует оптимизации лечения, сокращению койко-дня в отделении реанимации и интенсивной терапии в 1,5 раза, уменьшению летальности в 4,3 раза и исключает при этом различные осложнения.
Финансирование исследования. Работа проведена на личные средства авторов.
Конфликт интересов. Авторы подтверждают отсутствие финансовых и других конфликтных интересов, способных оказать влияние на их работу.
Литература
- Чучалин А.Г., Синопальников А.И., Козлов Р.С., Авдеев С.Н., Тюрин И.Е., Руднов В.А., Рачина С.А., Фесенко О.В. Клинические рекомендации по диагностике, лечению и профилактике тяжелой внебольничной пневмонии у взрослых. Пульмонология 2014; 4: 13–48.
- Авдеев С.Н. Неинвазивная вентиляция легких у пациентов с хронической обструктивной боленью легких в стационаре и домашних условиях. Пульмонология. 2017; 27(2): 232–249, https://doi.org/10.18093/0869-0189-2017-27-2-232-249.
- Власенко А.В., Грицан А.И., Киров М.Ю., Колесниченко А.П., Лебединский К.М., Марченков Ю.В., Мороз В.В., Николаенко Э.М., Проценко Д.Н., Ярошецкий А.И. Применение неинвазивной вентиляции легких. Клинические рекомендации. 2013.
- Власенко А.В., Гаврилин С.В., Гельфанд Б.Р., Еременко А.А., Заболотских И.Б., Зильбер А.П., Кассиль В.Л., Киров М.Ю., Колесниченко А.П., Лебединский К.М., Лейдерман И.Н., Мазурок В.А., Неймарк М.И., Николаенко Э.М., Проценко Д.Н., Руднов В.А., Садчиков Д.В., Садритдинов М.А., Солодов А.А., Храпов К.Н., Царенко С.В. Диагностика и интенсивная терапия острого респираторного дистресс-синдрома. Клинические рекомендации. 2015.
- Мороз В.В., Марченков Ю.В., Кузовлев А.Н. Неинвазивная масочная вентиляция легких при острой дыхательной недостаточности. М; 2013.
- Поваляева Л.В., Бородулин Б.Е., Бородулина Е.А., Черногаева Г.Ю., Чуманова Е.С. Факторы риска смерти пациентов с внебольничной пневмонией в современных условиях. Казанский медицинский журнал 2012; 93(5): 816–820.
- Бородулин Б.Е., Черногаева Г.Ю., Бородулина Е.А., Поваляева Л.В. Интенсивная терапия заболеваний органов дыхания. Самара; 2012.
- Janssens J.-P., Borel J.-C., Pépin J.-L. Nocturnal monitoring of home non-invasive ventilation: the contribution of simple tools such as pulse oximetry, capnography, built-in ventilator software and autonomic markers of sleep fragmentation. Thorax 2010; 66(5): 438–445, https://doi.org/10.1136/thx.2010.139782.
- Boldrini R., Fasano L., Nava S. Noninvasive mechanical ventilation. Curr Opin Crit Care 2012; 18(1): 48–53, https://doi.org/10.1097/mcc.0b013e32834ebd71.
- Chiumello D., Cressoni M., Carlesso E., Caspani M.L., Marino A., Gallazzi E., Caironi P., Lazzerini M., Moerer O., Quintel M., Gattinoni L. Bedside selection of positive end-expiratory pressure in mild, moderate, and severe acute respiratory distress syndrome. Crit Care Med 2014; 42(2): 252–264, https://doi.org/10.1097/ccm.0b013e3182a6384f.
- Guérin C., Reignier J., Richard J.C., Beuret P., Gacouin A., Boulain T., Mercier E., Badet M., Mercat A., Baudin O., Clavel M., Chatellier D., Jaber S., Rosselli S., Mancebo J., Sirodot M., Hilbert G., Bengler C., Richecoeur J., Gainnier M., Bayle F., Bourdin G., Leray V., Girard R., Baboi L., Ayzac L. Prone positioning in severe acute respiratory distress syndrome. N Engl J Med 2013; 368(23): 2159–2168, https://doi.org/10.1056/NEJMoa1214103.