Денервация легочных артерий у пациентов с пороками митрального клапана, осложненными фибрилляцией предсердий и высокой легочной гипертензией
Цель исследования — оценить эффективность симпатической денервации ствола и устьев легочных артерий как метода коррекции высокой легочной гипертензии, влияние ее на результаты хирургического лечения фибрилляции предсердий, выявить основные предикторы рецидива нарушений ритма у пациентов с дисфункцией митрального клапана, осложненной фибрилляцией предсердий и высокой легочной гипертензией.
Материалы и методы. Проанализированы результаты хирургического лечения 140 пациентов с митральным пороком, осложненным фибрилляцией предсердий и легочной гипертензией высокой степени (более 40 мм рт. ст.). Оперативное вмешательство у части больных (n=51) заключалось в хирургической коррекции митрального порока; хирургическом вмешательстве по поводу фибрилляции предсердий по схеме Maze IV, а также радиочастотной денервации ствола и устьев легочной артерии с целью коррекции высокой легочной гипертензии. Контрольной группе (n=89) с аналогичной патологией также выполнены коррекция митральной дисфункции и процедура Maze IV, но при этом денервация легочного ствола и устьев легочных артерий не проводилась.
Результаты. Установлено, что циркулярная, радиочастотная денервация ствола и устьев легочных артерий является эффективным методом хирургического лечения легочной гипертензии у пациентов с пороками митрального клапана, осложненными фибрилляцией предсердий и высокой легочной гипертензией. Она способствует значительному обратному ремоделированию полостей сердца, в частности левого предсердия (p=0,01), снижению легочной гипертензии, восстановлению и сохранению синусового ритма после сопутствующей процедуры Maze IV (p=0,008). Основными предикторами рецидива фибрилляции предсердий у таких пациентов после комплексного хирургического лечения являются стаж аритмии более 5 лет (p=0,04), исходная легочная гипертензия более 60 мм рт. ст. (p=0,028), сопутствующая выраженная трикуспидальная недостаточность (p=0,006) и атеросклеротическое поражение брахиоцефальных и церебральных сосудов.
Введение
Нарушения ритма в виде фибрилляции предсердий у пациентов с клапанной патологией сердца встречаются в 30–84% случаев. Наличие данной аритмии значительно снижает эффективность хирургического лечения клапанной патологии, способствует увеличению риска тромбоэмболических осложнений, нарастанию сердечной недостаточности и, как следствие, снижению качества жизни и увеличению смертности больных [1–3]. Встречаемость фибрилляции предсердий достигает 2%, и за последние десятилетия прослеживается тенденция к увеличению данной патологии [4, 5].
Встречаемость пороков митрального клапана, будь то стеноз или недостаточность, в популяции достигает 8% [6] и обусловливает возникновение комплекса разнообразных структурных нарушений в миокарде: повышения давления в полости левого предсердия, которое со временем расширяется; морфологических и электрических изменений в стенке миокарда, что обусловливает появление участков медленного и быстрого проведения импульсов с формированием патологических кругов re-entry [7, 8]. К тому же увеличение давления в левом предсердии служит причиной возрастания легочной гипертензии с последующими структурными изменениями в стенке легочных артерий и, как следствие, перегрузкой правых отделов сердца [9–11].
Увеличение давления в малом круге кровообращения способствует также появлению трикуспидальной недостаточности и, как следствие, нарастанию сердечной недостаточности, развитию коморбидной патологии, снижению качества жизни и увеличению смертности в данной группе пациентов [12].
В связи с этим хирургическая коррекция дисфункции клапанного аппарата является главной патогенетической задачей при хирургическом лечении фибрилляции предсердий [5, 13]. Однако, к сожалению, устранение порока митрального клапана у таких пациентов способствует восстановлению синусового ритма всего в 8,5–20,0% случаев, что требует дополнительных усилий по устранению нарушений ритма сердца [14–16].
В настоящее время под легочной гипертензией понимают повышение давления в легочной артерии до значения более 25 мм рт. ст. в состоянии покоя [17, 18]. Последняя классификация легочной гипертензии была предложена в 2013 г. G. Simonneau [19], который выделил 5 групп: гипертензия, ассоциированная с заболеваниями левых отделов сердца; ассоциированная с заболеваниями органов дыхания и гипоксией; артериальная гипертензия; хроническая тромбоэмболическая: идиопатическая гипертензия. Наличие высокой легочной гипертензии у больных с дисфункцией клапанов сердца снижает эффективность хирургического вмешательства, увеличивает сроки реабилитации, замедляет обратное ремоделирование камер сердца, а также способствует возникновению нарушений ритма и снижает эффективность хирургической коррекции фибрилляции предсердий [20]. Патогенез вторичной легочной гипертензии представлен несколькими вариантами: нарушение соотношения тромбоксана и простациклина в сторону усиления активности тромбоксана в эндотелии сосудов легких; тромбоз in situ; снижение синтеза оксида азота эндотелием, который является вазодилататором; возрастание продукции вазоконстрикторов и, как правило, гипертрофия гладкомышечных клеток с вторичной хронической вазоконстрикцией на фоне пролиферативной реакции интимы и адвентиции сосудов [21–23].
Лечение легочной гипертензии в настоящее время является одной из актуальных задач современной медицины. Медикаментозная терапия в данном случае недостаточно эффективна и сопряжена с приемом дорогостоящих препаратов [24].
Первые исследования симпатической регуляции сосудистого тонуса легочных артериол и прекапилляторного русла малого круга кровообращения были выполнены в 1962 г. группой авторов под руководством J. Osorio [25]. Было доказано наличие симпатических нервных сплетений в адвентиции легочного ствола и устьях легочных артерий, которые обусловливали сокращение гладкомышечных клеток и впоследствии — спазм легочных артериол с последующим повышением давления в малом круге кровообращения. В дальнейшем эти данные были также подтверждены другими авторами [26, 27].
Хирургическая коррекция вторичной легочной гипертензии (за исключением бандинга легочного ствола) впервые предложена в 2013 г. группой авторов под руководством S.L. Chen [28]. Их методика заключалась в эндоваскулярной катетерной радиочастотной аблации легочных артерий с целью денервации симпатических сплетений. Первые результаты были весьма обнадеживающими, что побудило исследовать эту методику более глубоко. Схожие работы по эндоваскулярной радиочастотной денервации симпатических ганглиев в стволе и устьях легочных артерий [29, 30] также продемонстрировали эффективность методики. При этом в исследовании S. Briongos Figuero и соавт. [31] показано, что исходная высокая степень легочной гипертензии имеет тесную корреляцию с сохранением высокой стойкой легочной гипертензии в послеоперационном периоде, несмотря на хирургическую коррекцию митральной дисфункции (отношение шансов — 1,761; p=0,03). Способ хирургической коррекции легочной гипертензии в условиях искусственного кровообращения при одновременном оперативном вмешательстве на митральном клапане, заключающийся в радиочастотной аблации передней стенки ствола и устьев легочных артерий с применением монополярного электрода-ручки, представлен в работе А.В. Богачева–Прокофьева и соавт. [32]. Также в литературе описана методика циркулярной радиочастотной денервации ствола и устьев легочных артерий с использованием биполярного деструктора [9, 33].
Несмотря на представленные данные, современная медицина не имеет общепринятой методики хирургического лечения пациентов с дисфункцией митрального клапана, осложненной фибрилляцией предсердий и высокой легочной гипертензией, что обусловливает необходимость дальнейшего поиска оптимального алгоритма комплексной хирургической коррекции этой патологии. Кроме того, отсутствуют данные о влиянии хирургического лечения высокой легочной гипертензии на эффективность процедуры Maze IV и сохранение синусового ритма в послеоперационном периоде.
Цель исследования — оценить эффективность симпатической денервации ствола и устьев легочных артерий как метода коррекции высокой легочной гипертензии, влияние ее на результаты хирургического лечения фибрилляции предсердий, а также выявить основные предикторы рецидива нарушений ритма у пациентов с дисфункцией митрального клапана, осложненной фибрилляцией предсердий и высокой легочной гипертензией.
Материалы и методы
Проанализированы результаты хирургического лечения 140 пациентов с митральным пороком, осложненным фибрилляцией предсердий и легочной гипертензией высокой степени (более 40 мм рт. ст.). Оперативное вмешательство у части больных (n=51) заключалось в хирургической коррекции митрального порока (реконструкция клапана либо, в большинстве случаев, протезирование); в хирургическом вмешательстве по поводу фибрилляции предсердий в виде выполнения биатриальной радиочастотной аблации по схеме Maze IV с использованием биполярного аблатора AtriCure (ATRICURE Inc., США); в радиочастотной денервации ствола и устьев легочной артерии с целью коррекции высокой легочной гипертензии.
Контрольную группу (n=89) составили больные с такой же патологией — пороком митрального клапана, осложненным фибрилляцией предсердий и высокой легочной гипертензией. Им также выполнена коррекция митральной дисфункции и процедура Maze IV, однако денервация легочного ствола и устьев легочных артерий не проводилась.
Критериями включения в экспериментальную группу служили наличие порока митрального клапана, фибрилляции предсердий; легочная гипертензия высокой степени (более 40 мм рт. ст.); отсутствие гемодинамически значимого поражения коронарных артерий, требующего реваскуляризации; отсутствие тромбоэмболических осложнений легочных артерий; отсутствие хронической обструктивной болезни легких с выраженной дыхательной недостаточностью в анамнезе. В послеоперационном периоде ни один из пациентов не принимал специфические препараты для коррекции легочной гипертензии. Все исследуемые в обязательном порядке до вмешательства были проинформированы о предстоящей расширенной операции с проведением дополнительной денервации легочных артерий, которую планировалось выполнить до основного этапа хирургического вмешательства. В соответствии с Хельсинкской декларацией (2013) подписаны добровольные информированные согласия, соблюдены принципы клинической практики международного стандарта Good Clinical Practice (GCP).
Экспериментальная группа и группа контроля были сопоставимы по основным клинико-демографическим показателям (табл. 1).

|
Таблица 1. Клинико-демографическая характеристика групп исследования до операции (M±m) |
Межгрупповые значимые различия характеризуют исследуемую группу пациентов как более тяжелую: по возрасту, шкале EuroSCORE, дилатации правых отделов сердца, левого желудочка, фракции изгнания левого желудочка, а также по степени легочной гипертензии.
Процедуру денервации ствола и устьев легочных артерий выполняли циркулярно, с использованием биполярного радиочастотного зажима-аблатора AtriCure. Интраоперационно, после подключения аппарата искусственного кровообращения, выделяли дистальные отделы ствола легочной артерии, наносили две аблационные линии, по 3 аппликации, на область легочного ствола (рис. 1).

|
Рис. 1. Денервация легочного ствола |
После этого аналогичным образом выделяли устья легочных артерий с нанесением аблационных линий радиочастотным деструктором. Для доступа к устью правой легочной артерии отодвигали аорту влево, чтобы визуализировать поперечный синус сердца (рис. 2).

|
Рис. 2. Денервация устья правой (а) и левой (б) легочных артерий |
В конечном виде радиочастотная денервация легочных артерий была представлена 6 аблационными линиями, по две на устьях левой и правой легочных артерий и 2 — на уровне дистального отдела ствола легочной артерии (рис. 3).

|
Рис. 3. Аблационные линии на стволе и устьях легочных артерий |
Среднее время выполнения радиочастотной денервации легочных артерий составило 5,5±1,5 мин.
После антеградной кардиоплегии в корень аорты раствором Кустодиола и остановки сердца проводили основной этап операции — хирургическую коррекцию дисфункции митрального клапана и фибрилляции предсердий. Время искусственного кровообращения в среднем составило 114,1±33,4 мин, время ишемии миокарда — 85,2±26,6 мин.
Пребывание пациентов с денервацией в отделении реанимации составило 2,4±3,1 сут и не отличалось от пациентов группы контроля (2,6±2,8 сут). Ведение больных в послеоперационном периоде было идентичным в обеих группах. Изменения показателей трансторакального эхоКГ контролировали через 3, 6, 12, 24 мес после оперативного вмешательства.
Статистический анализ результатов исследования проводили на персональном компьютере с применением программ Exel и Statistica 10.0. Данные, полученные в результате работы, представлены среднеарифметическими значениями и стандартной ошибкой (M±m). Статистическую значимость параметров во время межгруппового анализа вычисляли с использованием критерия Манна–Уитни. Сравнение абсолютных значений при анализе двух групп выполняли с применением критерия 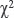 , в случаях анализа наблюдений менее пяти использовали двусторонний критерий Фишера. Предполагаемую ошибку обозначали как р и считали статистически значимой при р<0,05.
, в случаях анализа наблюдений менее пяти использовали двусторонний критерий Фишера. Предполагаемую ошибку обозначали как р и считали статистически значимой при р<0,05.
Результаты и обсуждение
Летальные исходы составили по 1 случаю в каждой группе и были обусловлены прогрессирующей острой сердечной недостаточностью. Осложнений, связанных с проводимой радиочастотной денервацией легочных артерий, в группе исследования не наблюдалось. Положительная динамика эхоКГ-показателей в послеоперационном периоде отмечена у пациентов обеих групп (табл. 2).

|
Таблица 2. Динамика эхоКГ-показателей через 24 мес после хирургического вмешательства (M±m) |
Результаты хирургического лечения демонстрируют положительную динамику в обеих группах, но значительно лучшие результаты представлены в группе комплексного лечения как по обратному ремоделированию полостей сердца, так и по увеличению сократительной функции левого желудочка, а также по снижению легочной гипертензии. При исходно худших показателях эхоКГ и более возрастного состава пациентов в исследуемой группе достигнуты сопоставимые результаты с группой контроля через 24 мес после оперативного вмешательства.
Радиочастотная денервация симпатических ганглиев легочного ствола и легочных артерий способствует расслаблению гладкомышечных клеток в стенке мелких артерий и артериол, что приводит к вазодилатации и, как следствие, увеличивает общую емкость малого круга кровообращения, что в конечном итоге способствует снижению легочной гипертензии после оперативного вмешательства.
Изменение средних значений легочной гипертензии в обеих группах представлено на рис. 4. Наглядно продемонстрировано преимущество комплексного подхода в хирургическом лечении порока митрального клапана, осложненного высокой легочной гипертензией и фибрилляцией предсердий. Предложенная методика в группе пациентов с исходной более выраженной легочной гипертензией позволила добиться значительного снижения гипертензии, сопоставимого с контрольной группой уже через 3 мес после оперативного вмешательства.

|
Рис. 4. Динамика средних значений легочной гипертензии в группах исследования Статистическая значимость различий значений оценена по критерию Манна–Уитни |
Нормализация давления в легочных артериях на фоне сосудистой вазодилатации в группе исследования способствует уменьшению давления в левом предсердии и значительному обратному ремоделированию по сравнению с группой контроля (см. табл. 2, р=0,01). Результатом обратного ремоделирования полостей сердца в исследуемой группе явились лучшая эффективность процедуры Maze IV и сохранность синусового ритма после оперативного вмешательства.
Хирургическая коррекция фибрилляции предсердий была выполнена пациентам обеих групп, но количество рецидивов фибрилляции было значительно больше в контрольной группе уже через 3 мес после операции (рис. 5).

|
Рис. 5. Сохранность синусового ритма в исследуемых группах после оперативного лечения (статистический анализ рассчитан по критерию 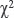 ) )
|
Группа исследования наглядно демонстрирует наилучшие показатели восстановления и сохранности синусового ритма в поcлеоперационном периоде за счет дополнительной хирургической коррекции высокой легочной гипертензии методом радиочастотной денервации ствола и устьев легочных артерий: уже через 3 мес 99,6% пациентов имели синусовый ритм, в то время как в группе контроля этот показатель был на уровне 80% (р=0,008).
В ходе проведенной исследовательской работы выполнен анализ неблагоприятных предикторов рецидива фибрилляции предсердий в экспериментальной группе (табл. 3), в группе контроля предикторы срыва ритма были классическими и не вызывали научного интереса.

|
Таблица 3. Предикторы рецидива фибрилляции предсердий у пациентов исследуемой группы (M±m) |
Результаты исследования демонстрируют высокие показатели рецидива фибрилляции предсердий у пациентов с длительным аритмическим анамнезом, атеросклеротическим поражением брахиоцефальных и церебральных сосудов, сопутствующей выраженной трикуспидальной недостаточностью, дилатацией левого желудочка, а также с высокой степенью легочной гипертензии.
Вероятность рецидива аритмии (фибрилляции предсердий) у пациентов с коррекцией митрального порока, процедурой Maze IV и денервацией легочных артерий в зависимости от стажа аритмии была рассмотрена более детально (рис. 6).

|
Рис. 6. Вероятность рецидива фибрилляции предсердий в зависимости от стажа аритмического анамнеза |
Проведенный анализ показал, что стаж фибрилляции предсердий более 5 лет практически у всех пациентов экспериментальной группы способствует рецидиву аритмии (p=0,04).
Степень легочной гипертензии, как показало исследование, также значительно повлияла на вероятность рецидива аритмии у пациентов экспериментальной группы (рис. 7).

|
Рис. 7. Вероятность рецидива фибрилляции предсердий в зависимости от исходной легочной гипертензии |
Исходное значение легочной гипертензии более 60 мм рт. ст. явилось прогностически неблагоприятным фактором возврата фибрилляции предсердий в послеоперационном периоде у пациентов с коррекцией клапанной патологии, процедурой Maze IV и денервацией легочных артерий.
Таким образом, в ходе проведенной работы проанализированы результаты хирургической коррекции легочной гипертензии у пациентов с пороком митрального клапана, фибрилляцией предсердий и высокой легочной гипертензией с использованием радиочастотной денервации легочного ствола и устьев легочных артерий. Несмотря на недостаточно большую выборку пациентов и отсутствие отдаленных результатов, полученные в экспериментальной группе данные позволяют говорить о значительном превосходстве показателей ремоделирования полостей сердца, снижения легочной гипертензии, увеличения сократительной способности миокарда и восстановления синусового ритма по сравнению с группой контроля. Снижение легочной гипертензии у таких пациентов происходит не только вследствие устранения порока митрального клапана, но и за счет вазодилатации мелких артерий и артериол и увеличения емкости малого круга кровообращения после дополнительной денервации симпатических нервных волокон ствола и устьев легочных артерий. Процедура денервации не влияет на ишемию миокарда во время операции, так как проводится на параллельном искусственном кровообращении, проста в исполнении и в нашей работе не сопровождалась специфическими осложнениями. В среднем время выполнения радиочастотной аблации легочных артерий составляло 5–7 мин.
Применение биполярного зажима-деструктора AtriCure позволяет выполнить денервацию легочных артерий циркулярно, по всей окружности сосудов, что значительно повышает эффективность методики (по сравнению с аблацией передней стенки) за счет тотального повреждения симпатических нервных сплетений, расположенных в стволе и устьях легочных артерий. В ходе работы продемонстрирована практическая значимость предложенной методики, ее эффективность и безопасность. Кроме того, при одномоментном хирургическом лечении фибрилляции предсердий путем выполнения процедуры Maze IV нет необходимости в использовании дополнительных расходных материалов, так как применяется один и тот же зажим-деструктор AtriCure.
Заключение
Циркулярная, радиочастотная денервация ствола и устьев легочных артерий является эффективным методом хирургического лечения вторичной легочной гипертензии у пациентов с пороками митрального клапана, осложненными фибрилляцией предсердий и высокой легочной гипертензией. Она способствует значительному обратному ремоделированию полостей сердца, в частности левого предсердия (p=0,01), снижению легочной гипертензии, восстановлению и сохранению синусового ритма после сопутствующей процедуры Maze IV (p=0,008).
Основными предикторами рецидива фибрилляции предсердий у пациентов с дисфункцией митрального клапана, сопутствующей фибрилляцией предсердий и высокой легочной гипертензией после комплексного хирургического лечения с использованием радиочастотной денервации являются стаж аритмии более 5 лет (p=0,04), исходная легочная гипертензия более 60 мм рт. ст. (p=0,028), сопутствующая выраженная трикуспидальная недостаточность (p=0,006) и атеросклеротическое поражение брахиоцефальных и церебральных сосудов.
Финансирование исследования. Работа не финансировалась никакими источниками.
Конфликт интересов отсутствует.
Литература
- Kim J.S., Lee S.A., Park J.B., Chee H.K., Chung J.W. Preoperative risk factor analysis of postoperative stroke after Cox-maze procedure with mitral valve repair. BMC Cardiovasc Disord 2014; 14(1): 166, https://doi.org/10.1186/1471-2261-14-116.
- Бокерия Л.А., Шенгелия Л.Д. Лечение фибрилляции предсердий. Часть II. Сегодняшние реалии и завтрашние перспективы. Анналы аритмологии 2014; 11(2): 76–86, https://doi.org/10.15275/annaritmol.2014.2.2.
- Тер-Акопян А.В., Ликов В.Ф., Алехин М.Н., Абрамов А.С., Тагаев Н.Б., Гогин Г.Е. Опыт эндоваскулярной имплантации устройства WATCHMAN у больных с фибрилляцией предсердий. Кардиология 2015; 55(9): 22–24.
- Сулимов В.А., Лишута А.С. Перспективы лечения пациентов с фибрилляцией предсердий. Рациональная фармакотерапия в кардиологии 2011; 7(3): 323–333.
- Трофимов Н.А., Медведев А.П., Бабокин В.Е., Демарин О.И., Жамлиханов Н.Х., Драгунов А.Г., Гартфельдер М.В., Николаева О.В., Драгунова М.В. Улучшение результатов хирургической коррекции сложных нарушений ритма и профилактика их рецидива у кардиохирургических пациентов. Альманах клинической медицины 2015; 38: 74–80.
- Белозеров Ю.М., Османов И.М., Магомедова Ш.М. Пролапс митрального клапана у детей и подростков. Том 1. М: Медпрактика-М; 2010; 132 с.
- Богачев-Прокофьев А.В., Сапегин А.В., Пивкин А.Н., Шарифулин Р.М., Афанасьев А.В., Овчаров М.А., Караськов А.М. Оценка частоты возникновения фибрилляции предсердий у больных с пороками митрального клапана и атриомегалией. Анналы аритмологии 2017; 14(2): 73–80, https://doi.org/10.15275/annaritmol.2017.2.2.
- Бабокин В.Е., Шипулин В.М., Антонченко И.В., Баталов Р.Е., Лукьяненок П.И., Айманов Р.В., Попов С.В. Радиочастотные метки в хирургическом лечении больных с постинфарктной аневризмой левого желудочка и желудочковыми тахикардиями. Грудная и сердечно-сосудистая хирургия 2011; 5: 23–28.
- Трофимов Н.А., Медведев А.П., Драгунов А.Г., Бабокин В.Е., Никольский А.В., Мизурова Т.Н., Гартфельдер М.В., Орлова А.В. Денервация легочного ствола и устьев легочных артерий у пациентов с хирургической коррекцией патологии митрального клапана на фоне высокой легочной гипертензии. Альманах клинической медицины 2017; 45(3): 192–199, https://doi.org/10.18786/2072-0505-2017-45-3-192-199.
- Трофимов Н.А., Медведев А.П., Бабокин В.Е., Жамлиханов Н.Х., Драгунов А.Г., Гартфельдер М.В., Николаева О.В., Драгунова М.В. Эффективность оперативного лечения митральной недостаточности, с фибрилляцией предсердий неишемической этиологии. Медицинский альманах 2014; 5(35): 165–169, https://doi.org/10.18786/2072-0505-2017-45-3-192-199.
- Шипулин В.М., Козлов Б.Н., Кривощеков Е.В., Казаков В.А., Лежнев А.А., Бабокин В.Е., Ватолина Т.В. Морфофункциональная характеристика миокарда пациентов с постинфарктным ремоделированием как возможная причина неблагоприятных результатов оперативного лечения. Грудная и сердечно-сосудистая хирургия 2009; 5: 37–41.
- Железнев С.И., Демидов Д.П., Афанасьев А.В., Назаров В.М., Демин И.И., Богачев-Прокофьев А.В., Астапов Д.А., Караськов А.М. Радиочастотная денервация легочной артерии при хирургической коррекции диспластических пороков митрального клапана с высокой легочной гипертензией. Российский кардиологический журнал 2016, 11: 70–72, https://doi.org/10.15829/1560-4071-2016-11-70-72.
- Мамчур С.Е., Хоменко Е.А., Чистюхин О.М., Курилин М.Ю., Иванов А.Ю. Эффективность и безопасность радиочастотной аблации медленных путей атриовентрикулярного проведения в орошаемом режиме с использованием нефлюороскопического навигационного картирования. Вестник аритмологии 2012; 69: 28–31.
- Kirchhof P., Benussi S., Kotecha D., Ahlsson A., Atar D., Casadei B., Castella M., Diener H.C., Heidbuchel H., Hendriks J., Hindricks G., Manolis A.S., Oldgren J., Popescu B.A., Schotten U., Van Putte B., Vardas P., Agewall S., Camm J., Baron Esquivias G., Budts W., Carerj S., Casselman F., Coca A., De Caterina R., Deftereos S., Dobrev D., Ferro J.M., Filippatos G., Fitzsimons D., Gorenek B., Guenoun M., Hohnloser S.H., Kolh P., Lip G.Y., Manolis A., McMurray J., Ponikowski P., Rosenhek R., Ruschitzka F., Savelieva I., Sharma S., Suwalski P., Tamargo J.L., Taylor C.J., Van Gelder I.C., Voors A.A., Windecker S., Zamorano J.L., Zeppenfeld K. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Europace 2016; 18(11): 1609–1678.
- Васковский В.А., Сергуладзе С.Ю. Возможности и перспективы хирургического лечения фибрилляции предсердий. Анналы аритмологии 2016; 13(2): 64–72, https://doi.org/10.15275/annaritmol.2016.2.1.
- Gillinov A.M., Gelijns A.C., Parides M.K., DeRose J.J. Jr., Moskowitz A.J., Voisine P., Ailawadi G., Bouchard D., Smith P.K., Mack M.J., Acker M.A., Mullen J.C., Rose E.A., Chang H.L., Puskas J.D., Couderc J.P., Gardner T.J., Varghese R., Horvath K.A., Bolling S.F., Michler R.E., Geller N.L., Ascheim D.D., Miller M.A., Bagiella E., Moquete E.G., Williams P., Taddei-Peters W.C., O’Gara P.T., Blackstone E.H., Argenziano M.; CTSN Investigators. Surgical ablation of atrial fibrillation during mitral-valve surgery. N Engl J Med 2015; 372(15): 1399–1409, https://doi.org/10.1056/nejmoa1500528.
- Hurdman J., Condliffe R., Elliot C.A., Davies C., Hill C., Wild J.M., Capener D., Sephton P., Hamilton N., Armstrong I.J., Billings C., Lawrie A., Sabroe I., Akil M., O’Toole L., Kiely D.G. ASPIRE registry: assessing the spectrum of pulmonary hypertension identified at a REferral centre. Eur Respir J 2012; 39(4): 945–955, https://doi.org/10.1183/09031936.00078411.
- Богунецкий А.А., Усов В.Ю., Бабокин В.Е. Магнитно-резонансная томография сердца с контрастным усилением: прогностическая роль в определении аритмогенного очага. Бюллетень сибирской медицины 2014; 13(1): 98–102.
- Simonneau G., Gatzoulis M.A., Adatia I., Celermajer D., Denton C., Ghofrani A., Gomez Sanchez M.A., Krishna Kumar R., Landzberg M., Machado R.F., Olschewski H., Robbins I.M., Souza R. Updated clinical classification of pulmonary hypertension. J Am Coll Cardiol 2013; 62(25 Suppl): D34–D41.
- Трофимов Н.А., Медведев А.П., Бабокин В.Е., Драгунов А.Г., Ефимова И.П., Гартфельдер М.В., Николаева О.В., Драгунова М.В., Созыкин А.В., Аверин Е.Е., Шлыков А.В., Новикова Н.Т. Эффективность процедуры PADN у пациентов с высокой легочной гипертензией на фоне дисфункции митрального клапана, осложненной фибрилляцией предсердий, и влияние на сохранность синусового ритма в послеоперационном периоде. Медицинский алфавит 2018; 4(37): 18–24.
- Rubin L.J. Primary pulmonary hypertension. N Engl J Med 1997; 336(2): 111–117, https://doi.org/10.1056/nejm199701093360207.
- Galiè N., Manes A., Negro L., Palazzini M., Bacchi-Reggiani M.L., Branzi A. A meta-analysis of randomized controlled trials in pulmonary arterial hypertension. Eur Heart J 2009; 30(4): 394–403, https://doi.org/10.1093/eurheartj/ehp022.
- Hoeper M.M., Barberà J.A., Channick R.N., Hassoun P.M., Lang I.M., Manes A., Martinez F.J., Naeije R., Olschewski H., Pepke-Zaba J., Redfield M.M., Robbins I.M., Souza R., Torbicki A., McGoon M. Diagnosis, assessment, and treatment of non-pulmonary arterial hypertension pulmonary hypertension. J Am Coll Cardiol 2009; 54(1 Suppl): S85–S96, https://doi.org/10.1016/j.jacc.2009.04.008.
- Guazzi M., Vitelli A., Labate V., Arena R. Treatment for pulmonary hypertension of left heart disease. Curr Treat Options Cardiovasc Med 2012; 14(4): 319–327, https://doi.org/10.1007/s11936-012-0185-6.
- Osorio J., Russek M. Reflex changes on the pulmonary and systemic pressures elicited by stimulation of baroreceptors in the pulmonary artery. Circ Res 1962; 10(4): 664–667, https://doi.org/10.1161/01.res.10.4.664.
- Baylen B.G., Emmanouilides G.C., Juratsch C.E., Yoshida Y., French W.J., Criley J.M. Main pulmonary artery distention: a potential mechanism for acute pulmonary hypertension in the human newborn infant. J Pediatr 1980; 96(3 Pt 2): 540–544, https://doi.org/10.1016/s0022-3476(80)80863-8.
- Juratsch C.E., Jengo J.A., Castagna J., Laks M.M. Experimental pulmonary hypertension produced by surgical and chemical denervation of the pulmonary vasculature. Chest 1980; 77(4): 525–530, https://doi.org/10.1378/chest.77.4.525.
- Chen S.L., Zhang F.F., Xu J., Xie D.J., Zhou L., Nguyen T., Stone G.W. Pulmonary artery denervation to treat pulmonary arterial hypertension: the single-center, prospective, first-in-man PADN-1 study (first-in-man pulmonary artery denervation for treatment of pulmonary artery hypertension). J Am Coll Cardiol 2013; 62(12): 1092–1100, https://doi.org/10.1016/j.jacc.2013.05.075.
- Zhang H., Zhang J., Xie D.J., Jiang X., Zhang F.F., Chen S.L. Pulmonary artery denervation for treatment of a patient with pulmonary hypertension secondary to left heart disease. Pulm Circ 2016; 6(2): 240–243, https://doi.org/10.1086/685550.
- Song X., Zhang C., Chen X., Chen Y., Shi Q., Niu Y., Xiao J., Mu X. An excellent result of surgical treatment in patients with severe pulmonary arterial hypertension following mitral valve disease. J Cardiothorac Surg 2015; 10(1): 70, https://doi.org/10.1186/s13019-015-0274-1.
- Briongos Figuero S., Moya Mur J.L., García-Lledó A., Centella T., Salido L., Aceña Navarro Á., García Martín A., García-Andrade I., Oliva E., Zamorano J.L. Predictors of persistent pulmonary hypertension after mitral valve replacement. Heart Vessels 2016; 31(7): 1091–1099, https://doi.org/10.1007/s00380-015-0700-2.
- Богачев-Прокофьев А.В., Железнев С.И., Афанасьев А.В., Фоменко М.С., Демидов Д.П., Шарифулин Р.М., Пивкин А.Н., Астапов Д.А., Семенова Е.И., Иванов С.Н., Караськов А.М. Аблация ганглионарных сплетений легочной артерии при хирургическом лечении пороков митрального клапана у пациентов с высокой легочной гипертензией. Патология кровообращения и кардиохирургия 2015; 19(4): 19–25.
- Трофимов Н.А., Медведев А.П., Драгунов А.Г., Никольский А.В., Мизурова Т.Н., Гартфельдер М.В., Орлова С.А., Николаева О.В., Драгунова М.В. Способ хирургического лечения вторичной легочной гипертензии у пациентов с хирургической коррекцией патологии митрального клапана. Медицинский альманах 2017; 3(48): 33–37, https://doi.org/10.21145/2499-9954-2017-3-33-37.










