Цифровой электрокардиографический комплекс для оценки электрической нестабильности миокарда и его возможности
Цель работы — разработка электрокардиографического программно-аппаратного комплекса для оценки электрической нестабильности миокарда и исследование его диагностических и прогностических возможностей в кардиологической клинике.
Материалы и методы. Разработан программно-аппаратный комплекс «Интекард 7.3», позволяющий измерять в режиме beat-to-beat флуктуации амплитудно-временных параметров ЭКГ. «Интекард 7.3» оценивает совокупность ЭКГ-маркеров, отражающих электрическую нестабильность миокарда. Среди них фрагментированный комплекс QRS, пространственный угол QRS-T, альтернация Т-волны, продолжительность и дисперсия интервала Q–T, турбулентность и ускорение/замедление сердечного ритма.
Клинические испытания комплекса «Интекард 7.3» проведены у 734 пациентов с ишемической болезнью сердца или кардиомиопатией и 112 здоровых лиц.
Результаты. «Интекард 7.3» надежно выявляет фрагментированные комплексы QRS путем обнаружения коротких спайков <25 мс на фронтах зубцов Q, R и S. Угол QRS-T измеряется по реперным амплитудам зубцов R и T в отведениях avF, V2, V5 и V6. Прецизионная цифровая обработка ЭКГ-сигнала позволяет повысить точность анализа до нескольких микровольт и микросекунд.
Программно измерялась амплитуда Т-волны в каждом из 300–500 кардиобитов, по методу бегущей средней оценивалась ее альтернация. В типичном кардиобите рассчитывалась дисперсия интервала Q–T по 12 отведениям ЭКГ. По данным последовательности R–R-интервалов определялись турбулентность и замедление сердечного ритма.
В период наблюдения 5,0 [2,1; 5,9] года у 90 из 734 пациентов (12,3%) зафиксированы неблагоприятные кардиоваскулярные события (НКС). Установлено, что электрическая нестабильность миокарда статистически значимо выше у пациентов с НКС в сравнении с пациентами без них. Частота выявления фрагментированных QRS составила 72,2±4,7 против 16,8±1,5% (p<0,01); угол QRS-T — 128 [55; 101] против 80 [53; 121]° (p<0,001); альтернация Т-волны — 36,9 [15,5; 62,1] против 21,9 [10,2; 30,7] мкВ (p<0,005); интервал Q–T — 408 [383; 438] против 376 [351; 400] мс (p<0,001); дисперсия интервала Q–T — 76 [57; 96] против 64 [50; 92] мс (p<0,005) соответственно. У пациентов с НКС превышено пороговое значение начала патологической турбулентности ритма (>0%) в сравнении с группой контроля (здоровые лица) (p<0,001) и снижено замедление сердечного ритма от 19,2 [2,2; 38,0] до 8,8 [4,0; 16,8] мс (p<0,05).
Разработана персонифицированная модель риск-стратификации НКС. Площадь под ROC-кривой составила 0,856; чувствительность — 75%; специфичность — 78%; предиктивная точность — 77%.
Заключение. Цифровой электрокардиографический комплекс «Интекард 7.3» по данным ЭКГ-маркеров электрической неста-бильности миокарда поволяет прогнозировать опасные желудочковые тахиаритмии и внезапную сердечную смерть с предиктивной точностью 77%. Неинвазивность, высокая производительность и приемлемая стоимость обеспечивают доступность технологии прогнозирования во всех звеньях здравоохранения.
Введение
Прогресс электрокардиографии (ЭКГ) стал возможен с развитием прецизионных методов цифровой обработки сигналов. Новые диагностические качества ЭКГ раскрылись при применении дисперсионного, высокочастотного и фазового анализа. Получен визуальный портрет миокарда, выявляющий зоны ишемии [1], высокочастотные компоненты ЭКГ позволили диагностировать стенозы в правой коронарной артерии [2], установлено, что фазовый анализ ЭКГ — более чувствительный, чем временной [3]. Эти и аналогичные разработки демонстрируют неисчерпаемый диагностический потенциал метода.
С начала 2000-х гг. развивается направление, связанное с анализом в режиме beat-to-beat флуктуаций амплитудно-временных параметров ЭКГ. Тесную зависимость дисперсионных флуктуаций с риском жизненно опасных аритмий и смертностью обнаружила R. Lampert [4], она же ввела в медицинскую практику термин «раздраженное сердце». Позже такое состояние было обобщено в названии «электрическая нестабильность миокарда». ЭКГ-маркерами электрической нестабильности в фазе деполяризации выступают фрагментация комплекса QRS и пространственный угол QRS-T. Нестабильность в фазе реполяризации отражают альтернация Т-волны, длительность и дисперсия интервала Q–T. ЭКГ-маркерами дисфункции вегетативного контроля сердечной деятельности считаются турбулентность и замедление/ускорение сердечного ритма. Для всех маркеров электрической нестабильности миокарда приняты международные консенсусы по стандартам измерения и клинической интерпретации [5–10]. В комплексе маркеры обладают диагностическими и прогностическими возможностями, расширяющими потенциал традиционной ЭКГ. Однако до сих пор лимитирующим фактором при использовании их в клинической практике является отсутствие специализированного программно-аппаратного обеспечения для их анализа.
Цель исследования — разработка электрокардиографического программно-аппаратного комплекса для изучения электрической нестабильности миокарда и оценки его диагностических и прогностических возможностей в кардиологической клинике.
Материалы и методы
Исследование выполнено на разработанном нами программно-аппаратном комплексе «Интекард 7.3», который путем прецизионной цифровой обработки ЭКГ-сигнала оценивает вышеупомянутые маркеры электрической нестабильности миокарда (ЭНМ) по данным 5–7-минутных записей ЭКГ в 12 стандартных отведениях. Комплекс создан на платформе 12-канального цифрового ЭКГ-коммуникатора, компьютера и лазерного принтера. Диапазон измерения ЭКГ-сигналов составляет от 0,03 до 5 мВ, входной импеданс >10 МОм, коэффициент ослабления синфазной помехи — 110 дБ, постоянная времени >3,2 с, частота квантования — 1000 Гц/канал, разрядность — 24 бита, выходной интерфейс — USB 2.0. Комплекс оснащен комплектом адаптивных цифровых фильтров сетевой, мышечной и дыхательной помех, не искажающих нативную форму ЭКГ.
В соответствии с международными стандартами ЭНМ в фазе деполяризации выявляли при фрагментации комплексов frQRS в двух и более отведениях ЭКГ и/или угле QRS-T>1050. ЭНМ в фазе реполяризации фиксировали при альтернации T-волны >47 мкВ и/или дисперсии интервала Q–T >70 мс. Дисфункцию вегетативного контроля определяли при патологической турбулентности сердечного ритма (начало >0%, наклон <15 мс/R–R) и/или замедлении сердечного ритма <4,5 мс.
Для оценки диагностических и прогностических возможностей комплекса «Интекард 7.3» было обследовано 846 человек, из них 734 пациента с ишемической болезнью сердца или кардиомиопатией, средний возраст — 50±15 лет, и 112 здоровых лиц, средний возраст — 31±14 лет (группа контроля). У пациентов фиксировали следующие неблагоприятные кардиоваскулярные события (НКС): устойчивую желудочковую тахикардию, фибрилляцию желудочков, успешную сердечно-легочную реанимацию, разряды имплантированных устройств и признаки внезапной сердечной смерти. Период наблюдения за пациентами составил 5,0 [2,1; 5,9] года. Исследование проведено в соответствии с Хельсинкской декларацией (2013) и одобрено Этическим комитетом Республиканского научно-практического центра «Кардиология». От всех пациентов получено письменное информированное согласие.
Статистический анализ. Обработка данных выполнена с помощью прикладных пакетов Statistica 10.0 (Stat Soft) и SPSS Statistics 23.0 (IBM). Результаты представлены в виде M±SD или Me [Q1; Q3] в зависимости от типа распределения. Проверку нормальности распределения выполняли с помощью критерия Шапиро–Уилка. Применяли метод категориальной регрессии, значения относительного риска определяли при 95% доверительном интервале. При анализе различий между группами использовали t-критерий Стьюдента, критерий 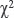 Пирсона или U-критерий Манна–Уитни в зависимости от типа распределения. Качество прогностической модели оценивали площадью под ROC-кривой и предиктивной точностью. Критическое значение уровня статистической значимости при проверке нулевых гипотез принималось равным 0,05.
Пирсона или U-критерий Манна–Уитни в зависимости от типа распределения. Качество прогностической модели оценивали площадью под ROC-кривой и предиктивной точностью. Критическое значение уровня статистической значимости при проверке нулевых гипотез принималось равным 0,05.
Результаты
Путем прецизионной цифровой обработки ЭКГ-сигнала комплекс «Интекард 7.3» позволил повысить точность анализа до нескольких микровольт и микросекунд, что отражает эволюционный переход к 4-му поколению электрокардиографии. Это дает возможность надежно идентифицировать фрагментированные комплексы QRS (frQRS), которые признаны маркерами рубцовых изменений, ишемии и фиброза ткани миокарда. В окрестности данных зон формируются пограничные слои с замедленной скоростью проводимости возбуждения. На ЭКГ это проявляется в виде коротких спайков длительностью менее 25 мс на зубцах Q, R или S. Если обычный электрокардиограф еще зафиксирует расщепление вершины R-зубца, то спайки на фронтах Q, R, S останутся незамеченными. С помощью «Интекарда 7.3» при частоте дискретизации 1000 Гц фиксируется достаточное количество отсчетов ЭКГ, позволяющее с помощью высших производных идентифицировать спайки frQRS. Это наглядно видно при сравнении ЭКГ, зарегистрированной на аппарате с верхней частотой полосы пропускания 40 Гц (рис. 1, а), и этой же ЭКГ, зарегистрированной c частотой дискретизации 1000 Гц и верхней частотой полосы пропускания более 100 Гц (рис. 1, б). На второй ЭКГ отчетливо проявились незамеченные ранее спайки frQRS.
При наличии неоднородностей в структуре миокарда градиент волны возбуждения дефрагментируется, что приводит к затягиванию фазы деполяризации и задержке фазы реполяризации. Степень неоднородности матрикса миокарда пропорциональна значению угла между векторами QRS и T. Для измерения угла QRS-T обычно используют ортогональные отведения XYZ. Мы же оценивали угол QRS-T по методике, адаптированной к 12 отведениям ЭКГ [11]. Использовались отведения avF, V2, V5 и V6, в которых нативные амплитуды R и T были преобразованы в соответствующие реперные точки:
QRSrep = R – abs(max Q или S),
Trep = T(+) – absT(–),
где QRSrep — реперное значение QRS; R — амплитуда R; abs — абсолютное значение; max — максимум среди зубцов Q или S; Trep — реперное значение Т-волны; T(+), T(–) — наибольшие положительная и отрицательная амплитуды Т-волны.
Программа «Интекард 7.3» накапливает 300–500 кардиобитов и измеряет амплитуды Т-волны в каждом из них. С помощью метода бегущей средней определяются усредненные значения Т в четных и нечетных кардиобитах. Разность между ними служит мерой альтернации Т-волны, измеряемой в микровольтах [7]. Кроме того, в типичном кардиобите измеряется дисперсия интервала Q–T как разность между максимальным и минимальным значениями Q–T в 12 отведениях ЭКГ [8].
При обнаружении желудочковой экстрасистолы выполняется измерение параметров турбулентности сердечного ритма: TO — начало и TS — наклон [10]. Одновременно в программе «Интекард 7.3» предусмотрено дефрагментирование последовательности интервалов R–R на участки ускорения и замедления. Методом синхронного детектирования измеряются ускорение и торможение сердечного ритма [10].
В процессе клинических испытаний комплекса «Интекард 7.3» у 644 из 734 пациентов (87,7%) не зафиксированы НКС, а у 90 пациентов (12,3%) неблагоприятные события обнаружены. В табл. 1 представлены результаты оценки ЭКГ-маркеров ЭНМ у здоровых лиц (контроль) и у пациентов без и с НКС.

|
Таблица 1. Значения ЭКГ-маркеров электрической нестабильности миокарда у здоровых лиц и пациентов кардиологического профиля (Me [Q1; Q3]) |
Из табл. 1 следует, что параметры ЭНМ в 1-й группе и у пациентов 2-й группы практически не отличаются и, наоборот, статистически значимые различия значений ЭКГ-маркеров ЭНМ зафиксированы у пациентов 2-й и 3-й групп. Так, у пациентов 3-й группы статистически значимо выше ЭКГ-маркеры ЭНМ в фазе деполяризации — частота обнаружения фрагментированных QRS (p<0,01) и значение угла QRS-T (p<0,001), а также в фазе реполяризации — альтернация Т-волны, длительность и дисперсия интервала Q–T (p<0,005). Маркеры вегетативной нервной регуляции — турбулентность и замедление сердечного ритма — статистически значимо не различались.
Обсуждение
Клинические испытания комплекса «Интекард 7.3» показали возможность извлечения из ЭКГ полезной диагностической и прогностической информации. Например, традиционный маркер Q-зубец нивелируется либо исчезает после инфаркта миокарда. В отличие от него фрагментированный комплекс QRS стабилен во времени и потому его чувствительность в 2,3 раза выше [12]. Кроме того, frQRS позволяет дифференцировать локализацию стенозов коронарных артерий. Так, наличие frQRS в грудных отведениях V1–V6 свидетельствует о стенозе в левой коронарной артерии, а если frQRS в нижних отведениях II, III, avF — то в правой [13].
По нашим данным, только у пациентов 3-й группы с НКС превышено пороговое значение угла QRS-T — 105°, что свидетельствует о значимом нарушении синергичности процессов возбуждения и релаксации миокарда.
У пациентов 3-й группы (НКС) ЭНМ в фазе реполяризации была выражена повышением альтернации Т-волны в 2 раза и дисперсии интервала Q–T на 18% в сравнении со 2-й группой. Не случайно, что фазу реполяризации считают наиболее уязвимой при аритмогенезе. В данной группе также статистически значимо изменились показатели турбулентности и замедления сердечного ритма в сравнении с группой контроля, что указывает на ухудшение эффективности вегетативной нервной регуляции.
Статистически значимые различия ЭКГ-маркеров ЭНМ у пациентов без и с НКС были положены в основу прогностической модели. Включены фрагментированный комплекс QRS, угол QRS-T, альтернация T-волны и интервал Q–T, обладающие наибольшей площадью под ROC-кривой. Определены «коэффициенты важности», отражающие влияние каждого из маркеров ЭНМ на вероятность развития НКС. В табл. 2 показаны значения относительного риска и коэффициенты регрессии модели риск-стратификации, разработанной с помощью метода категориальной регрессии с оптимальным шкалированием.

|
Таблица 2. Значения относительного риска и коэффициенты модели риск-стратификации на основе ЭКГ-маркеров электрической нестабильности миокарда |
Модель с нормированными коэффициентами имеет следующий вид:
F(x)=a1·x1+a2·x2+a3·x3+a4·x4,
где F(x) — интегральный индекс ЭНМ; x1=1, если frQRS обнаружен, в противном случае — 0; x2=1, если угол QRS-T >105°, в противном случае — 0; x3=1, если альтернация Т-волны >47 мкВ, в противном случае — 0; x4=1, если интервал Q–T >395 мс, в противном случае — 0; a1=46; a2=27; a3=15; a4=12.
Если значение индекса F(x) ЭНМ находится в диапазоне 0–25, то риск НКС низкий; при 25–50 — средний; при 50–75 — высокий и при >75 — критический.
Качество модели риск-стратификации оценивалось площадью под ROC-кривой — AUC. В данном случае AUC=0,856, чувствительность — 75%, специфичность — 78%, предиктивная точность — 77%, что говорит о хорошем качестве прогностической модели (рис. 2). Полученную точность прогноза 77% можно считать приемлемой.
Известные модели риск-стратификации Euroscore II, Timi, Seattle Risk Score и другие основаны на традиционных популяционных факторах риска. Они хорошо предсказывают госпитальную смертность (AUC — 0,73–0,87), однако в долгосрочном периоде их точность резко падает [14]. В отличие от них разработанная нами технология прогноза является персонифицированной, так как основана на биоэлектрической активности миокарда конкретного пациента. По данным индекса ЭНМ можно выявлять лиц с высоким риском внезапной сердечной смерти и рекомендовать им имплантацию ритм-поддерживающих систем.
Лимитирующие факторы исследования — моноцентровый характер и отсутствие в РФ и Республике Беларусь стандартов по применению ЭКГ-маркеров ЭНМ в клинической практике.
Заключение
Цифровой электрокардиографический программно-аппаратный комплекс «Интекард 7.3» поволяет прогнозировать опасные желудочковые тахиаритмии и внезапную сердечную смерть по данным ЭКГ-маркеров электрической нестабильности миокарда с предиктивной точностью 77%.
Неинвазивность, высокая производительность и приемлемая стоимость обеспечивают доступность технологии прогнозирования всем звеньям здравоохранения, в том числе первичным.
Финансирование исследования. Работа выполнена в рамках НИОКР №408 Республиканского научно-практического центра «Кардиология» (Республика Беларусь) в 2017–2019 гг.
Конфликты интересов, связанные с данной статьей, отсутствуют.
Литература
- Сула А.С., Рябыкина Г.В., Гришин В.Г. ЭКГ-анализатор «Кардиовизор-06C»: новые возможности выявления ишемии миокарда при скрининговых обследованиях и перспективы использования в функциональной диагностике. Функциональная диагностика 2003; 2: 64–77.
- Kolosova K.S., Grigoryeva N.Yu., Kosyuga Yu.I. High-frequency ECG for detection of myocardial ischemia associated with right coronary artery stenosis in IHD patients. Sovremennye tehnologii v medicine 2020; 12(1): 86–91, https://doi.org/10.17691/stm2020.12.1.11.
- Минина Е.Н., Файнзильберг Л.С. Анализ состояния сердечно-сосудистой системы по совокупности признаков фазового пространства одноканальной ЭКГ. Российский кардиологический журнал 2015; 12: 7–13.
- Lampert R. ECG signatures of physiological stress. J Electrocardiol 2015; 48(6): 1000–1005, https://doi.org/10.1016/j.jelectrocard.2015.08.005.
- Pietrasik G., Zaręba W. QRS fragmentation: diagnostics and prognostic significance. Cardiol J 2012; 19(2): 114–121, https://doi.org/10.5603/cj.2012.0022.
- Kardys I., Kors J.A., van der Meer I.M., Hofman A., van der Kuip D.A., Witterman J.C. Spatial QRS-T angle predicts cardiac death in general population. Eur Heart J 2003; 24(14): 1357–1364, https://doi.org/10.1016/s0195-668x(03)00203-3.
- Verrier R.L., Klingenheben T., Malik M., El-Sherif N., Exner D.V., Hohnloser S.H., Ikeda T., Martínez J.P., Narayan S.M., Nieminen T., Rosenbaum D.S. Microvolt T-wave alternans. Physiological basic, methods of measurement, and clinical utility — consensus guideline by International Society for Holter and Noninvasive Electrocardiology. J Am Coll Cardiol 2011; 58(13): 1309–1324, https://doi.org/10.1016/j.jacc.2011.06.029.
- Malik M., Batchvarov V.N. Measurement, interpretation, and clinical potential of QT interval dispersion. J Am Coll Cardiol 2000; 36(6): 1749–1766, https://doi.org/10.1016/s0735-1097(00)00962-1.
- Bauer A., Malik M., Schmidt G., Barthel P., Bonnemeier H., Cygankiewicz I., Guzik P., Lombardi F., Müller A., Oto A., Schneider R., Watanabe M., Wichterle D., Zareba W. Heart rate turbulence: standards of measurement, physiological interpretation, and clinical use: International Society for Holter and Noninvasive Electrophysiology Consensus. J Am Coll Cardiol 2008; 52(17): 1353–1365, https://doi.org/10.1016/j.jacc.2008.07.041.
- Bauer A., Kantelhardt J.W., Barthel P., Schneider R., Mäkikallio T., Ulm K., Hnatkova K., Schömig A., Huikuri H., Bunde A., Malik M., Schmidt G. Deceleration capacity of heart rate as a predictor of mortality after myocardial infarction: cohort study. Lancet 2006; 367(9523): 1674–1681, https://doi.org/10.1016/s0140-6736(06)68735-7.
- Rautaharju P.M., Prineas R.J., Zhang Z.M. A simple procedure for estimation of the spatial QRS/T angle from the standard 12-lead electrocardiogram. J Electrocardiol 2007; 40(3): 300–304, https://doi.org/10.1016/j.jelectrocard.2006.11.003.
- Das M.K., Khan B., Jakob S., Kumar A., Mahenthiran J. Significance of fragmented QRS complex versus a Q wave in patients with coronary artery disease. Circulation 2006; 113(21): 2495–2501, https://doi.org/10.1161/circulationaha.105.595892.
- Sharma S., Jayakumar T., Rupesh G., Rajesh G., Chamanshaikh S.N., Deofi G., Abdulkhamar S. Significance of fragmented QRS complex in acute coronary syndrome and its correlation with coronary angiography to identify the culprit lesion. Int J Sci Stud 2016; 4(4): 246–252.
- Czub P., Cacko A., Gawałko M., Tataj E., Poliński J., Pawlik K., Cichoń R., Hendzel P. Perioperative risk assessment wih Euroscore and Euroscore II in patients with coronary artery and valvular desease. Medicine (Baltimore) 2018; 97(50): e13572, https://doi.org/10.1097/md.0000000000013572.












