Диагностические возможности островковых аутоантител у детей с впервые выявленным сахарным диабетом 1-го типа и здоровых сибсов
Цель исследования — в рамках создания скрининговой программы определить диагностическую ценность отдельных островковых аутоантител и их комбинаций для выявления лиц, предрасположенных к сахарному диабету 1-го типа (СД 1), среди здоровых сибсов в детской популяции.
Материалы и методы. Обследовано 424 ребенка, из них 260 детей с впервые выявленным СД 1 и 164 здоровых, имеющих братьев и/или сестер с СД 1. У всех участников с помощью иммуноферментного анализа проведено исследование крови на комплекс аутоантител: к инсулину (IAA), тирозинфосфатазе (IA-2A), транспортеру цинка 8 (ZnT8A), β-клеткам поджелудочной железы (ICA), глутаматдекарбоксилазе (GADA).
Результаты. Установлено, что диагностическая ценность отдельных аутоантител не одинакова и варьирует в зависимости от возраста. Определены оптимальные возрастные группы для иммунологического контроля риска развития СД 1 среди здоровых сибсов. Наиболее высокие риски отмечены при комбинации GADA, ZnT8A и IA-2А.
Заключение. Островковые аутоантитела могут служить прогностическими маркерами риска развития СД 1 у здоровых сибсов.
Введение
Появление аутоантител к антигенам островковых клеток (ААТ) является установленным признаком развития аутоиммунной реакции, направленной против инсулинпродуцирующих β-клеток и характеризующей начало доклинической стадии сахарного диабета 1-го типа (СД 1). В качестве маркеров аутоиммунного воспаления в настоящее время используют пять основных видов ААТ: к инсулину (IAA), островковым клеткам (ICA), декарбоксилазе глутаминовой кислоты 65 (GADА), тирозинфосфатазе (IA-2А) и транспортеру цинка 8 (ZnT8А) [1].
Результаты анализов на ААТ показали свою неоднозначность. Установлено, что риск развития СД 1 растет с увеличением количества определяемых видов ААТ. Однако наличие ААТ отличается нестабильностью. В процессе динамического наблюдения они могут исчезать, особенно в случае присутствия одного положительного вида ААТ [2]. Структура ААТ также может варьировать без видимой закономерности, а титры не всегда увеличиваются к моменту манифестации СД 1, что затрудняет их прогностическую интерпретацию [3]. Кроме того, существуют возрастные и этнические особенности присутствия тех или иных ААТ.
В рамках практической реализации научной идеи по созданию моноклональных антител для предупреждения развития СД 1 проводится разработка скрининговой программы по выявлению пациентов на доклинической стадии развития СД 1, имеющих достаточный запас функционирующих островков и, соответственно, потенциал для дальнейшей иммунотерапии. Одним из возможных путей для выявления целевой группы служит оценка прогностических возможностей известных ААТ. Несмотря на большое количество исследований, посвященных теме изучения ААТ при СД 1, диагностическая ценность определения отдельных ААТ на различных стадиях развития СД 1, выбор целевой группы, оптимальные возрастные и временные периоды наблюдения по-прежнему представляют большой научный и практический интерес.
Цель исследования — в рамках создания скрининговой программы определить диагностическую ценность определения отдельных островковых аутоантител и их комбинаций для выявления лиц, предрасположенных к сахарному диабету 1-го типа среди здоровых сибсов в детской популяции.
Материалы и методы
Обследовано 424 ребенка в Нижегородской области, Чувашии и Республике Марий Эл, из них 260 детей с впервые выявленным СД 1 (1-я группа) и 164 здоровых, имеющих братьев и/или сестер с СД 1 (2-я группа). Группы статистически значимо не различались по возрасту и полу. Возраст в 1-й группе составил 8 [4,5; 11] лет, во 2-й группе — 8 [4; 15] лет. Соотношение мальчиков и девочек — 57,7 и 42,3% в группе с СД 1, 58,5 и 41,5% в группе без СД 1 соответственно.
Исследование проведено в соответствии с Хельсинкской декларацией (2013) и одобрено Этическим комитетом Приволжского исследовательского медицинского университета. От родителей пациентов получено информированное согласие.
Всем пациентам с впервые выявленным СД 1 и здоровым сибсам выполняли анализ крови на ААТ, гликированный гемоглобин (HbA1c) и С-пептид. Использовали тест-системы для твердофазного иммуноферментного анализа на абсорбционном микропланшетном фотометре Sunrise Tecan (Austria GmbH, Австрия): антитела IgG к инсулину — IAA (Orgentec, Германия), тирозинфосфатазе — IA-2A (Medipan, Германия), транспортеру цинка 8 — ZnT8A (Medipan), β-клеткам поджелудочной железы — ICA (Biomerica, США), глутаматдекарбоксилазе — GADA (Euroimmun AG, Германия). Значения ААТ выше референсных считались положительными. Анализ HbA1c проводился методом высокоэффективной жидкостной хроматографии на анализаторе VARIANT IV TURBO (Bio-RAD, США/Франция), С-пептида — методом твердофазного хемилюминесцентного иммyноанализа на анализаторе IMMULITE 2000XPi (Siemens Healthcare Diagnostics, США).
Статистическая обработка данных выполнена с использованием программы Statistica 12.0. Количественные величины представлены в виде медианы и интерквартильного интервала [Q1; Q3], дискретные данные — в виде частот признака (в процентах). Распределение признаков не соответствовало закону нормального распределения согласно критерию Шапиро–Уилка. Анализ сравнения медиан независимых выборок проводили с помощью непараметрического критерия Манна–Уитни и критерия Краскела–Уоллиса. Статистический анализ распределения частот осуществляли с использованием таблиц сопряженности и критерия 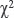 с поправкой Йетса на непрерывность. Изучение количественной взаимосвязи между признаками выполняли с помощью метода ранговой корреляции Спирмена. Статистически значимыми считали различия при уровне значимости p<0,05.
с поправкой Йетса на непрерывность. Изучение количественной взаимосвязи между признаками выполняли с помощью метода ранговой корреляции Спирмена. Статистически значимыми считали различия при уровне значимости p<0,05.
Результаты
Медиана возраста манифестации СД 1 составила 8 [4,5; 11] лет с увеличением заболеваемости в диапазоне возраста от 2 до 12 лет (74) в сравнении с 12% случаев в возрасте до 2 лет и 14% — после 12 лет (р<0,001).
Сравнительная характеристика частоты встречаемости отдельных положительных ААТ в группах представлена в табл. 1. У подавляющего большинства детей с впервые выявленным СД 1 определялись положительные GADA, далее с одинаковой частотой следовали IA-2A и ZnT8A. В группе здоровых детей с положительными ААТ превалировали также GADA, несколько реже регистрировались ICA и IA-2A. Группы статистически значимо не отличались по частоте встречаемости ICA.
 |
Таблица 1. Частота встречаемости отдельных ААТ в группах, % |
В группе здоровых у большинства детей (88,4%) ААТ отсутствовали или отмечалось только одно ААТ. Почти в половине случаев при манифестации СД 1 встречалась комбинация из трех ААТ. В 3,8% случаев ААТ отсутствовали (табл. 2).

|
Таблица 2. Суммарное количество ААТ у пациентов в группах, % |
На рис. 1 у детей с впервые выявленным СД 1 и здоровых представлена частота встречаемости как отдельных ААТ, так и их комбинаций. Среди детей с СД 1 и единичными ААТ в 61% случаев наблюдались положительные GADA и в 25% случаев — ZnT8A. Интересно, что в этой группе не встречались IА-2A. Получены положительные корреляции между уровнями титров GADA/IA-2A (R=0,472; p<0,0001), GADA/ZnT8A (R=0,212; p<0,0005) и IA-2A/ZnT8A (R=0,389; p<0,0001). Наиболее частое сочетание положительных ААТ образовывали пары GADA/IA-2A и IA-2A/ZnT8A (р<0,001). У 91% детей с впервые выявленным СД 1 регистрировали сочетание GADA/IA-2A/ZnT8A.

|
Рис. 1. Распределение ААТ среди пациентов, серопозитивных по нескольким аутоантителам:
а — по одному; б — по двум; в — по трем |
В группе здоровых детей подобные комбинации встречались с меньшей частотой: GADA/IA-2A — у 33%, GADА/ZnT8A — у 25%. Наблюдалась положительная взаимосвязь между уровнем титров IA-2A/ZnT8A (R=0,192; p<0,014). По одному ребенку имели сочетание GADA/ICA/IA-2A, GADA/ICA/IAA или GADA/ICA/ZnT8A и 4 ребенка — GADA-IA-2A/ZnT8A. Через 6 мес у 2 детей с последней комбинацией манифестировал СД 1.
Возраст манифестации СД 1 (рис. 2) положительно коррелировал с титром ZnT8A (R=0,126; р=0,043) и отрицательно — с титром IAA (R=–0,226; р=0,0003). Медиана возраста у ZnT8A-позитивных детей составила 8 [5; 11] лет в сравнении с 7 [3; 11] годами у ZnT8A-негативных детей (р=0,044). Положительные IAA в свою очередь регистрировались в более младшем возрасте. Медиана возраста с IAA-позитивными результатами составила 3 [2,5; 5] года в сравнении с 8 [5; 11] годами у лиц с IAA-негативными (р=0,0003). Доминирующими ААТ в возрасте до 2 лет были GADA (83%) и IA-2А (42%). ZnT8А, IAA и ICA составили 30, 17 и 17% соответственно.

|
Рис. 2. Частота встречаемости впервые выявленного СД 1 в зависимости от возраста |
Анализ подгрупп по возрасту манифестации СД 1 показал, что статистически значимо чаще выявление положительных IAA регистрировалось в дошкольном периоде жизни (0–6 лет) — 15% в сравнении с младшим школьным (7–12 лет) — 3% и подростковым (13 лет и старше) возрастами — 3% (р=0,001). По остальным ААТ значимых различий не установлено. В группе здоровых сибсов каких-либо закономерностей обнаружить не удалось.
Дети с СД 1 младшего возраста характеризовались наличием более высоких титров IAA. Титр ZnT8A имел тенденцию к увеличению в возрасте 7–12 лет с дальнейшим снижением. В группе здоровых детей титр любых ААТ был значительно ниже, за исключением тенденции к увеличению титра IAA в более младшем возрасте (табл. 3).

|
Таблица 3. Титр ААТ в возрастных подгруппах исследуемых детей, Me [Q1; Q3] |
Анализ титров ААТ в зависимости от возраста манифестации заболевания (рис. 3) показал, что медианы титров GADA и IAA имели стабильно устойчивые значения во всех возрастных группах, несколько снижаясь у GADA в возрасте 3 лет. Медианы титров IA-2A и ZnT8A отличались в целом однонаправленными пилообразными колебаниями, тренд которых увеличивался после достижения двухлетнего возраста и снижался после 12 лет.

|
Рис. 3. Медиана титров ААТ в зависимости от возраста манифестации СД 1 |
В процессе наблюдения у 4 мальчиков из здоровых сибсов манифестировал СД 1. Данные доступны для двух детей. Пациент М. заболел СД 1 в возрасте 8 лет, так же, как и его брат ранее. Пациент Р. заболел СД 1 в возрасте 2 лет, его брат — ранее, в возрасте 1 год (табл. 4). У обоих детей за 5 мес до начала клинических симптомов СД 1 наблюдалось повышение уровня гликированного гемоглобина и снижение уровня С-пептида. Первоначально отмечалось повышение трех ААТ: GADA, IA-2A, ZnT8A, показатели титров которых значительно снизились в период манифестации СД 1, за исключением ZnT8A у пациента Р. У него же появились положительные ICA.

|
Таблица 4. Титры ААТ у пациентов, заболевших СД 1 в процессе наблюдения |
Обсуждение
В настоящее время считается, что на риск развития СД 1 влияют возраст, а также количество, вид и комбинация ААТ.
Отмечено [4, 5], что данный риск обратно пропорционален возрасту. Полученные нами данные показывают, что более часто СД 1 манифестирует в возрасте от 2 до 12 лет. Это может определять целевую возрастную группу для иммунологического контроля здоровых сибсов.
Известно, что наличие множественных ААТ сигнализирует о высоком риске манифестации СД 1. Как правило, у 70% детей к моменту появления клинических симптомов диабета отмечаются три или четыре положительных ААТ и только у 10% — хотя бы одно положительное ААТ [6]. В нашей работе почти половина заболевших детей имели три положительных ААТ и примерно одинаковое количество — по два и четыре ААТ. Понятие множественных ААТ включает стабильное определение двух и более положительных ААТ [2], поэтому детей, серопозитивных как минимум по двум ААТ, целесообразно обследовать и наблюдать в качестве лиц из группы повышенного риска в плане развития СД 1. Единичные положительные ААТ, как правило, исчезают в течение двух лет после сероконверсии [2].
Однако даже среди лиц с множественными ААТ риск развития СД 1 различен. Предыдущие исследования [7, 8] показали, что появление в младшем возрасте и быстрая сероконверсия во времени до нескольких ААТ ассоциированы с высоким риском прогрессирования заболевания. Кроме того, имеет значение и вид комбинации ААТ.
Критический период для начала островковой аутоиммунной реакции приходится на возраст до 8 лет, хотя более раннее и позднее начало также не исключаются. Cчитают, что IAA начинают выявляться в раннем возрасте — с 1 до 4 лет, достигая пика появления к 8 годам с последующим резким снижением. GADA имеют тенденцию регистрироваться позднее, после двух лет, а максимальный потенциал риска прогрессирования заболевания развивается к 14 годам [4]. Показано, что риск развития СД 1 уменьшается при снижении титра IAA, независимо от статуса других ААТ [8]. Наши данные свидетельствуют об увеличении как титра, так и частоты регистрации IAA в младшем возрасте у пациентов с СД 1. В группе здоровых сибсов наблюдалась тенденция к повышенным титрам IAA в младшей возрастной группе. Титры ZnТ8A были наиболее высокими в группе детей, у которых диабет манифестировал позднее, в возрасте 7–12 лет, что согласуется с другими работами [9]. Обнаружение единичных IA-2A также коррелировало с низким риском, увеличиваясь при появлении GADA [10]. Среди детей с СД 1 частота выявления единичных ААТ была выше у GADA-позитивных лиц, далее по значимости следовали ZnT8A и ICA.
Сочетание различных ААТ также несет неодинаковые риски. ZnT8A и IA-2А появляются ближе к клиническому дебюту заболевания. У лиц, исходно положительных по ZnT8A/IA-2А, СД 1 прогрессирует быстрее до клинической стадии вне зависимости от вида других присоединившихся ААТ, например для тех, кто первоначально имел комбинацию IAA/GADA. Прогностические риски единичных IAA и GADA низкие, но при выделении их в паре риск может повышаться. Поэтому совместное определение этих ААТ прогностически более значимо, чем их определение по отдельности [10–12]. Установлено, что определение трех положительных ААТ, два из которых — обязательно ZnT8A и IA-2А, отражает субклиническое течение СД 1. В то же время прогрессирование диабета может замедляться в случае утери позитивных IAA [5].
Нами показано, что пары GADA/ZnT8A и GADA/IA-2А выявляются у подавляющего большинства пациентов с впервые обнаруженным диабетом и более чем в половине случаев — в группе здоровых сибсов. Примером тому служат данные об ААТ у двух здоровых сибсов, заболевших СД 1 в процессе наблюдения. Сочетание высоких титров IAA/IA-2А увеличивает риск развития СД 1 в течение пяти лет после появления первого ААТ [13].
Большинство исследователей, изучавших прогностическую ценность ZnT8A, пришли к выводу, что его определение помогает стратифицировать риск у лиц с другими положительными ААТ [14].
Прогностическая ценность ICA в сравнении с другими островковыми ААТ не высока. Присутствие ICA может нести дополнительные риски для детей, уже имеющих другие ААТ. Однако, по нашим данным, 11% детей с впервые выявленным диабетом имели только единичные ICA.
Титры ААТ также могут быть предикторами прогрессирования заболевания. Риски появления множественных ААТ значительно увеличивались в присутствии повышенного титра GADA, а риск дисгликемии — при повышении титра IA-2A [10]. В нашем случае каких-либо значимых закономерностей по титру ААТ не обнаружено. Медианы титров GADA и IAA характеризовались устойчивыми повышениями во всех возрастных группах. Медианы титров IA-2A и ZnT8A показали однонаправленные колебания в пределах повышенных значений.
Заключение
Результаты исследования показали, что наиболее целесообразно проводить скрининг и динамическое наблюдение за детьми с риском развития СД 1 (у здоровых сибсов) в возрасте от 2 до 12 лет, у лиц, имеющих два и более положительных ААТ. Динамическое наблюдение за детьми с единичными ААТ желательно проводить в течение 1–2 лет после их появления. Наиболее значимыми маркерами доклинической стадии СД 1 являются GADA, IA-2A и ZnT8А. GADA могут быть информативны в любых возрастных группах. IA-2A и ZnT8А появляются, как правило, позднее (при прогрессировании заболевания) и могут привнести дополнительную информацию, особенно в случае положительных GADA. Положительные IAA распространены среди детей младшего возраста.
Полученные результаты не противоречат, но и не во всем согласуются с данными других исследований. Это может быть связано с этническими различиями контингента, со временем выявления определяемых ААТ на доклинической стадии или их набором. Нет сомнения, что определение ААТ представляет ценную, но в то же время не исчерпывающую информацию. С учетом безусловного влияния на развитие СД 1 генетической предрасположенности в сочетании с влиянием ряда факторов окружающей среды дополнительная информация о свойствах ААТ может помочь в разработке модели пациента, имеющего риск развития СД 1 в будущем. Накопление знаний по раннему прогнозированию СД 1 может в конечном итоге сделать возможным успешное вмешательство для предотвращения заболевания в целом.
Финансирование исследования. Работа выполнена в рамках госзадания 3 00 057 056 «Разработка терапевтических моноклональных антител для направленной терапии Т-клеточных и онкогематологических и аутоиммунных заболеваний».
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Литература
- Couper J.J., Haller M.J., Greenbaum C.J., Ziegler A.G., Wherrett D.K., Knip M., Craig M.E. ISPAD Clinical Practice Consensus Guidelines 2018: stages of type 1 diabetes in children and adolescents. Pediatr Diabetes 2018; 19(Suppl 27): 20–27, https://doi.org/10.1111/pedi.12734.
- Vehik K., Lynch K.F., Schatz D.A., Akolkar B., Hagopian W., Rewers M., She J.X., Simell O., Toppari J., Ziegler A.G., Lernmark Å., Bonifacio E., Krischer J.P.; TEDDY Study Group. Reversion of β-cell autoimmunity changes risk of type 1 diabetes: TEDDY study. Diabetes Care 2016; 39(9): 1535–1542, https://doi.org/10.2337/dc16-0181.
- Bonifacio E. Predicting type 1 diabetes using biomarkers. Diabetes Care 2015; 38(6): 989–996, https://doi.org/10.2337/dc15-0101.
- Bosi E., Boulware D.C., Becker D.J., Buckner J.H., Geyer S., Gottlieb P.A., Henderson C., Kinderman A., Sosenko J.M., Steck A.K., Bingley P.J.; Type 1 Diabetes TrialNet Study Group. Impact of age and antibody type on progression from single to multiple autoantibodies in type 1 diabetes relatives. J Clin Endocrinol Metab 2017; 102(8): 2881–2886, https://doi.org/10.1210/jc.2017-00569.
- Gorus F.K., Balti E.V., Messaaoui A., Demeester S., Van Dalem A., Costa O., Dorchy H., Mathieu C., Van Gaal L., Keymeulen B., Pipeleers D.G., Weets I.; Belgian Diabetes Registry. Twenty-year progression rate to clinical onset according to autoantibody profile, age, and HLA-DQ genotype in a registry-based group of children and adults with a first-degree relative with type 1 diabetes. Diabetes Care 2017; 40(8): 1065–1072, https://doi.org/10.2337/dc16-2228.
- Regnell S.E., Lernmark Å. Early prediction of autoimmune (type 1) diabetes. Diabetologia 2017; 60(8): 1370–1381, https://doi.org/10.1007/s00125-017-4308-1.
- Steck A.K., Dong F., Waugh K., Frohnert B.I., Yu L., Norris J.M., Rewers M.J. Predictors of slow progression to diabetes in children with multiple islet autoantibodies. J Autoimmun 2016; 72: 113–117, https://doi.org/10.1016/j.jaut.2016.05.010.
- Endesfelder D., Hagen M., Winkler C., Haupt F., Zillmer S., Knopff A., Bonifacio E., Ziegler A.G., Zu Castell W., Achenbach P. A novel approach for the analysis of longitudinal profiles reveals delayed progression to type 1 diabetes in a subgroup of multiple-islet-autoantibody-positive children. Diabetologia 2016; 59(10): 2172–2180, https://doi.org/10.1007/s00125-016-4050-0.
- Garnier L., Marchand L., Benoit M., Nicolino M., Bendelac N., Wright C., Moulin P., Lombard C., Thivolet C., Fabien N. Screening of ZnT8 autoantibodies in the diagnosis of autoimmune diabetes in a large French cohort. Clin Chim Acta 2018; 478: 162–165, https://doi.org/10.1016/j.cca.2017.12.043.
- Xu P., Krischer J.P.; Type 1 Diabetes TrialNet Study Group. Prognostic classification factors associated with development of multiple autoantibodies, dysglycemia, and type 1 diabetes — a recursive partitioning analysis. Diabetes Care 2016; 39(6): 1036–1044, https://doi.org/10.2337/dc15-2292.
- Gorus F.K., Balti E.V., Vermeulen I., Demeester S., Van Dalem A., Costa O., Dorchy H., Tenoutasse S., Mouraux T., De Block C., Gillard P., Decochez K., Wenzlau J.M., Hutton J.C., Pipeleers D.G., Weets I.; Belgian Diabetes Registry. Screening for insulinoma antigen 2 and zinc transporter 8 autoantibodies: a cost-effective and age-independent strategy to identify rapid progressors to clinical onset among relatives of type 1 diabetic patients. Clin Exp Immunol 2013; 171(1): 82–90, https://doi.org/10.1111/j.1365-2249.2012.04675.x.
- Bingley P.J., Boulware D.C., Krischer J.P. Type 1 Diabetes TrialNet Study Group. The implications of autoantibodies to a single islet autoantigen to relatives with normal glucose tolerance. Diabetologia 2016; 59(3): 542–549, https://doi.org/10.1007/s00125-015-3830-2.
- Steck A.K., Vehik K., Bonifacio E., Lernmark A., Ziegler A.G., Hagopian W.A., She J., Simell O., Akolkar B., Krischer J., Schatz D., Rewers M.J.; TEDDY Study Group. Predictors of progression from the appearance of islet autoantibodies to early childhood diabetes: The Environmental Determinants of Diabetes in the Young (TEDDY). Diabetes Care 2015; 38(5): 808–813, https://doi.org/10.2337/dc14-2426.
- Williams C.L., Long A.E. What has zinc transporter 8 autoimmunity taught us about type 1 diabetes? Diabetologia 2019; 62(11): 1969–1976, https://doi.org/10.1007/s00125-019-04975-x.










