Поиск эффективных сывороточных онкомаркеров для ранней диагностики гепатоцеллюлярной карциномы, ассоциированной с гепатитом C
Цель исследования — по совокупности диагностических характеристик и корреляционных связей определить наиболее эффективные сывороточные онкомаркеры для ранней диагностики гепатоцеллюлярной карциномы.
Материалы и методы. Под наблюдением находились 55 больных хроническим гепатитом С в стадии цирроза печени с верифицированным диагнозом гепатоцеллюлярной карциномы. Группу сравнения составили 55 больных хроническим гепатитом С в стадии цирроза печени без гепатоцеллюлярной карциномы, сопоставимых по основным клиническим характеристикам с опытной группой. В обеих группах определяли следующие онкомаркеры: альфа-фетопротеин (AFP), альфа-фетопротеин L3 (AFP-L3), аннексин А2 (ANXA2), гепарин-связывающий фактор роста Midkine (MDK), глипикан-3 (GPC3), дез-гамма-карбоксипротромбин (DCP, PIVKA-II), диккопф-подобный протеин 1 (DKK-1), остеопонтин (OPN), протеин Гольджи-73 (GP73). Оценивали такие показатели, как диагностическая чувствительность, специфичность, положительное прогностическое значение, отрицательное прогностическое значение, отношение правдоподобия положительного результата, наличие корреляции между альфа-фетопротеином и другими онкомаркерами. Расчет площади под ROC-кривой (AUC) проводили при уровне доверительного интервала 95%.
Результаты. Наибольшая чувствительность выявлена при использовании гепарин-связывающего фактора роста, аннексина А2, остеопонтина. Наилучшими показателями специфичности характеризовались альфа-фетопротеин, альфа-фетопротеин L3, глипикан-3, дез-гамма-карбоксипротромбин, диккопф-подобный протеин 1. Показатель AUC>0,75 выявлен у аннексина А2, гепарин-связывающего фактора роста, глипикана-3, дез-гамма-карбоксипротромбина, остеопонтина, протеина Гольджи-73. Отношение правдоподобия положительного результата оказалось самым высоким у глипикана-3. Значимая корреляция обнаружена между альфа-фетопротеином и альфа-фетопротеином L3, аннексином А2, дез-гамма-карбоксипротромбином.
Заключение. По совокупным показателям диагностической эффективности к наиболее перспективным из исследованных следует отнести гепарин-связывающий фактор роста, глипикан-3 и остеопонтин. Уровень этих онкомаркеров в крови больных гепатоцеллюлярным раком не коррелирует с альфа-фетопротеином, интегральный показатель AUC при их использовании показывает значения выше среднего. Они применимы для диагностики рака печени у AFP-негативных больных. Комбинированное использование AFP + GPC3, AFP + OPN уже показало их преимущество. Однако эффективность комбинации AFP + MDK, GPC3 + OPN еще не определена, поэтому оценку значимости комбинированного использования указанных онкомаркеров в диагностике рака печени следует ожидать в ближайшем будущем.
Введение
Среди причин смерти онкологических больных гепатоцеллюлярная карцинома (ГЦК) занимает второе место в мире [1]. Такой высокий показатель обусловлен поздней диагностикой заболевания, так как на ранней стадии ГЦК протекает бессимптомно и может быть выявлена уже на стадии роста опухолевого узла при проведении ультразвукового обследования печени.
Основным фактором риска развития ГЦК является инфицирование вирусами гепатитов B и C. В связи с появлением в 90-х годах вакцины против гепатита В и массовой вакцинацией населения значение гепатита В значительно уменьшилось. В результате в оценке этиологической значимости акценты сместились в сторону гепатита С, который сегодня стал основной инфекционной причиной развития ГЦК [2].
Патогенез рака печени при гепатите С предполагает в качестве первого этапа развитие цирроза печени, на фоне которого риски возникновения ГЦК многократно увеличиваются. Так, даже после элиминации вируса в результате противовирусной терапии у больных сохраняются риски возникновения ГЦК, которые составляют при циррозе класса А по шкале Чайлда–Пью 2,1% в год, а класса В — 7,8% в год [3].
В этих условиях совершенствование методов раннего обнаружения ГЦК является актуальной задачей современного здравоохранения, решение которой позволит выстроить эффективную систему оказания помощи больным и снизить смертность от этого заболевания.
В соответствии с клиническими рекомендациями Европейской ассоциации по изучению болезней печени (EASL) [4] и методическим руководством Российской гастроэнтерологической ассоциации и Ассоциации онкологов России [5] ранняя диагностика ГЦК основывается на ультразвуковом исследовании печени и определении уровня гликопротеина альфа-фетопротеина (AFP) в сыворотке крови.
Ультразвуковое исследование брюшной полости широко распространено в медицинских учреждениях, но его эффективность зависит от класса аппарата, опыта врача и размера опухоли. Чувствительность этого метода достигает 90% для опухолей более 5 см в диаметре, 70% — для узлов диаметром 1–2 см и только 50% — при размере опухоли менее 1 см [6].
Второй диагностический компонент — AFP, синтезируемый эндодермальными клетками желточного мешка зародыша, а в последующем — эмбриональными гепатоцитами [7]. Повышение уровня AFP в сыворотке крови наблюдается при различных онкологических заболеваниях, но в большей степени характерно для ГЦК [8]. Анализ литературы, оценивающей AFP в качестве биомаркера ГЦК, показал диапазон его чувствительности и специфичности на разных стадиях развития ГЦК 26–65 и 80–94 соответственно [9, 10]. В связи с низкой чувствительностью AFP в некоторых национальных версиях клинических рекомендаций он исключен из диагностического алгоритма ГЦК [11, 12].
В связи с этим в последние годы во всех странах мира ведутся интенсивные поиски молекул и веществ, определение которых в биологических средах организма позволило бы на ранней стадии и с высокой степенью эффективности диагностировать ГЦК. Такие разработки осуществляются в области протеомики, геномики и метаболомики. Наиболее перспективно определение белковых молекул, так как методы индикации различных протеинов достаточно хорошо автоматизированы, имеют высокую чувствительность и воспроизводимость.
Цель исследования — по совокупности диагностических характеристик и корреляционных связей определить наиболее эффективные сывороточные онкомаркеры для ранней диагностики гепатоцеллюлярной карциномы.
Материалы и методы
Под нашим наблюдением находились 110 больных хроническим гепатитом С (ХГС) в стадии цирроза печени, в том числе 55 — без признаков ГЦК и 55 — с верифицированным диагнозом ГЦК.
Диагноз гепатита С устанавливали на основании данных анамнеза, клинического обследования, определения активности печеночных трансаминаз, выявления анти-HCV IgG и РНК вируса гепатита С. Стадию фиброза печени определяли с помощью аппарата FibroScan 502 (Echosens, Франция). Генотип 1 вируса был выявлен у 56 больных (50,9%), генотип 2 — у 7 (6,4%), генотип 3 — у 47 (42,7%). В анамнезе противовирусную терапию указанные пациенты не получали. Цирроз печени был подтвержден на основании клинико-лабораторных данных, эластометрии печени, результатов УЗИ, компьютерной и/или магнитно-резонансной томографии. Степень тяжести цирроза определяли по шкале Чайлда–Пью [13, 14].
Диагноз ГЦК устанавливали с учетом критериев EASL [4]. Больные наблюдались и лечились в Об-
ластной клинической инфекционной больнице, Областном клиническом консультативно-диагностическом центре и Областном онкологическом диспансере (Иркутск). У всех больных диагноз был верифицирован морфологически. У 10 человек (18,2%) заболевание было выявлено на I стадии болезни по классификации TNM, у 45 (81,8%) — на II–IIIA стадии. Настоящая работа была проведена в соответствии с принципами Хельсинкской декларации (2013) и одобрена комитетом по этике Иркутского государственного медицинского университета. Информированное согласие было получено от каждого участника.
Для лабораторных исследований использовали пробы крови, полученные до проведения оперативного лечения или процедуры локальной деструкции опухоли. Группа больных ХГС была сопоставима по основным клиническим характеристикам с группой больных ГЦК (табл. 1).

|
Таблица 1. Клиническая характеристика больных хроническим гепатитом С с гепатоцеллюлярной карциномой и без нее (M±m) |
Диспансерное наблюдение за пациентами с ХГС осуществлялось в среднем в течение 12 мес и включало клинический осмотр, общеклинические и биохимические анализы, эластометрию печени, УЗИ органов брюшной полости. При необходимости выполнялась компьютерная или магнитно-резонансная томография печени. Таким образом, в контрольной группе было подтверждено отсутствие ГЦК как минимум в течение одного года после забора крови на определение онкомаркеров.
После забора крови все образцы сыворотки центрифугировали и хранили при –80°С.
Для определения уровня онкомаркеров использовали иммунохимический анализатор с хемилюминесцентной технологией Architect i2000SR (Abbott Diagnostics, Корея) и иммуноферментный анализатор Victor3 Plate Reader (PerkinElmer, США). Производители диагностических наборов и технические характеристики тест-систем для определения онкомаркеров представлены в табл. 2.
 |
Таблица 2. Технические характеристики тест-систем для определения онкомаркеров, использованных в работе |
Лабораторные исследования осуществляли в НИИ биомедицинских технологий Иркутского государственного медицинского университета и в лаборатории аналитической иммунологии Института передовых биологических наук Университета Гренобль-Альпы (Франция).
Методы статистической обработки. Статистическую обработку осуществляли с использованием программы Meta-DiSc 1.4 Software, которая находится в открытом доступе по ссылке https://meta-disc.software.informer.com/1.4/. Статистический анализ включал в себя сравнение двух выборок и корреляционный анализ. Определение порогового значения (cut-off) для каждого онкомаркера проводили путем расчета наибольшего значения индекса Юдена [15]. Оценивали такие показатели, как диагностическая чувствительность (Se), специфичность (Sp), положительное прогностическое значение (PPV), отрицательное прогностическое значение (NPV) и отношение правдоподобия положительного результата (PLR). Значимость различий изучаемых показателей в группах определяли по критериям хи-квадрат (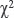 ) и точного метода Фишера для четырехпольных таблиц.
) и точного метода Фишера для четырехпольных таблиц.
Для оценки диагностической эффективности отдельных онкомаркеров использовали ROC-анализ [15]. Расчет площади под ROC-кривой (AUC) проводили при уровне доверительного интервала 95% (confidence interval, 95% CI). Показатели AUC оценивали по следующим критериям: AUC≤0,75 — низкая диагностическая эффективность; 0,75<AUC<0,90 — средняя; AUC≥0,90 — высокая. Уровнем статистической значимости считали р≤0,05.
Результаты
На первом этапе были определены оптимальные пороговые значения (cut-off) для каждого онкомаркера по наибольшему значению индекса Юдена (табл. 3). Выбранное пороговое значение соответствовало оптимальному соотношению чувствительности и специфичности. Наибольшая чувствительность (≥80,0%) выявлена при использовании для диагностики ГЦК маркеров MDK, ANXA2, OPN. В то же время наилучшими показателями специфичности (≥80,0%) характеризовались маркеры AFP, AFP-L3, GPC3, DCP (PIVKA-II), DKK-1, GP73 (табл. 4).

|
Таблица 3. Оптимальное пороговое значение и взаимосвязь между AFP и другими онкомаркерами |
 |
Таблица 4. Оценка диагностической эффективности онкомаркеров гепатоцеллюлярной карциномы при оптимальном cut-off |
У шести маркеров из девяти исследуемых такой интегральный показатель, как AUC, оказался выше среднего значения: у ANXA2, MDK, GPC3, DCP (PIVKA-II), OPN, GP73. Это характеризует их как потенциально перспективные в диагностическом плане белки. Вместе с тем PLR оказалось самым высоким у GPC3 (см. табл. 4). Это означает, что вероятность положительного теста у больных ХГС с ГЦК в 16,67 раза выше, чем у больных ХГС без ГЦК, что свидетельствует о существенном диагностическом преимуществе использования данного онкомаркера.
Для определения эффективной комбинации маркеров с AFP важно знать степень корреляции между ними. В случае отсутствия корреляции и при AUC >0,75 каждый онкомаркер вносит свой дополнительный вклад в диагностическую эффективность, а не дублирует показатели AFP. Значимая корреляция обнаружена между AFP и AFP-L3, ANXA2, DCP (PIVKA-II), что заставляет усомниться в целесообразности их совместного использования (см. табл. 3).
Еще одним критерием для отбора перспективных диагностических онкомаркеров ГЦК является частота положительных результатов выявления онкомаркера у больных с AFP-негативной ГЦК [10]. В этом плане наилучшие результаты показали MDK, OPN, GP73 и GPC3 (см. табл. 3).
Обсуждение
За последнее время для ранней диагностики ГЦК предложено несколько десятков онкомаркеров, находящихся на различных стадиях клинической апробации [16–18]. Как следует из отдельных публикаций и комплексных обзоров, достичь 80% уровня чувствительности позволяет использование таких специфических белков, как ANXА2, MDK, α-1-фукозидаза (AFU), иммунный комплекс IgM-антиген плоскоклеточного рака (SCCA-IgM). Однако при высокой чувствительности диагностическая специфичность определения этих онкомаркеров достаточно низкая и варьирует от 50,0 до 70,5% [16, 19–22]. И наоборот, высокоспецифичные (>90%) белковые маркеры (AFP-L3, рецептор-активатор плазминогена (suPAR), DCP (PIVKA-II)) показывают низкую чувствительность — 28–76% [16, 22–25]. Таким образом, в настоящее время ни один онкомаркер, взятый по отдельности, не обеспечивает на ранней стадии ГЦК высокой диагностической эффективности [26].
По этим причинам основной поиск идет в направлении комбинированного использования двух, трех и даже четырех онкомаркеров с различными механизмами экспрессии в процессе канцерогенеза [27–30]. Описаны комбинации, включающие AFP, AFP-L3, DCP (PIVKA-II), ANXА2, OPN, DKK-1, рецептор тирозинкиназы sAxl (AXL), тиоредоксин (Trx1) [22, 26, 27, 31, 32]. Это в большинстве случаев позволяет несколько повысить эффективность диагностики. Однако комбинация тех или иных онкомаркеров, как правило, осуществляется интуитивно, произвольным образом. Кроме того, необходимо учитывать, что в методическом плане многие исследования выполнены с использованием неоднородных по этиологическому фактору ГЦК клинических групп. Нередко в исследования включаются пациенты, находящиеся на разных стадиях болезни. Очевидно, что присутствие в анализируемых группах больных, находящихся как на ранней, так и на продвинутой стадии болезни, не позволяет оценить значение маркера именно для ранней диагностики ГЦК (I–II стадия по классификации TNM), тем более, что при размере опухолевого узла более 2,0 см достаточно эффективны инструментальные методы диагностики (УЗИ, компьютерная и магнитно-резонансная томография) и необходимость определения сывороточных онкомаркеров отпадает [4].
В настоящей работе были исследованы наиболее информативные параметры, влияющие на диагностическую эффективность онкомаркеров, и возможность их комбинированного использования с AFP (табл. 5).

|
Таблица 5. Показатели диагностической эффективности онкомаркеров |
Оказалось, что наибольшим набором диагностических преимуществ обладают MDK, GPC3 и OPN. По отдельности эти онкомаркеры уже были в той или иной степени апробированы в диагностике ГЦК [17, 19, 26, 33].
MDK является фактором роста, стимулирующим пролиферацию и дифференцировку клеток. Установлено, что уровень MDK у больных ГЦК в среднем в 5 раз выше, чем у больных циррозом печени без ГЦК. При этом Se изолированного определения MDK составила 90%, а AFP — лишь 50% [19].
GPC3 принадлежит к семейству глипиканов-протеогликанов. Повышенный уровень GPC3 выявляется у 50–55% пациентов с ГЦК и только у 5% больных с циррозом печени [34]. Самостоятельное значение GPC3 для диагностики ГЦК ограничено в связи с низкой чувствительностью [35]. GPC3 определяется иммуногистохимически в биоптатах печени, что используется в клинике при дифференциальной диагностике ГЦК и других поражений печени [36].
OPN представляет собой интегрин-связывающий гликофосфопротеин, который продуцируется в повышенном количестве при многих злокачественных новообразованиях [37]. OPN повышается за 6–12 мес до инструментального обнаружения ГЦК и обладает лучшей чувствительностью, чем AFP [38].
Уровень данных онкомаркеров в крови больных ГЦК не коррелирует с AFP, интегральный показатель AUC при их использовании показывает значения выше среднего, они применимы для диагностики ГЦК у AFP-негативных больных. Кроме того, GPC3 отличается от остальных онкомаркеров существенно более высоким показателем PLR, что ставит его в ряд перспективных при комбинированном использовании.
Комбинированное использование AFP + GPC3 и AFP + OPN уже показало их преимущество (AUC равно 0,85 и 0,90 соответственно) [29, 33]. Однако исследования MDK, а также комбинации AFP + MDK, GPC3 + OPN до настоящего времени не проводились, поэтому оценку эффективности комбинированного использования указанных онкомаркеров следует ожидать в ближайшем будущем.
Заключение
В результате исследования выявлены кандидатные белки, количественное определение которых в сыворотке крови больных хроническим гепатитом С имеет ряд диагностических преимуществ по сравнению с другими онкомаркерами. Среди них наиболее перспективными являются MDK, GPC-3 и OPN. ROC-анализ и исследование корреляционных связей дают основание ожидать высокоэффективных результатов от использования онкомаркеров в сочетании с AFP, а также в комбинации друг с другом.
Финансирование исследования. Работа выполнена при финансовой поддержке Министерства науки и высшего образования Российской Федерации в рамках Федеральной целевой программы проведения исследований по приоритетным направлениям с участием научно-исследовательских организаций и университетов российско-французской Партнерской программы Юбера Кюрьена «Колмогоров» (контракт №14.616.21.0098; уникальный идентификационный номер проекта RFMEFI61618X0098).
Конфликт интересов. У авторов статьи конфликт интересов отсутствует.
Литература
- Bray F., Ferlay J., Soerjomataram I., Siegel R.L., Torre L.A., Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin 2018; 68(6): 394–424, https://doi.org/10.3322/caac.21492.
- Kim H.S., El-Serag H.B. The epidemiology of hepatocellular carcinoma in the USA. Curr Gastroenterol Rep 2019; 21(4): 17, https://doi.org/10.1007/s11894-019-0681-x.
- Calvaruso V., Cabibbo G., Cacciola I., Petta S., Madonia S., Bellia A., Tinè F., Distefano M., Licata A., Giannitrapani L., Prestileo T., Mazzola G., Di Rosolini M.A., Larocca L., Bertino G., Digiacomo A., Benanti F., Guarneri L., Averna A., Iacobello C., Magro A., Scalisi I., Cartabellotta F., Savalli F., Barbara M., Davì A., Russello M., Scifo G., Squadrito G., Cammà C., Raimondo G., Craxì A., Di Marco V.; Rete Sicilia Selezione Terapia–HCV (RESIST-HCV). Incidence of hepatocellular carcinoma in patients with HCV-associated cirrhosis treated with direct-acting antiviral agents. Gastroenterology 2018; 155(2): 411–421.e4, https://doi.org/10.1053/j.gastro.2018.04.008.
- European Association for the Study of the Liver. EASL clinical practice guidelines: management of hepatocellular carcinoma. J Hepatol 2018; 69(1): 182–236, https://doi.org/10.1016/j.jhep.2018.03.019.
- Ивашкин В.Т., Маев И.В., Каприн А.Д., Агапов М.Ю., Андреев Д.Н., Водолеев А.С., Жаркова М.Ю., Королев М.П., Кучерявый Ю.А., Лапина Т.Л., Маевская М.В., Охлобыстин А.В., Павлов Ч.С., Параскевова А.В., Пирогов С.С., Полуэктова Е.А., Румянцева Д.Е., Трухманов А.С., Царьков П.В., Шептулин А.А., Шифрин О.С. Раннее выявление онкологических заболеваний органов пищеварения (методическое руководство Российской гастроэнтерологической ассоциации и Ассоциации онкологов России для врачей первичного звена здравоохранения). Российский журнал гастроэнтерологии, гепатологии, колопроктологии 2019; 29(5): 53–74, https://doi.org/10.22416/1382-4376-2019-29-5-53-74.
- Singal A., Volk M.L., Waljee A., Salgia R., Higgins P., Rogers M.A., Marrero J.A. Meta-analisis: surveilance with ultrasound for early-stage hepatocellular carcinoma in patients with cirrhosis. Aliment Pharmacol Ther 2009; 30(1): 37–47, https://doi.org/10.1111/j.1365-2036.2009.04014.x.
- Abelev G.I. Production of embrional serum alpha-globulin by hepatomas: review of experimental and clinical data. Cancer Res 1968; 28(7): 1344–1350.
- Bai D.S., Zhang C., Chen P., Jin S.J., Jiang G.Q. The prognostic correlation of AFP level at diagnosis with pathological grade, progression, and survival of patients with hepatocellular carcinoma. Sci Rep 2017; 7(1): 12870, https://doi.org/10.1038/s41598-017-12834-1.
- Zhang K., Song P., Gao J., Li G., Zhao X., Zhang S. Perspectives on a comdined test of multi serum biomarkers in China: towards screening for and diagnosing hepatocellular carcinoma at an earlier stage. Drug Discov Ther 2014; 8(3): 102–109, https://doi.org/10.5582/ddt.2014.01026.
- Shu H., Li S., Shang S., Qin X., Zhang S., Liu Y. Diagnosis of AFP-negative early-stage hepatocellular carcinoma using Fuc-PON1. Discov Med 2017; 23(126): 163–168.
- Aubé C., Oberti F., Lonjon J., Pageaux G., Seror O., N’Kontchou G., Rode A., Radenne S., Cassinotto C., Vergniol J., Bricault I., Leroy V., Ronot M., Castera L., Michalak S., Esvan M., Vilgrain V.; CHIC Group. EASL and AASLD recommendations for the diagnosis of HCC to the test of daily practice. Liver Int 2017; 37(10): 1515–1525, https://doi.org/10.1111/liv.13429.
- Frenette C.T., Isaacson A.J., Bargellini I., Saab S., Singal A.G. A practical guideline for hepatocellular carcinoma screening in patients at risk. Mayo Clin Proc Innov Qual Outcomes 2019; 3(3): 302–310, https://doi.org/10.1016/j.mayocpiqo.2019.04.005.
- Child C.G., Turcotte J.G. Surgery and portal hypertension. Major Probl Clin Surg 1964; 1: 1–85.
- Pugh R.N., Murray-Lyon I.M., Dawson J.L., Pietroni M.C., Williams R. Transection of the oesophagus for bleeding oesophageal varices. Br J Surg 1973; 60(8): 646–649, https://doi.org/10.1002/bjs.1800600817.
- Старовойтов В.В., Голуб Ю.И. Сравнительный анализ оценок качества бинарной классификации. Информатика 2020; 17(1): 87–101, https://doi.org/10.37661/1816-0301-2020-17-1-87-101.
- Reichl P., Mikulits W. Accuracy of novel diagnostic biomarkers for hepatocellular carcinoma: an update for clinicians (review). Oncol Rep 2016; 36(2): 613–625, https://doi.org/10.3892/or.2016.4842.
- Sengupta S., Parikh N.D. Biomarker development for hepatocellular carcinoma early detection: current and future perspectives. Hepat Oncol 2017; 4(4): 111–122, https://doi.org/10.2217/hep-2017-0019.
- Hemken P.M., Sokoll L.J., Yang X., Dai J., Elliott D., Gawel S.H., Lucht M., Feng Z., Marrero J.A., Srivastava S., Chan D.W., Davis G.J. Validation of a novel model for the early detection of hepatocellular carcinoma. Clin Proteomics 2019; 16: 2, https://doi.org/10.1186/s12014-018-9222-0.
- Hodeib H., ELshora O., Selim A., Sabry N.M., El-Ashry H.M. Serum midkine and osteopontin levels as diagnostic biomarkers of hepatocellular carcinoma. Electron Physician 2017; 9(1): 3492–3498, https://doi.org/10.19082/3492.
- Junna Z., Gongde C., Jinying X., Xiu Z. Serum AFU, 5’-NT and AFP as biomarkers for primary hepatocellular carcinoma diagnosis. Open Med (Wars) 2017; 12: 354–358, https://doi.org/10.1515/med-2017-0051.
- Liu C.H., Gil-Gómez A., Ampuero J., Romero-Gómez M. Diagnostic accuracy of SCCA and SCCA-IgM for hepatocellular carcinoma: a meta-analysis. Liver Int 2018; 38(10): 1820–1831, https://doi.org/10.1111/liv.13867.
- Malov S.I., Malov I.V., Dvornichenko V.V., Marche P.N., Decaens T., Macek-Jilkova Z., Yushchuk N.D. Biomarkers in diagnosis and prediction of hepatocellular carcinoma recurrence (review). Sovremennye tehnologii v medicine 2019; 11(2): 183–196, https://doi.org/10.17691/stm2019.11.2.23.
- Taketa K., Endo Y., Sekiya C., Tanikawa K., Koji T., Taga H., Satomura S., Matsuura S., Kawai T., Hirai H. A collaborative study for the evaluation of lectin-reactive alpha-fetoproteins in early detection of hepatocellular carcinoma. Cancer Res 1993; 53(22): 5419–5423.
- Chounta A., Ellinas C., Tzanetakou V., Pliarhopoulou F., Mplani V., Oikonomou A., Leventogiannis K., Giamarellos-Bourboulis E.J. Serum soluble urokinase plasminogen activator receptor as a screening test for the early diagnosis of hepatocellular carcinoma. Liver Int 2015; 35(2): 601–607, https://doi.org/10.1111/liv.12705.
- Wu J., Xiang Z., Bai L., He L., Tan L., Hu M., Ren Y. Diagnostic value of serum PIVKA-II levels for BCLC early hepatocellular carcinoma and correlation with HBV DNA. Cancer Biomark 2018; 23(2): 235–242, https://doi.org/10.3233/cbm-181402.
- Tsuchiya N., Sawada Y., Endo I., Saito K., Uemura Y., Nakatsura T. Biomarkers for the early diagnosis of hepatocellular carcinoma. World J Gastroenterol 2015; 21(37): 10573–10583, https://doi.org/10.3748/wjg.v21.i37.10573.
- Ge T., Shen Q., Wang N., Zhang Y., Ge Z., Chu W., Lv X., Zhao F., Zhao W., Fan J., Qin W. Diagnostic values of alpha-fetoprotein, dickkopf-1, and osteopontin for hepatocellular carcinoma. Med Oncol 2015; 32(3): 59, https://doi.org/10.1007/s12032-014-0367-z.
- Jang E.S., Jeong S.H., Kim J.W., Choi Y.S., Leissner P., Brechot C. Diagnostic performance of alpha-fetoprotein, alpha-fetoprotein-L3, protein induced by vitamin K absence, osteopontin, Dickkopf-1 and its combinations for hepatocellular carcinoma. PLoS One 2016, 11(3): e0151069, https://doi.org/10.1371/journal.pone.0151069.
- Cerban R., Ester C., Iacob S., Ghioca M., Paslaru L., Dumitru R., Grasu M., Constantin G., Popescu I., Gheorghe L. Alpha-fetoprotein, alpha-fetoprotein-L3, protein induced by vitamin K absence, glypican 3 and its combinations for diagnosis of hepatocellular carcinoma. Surg Gastroenterol Oncol 2019; 24(1): 37–44, https://doi.org/10.21614/sgo-24-1-37.
- Yanming L., Yue C., Wencan C., Liangyin W., Xijun L., Jiafeng Z., Fengping H.E. Combined detection of AFP-L3, GP73 and TIP30 enhances diagnostic accuracy for HBV-related cirrhosis and hepatocellular carcinoma. J Pak MED Assoc 2019; 69(9): 1278–1286.
- Waidely E., Al-Yuobi A.R., Bashammakh A.S., El-Shahawi M.S., Leblanc R.M. Serum protein biomarkers relevant to hepatocellular carcinoma and their detection. Analyst 2016; 141(1): 36–44, https://doi.org/10.1039/c5an01884f.
- Park S.J., Jang J.Y., Jeong S.W., Cho Y.K., Lee S.H., Kim S.G., Cha S.W., Kim Y.S., Cho Y.D., Kim H.S., Kim B.S., Park S., Bang H.I. Usefulness of AFP, AFP-L3, and PIVKA-II, and their combinations in diagnosing hepatocellular carcinoma. Medicine (Baltimore) 2017; 96(11): e5811, https://doi.org/10.1097/md.0000000000005811.
- Liu S., Wang M., Zheng C., Zhong Q., Shi Y., Han X. Diagnostic value of serum glypican-3 alone and in combination with AFP as an aid in the diagnosis of liver cancer. Clin Biochem 2020; 79: 54–60, https://doi.org/10.1016/j.clinbiochem.2020.02.009.
- Montalbano M., Georgiadis J., Masterson A.L., McGuire J.T., Prajapati J., Shirafkan A., Rastellini C., Cicalese L. Biology and function of glypican-3 as a candidate for early cancerous transformation of hepatocytes in hepatocellular carcinoma (review). Oncol Rep 2017; 37(3): 1291–1300, https://doi.org/10.3892/or.2017.5387.
- Van Hees S., Michielsen P., Vanwolleghem T. Circulating predictive and diagnostic biomarkers for hepatitis B virus-associated hepatocellular carcinoma. World J Gastroenterol 2016; 22(37): 8271–8282, https://doi.org/10.3748/wjg.v22.i37.8271.
- Majeed S., Mushtaq S., Azam M., Akhtar N., Hussain M., Loya A. Diagnostic accuracy of glypican-3 in differentiating hepatocellular carcinoma from metastatic liver tumours. J Pak Med Assoc 2018; 68(7): 1029–1031.
- Zhao H., Chen Q., Alam A., Cui J., Suen K.C., Soo A.P., Eguchi S., Gu J., Ma D. The role of osteopontin in the progression of solid organ tumour. Cell Death Dis 2018; 9(3): 356, https://doi.org/10.1038/s41419-018-0391-6.
- Cabiati M., Gaggini M., Cesare M.M., Caselli C., De Simone P., Filipponi F., Basta G., Gastaldelli A., Del Ry S. Osteopontin in hepatocellular carcinoma: a possible biomarker for diagnosis and follow-up. Cytokine 2017; 99: 59–65, https://doi.org/10.1016/j.cyto.2017.07.004.










