Программа ускоренного восстановления при лечении пациентов с полисегментарными дегенеративными заболеваниями поясничного отдела позвоночника
Цель исследования — оценить эффективность программы ускоренного восстановления при лечении пациентов с полисегментарными дегенеративными заболеваниями поясничного отдела позвоночника.
Материалы и методы. В проспективное исследование включено 53 пациента, которым выполнен двухуровневый трансфораминальный межтеловой спондилодез в сегментах LII–SI. Выделено 2 группы: в 1-й (n=24) операции выполняли с использованием программы ускоренного восстановления, во 2-й (n=29) применяли открытую ригидную стабилизацию с традиционной внутривенной анестезией. Основными анализируемыми параметрами являлись количество проведенных после операции койко-дней, число периоперационных хирургических осложнений и неблагоприятных последствий анестезиологического пособия, частота повторных госпитализаций в течение 90 дней. Дополнительно оценивали сроки активизации, уровень болевого синдрома в области операции по визуально-аналоговой шкале (ВАШ) в течение госпитализации, качество жизни пациентов в отдаленном послеоперационном периоде (медиана 18 мес) по анкете SF-36 (физический и психологический компоненты здоровья).
Результаты. При сравнительном анализе в группе пациентов с использованием программы ускоренного восстановления зарегистрированы меньшие параметры продолжительности операции и наркоза, объема кровопотери, количества введенных опиоидных препаратов, времени вертикализации и длительности стационарного лечения (p<0,05 для всех параметров). У пациентов 1-й группы отмечен минимальный уровень интенсивности болевого синдрома в области операции по ВАШ в течение госпитализации (p<0,05), лучшие отдаленные показатели физического и психологического компонентов здоровья по анкете SF-36 (p<0,05), меньшее количество неблагоприятных последствий анестезиологического пособия (p<0,05) и хирургических послеоперационных осложнений (p<0,05). Во 2-й группе в 4 случаях (13,8%) в течение 90-дневного послеоперационного периода наблюдения появилась необходимость во внеочередном обращении в лечебное учреждение для проведения дополнительных лечебно-диагностических мероприятий.
Заключение. Исследование результатов внедрения программы ускоренного восстановления после выполнения двухуровневого межтелового спондилодеза показало ее безопасность и высокую клиническую эффективность при лечении пациентов с полисегментарными дегенеративными заболеваниями поясничного отдела позвоночника. Предлагаемая программа может быть использована в любом вертебрологическом центре, в котором возможно эффективное взаимодействие поливалентной врачебной и сестринской команды.
Введение
В последние два десятилетия активно внедряются минимально-инвазивные технологии в спинальную нейроортопедию [1, 2]. Наиболее часто применяемой хирургической процедурой у пациентов с симптоматичными дегенеративными заболеваниями поясничного отдела позвоночника является трансфораминальный межтеловой спондилодез с транспедикулярной стабилизацией [2]. С одной стороны, минимально-инвазивные дорсальные оперативные вмешательства позволяют снизить повреждение тканей при доступе и уменьшить локальный болевой синдром, с другой — они имеют сопоставимые отдаленные клинические и рентгенологические результаты с открытыми декомпрессивно-стабилизирующими вмешательствами [3, 4]. Учитывая преимущественно многоуровневый характер вертеброгенной патологии и возрастающие при этом риски при выполнении полисегментарных манипуляций, на сегодняшний день мы считаем актуальным вопрос об улучшении результатов лечения пациентов с распространенными дегенеративными заболеваниями поясничных сегментов [5].
В настоящее время в различных областях хирургии, а также в вертебрологии наблюдаются кардинальные изменения подходов к ведению пациентов в периоперационном периоде [6, 7]. Применяются также новые подходы к аналгезии в сочетании с методиками, направленными на снижение стрессового ответа пациента на хирургическое вмешательство, что способствует снижению количества осложнений и сокращению сроков стационарного лечения [8, 9]. Данная тактика ассоциируется с концепциями fast-track («быстрый путь» в хирургии) и ERAS (enhanced recovery after surgery — ускоренное восстановление после хирургических операций) [10]. Такие протоколы ведения пациентов основываются на результатах крупных исследований, имеющих высокий класс доказательности, и рекомендованы к использованию профессиональными сообществами [11–13].
Реализация мультидисциплинарного подхода осуществляется за счет преемственности ведения пациентов на догоспитальном этапе, в стационаре и во время амбулаторного послеоперационного наблюдения [12]. Это обеспечивает снижение выраженности операционного стресса, способствует ранней активизации и ускоренной реабилитации пациентов, сокращению финансовых затрат практического здравоохранения [13, 14].
Информации об использовании программ ускоренного восстановления (ПУВ) в спинальной хирургии недостаточно. Отсутствуют и конкретные рекомендации ERAS для лечения пациентов с дегенеративными заболеваниями позвоночника.
С 2017 г. в клинической больнице «РЖД-Медицина» (Иркутск) применяется мультидисциплинарный подход к ускоренной реабилитации пациентов после проведения многоуровневых вертебрологических манипуляций, основанный на использовании замкнутого цикла непрерывного взаимодействия амбулаторно-поликлинического, стационарного и реабилитационного этапов.
Оценка эффективности предлагаемой нами программы ускоренного восстановления при лечении пациентов с полисегментарными дегенеративными заболеваниями поясничного отдела позвоночника и стала целью настоящего исследования.
Материалы и методы
Проведено продольное проспективное одноцентровое нерандомизированное исследование. Изучены результаты хирургического лечения 53 пациентов, оперированных с применением методики двухуровневого трансфораминального межтелового спондилодеза в сегментах LII–SI с декабря 2017 г. по декабрь 2019 г. в Центре нейрохирургии и отделении анестезиологии и реанимации №1 клинической больницы «РЖД-Медицина» (Иркутск).
Критерии включения в исследование: наличие болевого синдрома в нижней части спины и корешковой клинической симптоматики вследствие дегенеративного заболевания в поясничном отделе позвоночника; распространенный характер поражения (2 смежных позвоночных сегмента); неэффективность консервативного лечения в течение 6–8 нед.
Критерии исключения: одноуровневые дегенеративные поражения поясничного отдела позвоночника; степень физического статуса ASA выше III класса; предшествующие операции на позвоночнике в анамнезе; наличие конкурирующей патологии в поясничном отделе (инфекционно-воспалительные заболевания, опухоли, травматические повреждения); значительное снижение минеральной плотности костной ткани (остеопороз); любая сопутствующая патология в стадии декомпенсации; непереносимость всех используемых препаратов.
Пациенты были разделены на 2 репрезентативные группы: в 1-й группе (n=24) дорсальные декомпрессивно-стабилизирующие операции выполняли с использованием ПУВ; во 2-й (n=29) применяли ригидную стабилизацию из заднего срединного доступа с традиционной внутривенной анестезией и искусственной вентиляцией легких. Прослежены результаты хирургического лечения в среднем катамнезе: в 1-й группе — 18 [12; 22] мес, во 2-й — 18 [14; 25] мес. Исследование проведено в соответствии с Хельсинкской декларацией (2013) и одобрено Этическим комитетом Иркутского государственного медицинского университета.
Все хирургические вмешательства осуществлялись операционной бригадой с опытом проведения открытых и минимально-инвазивных дорсальных вмешательств более 15 лет. Все оперированные пациенты находились под интенсивным наблюдением одного врача-анестезиолога. Разработкой основной концепции программы занималась группа специалистов (спинальные хирурги, анестезиолог, невролог, врач лечебной физкультуры и медицинские сестры), понимающих основные принципы ПУВ.
Программа ускоренного восстановления состояла из замкнутого и непрерывного взаимодействия трех блоков: амбулаторно-поликлинического, стационарного и реабилитационного (табл. 1).
 |
 |
Таблица 1. Подходы к периоперационному ведению пациентов с полисегментарными заболеваниями поясничного отдела позвоночника |
Основными анализируемыми параметрами являлись количество проведенных после операции койко-дней, число периоперационных хирургических осложнений и неблагоприятных последствий анестезиологического пособия, частота повторных госпитализаций в течение 90 дней. Дополнительно оценивали сроки вертикализации, уровень болевого синдрома в области операционного вмешательства по визуально-аналоговой шкале (ВАШ) в течение госпитализации, качество жизни пациентов в отдаленном послеоперационном периоде (медиана 18 мес) по анкете SF-36 (физический и психологический компоненты здоровья).
Статистическая обработка результатов выполнена с использованием программы Statistica 8.0. Оценку нормальности распределения признаков производили по тестам Шапиро−Уилка, Колмогорова−Смирнова и Лиллиефорса. Распределение считали отличным от нормального с учетом наличия по указанным тестам статистически значимых различий (p<0,05). В связи с этим для оценки значимости различий выборочных совокупностей использовали критерии непараметрической статистики. Различия считали статистически значимыми при p<0,05. Полученные результаты представлены медианой, значениями 1-го и 3-го квартилей — Me [25; 75]. Для сравнительного анализа полученных значений использовали U-тест Манна−Уитни и критерий Вилкоксона для непараметрических данных, критерий 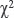 — для биноминальных знаков.
— для биноминальных знаков.
Результаты
Сведения о пациентах исследуемых групп представлены в табл. 2. Значимых различий исследуемых параметров не выявлено (p>0,05).

|
Таблица 2. Характеристика пациентов исследуемых групп |
При сравнительном анализе в группе использования ПУВ зарегистрированы меньшие параметры (p<0,05) продолжительности операции и наркоза, объема кровопотери, количества введенных опиоидных препаратов, времени вертикализации и длительности стационарного лечения (табл. 3). При этом продолжительность стационарного лечения в 1-й группе обусловлена необходимостью проведения ранних реабилитационных мероприятий непосредственно в профильном отделении с привлечением специалиста по лечебной физкультуре и массажиста.

|
Таблица 3. Характеристика оперативного вмешательства и послеоперационного ведения пациентов, Ме [25; 75] |
Сравнительный анализ интенсивности степени болевого синдрома в области операции по ВАШ показал значительно меньший уровень боли среди пациентов, оперированных с использованием ПУВ, в течение всего периода стационарного лечения (p<0,05) (рис. 1).

|
Рис. 1. Выраженность болевого синдрома в области операции в течение госпитализации по визуально-аналоговой шкале |
При изучении качества жизни пациентов по анкете SF-36 установлено статистически значимое улучшение физического и психологического компонентов здоровья как в 1-й, так и во 2-й группах (рис. 2). В отдаленном послеоперационном периоде лучшие показатели наблюдались у пациентов 1-й группы (p<0,05).

|
Рис. 2. Параметры качества жизни по опроснику SF-36 |
Неблагоприятных последствий анестезиологического пособия, повлиявших на удлинение сроков нахождения в палате реанимации, у пациентов при использовании ПУВ не выявлено (p<0,05) (табл. 4). У пациентов 2-й группы в 5 случаях (17,2%) установлено длительное восстановление нервно-мышечной проводимости, что потребовало продления наблюдения в отделении интенсивной терапии.

|
Таблица 4. Развитие неблагоприятных последствий анестезиологического пособия, n (%) |
Наибольшее количество верифицированных хирургических послеоперационных осложнений отмечено во 2-й группе (p=0,003) (табл. 5). У 4 пациентов (13,8%) в течение 90-дневного послеоперационного периода наблюдения появилась необходимость во внеочередном обращении в лечебное учреждение для проведения дополнительных лечебно-диагностических мероприятий. У пациентов 1-й группы не зарегистрировано осложнений, требующих повторной госпитализации.

|
Таблица 5. Хирургические послеоперационные осложнения, n (%) |
Обсуждение
Многочисленные исследования подтвердили эффективность применения протокола ERAS в различных областях хирургии [11, 12]. При этом конкретные указания для выполнения отдельных элементов протокола ERAS в спинальной хирургии в настоящее время отсутствуют. J. Smith с соавт. [15] считают, что при выполнении одно- и двухуровневой поясничной фиксации необходимы мультимодальная анестезия, включающая дооперационный прием ацетаминофена и габапентина; ранняя послеоперационная вертикализация и раннее физиотерапевтическое лечение, а также профилактика послеоперационной тошноты и рвоты. При этом авторы не изучали необходимость в интраоперационном управлении водно-электролитным балансом и гемодинамическими параметрами.
По данным Y. Ren с соавт. [16], программа ERAS при выполнении заднего поясничного спондилодеза должна включать предоперационное информирование пациента, предоперационную подготовку кишечника и предоперационное голодание, возможный прием жидкости, интраоперационный контроль температуры тела, использование короткодействующих обезболивающих препаратов и предоперационную антибиотикопрофилактику, управление пассажем по желудочно-кишечному тракту с предотвращением тошноты и рвоты, а также раннюю экстубацию.
E.М. Soffin с соавт. [17] при минимально-инвазивной поясничной декомпрессии рекомендуют следующий подход к ERAS:
до операции — превентивную аналгезию, предоперационное информирование пациента, минимальный период предоперационного голодания, профилактику тошноты и рвоты;
во время операции — стандартный анестезиологический протокол с использованием кетамина или пропофола, опиоидсберегающую мультимодальную анестезию с применением кеторолака или лидокаина, минимально-инвазивную хирургическую технику, отсутствие дренирования раны и катетеризацию мочевого пузыря, поддержание нормотермии и нормоволемии, антибиотикопрофилактику, профилактику тошноты и рвоты;
после операции — раннее питание, раннюю вертикализацию, опиоид-сберегающую аналгезию.
Licina с соавт. [9] предлагают 22 критерия ПУВ, которые потенциально могут быть использованы в спинальной хирургии:
до госпитализации — предоперационное информирование, стратификацию риска и модифицирование факторов образа жизни (алкоголь, курение), тренировку мышечно-связочного аппарата, предоперационное питание, предоперационный контроль анемии, предоперационную углеводную нагрузку, превентивную аналгезию;
в интраоперационном периоде — периоперационные технологии кровесбережения, минимально-инвазивные хирургические доступы, антибиотикопрофилактику, локальную инфильтрационную анестезию, использование протокола анестезии, профилактику тошноты и рвоты, поддержание нормотермии, поддержание водного баланса, предупреждающую периоперационную аналгезию;
в послеоперационном периоде — профилактику тромбозов, отказ от катетеризации мочевого пузыря, послеоперационное питание и поддержание водного баланса, контроль уровня гликемии, раннюю активизацию, аудит.
Однако авторы акцентируют внимание на том, что требуется дополнительное подтверждение эффективности этих критериев по результатам рандомизированных клинических испытаний и метаанализов.
Несмотря на активное выполнение декомпрессивно-стабилизирующих вмешательств на поясничном отделе позвоночника, в настоящее время существуют значительные вариации в регистрации периоперационных осложнений, длительности госпитализации, интенсивности послеоперационного болевого синдрома и уровня функционального восстановления за счет использования различных хирургических доступов и анатомических коридоров, многообразия стабилизирующих конструкций и различного опыта хирургической бригады [18, 19]. В связи с этим унифицирование мультидисциплинарных подходов к хирургическому лечению и реабилитации пациентов с отдельными нозологическими формами вертеброгенной патологии может обеспечить повышение клинической и экономической эффективности оказания специализированной медицинской помощи. Снижение финансовых затрат достигается преимущественно путем сокращения ненужных периоперационных процедур, предупреждения развития осложнений и правильной маршрутизации пациента [20].
В проведенном нами исследовании использованы стандартные критерии общепринятого протокола ERAS для общей хирургии с положительными эффектами, подтвержденными систематическими обзорами или метаанализами, а также крупными когортными исследованиями. Эти критерии были применены при проведении двухуровневых декомпрессивно-стабилизирующих дорсальных вмешательств у пациентов с полисегментарными дегенеративными заболеваниями поясничного отдела позвоночника. Особенностью исследования также являлось акцентирование внимания на преемственности и междисциплинарном взаимодействии амбулаторного, стационарного и реабилитационного звеньев для максимально быстрой социально-трудовой реабилитации пациентов.
Важным фактором комплексной программы ERAS, направленной на ускоренное восстановление после спинальных оперативных вмешательств, является эффективное управление периоперационным обезболиванием. Так, по данным M.Y. Wang с соавт. [7], применение седации и инфильтрационной анестезии позволяет улучшить функциональные показатели и сократить количество осложнений при проведении декомпрессивно-стабилизирующих вмешательств. При этом E.M. Soffin и соавт. [17] указывают на приоритетность общего обезболивания во время выполнения мини-инвазивной поясничной декомпрессии для обеспечения адекватной легочной вентиляции, исключения движений пациента и оптимальной степени аналгезии.
Выбор в пользу минимально-инвазивной хирургической технологии позволяет не только улучшить клинические показатели, но и уменьшить сроки стационарного лечения. Исследование H.K. Chang с соавт. [4] показало, что использование ERAS-программы минимально-инвазивного трансфораминального спондилодеза с эндоскопической ассистенцией и внутривенной седацией дает возможность значительно снизить потребление опиоидных анальгетиков и сократить длительность стационарного лечения в среднем на 1,4 дня при проведении одно- и двухуровневых декомпрессивно-стабилизирующих вмешательств по сравнению с общепринятой ригидной стабилизацией. А.Г. Назаренко с соавт. [21] установили, что использование ПУВ при микродискэктомии позволяет снизить выраженность болевого синдрома в раннем послеоперационном периоде на 10% и достигнуть функционального улучшения на 20% по сравнению со стандартным периоперационным ведением пациентов с грыжами межпозвонкового диска.
Помимо снижения интенсивности послеоперационного болевого синдрома и сокращения длительности госпитализации целью использования протоколов ERAS является предупреждение развития нежелательных эффектов опиатов, таких как дыхательная недостаточность, дисфункция кишечника, тошнота, рвота и задержка мочеиспускания [22]. Использование мини-инвазивных хирургических технологий дорсальной ригидной стабилизации позволяет сократить время стационарного лечения по сравнению с открытым декомпрессивно-стабилизирующим вмешательством (3,4 и 5,1 дней соответственно; p<0,02) и снизить потребность в применении наркотических анальгетиков (37,5 и 49,5 мг морфина в сутки соответственно; p<0,015) [23]. J.S. Cheng с соавт. [24], сравнивая группы пациентов после выполнения одноуровневого минимально-инвазивного и открытого трансфораминального спондилодезов, указывают на меньшую потребность в опиатах — 66,5 и 201,5 мг/сут соответственно (p=0,019), а также на более короткие сроки госпитализации — 4,80 и 6,05 дней соответственно (p=0,006) — и снижение финансовых затрат в 1-й группе.
На сегодняшний день концепция ERAS является предметом активных дискуссий в вертебрологическом сообществе. Однако большинство исследователей позиционируют внедрение менее инвазивных оперативных технологий, амбулаторное оказание хирургической помощи, опиоидсберегающие анестестезиологические подходы [25, 26] как повышающие эффективность работы практического здравоохранения.
M.V. Corniola с соавт. [27] в период с декабря 2019 г. по январь 2020 г. провели онлайн-анкетирование 234 членов EANS (European Association of Neurosurgical Societies), включающее 9 вопросов, которые касались протоколов ERAS в хирургии позвоночника. 54,7% участников опроса не имели представления о ПУВ в спинальной хирургии, 36% респондентов активно использовали элементы ERAS в своей практике. В связи с этим для популяризации технологии быстрого восстановления в вертебрологии (что имеет место в других хирургических специальностях) необходимо обеспечить информированность узких специалистов об эффективности применения ПУВ у пациентов с заболеваниями позвоночника.
В нашем исследовании установлено, что использование программы ПУВ при проведении двухуровневых дорсальных декомпрессивно-стабилизирующих вмешательств позволяет не только улучшить клинические показатели, но и значительно снизить число повторных госпитализаций, частоту развития хирургических периоперационных осложнений и неблагоприятных лекарственных последствий.
Существенным ограничением настоящего исследования является его одноцентровой характер и небольшие когорты анализируемых пациентов. Также не учитывалось влияние различных видов стабилизирующих конструкций на особенности ведения пациентов в интра- и периоперационном периодах.
Заключение
Исследование результатов внедрения программы ускоренного восстановления показало ее безопасность и высокую клиническую эффективность при лечении пациентов с дегенеративными заболеваниями поясничного отдела позвоночника.
Предлагаемая нами программа может быть использована в любом вертебрологическом центре, в котором возможно эффективное взаимодействие поливалентной команды, включающей нейрохирурга, анестезиолога-реаниматолога, невролога, клинического фармаколога, физиотерапевта, специалиста по лечебной физкультуре, реабилитолога и специально обученный средний медицинский персонал.
Активное внедрение персонифицированной медицины, разработка протоколов и стандартов оказания высокотехнологичной медицинской помощи пациентам вертебрологического профиля, основанных на высокой степени доказательности, обеспечит улучшение качества оказания специализированных медицинских услуг и снижение их стоимости.
Финансирование исследования. Работа выполнена в рамках договора №3875ГС1/63146 на выполнение научно-исследовательских и опытно-конструкторских работ, финансируемого Фондом содействия развитию малых форм предприятий в научно-технической сфере.
Конфликт интересов. Авторы декларируют отсутствие конфликтов интересов, связанных с публикацией настоящей статьи.
Литература
- Бывальцев В.А., Калинин А.А., Коновалов Н.А. Минимально инвазивная хирургия позвоночника: этапы развития. Вопросы нейрохирургии имени Н.Н. Бурденко 2019; 83(5): 328–339.
- Weiss H., Garcia R.M., Hopkins B., Shlobin N., Dahdaleh N.S. A systematic review of complications following minimally invasive spine surgery including transforaminal lumbar interbody fusion. Curr Rev Musculoskelet Med 2019; 12(3): 328–339, https://doi.org/10.1007/s12178-019-09574-2.
- Бывальцев В.А., Калинин А.А., Шепелев В.В. Сравнение результатов и экономической эффективности минимально инвазивного и открытого трансфораминального поясничного межтелового спондилодеза: метаанализ проспективных когортных исследований. Вестник Российской академии медицинских наук 2019; 74(2): 125–135, https://doi.org/10.15690/vramn1093.
- Chang H.K., Huang M., Wu J.C., Huang W.C., Wang M.Y. Less opioid consumption with Enhanced Recovery After Surgery transforaminal lumbar interbody fusion (TLIF): a comparison to standard minimally-invasive TLIF. Neurospine 2020; 17(1): 228–236, https://doi.org/10.14245/ns.1938422.211.
- Hall J.F., McLean J.B., Jones S.M., Moore M.A., Nicholson M.D., Dorsch K.A. Multilevel instrumented posterolateral lumbar spine fusion with an allogeneic cellular bone graft. J Orthop Surg Res 2019; 14(1): 372, https://doi.org/10.1186/s13018-019-1424-2.
- Лядов К.В., Кочатков А.В., Лядов В.К. Концепция ускоренной послеоперационной реабилитации в лечении опухолевых заболеваний ободочной кишки. Хирургия. Журнал им. Н.И. Пирогова 2015; 6: 84–90, https://doi.org/10.17116/hirurgia2015684-90.
- Wang M.Y., Chang P.Y., Grossman J. Development of an Enhanced Recovery After Surgery (ERAS) approach for lumbar spinal fusion. J Neurosurg Spine 2017; 26(4): 411–418, https://doi.org/10.3171/2016.9.spine16375.
- Ачкасов С.И., Лукашевич И.В., Суровегин Е.С. Влияние полноты реализации программы ускоренного выздоровления пациентов, перенесших резекцию ободочной кишки по поводу рака, на эффективность лечения. Онкологическая колопроктология 2016; 6(2): 29–34, https://doi.org/10.17650/2220-3478-2016-6-2-29-34.
- Licina A., Silvers A., Laughlin H., Russell J., Wan C. Proposed pathway for patients undergoing enhanced recovery after spinal surgery: protocol for a systematic review. Syst Rev 2020; 9(1): 39, https://doi.org/10.1186/s13643-020-1283-2.
- Порханов В.А., Жихарев В.А., Поляков И.С., Шолин И.Ю., Малышев Ю.П. Стратегия реализации принципов ERAS (Enhanced Recovery After Surgery) после хирургических операций в лечении пациентов раком лёгкого. Анестезиология и реаниматология 2017; 62(5): 352–357.
- John J.B., Hemsley A., Nunns M., McGrath J.S. Time to make Enhanced Recovery After Surgery the standard. Br J Hosp Med (Lond) 2020; 81(3): 1–4, https://doi.org/10.12968/hmed.2020.0029.
- Dietz N., Sharma M., Adams S., Alhourani A., Ugiliweneza B., Wang D., Nuño M., Drazin D., Boakye M. Enhanced Recovery After Surgery (ERAS) for spine surgery: a systematic review. World Neurosurg 2019; 130: 415–426, https://doi.org/10.1016/j.wneu.2019.06.181.
- Heathcote S. Sr., Duggan K., Rosbrugh J., Hill B., Shaker R., Hope W.W., Fillion M.M. Enhanced Recovery After Surgery (ERAS) protocols expanded over multiple service lines improves patient care and hospital cost. Am Surg 2019; 85(9): 1044–1050.
- Ljungqvist O., Scott M., Fearon K.C. Enhanced Recovery After Surgery: a review. JAMA Surg 2017; 152(3): 292–298, https://doi.org/10.1001/jamasurg.2016.4952.
- Smith J., Probst S., Calandra C., Davis R., Sugimoto K., Nie L., Gan T.J., Bennett-Guerrero E. Enhanced Recovery After Surgery (ERAS) program for lumbar spine fusion. Perioper Med 2019; 8: 4, https://doi.org/10.1186/s13741-019-0114-2.
- Ren Y., Feng X.Q., Ma Y.J., Shen S.Y., Xiao Y.X., Li J. Application of Enhanced Recovery After Surgery program for posterior lumbar decompression and fusion. TMR Integr Nurs 2019; 3(1): 35–41, https://doi.org/10.12032/tmrin20180304.
- Soffin E.M., Vaishnav A.S., Wetmore D.S., Barber L., Hill P., Gang C.H., Beckman J.D., Albert T.J., Qureshi S.A. Design and implementation of an Enhanced Recovery After Surgery (ERAS) program for minimally invasive lumbar decompression spine surgery: initial experience. Spine (Phila Pa 1976) 2019; 44(9): E561–E570, https://doi.org/10.1097/brs.0000000000002905.
- Deyo R.A., Mirza S.K., Martin B.I. Error in trends, major medical complications, and charges associated with surgery for lumbar spinal stenosis in older adults. JAMA 2011; 306(10): 1088, https://doi.org/10.1001/jama.2011.1300.
- Machado G.C., Maher C.G., Ferreira P.H., Harris I.A., Deyo R.A., McKay D., Li Q., Ferreira M.L. Trends, complications, and costs for hospital admission and surgery for lumbar spinal stenosis. Spine (Phila Pa 1976) 2017; 42(22): 1737–1743, https://doi.org/10.1097/brs.0000000000002207.
- Stone A.B., Grant M.C., Pio Roda C., Hobson D., Pawlik T., Wu C.L., Wick E.C. Implementation costs of an Enhanced Recovery After Surgery program in the United States: a financial model and sensitivity analysis based on experiences at a quaternary academic medical center. J Am Coll Surg 2016; 222(3): 219–225, https://doi.org/10.1016/j.jamcollsurg.2015.11.021.
- Назаренко А.Г., Коновалов Н.А., Крутько А.В., Замиро Т.Н., Героева И.Б., Губайдуллин Р.Р., Хорева Н.Е., Комаров А.Н., Степанян М.А., Константинова М.В., Казачонок А.М., Оноприенко Р.А., Королишин В.А., Кубынина Т.Н., Мартынова М.А. Применение технологии быстрого восстановления после хирургических вмешательств у пациентов с грыжами межпозвонковых дисков пояснично-крестцового отдела позвоночника. Вопросы нейрохирургии им. Н.Н. Бурденко 2016; 80(4): 5–12.
- Oderda G.M., Gan T.J., Johnson B.H., Robinson S.B. Effect of opioid-related adverse events on outcomes in selected surgical patients. J Pain Palliat Care Pharmacother 2013; 27(1): 62–70, https://doi.org/10.3109/15360288.2012.751956.
- Isaacs R.E., Podichetty V.K., Santiago P., Sandhu F.A., Spears J., Kelly K., Rice L., Fessler R.G. Minimally invasive microendoscopy-assisted transforaminal lumbar interbody fusion with instrumentation. J Neurosurg Spine 2005; 3(2): 98–105, https://doi.org/10.3171/spi.2005.3.2.0098.
- Cheng J.S., Park P., Le H., Reisner L., Chou D., Mummaneni P.V. Short-term and long-term outcomes of minimally invasive and open transforaminal lumbar interbody fusions: is there a difference? Neurosurg Focus 2013; 35(2): E6, https://doi.org/10.3171/2013.5.focus1377.
- Debono B., Corniola M.V., Pietton R., Sabatier P., Hamel O., Tessitore E. Benefits of Enhanced Recovery After Surgery for fusion in degenerative spine surgery: impact on outcome, length of stay, and patient satisfaction. Neurosurg Focus 2019; 46(4): E6, https://doi.org/10.3171/2019.1.focus18669.
- Venkata H.K., van Dellen J.R. A perspective on the use of an enhanced recovery program in open, non-instrumented day surgery for degenerative lumbar and cervical spinal conditions. J Neurosurg Sci 2018; 62(3): 245–254, https://doi.org/10.23736/s0390-5616.16.03695-x.
- Corniola M.V., Debono B., Joswig H., Lemée J.M., Tessitore E. Enhanced recovery after spine surgery: review of the literature. Neurosurg Focus 2019; 46(4): E2, https://doi.org/10.3171/2019.1.focus18657.










