Использование искусственной нейронной сети для прогнозирования развития коронарной микрососудистой обструкции (феномена no-reflow) в ходе выполнения чрескожных коронарных вмешательств у пациентов с инфарктом миокарда
Цель исследования — разработать, оценить и валидизировать искусственную нейронную сеть для прогнозирования развития коронарной микрососудистой обструкции (КМСО) в ходе выполнения чрескожных коронарных вмешательств (ЧКВ) у пациентов с инфарктом миокарда (ИМ) на основании показателей, рутинно доступных в операционной на момент выбора хирургической тактики.
Материалы и методы. Из базы данных Городской клинической больницы №13 Н. Новгорода ретроспективно отобран 5621 пациент с ИМ и экстренным ЧКВ, из них 3935 мужчин (70%) и 1686 женщин (30%), средний возраст — 61,5±10,8 года. У 201 пациента (4%) зарегистрирована КМСО (кровоток в инфаркт-ответственной артерии после ЧКВ — менее 3 баллов по шкале TIMI flow grade). Оценивали следующие входные показатели: возраст, пол, коронарный анамнез, предшествующая реваскуляризация, наличие подъема сегмента ST, класс острой сердечной недостаточности, факт проведения системной тромболитической терапии и ее эффективность, время «симптом–баллон», тяжесть коронарного тромбоза и атеросклеротического поражения, число стентов и количество прооперированных коронарных артерий. Выборка разделена на группы: для обучения (n=4060), тестирования (n=717) и независимой валидации (n=844).
Результаты. С целью прогнозирования КМСО на основе подвыборок для обучения и тестирования разработана искусственная нейронная сеть по типу полносвязного многослойного перцептрона с прямым распространением сигнала и двумя скрытыми слоями (площадь под ROC-кривой — 0,69). Сеть протестирована на независимой подвыборке (площадь под ROC-кривой — 0,64; прогностическая ценность отрицательного результата — 97,4%; прогностическая ценность положительного результата — 14,6%).
Заключение. Разработанная искусственная нейронная сеть, позволяющая использовать рутинно доступные на момент выбора хирургической тактики показатели, дает возможность прогнозировать развитие КМСО в ходе выполнения ЧКВ у пациентов с ИМ с достаточной для практического применения точностью.
Введение
Под коронарной микрососудистой обструкцией (КМСО, феномен no-reflow) понимают неадекватную перфузию миокарда после успешного восстановления просвета коронарной артерии (КА), прооперированной в ходе чрескожного коронарного вмешательства (ЧКВ). Данный феномен остается одним из наиболее часто встречающихся осложнений при эндоваскулярном лечении инфаркта миокарда (ИМ) и наблюдается примерно у 10% пациентов в случае использования ангиографических критериев [1]. Значительные трудности прогнозирования и лечения КМСО в большей степени обусловлены тем, что в основе патогенеза этого осложнения лежат несколько механизмов, вклад которых в его развитие существенно варьирует у разных пациентов [2].
В настоящее время наиболее перспективной для прогнозирования данного феномена следует считать прогностическую модель J.W. Wang с соавт. [3], полученную методом логистической регрессии и отличающуюся достаточно высоким качеством (площадь под ROC-кривой — 0,800; 95% доверительный интервал (95% CI) — 0,772–0,826), а также приемлемыми показателями чувствительности и специфичности (76,1 и 70,8% соответственно). При этом указанная модель имеет ряд ограничений: использование лабораторных маркеров, часто недоступных при экстренном поступлении пациента с ИМ в операционную, и отсутствие валидации на независимых данных.
Одним из актуальных подходов, который может обеспечить сопоставимую по эффективности и лишенную вышеуказанных ограничений прогностическую модель, является анализ больших объемов данных с использованием методов машинного обучения, в частности — искусственных нейронных сетей (ИНС).
Цель исследования — разработать, оценить и валидизировать искусственную нейронную сеть для прогнозирования развития коронарной микрососудистой обструкции (феномена no-reflow) в ходе выполнения чрескожных коронарных вмешательств у пациентов с инфарктом миокарда на основании показателей, рутинно доступных в операционной на момент выбора хирургической тактики.
Материалы и методы
Описание выборки. Для создания ИНС были ретроспективно проанализированы данные о 19 596 пациентах из регистра лечения и госпитальных исходов больных с острым коронарным синдромом Городской клинической больницы №13 (Н. Новгород) за 2011–2020 гг. Перед проведением отбора и статистического анализа информация о пациентах была анонимизирована.
Критериями включения в исследование служили подтвержденный ИМ и выполненное ЧКВ. Из последующего анализа были исключены файлы пациентов с неполными данными и содержащие информацию, которую с позиций статистического анализа следовало квалифицировать как «выброс». В итоге был отобран 5621 пациент. Общая схема процесса включения пациентов в исследование и создания прогностических моделей представлена на рис. 1.

|
Рис. 1. Схема процесса включения пациентов в исследование и создания прогностических моделей |
Диагноз ИМ ставился на основании клинических и биохимических критериев, согласно третьему, а затем четвертому универсальному определению ИМ [4]. Выполненное ЧКВ заключалось в имплантации стента в инфаркт-ответственную артерию (ИОА) с остаточным стенозом менее 50%. Тяжесть острой сердечной недостаточности (ОСН) оценивали по классификации Killip [1, 3], степень кровотока в ИОА после ЧКВ — по шкале Thrombolysis in myocardial infarction (TIMI) flow grade [5], выраженность тромбоза ИОА (после проведения коронарного проводника) — по TIMI thrombus grade [6].
Феномен КМСО был выявлен у 201 пациента (4%) из всех включенных в исследование (n=5621). Развитие КМСО диагностировали на основании оценки кровотока в ИОА по TIMI flow grade на момент окончания ЧКВ. Критерием диагностики КМСО служил кровоток менее 3 баллов при условии отсутствия других причин, способных вызвать его снижение (стойкий спазм, диссекция КА, крупный тромбоэмбол, выраженный остаточный стеноз).
Для создания ИНС были отобраны следующие параметры: возраст, пол, стенокардия и/или ИМ в анамнезе, проведенное ранее ЧКВ и/или коронарное шунтирование, наличие стойкого подъема сегмента ST на электрокардиограмме, класс ОСН, факт проведения системной тромболитической терапии и ее эффективность, время «симптом–баллон» (от начала ангинозного статуса до восстановления коронарного кровотока в ходе ЧКВ), выраженный тромбоз ИОА (4, 5-я степени по TIMI thrombus grade), тяжесть атеросклеротического поражения КА (одно-, двух-, трехсосудистое и/или поражение ствола левой КА), количество имплантированных стентов и число прооперированных КА. Характеристика групп пациентов с развившейся и неразвившейся КМСО представлена в табл. 1.

|
Таблица 1. Характеристика групп пациентов с развившейся и неразвившейся коронарной микрососудистой обструкцией |
Статистическая обработка. Для определения характера распределения применяли критерий Колмогорова–Смирнова. Учитывая характер распределения, для оценки статистической значимости различий количественных данных использовали тест Манна–Уитни, для оценки значимости различий качественных данных — критерий 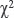 Пирсона. Различия считали статистически значимыми при р≤0,05. Количественные данные представлены в виде медианы и интерквартильных интервалов (Me [Q1; Q3]). Статистическую обработку проводили с помощью программ Statistica 10.0 (StatSoft Inc., США) и MedCalc 11.5 (MedCalc Software Ltd, Бельгия).
Пирсона. Различия считали статистически значимыми при р≤0,05. Количественные данные представлены в виде медианы и интерквартильных интервалов (Me [Q1; Q3]). Статистическую обработку проводили с помощью программ Statistica 10.0 (StatSoft Inc., США) и MedCalc 11.5 (MedCalc Software Ltd, Бельгия).
Подготовка данных. Включенные в исследование пациенты (n=5621) случайным образом были разделены на три подвыборки (подгруппы): обучающую (TRAIN), контрольную (TEST) и валидизирующую (VALID) в соотношении 4060 (72,2%), 717 (12,8%) и 844 (15,0%) пациента соответственно (см. рис. 1). Число больных с КМСО в подвыборке TRAIN составило 143 (3,5% от 4060 пациентов) человека, в подвыборке TEST — 25 (3,5% от 717), в подвыборке VALID — 33 (3,9% от 844).
Непрерывные числовые параметры (возраст и время «симптом–баллон») были нормализованы на среднее значение и стандартное отклонение (M±SD) [7]. Расчет среднего и стандартного отклонения проводили на основании данных подвыборки TRAIN, далее полученные значения использовали для нормализации показателей в других подвыборках. Средний возраст в подгруппе TRAIN составил 61,4±10,0 года, среднее время «симптом–баллон» — 14,9±14,2 ч. Категориальные данные были перекодированы методом унитарного кода (one-hot encoding) [7]. В заключение данные были перемешаны.
С учетом несбалансированности набора данных по проценту пациентов с развившейся КМСО (всего 3,5% в подгруппе TRAIN) был применен ряд методов устранения дисбаланса классов в обучающей подвыборке. Использовали следующие методики: случайное уменьшение размера доминантного класса (random undersampling) до соотношения 143/143, случайное увеличение размера миноритарного класса (random oversampling) до соотношения 3917/3917, увеличение размера миноритарного класса с помощью синтетических образцов (synthetic minority oversampling technique, SMOTE) до соотношения 3917/3917, обучение с учетом корригирующих весов для прогнозируемых классов (0,52 — для пациентов без КМСО и 14,20 — для больных с развившимся данным осложнением) [8].
Структура и обучение искусственных нейронных сетей. Создание ИНС было выполнено в среде программирования Python с использованием библиотек для машинного обучения с открытым исходным кодом TensorFlow, Keras и scikit-learn [9]. С целью устранения несбалансированности исходных данных применяли алгоритмы из библиотеки imbalanced-learn [10]. Для обучения модели использовали подвыборку TRAIN, для контроля «сходимости» — TEST. Подвыборку VALID применяли в последующем для независимой валидации (см. рис. 1). В процессе создания и обучения ИНС были опробованы различные варианты структуры и размерности сети, функций активации и потери, алгоритмов обучения и регуляризации, а также разнообразные подходы к работе с несбалансированными данными.
Оптимальная из всех полученных ИНС имела структуру полносвязного многослойного перцептрона (multilayered perceptron, MLP) [11] с прямым распространением сигнала, количеством входов — 35, двумя скрытыми слоями (36 и 72 скрытых нейрона) и количеством выходов — 1 (формула MLP 35-36-72-1). На первом скрытом слое в качестве функции активации использовали линейную, на втором — функцию усеченного линейного преобразования (rectified linear unit, ReLU), на выходном элементе — сигмоидную функцию.
Функция прямого распространения сигнала была стандартной для вышеуказанного типа ИНС. Для каждого узла текущего слоя значение узла вышележащего слоя умножалось на его вес и суммировалось с результатами других узлов и весом смещения, после чего обрабатывалось функцией активации [11]:
ƒ (x1w1 + x2w2 + … + xnwn + b),
где: ƒ — функция активации текущего слоя; x — значение узла вышележащего слоя; w — вес узла вышележащего слоя, относящийся к текущему узлу; n — число узлов в вышележащем слое; b — вес смещения для текущего узла.
Полученная ИНС выдавала прогноз развития неблагоприятного исхода (КМСО) в диапазоне от 0 до 1. Для классификации результата использовали пороговое значение, при превышении которого считали, что ИНС предсказывает развитие неблагоприятного исхода.
Так как дальнейшее усложнение и увеличение размерности сети не приводило к повышению ее эффективности, было принято решение остановиться на описанной выше архитектуре. Структурный граф созданной ИНС отражен на рис. 2.

|
Рис. 2. Структурный граф созданной искусственной нейронной сети
n — число нейронов в слое |
Для оптимизации весов в ходе обучения ИНС использовали алгоритм адаптивной оценки момента (adaptive moment estimation, Adam) со скоростью обучения 0,001 и остальными параметрами по умолчанию [12]. В качестве функции оценки потери применяли бинарную кросс-энтропию (binary cross-entropy) [13]. В процессе обучения для начальной инициализации весов была использована равномерная инициализация Ксавье (Xavier uniform initialization/Glorot uniform initialization), для ускорения обучения рассчитано начальное смещение (initial bias) [14].
Для оценки эффективности получаемых ИНС и поиска оптимального порогового значения (cut-off value) использовали ROC-анализ с оценкой площади под ROC-кривой AUC. На основании полученного порогового значения строили матрицу ошибок и оценивали метрики. Матрица ошибок включала четыре ячейки с числом случаев, отнесенных к одной из категорий: истинно-положительные (true positive, TP), ложноположительные (false positive, FP), истинно-отрицательные (true negative, TN) и ложноотрицательные (false negative, FN). В качестве метрик анализировали чувствительность/полноту (sensitivity/recall), специфичность (specificity), прогностическую ценность положительного результата (positive predictive value), прогностическую ценность отрицательного результата/точность (negative predictive value/precision), F1-меру (F1-score). Расчет метрик проводили по следующим формулам:
чувствительность = TP / (TP + FN);
специфичность = TN / (TN + FP);
прогностическая ценность
положительного результата = TP / (TP + FP);
прогностическая ценность
отрицательного результата = TN / (TN + FN);
F1-мера = 2 · точность · полнота / (точность + полнота).
С целью предотвращения переобучения ИНС использовали промежуточные исключающие слои (dropout layers) с вероятностью исключения 0,5; применяли L1-регуляризацию выходного слоя с фактором регуляризации 0,1; реализовывали функцию ранней остановки на основе оценки F1-меры [15].
Наиболее эффективная из созданных ИНС (с максимальным значением F1-меры и AUC) была получена при обучении с учетом корригирующих весов для прогнозируемых классов. Данная сеть была выбрана для дальнейшей работы и валидации.
Создание сравнительной логистической регрессионной модели. Для сравнительной оценки эффективности полученной ИНС была создана логистическая регрессионная модель:
logit (p) = –6,2683 + 0,03052 · возраст (лет) + 0,9561 · TIMI thrombus grade 4, 5 (да/нет) + 0,6897 · ИМ с подъемом сегмента ST (да/нет) + 1,4631 · ОСН 4-го класса по Killip (да/нет) + 0,9496 · имплантация 3 стентов и более (да/нет) + 0,5813 · неэффективный системный тромболизис (да/нет).
Здесь logit (p) — переменная отклика уравнения логистической регрессии.
Для создания модели использовали пошаговый метод (stepwise) с исключением при p>0,05 [16]. Модель была разработана на объединенном наборе данных из подвыборок TRAIN и TEST. Оценку эффективности полученной логистической модели осуществляли аналогично оценке ИНС.
Независимая валидация. Валидацию полученных моделей проводили на подвыборке VALID. Для сравнения AUC моделей использовали тест DeLong.
Результаты
Госпитальная летальность в исследуемой выборке составила 3,8% (скончались 213 пациентов из 5621). Сравнение групп пациентов с развившейся и неразвившейся КМСО представлено в табл. 1. В группе КМСО отмечена более высокая госпитальная летальность и бόльшая доля пациентов, имевших такие предикторы КМСО, как возраст, ИМ с подъемом сегмента ST, тяжелая ОСН, неэффективная тромболитическая терапия, выраженный тромбоз ИОА, более выраженное атеросклеротическое поражение КА, большое количество стентов и одномоментное стентирование нескольких КА. Однако время «симптом–баллон» в данной группе было меньше.
Результаты обучения, оценки точности и валидации ИНС, а также создания и валидации логистической регрессионной модели представлены в табл. 2.

|
Таблица 2. Результаты создания, обучения и валидации моделей |
Сравнение AUC, полученных с помощью ИНС и логистической регрессии на подвыборке VALID (рис. 3), показало отсутствие статистически значимых различий (p=1,00).

|
Рис. 3. Сравнение ROC-кривых моделей на подвыборке VALID |
Обсуждение
Вследствие использования ретроспективного анализа и обусловленной им ограниченности имеющейся информации факт развития КМСО констатировали только по шкале TIMI flow grade в ИОА после выполнения ЧКВ. Таким образом, изучению подвергались наиболее тяжелые случаи КМСО, частота которых на практике относительно мала (4% в представленной работе). Ожидаемо развитие тяжелой КМСО было ассоциировано с «классическими» предикторами и увеличивало риск госпитальной смерти. Меньшее время «симптом–баллон» у пациентов с КМСО, по-видимому, обусловлено включением в исследование лиц с ИМ без стойкого подъема сегмента ST. Подобные больные попадают на операцию позже и при этом имеют меньший риск развития обсуждаемого осложнения.
Известно, что патогенез синдрома КМСО весьма неоднороден. К развитию данного феномена могут приводить дистальная тромботическая микроэмболизация, ишемическо-реперфузионное повреждение и исходно существовавшая у пациента эндотелиальная дисфункция, развившаяся на фоне сопутствующей патологии или наличия некоторых вариантов однонуклеотидного полиморфизма генов [2]. Вследствие этого у каждого конкретного пациента можно наблюдать различное сочетание и выраженность описанных выше патогенетических механизмов, что в свою очередь обусловливает существенные трудности в прогнозировании развития КМСО и подчеркивает необходимость валидации на независимых данных [17].
Попытки объединить в рамках одной модели показатели, отражающие все патогенетические звенья развития КМСО, приводят к чрезмерному усложнению модели и трудности ее эффективного использования в реальной клинической практике. Так, для известной модели J.W. Wang [3] необходимы лабораторные показатели, которые редко доступны во время операции у пациентов с ИМ вследствие необходимости выполнять экстренное ЧКВ без задержек.
В рамках данной работы нами была предпринята попытка создать прогностическую модель, сочетающую в себе простоту (использование показателей, рутинно доступных на момент выбора хирургической тактики), достаточную точность (результат должен иметь клиническую ценность) и доказанную эффективность (наличие валидации на независимых данных). Такие требования во многом определили выбор ИНС для построения прогностической модели.
Известно, что ИНС позволяют находить сложные зависимости и проводить классификацию на основе множеств признаков, плохо разделяемых с помощью других видов анализа [8, 11]. Данное свойство ИНС представлялось нам особенно важным в условиях недоступности при прогнозировании ряда высокоспецифичных для КМСО показателей. Однако при проведении сравнительного анализа полученных результатов было установлено, что точность логистической регрессионной модели во многом сопоставима с точностью созданной ИНС. Так, AUC, полученные на подвыборке VALID, были одинаковыми (см. рис. 3). По всей видимости, данный факт объясняется недостаточной специфичностью доступных показателей по отношению к КМСО. Отсутствие во входных данных точных лабораторных маркеров сделало поставленную задачу непростой и не позволило ИНС реализовать свой потенциал в классификации сложных закономерностей. Кроме того, низкая частота КМСО в изучаемой выборке привела к возникновению проблемы несбалансированных данных [8, 10], суть которой заключается в игнорировании ИНС миноритарного класса (пациенты с КМСО) при обучении. Данную проблему удалось решить с помощью техник устранения дисбаланса и специальных метрик (F1-мера).
По всей вероятности, указанные выше сложности патогенеза КМСО, несбалансированность и низкая специфичность входных данных также являются основными причинами умеренной точности создаваемых моделей в целом (см. табл. 2). При этом важно подчеркнуть, что, несмотря на все ограничения, полученная ИНС не лишена клинической ценности и имеет ряд преимуществ перед регрессионной моделью. Учитывая высокую прогностическую ценность отрицательного результата (97,4%), исключающий КМСО результат расчета ИНС дает хирургу уверенность в безопасности проведения технически сложного и «агрессивного» ЧКВ, если это необходимо (использование нескольких стентов, постдилатация баллонами высокого давления и т.д.) [18]. Напротив, казалось бы, скромная прогностическая ценность положительного результата (14,6%) с учетом низкой частоты КМСО (4%) делает факт получения прогнозирующих это осложнение данных весьма полезным. В этом случае у врача появляются дополнительные аргументы для выполнения минимально-инвазивной процедуры, а также для переоценки рисков и назначения дополнительного лечения, например IIb/IIIa-блокаторов гликопротеиновых рецепторов тромбоцитов [19]. Важно, что при проведении валидации ИНС показала более высокие значения F1-меры — 21,3% против 17,1% у регрессионной модели, что свидетельствует о ее большей точности в условиях несбалансированности данных. Отметим, что существенным плюсом полученных моделей является проведенная валидация на независимых данных, и это намного увеличивает доверие к ним. Созданную ИНС следует считать полезным дополнительным инструментом для принятия решения об оптимальной хирургической тактике у больных с ИМ.
Ограничения исследования. Представленное исследование и разработанная модель имеют ряд ограничений. Ретроспективный характер сбора показателей и ограничения использованной базы данных не позволили включить в модель ряд потенциальных предикторов КМСО (например, выраженность коллатерального кровотока), а также использовать более широкие критерии для диагностики исхода (перфузию миокарда по шкале Myocardial blush grade (MBG) и нормализацию сегмента ST на электрокардиограмме). Согласно исходным критериям включения, модель может быть использована только для пациентов, поступивших с диагнозом ИМ. Умеренные показатели точности модели диктуют необходимость ее осторожного и взвешенного использования. Для лучшей оценки точности целесообразно провести дополнительную проспективную валидацию на выборке пациентов из других учреждений.
Заключение
Созданная искусственная нейронная сеть использует рутинно доступные на момент выбора хирургической тактики показатели и позволяет прогнозировать развитие феномена коронарной микрососудистой обструкции (no-reflow) в ходе выполнения чрескожных коронарных вмешательств у пациентов с инфарктом миокарда с достаточной для практического применения точностью (площадь под ROC-кривой — 0,69). Существенным плюсом созданной модели является валидация на независимом наборе данных (площадь под ROC-кривой — 0,64; прогностическая ценность отрицательного результата — 97,4%; прогностическая ценность положительного результата — 14,6%).
Источники финансирования. Исследование не имело спонсорской поддержки.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Литература
- Gupta S., Gupta M.M. No reflow phenomenon in percutaneous coronary interventions in ST-segment elevation myocardial infarction. Indian Heart J 2016; 68(4): 539–551, https://doi.org/10.1016/j.ihj.2016.04.006.
- Niccoli G., Scalone G., Lerman A., Crea F. Coronary microvascular obstruction in acute myocardial infarction. Eur Heart J 2016; 37(13): 1024–1033, https://doi.org/10.1093/eurheartj/ehv484.
- Wang J.W., Zhou Z.Q., Chen Y.D., Wang C.H., Zhu X.L. A risk score for no reflow in patients with ST-segment elevation myocardial infarction after percutaneous coronary intervention. Clin Cardiol 2015; 38(4): 208–215, https://doi.org/10.1002/clc.22376.
- Thygesen K., Alpert J.S., Jaffe A.S., Chaitman B.R., Bax J.J., Morrow D.A., White H.D.; ESC Scientific Document Group. Fourth universal definition of myocardial infarction (2018). Eur Heart J 2018; 40(3): 237–269, https://doi.org/10.1093/eurheartj/ehy462.
- The TIMI Study Group. The thrombolysis in myocardial infarction (TIMI) trial. Phase I findings. N Engl J Med 1985; 312(14): 932–936, https://doi.org/10.1056/nejm198504043121437.
- Gibson C.M., de Lemos J.A., Murphy S.A., Marble S.J., McCabe C.H., Cannon C.P., Antman E.M., Braunwald E. Combination therapy with abciximab reduces angiographically evident thrombus in acute myocardial infarction: a TIMI 14 substudy. Circulation 2001; 103(21): 2550–2554, https://doi.org/10.1161/01.cir.103.21.2550.
- Alasadi S.A., Bhaya W.S. Review of data preprocessing techniques in data mining. J Eng Appl Sci 2017; 12(16): 4102–4107.
- Kaur H., Pannu H.S., Malhi A.K. A systematic review on imbalanced data challenges in machine learning: applications and solutions. ACM Comput Surv 2019; 52(4): 1–36, https://doi.org/10.1145/3343440.
- Pang B., Nijkamp E., Wu Y.N. Deep learning with TensorFlow: a review. J Educ Behav Stat 2020; 45(2): 227–248, https://doi.org/10.3102/1076998619872761.
- Susan S., Kumar A. The balancing trick: optimized sampling of imbalanced datasets — a brief survey of the recent state of the art. Eng Reports 2020; 3(4): e12298, https://doi.org/10.1002/eng2.12298.
- Ramchoun H., Amine M., Idrissi J., Ghanou Y., Ettaouil M. Multilayer perceptron: architecture optimization and training. Int J Interact Multimed Artif Intell 2016; 4(1): 26–30, https://doi.org/10.9781/ijimai.2016.415.
- Liu X., Pan Z., Yang H., Zhou X., Bai W., Niu X. An adaptive moment estimation method for online AUC maximization. PLoS One 2019; 14(4): e0215426, https://doi.org/10.1371/journal.pone.0215426.
- Ramos D., Franco-Pedroso J., Lozano-Diez A., Gonzalez-Rodriguez J. Deconstructing cross-entropy for probabilistic binary classifiers. Entropy (Basel) 2018; 20(3): 208, https://doi.org/10.3390/e20030208.
- Burnaev E.V., Erofeev P.D. The influence of parameter initialization on the training time and accuracy of a nonlinear regression model. J Commun Technol Electron 2016; 61(6): 646–660, https://doi.org/10.1134/s106422691606005x.
- Ying X. An overview of overfitting and its solutions. J Phys: Conf Ser 2019; 1168: 022022, https://doi.org/10.1088/1742-6596/1168/2/022022.
- Ranganathan P., Pramesh C.S., Aggarwal R. Common pitfalls in statistical analysis: measures of agreement. Perspect Clin Res 2017; 8(4): 187–191, https://doi.org/10.4103/picr.picr_123_17.
- Niccoli G., Montone R.A., Ibanez B., Thiele H., Crea F., Heusch G., Bulluck H., Hausenloy D.J., Berry C., Stiermaier T., Camici P.G., Eitel I. Optimized treatment of ST-elevation myocardial infarction the unmet need to target coronary microvascular obstruction as primary treatment goal to further improve prognosis. Circ Res 2019; 125(2): 245–258, https://doi.org/10.1161/circresaha.119.315344.
- Karamasis G.V., Kalogeropoulos A.S., Gamma R.A., Clesham G.J., Marco V., Tang K.H., Jagathesan R., Sayer J.W., Robinson N.M., Kabir A., Aggarwal R.K., Kelly P.A., Prati F., Keeble T.R., Davies J.R. Effects of stent postdilatation during primary PCI for STEMI: insights from coronary physiology and optical coherence tomography. Catheter Cardiovasc Interv 2021; 97(7): 1309–1317, https://doi.org/10.1002/ccd.28932.
- Karathanos A., Lin Y., Dannenberg L., Parco C., Schulze V., Brockmeyer M., Jung C., Heinen Y., Perings S., Zeymer U., Kelm M., Polzin A., Wolff G. Routine glycoprotein IIb/IIIa inhibitor therapy in ST-segment elevation myocardial infarction: a meta-analysis. Can J Cardiol 2019; 35(11): 1576–1588, https://doi.org/10.1016/j.cjca.2019.05.003.










