Современные технологии реабилитации пациентов с двигательными нарушениями в раннем восстановительном периоде мозгового инсульта (обзор)
Мозговой инсульт является одной из ведущих причин инвалидности среди взрослого населения во всем мире. Число пациентов, перенесших инсульт и нуждающихся в реабилитации, в том числе двигательной, растет ежегодно. Стандартные методы моторной реабилитации оказывают ограниченное влияние на восстановление утраченных двигательных функций конечностей. В связи с этим в последние годы предлагаются новые технологии постинсультной реабилитации. В настоящем обзоре обобщены имеющиеся в литературе данные о возможностях применения современных методов реабилитации пациентов с двигательными нарушениями в раннем восстановительном периоде мозгового инсульта. Существующие современные технологии разделены на методы, основанные на теории «межполушарной конкуренции» (ритмическая транскраниальная магнитная стимуляция, транскраниальная электрическая стимуляция постоянным током), и на теории «зеркальных нейронов» (системы виртуальной реальности и нейрокомпьютерные интерфейсы). Представлены нейрофизиологическое обоснование и возможные протоколы применения данных методов в клинической практике, результаты клинических исследований в зависимости от исходной степени тяжести двигательных нарушений и давности инсульта, а также факторы, влияющие на эффективность двигательной реабилитации при использовании данных методов.
Введение
За период с 1990 по 2019 г. количество ежегодно регистрируемых случаев инсульта увеличилось на 70%, что составило 12,2 млн пациентов в год [1]. В настоящее время инсульт считается третьей по значимости причиной инвалидности взрослого населения во всем мире [1, 2]. Рост числа пациентов, нуждающихся в нейрореабилитации, требует от медицинского сообщества разработки и внедрения в клиническую практику новых методов восстановления утраченных функций.
Одной из важнейших задач постинсультной реабилитации является восстановление утраченных двигательных функций конечностей. Как минимум у 50% пациентов, перенесших инсульт, инвалидность обусловлена моторным дефицитом рук и/или ног [3, 4]. Постинсультные двигательные нарушения в руках считаются более клинически значимыми, они труднее поддаются восстановлению по сравнению с моторным дефицитом нижних конечностей [5–8]. Возможно, именно поэтому в настоящее время большинство имеющихся клинических исследований сосредоточено на моторной реабилитации пациентов с двигательными расстройствами верхних конечностей.
Для эффективной нейрореабилитации значимым является понимание межнейрональных взаимодействий, а также нейрофизиологических аспектов поражения и восстановления ткани головного мозга. Известно, что активность восстановления нарушенных в результате инсульта функций меняется с течением времени [4, 9]. В литературе приводятся данные о том, что естественная нейропластичность особенно выражена в первые 3–6 мес от момента развития инсульта [10, 11]. Следовательно, изучение применения высокотехнологичных методов в раннем восстановительном периоде представляется наиболее актуальной задачей в современной нейрореабилитации [7, 10].
Принципы использования современных технологий, направленных на восстановление движений, основываются на двух основных нейрофизиологических теориях: 1) теории межполушарной конкуренции (interhemispheric inhibition, IHI) и 2) теории зеркальных нейронов (mirrror neurons, MNs). В частности, к методам двигательной реабилитации, базирующимся на теории межполушарной конкуренции, принято относить ритмическую транскраниальную магнитную стимуляцию и транскраниальную электрическую стимуляцию постоянным током. Методы тренировки в виртуальной реальности и нейрокомпьютерные интерфейсы применяются с целью активации так называемой сети зеркальных нейронов.
Цель данного обзора — обобщение и анализ актуальной информации, касающейся применения современных технологий реабилитации пациентов с двигательными нарушениями в раннем восстановительном периоде мозгового инсульта.
Поиск литературы выполняли по реферативным базам данных Scopus и Web of Science; в поисковой системе PubMed по базам MEDLINE и PubMed Central; на платформе Springer Link; в BioMed Central; Free Medical Journals; SSRN; Google Scholar по ключевым словам: stroke rehabilitation/постинсультная реабилитация, motor disorders/двигательные нарушения, noninvasive brain stimulation/неинвазивная стимуляция мозга, repetitive transcranial magnetic stimulation/ритмическая транскраниальная магнитная стимуляция, transcranial direct current stimulation/транскраниальная электрическая стимуляция постоянным током, virtual reality/виртуальная реальность, brain–computer interface/нейрокомпьютерный интерфейс.
Высокотехнологичные методы двигательной реабилитации, возможные к применению в раннем восстановительном периоде инсульта, обобщены и представлены на рисунке. Подробнее они рассмотрены ниже.
Высокотехнологичные методы, основанные на теории межполушарной конкуренции
Считается, что в норме возбужденные нейроны одного полушария головного мозга оказывают тормозящее влияние на нейроны противоположного, что обусловливает межполушарное равновесие и сбалансированность нейрофизиологических процессов. Между тем, по данным исследований с применением функциональной магнитно-резонансной томографии (фМРТ) и диагностической транскраниальной магнитной стимуляции (ТМС), уменьшение количества функционирующих нейронов в пораженном инсультом полушарии может приводить к смещению равновесия в сторону незатронутой гемисферы и формированию избыточных уровней торможения пораженной коры. При этом степень выраженности межполушарной асимметрии и гиперактивации первичной моторной коры интактного полушария напрямую коррелирует с тяжестью двигательного дефицита [12–14] и считается фактором, препятствующим естественному восстановлению нарушенных двигательных функций [15].
С целью коррекции межполушарной асимметрии и повышения эффективности реабилитации пациентов с двигательным дефицитом после перенесенного мозгового инсульта обсуждается возможность использования в клинической практике некоторых методов неинвазивной стимуляции мозга. В частности, в качестве адъювантных методов нейрореабилитации предлагается применение ритмической транскраниальной магнитной стимуляции (рТМС) (repetitive transcranial magnetic stimulation) и транскраниальной электрической стимуляции постоянным током (tDCS) (transcranial direct current stimulation) [16].
Необходимо отметить, что в настоящее время отсутствует единое мнение о наличии патологической гипервозбудимости контралатеральной моторной коры и ее негативном влиянии на функциональные исходы пациентов с двигательными постинсультными нарушениями. Так, в большинстве клинических исследований теория межполушарной конкуренции находит свое подтверждение [17–19]. В то же время J. Xu и соавт. [20] при использовании диагностической ТМС регистрировали отсутствие патологического межполушарного торможения в остром и раннем восстановительном периодах мозгового инсульта и его появление по мере улучшения двигательных функций в позднем восстановительном периоде. Следовательно, вопрос о необходимости применения в раннем восстановительном периоде инсульта рТМС и tDCS с целью коррекции межполушарной асимметрии остается открытым. Кроме того, до конца не изучена эффективность использования данных методов нейромодуляции в двигательной постинсультной реабилитации, что требует дополнительных исследований.
Ритмическая транскраниальная магнитная стимуляция
Транскраниальная магнитная стимуляция представляет собой метод доставки электрических импульсов через кожу к тканям головного мозга с использованием магнитного поля. ТМС может быть применена как в диагностических, так и в терапевтических целях [21]. Режим диагностической ТМС предполагает подачу одиночных электрических импульсов и позволяет оценить целостность и функционирование двигательного пути нервной системы. С целью лечения и двигательной нейрореабилитации применяется режим рТМС.
Ритмическая транскраниальная магнитная стимуляция (синоним в русской литературе — повторяющаяся ТМС) заключается в подаче непрерывной серии электрических импульсов в ткани мозга с помощью переменного магнитного поля [15, 22]. В настоящее время используется два основных режима рТМС: высокочастотный и низкочастотный. Считается, что при высокой частоте стимуляции (3–10 Гц) возбудимость нейронов головного мозга повышается, тогда как при низкой (1 Гц) возникает противоположный эффект [23].
На сегодняшний день разработано несколько протоколов применения рТМС, оказывающих разные нейромодулирующие эффекты. К основным (simple) относят низкочастотную рТМС (НЧ-рТМС) контралатерального полушария и высокочастотную рТМС (ВЧ-рТМС) ипсилатерального полушария. Предлагаются и другие протоколы проведения рТМС. Ожидается, что они будут более эффективны для коррекции двигательных расстройств в раннем восстановительном периоде инсульта.
Основные протоколы рТМС. К основным протоколам относят низкочастотную рТМС контралатерального полушария. Одним из основных и наиболее часто применяющихся в двигательной постинсультной реабилитации протоколов рТМС считается низкочастотная рТМС контралатерального полушария [23]. Метод подразумевает воздействие магнитного поля на здоровое полушарие головного мозга для ослабления его избыточного тормозящего влияния. Эффективность НЧ-рТМС и факт снижения активации контралатерального полушария под ее воздействием были подтверждены в ряде клинических исследований с использованием различных методов функциональной диагностики: электроэнцефалографии (ЭЭГ) [24], фМРТ [14] и диагностической ТМС [25].
В большинстве работ [19, 26, 27] приводятся данные об отсутствии или наличии лишь незначительного превосходства данного протокола стимуляции по сравнению с группой плацебо в улучшении двигательных функций пораженных верхних и нижних конечностей в раннем восстановительном периоде инсульта (табл. 1).
При использовании высокочастотной рТМСипсилатерального полушария электроды накладываются над зоной М1 испилатерального полушария головного мозга. Считается, что ВЧ-рТМС способствует повышению возбудимости оставшихся нейронов пораженного инсультом полушария, и это ведет к реорганизации моторной коры и ускорению темпов восстановления утраченных двигательных функций. Эффективность применения ВЧ-рТМС ипсилатерального полушария подтверждена в исследованиях с использованием фМРТ [14] и диагностической ТМС [14, 28]. В целом продемонстрированы лучшие функциональные исходы как для верхней, так и для нижней конечности, по сравнению с группой плацебо [7, 29, 30] (см. табл. 1).
Вместе с тем, по данным J. Du и соавт. [14], сравнение протоколов НЧ-рТМС контралатерального полушария и ВЧ-рТМС испилатеральной гемисферы продемонстрировало эффективность обоих режимов в восстановлении двигательной функции верхней конечности. Однако более выраженные двигательные улучшения были выявлены при использовании высокочастотной стимуляции пораженного полушария.
Другие протоколы рТМС. К относительно более новым режимам использования рТМС можно отнести комбинированный протокол совместного применения НЧ- и ВЧ-рТМС. В частности, H. Long и соавт. [31] сравнивали эффективность этого протокола (группа 1) с использованием НЧ-рТМС контралатерального полушария (группа 2) и плацебо-имитацией (группа 3) в раннем восстановительном периоде инсульта. Авторы показали, что клинически значимые улучшения двигательных функций наблюдались во всех трех группах непосредственно после терапии и через 3 мес после ее завершения. При этом наилучшие результаты были получены в группе 1.
Высокочастотная рТМС контралатерального полушария. В большинстве случаев у пациентов, перенесших тяжелый инсульт с обширным поражением одного полушария, использование вышеописанных протоколов рТМС в двигательной постинсультной реабилитации недостаточно эффективно. Исследователи объясняют это тем, что при обширном одностороннем поражении головного мозга межполушарное торможение становится слабым, и нейронов в ипсилатеральном полушарии оказывается недостаточно для компенсации утраченных двигательных функций [32, 33]. С помощью фМРТ головного мозга показано, что в здоровом (контралатеральном очагу поражения) полушарии формируются компенсаторные нейрональные связи, способствующие функциональному восстановлению утраченных двигательных функций [32, 34]. В связи с этим у пациентов с обширным односторонним поражением коры головного мозга и выраженными двигательными нарушениями было предложено проводить ВЧ-рТМС М1 здорового полушария с целью дополнительной активации реорганизации контралатерального полушария. Эффективность данного протокола рТМС получила подтверждение в клинических исследованиях. Так, Q. Wang и соавт. [35] отмечали клинически значимые улучшения у пациентов, которым проводили ВЧ-рТМС контралатерального полушария, в то время как у больных, получавших НЧ-рТМС или плацебо-имитацию, положительных функциональных исходов после перенесенного инсульта не наблюдалось.
Стимуляцию тета-вспышками (theta burst stimulation, TBS) относят к новейшим протоколам нейромодуляции, основанным на ритмической ТМС. Метод заключается в доставке к тканям мозга серии «пакетов» электрических стимулов. «Пакеты» повторяются каждые 200 мс (частота 5 Гц) и состоят из трех, подающихся с интервалом 20 мс импульсов (частота 50 Гц) [36]. Предполагается, что данный метод стимуляции способен вызвать более стойкие нейропластические эффекты по сравнению с другими способами неинвазивной стимуляции мозга [37].
Предложено три режима TBS: постоянный (continuous TBS, cTBS), интермиттирующий (intermittent TBS, iTBS) и промежуточный (intermediate TBS, imTBS) [36, 38]. Считается, что постоянная TBS вызывает снижение возбудимости коры головного мозга за счет торможения синаптической передачи. Интермиттирующая TBS, напротив, облегчает нейротрансмиссию и индуцирует возбуждающие эффекты [36]. Оба режима (постоянный и интермиттирующий) находят свое применение в клинических исследованиях [39–43]. При использовании промежуточной TBS достигается баланс между эффектами торможения и облегчения синаптической передачи и отмечается отсутствие влияния на возбудимость коры головного мозга [36]. Поэтому данный режим в настоящее время не применяется в двигательной постинсультной реабилитации.
В целом данных об эффективности TBS в двигательной постинсультной реабилитации недостаточно. Проведенные к настоящему времени немногочисленные исследования демонстрируют положительное влияние TBS на нейропластичность в остром и раннем восстановительном периодах мозгового инсульта [39, 40, 42, 43].
Транскраниальная электрическая стимуляция постоянным током
Транскраниальная электрическая стимуляция — еще один распространенный метод неинвазивной стимуляции мозга, применяющийся с целью коррекции межполушарной асимметрии и повышения эффективности реабилитации пациентов с двигательными нарушениями после инсульта. Приводятся данные о возможности ее использования в трех основных режимах: постоянным током (tDCS), переменным током (transcranial alternating current stimulation, tACS) и током переменной частоты (transcratial random noise stimulation, tRNS) [44, 45]. Наибольшее распространение в постинсультной реабилитации получила tDCS. Два других режима (tACS и tRNS) к настоящему времени изучены недостаточно и не используются в клинической практике.
При tDCS происходит подача слабого постоянного тока (1,0–2,5 мА) в ткани мозга при помощи двух электродов [46]. В настоящее время используется два основных режима tDCS: анодный и катодный. Анодная стимуляция вызывает деполяризацию мембран нейронов и, следовательно, повышение возбудимости коры головного мозга, в то время как под воздействием катодной tDCS создается гиперполяризация и противоположный эффект [44, 46]. Факт наличия сдвигов мембранного потенциала покоя под воздействием анодного и катодного режимов tDCS был подтвержден в исследовании M.A. Nitsche и соавт. [47] с применением блокаторов натриевых и кальциевых каналов.
В последних публикациях приводятся данные о применении трех возможных протоколов tDCS в двигательной постинсультной реабилитации: анодной стимуляции М1 ипсилатерального полушария [48, 49] катодной стимуляции М1 контралатерального полушария [50] и биполушарной стимуляции М1, объединяющей вышеуказанные протоколы [51]. Нейрофизиологические основы предполагаемых механизмов реабилитационного воздействия каждого из перечисленных протоколов tDCS аналогичны таковым для ранее рассмотренных при рТМС.
Необходимо отметить, что в настоящее время работы, изучающие эффективность применения tDCS с целью двигательной нейрореабилитации пациентов в раннем восстановительном периоде мозгового инсульта, относительно малочисленны и не демонстрируют преимуществ данного метода над плацебо-имитацией [50–56] (табл. 2). В то же время в недавно опубликованных метаанализах и систематическом обзоре показано, что лучшие двигательные исходы под воздействием tDCS отмечались у пациентов, реабилитация которых была начата через 6 мес от момента развития инсульта [57–60]. Следовательно, наиболее целесообразным можно считать применение tDCS в позднем восстановительном периоде.
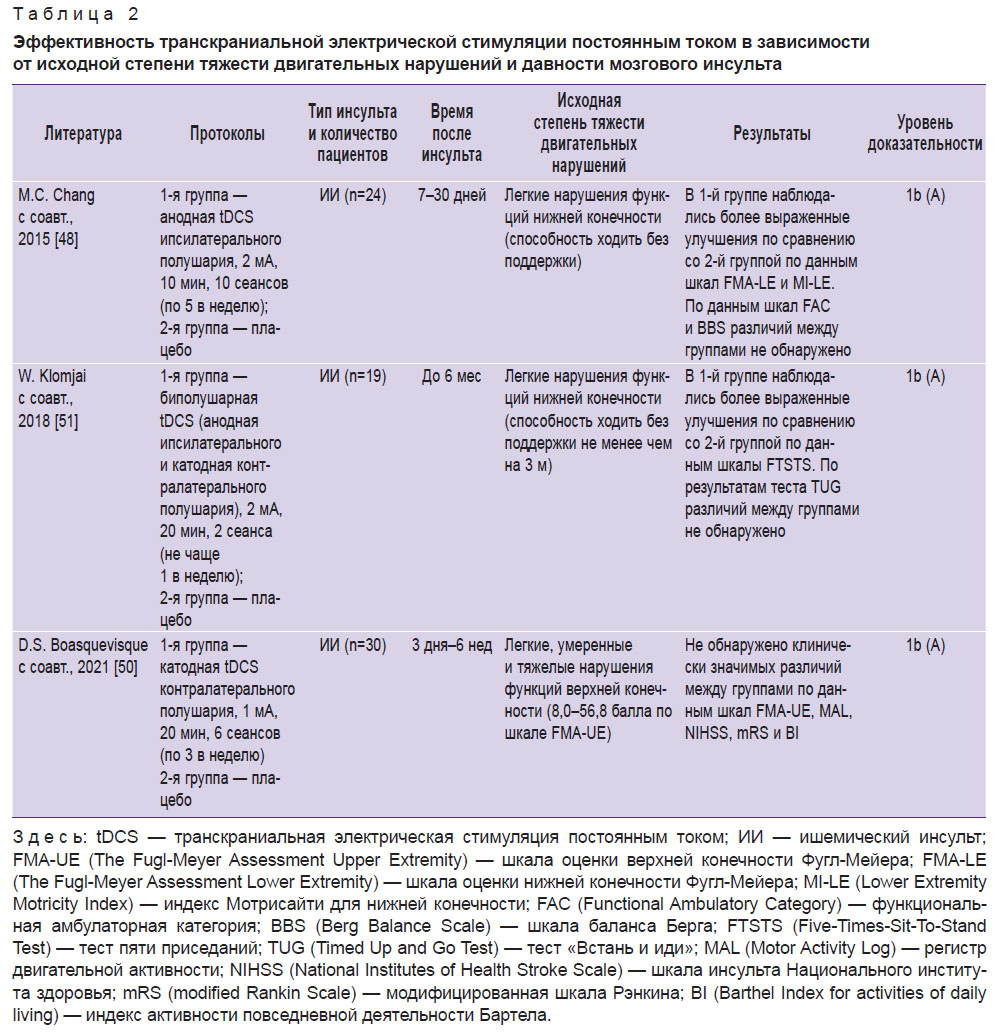
|
Таблица 2. Эффективность транскраниальной электрической стимуляции постоянным током в зависимости от исходной степени тяжести двигательных нарушений и давности мозгового инсульта |
Факторы, влияющие на эффективность двигательной реабилитации при использовании методов неинвазивной стимуляции мозга
В литературе, посвященной двигательной постинсультной реабилитации, приводятся противоречивые данные о наличии или отсутствии положительного эффекта при использовании различных методов неинвазивной стимуляции мозга. Неоднозначность полученных результатов, по-видимому, обусловлена различностью дизайнов исследований. С одной стороны, различия могут быть связаны с использованием неоднородных технических характеристик стимуляции и зависимостью реабилитационного эффекта от функционального состояния нейронов головного мозга, с другой стороны — с критериями, предъявляемыми к включению пациентов в исследования, и индивидуальными особенностями больных.
К техническим характеристикам относят частоту, интенсивность и продолжительность стимуляции [61], ориентацию катушки, а также количество сеансов и кратность их проведения [62].
Кроме технических характеристик определять наличие или отсутствие индукции нейропластичности при проводимой неинвазивной стимуляции может текущее функциональное состояние возбудимости нейронов. Уровень постсинаптической деполяризации во взаимосвязи с временным периодом воздействия и зависимостью ожидаемого реабилитационного эффекта от фазы проводимой неинвазивной стимуляции определяют термином «фазозависимая транскраниальная стимуляция» [63]. Фазозависимая транскраниальная стимуляция предполагает доставку импульсов к тканям мозга в соответствии с определенной фазой сенсомоторного ритма ЭЭГ. Одним из отражений функционального состояния нейронов сенсомоторной коры на ЭЭГ является µ-ритм [64]. Известно, что µ-колебания имеют ассиметричную форму, при этом площадь положительной фазы больше, чем отрицательной, и сопряжена с состоянием низкой возбудимости нейронов [64, 65]. D. Baur и соавт. [65], исследуя электрофизиологические особенности высшей нервной деятельности здоровых людей, показали, что на фоне случайной стимуляции (без учета функционального состояния возбудимости нейронов и фазы проводимой стимуляции) М1 и применения НЧ-рТМС в момент низкой возбудимости нейронов (положительный пик µ-ритма на ЭЭГ) возникали угнетающие нейрофизиологические эффекты. Напротив, при воздействии НЧ-рТМС в момент высокой возбудимости нейронов (отрицательный пик µ-ритма на ЭЭГ) наблюдалась тенденция к формированию эффектов возбуждения М1. Таким образом, авторы делают вывод о том, что при проведении неинвазивной стимуляции мозга для контроля индукции нейропластичности и эффективной нейрореабилитации необходимо учитывать колебательные фазы ритмов мозга и временной период доставки импульсов.
К критериям, предъявляемым к включению пациентов в исследования, и индивидуальным особенностям больных, вероятно, оказывающим влияние на эффективность двигательной постинсультной нейрореабилитации, относят исходную тяжесть нарушения функции, обширность и локализацию церебрального поражения, своевременность проведения неинвазивной стимуляции, наличие или отсутствие регистрируемой межполушарной асимметрии [9, 19, 20, 26, 30, 57, 66].
На сегодняшний день отсутствует единое мнение относительно необходимости и целесообразности применения неинвазивной стимуляции мозга в различных клинических ситуациях, а также оптимального выбора рекомендованных параметров, протоколов и технических характеристик проводимых рТМС и tDCS в зависимости от индивидуальных особенностей пациентов.
Высокотехнологичные методы, основанные на теории «зеркальных нейронов»
В настоящее время основная нейрофизиологическая теория, объясняющая механизм действия систем виртуальной реальности и нейрокомпьютерных интерфейсов, связана с активацией сети зеркальных нейронов. В современной литературе обсуждается три вида зеркальных нейронов: двигательные, коммуникативные и эмоциональные [67–69]. Принято считать, что система «двигательных» зеркальных нейронов включает в себя функциональную группу клеток, обнаруживаемых в различных структурах головного мозга и координирующих выполнение моторных и сенсорных задач [69]. К таким структурам принято относить М1, дополнительную моторную область, дорсальный и вентральный премоторный участки коры, нижнюю лобную извилину, нижние и верхние теменные дольки, внутритеменную борозду, первичную соматосенсорную кору, предклинье [67, 70]. Двигательные зеркальные нейроны демонстрируют свою электрофизиологическую активность как при исполнении или воображении движения, так и при наблюдении за выполняемым действием [28, 69–71]. Предполагается, что методы воздействия, направленные на активацию сети двигательных зеркальных нейронов, могут оказывать положительное влияние на нейропластичность и способствовать лучшему восстановлению моторных функций конечностей у пациентов, перенесших инсульт.
Системы виртуальной реальности
Системы виртуальной реальности (virtual reality, VR) основываются на компьютерных технологиях, симулирующих реальную среду и обеспечивающих пользователю или пациенту ощущение присутствия в ней [72]. Считается, что положительное влияние VR-систем в двигательной постинсультной нейрореабилитации обусловлено активацией сети зеркальных нейронов при наблюдении пациента за движениями виртуального аватара. Кроме того, бóльшая эффективность применения VR-систем по сравнению со стандартной двигательной реабилитацией может быть связана с обеспечением и поддержанием высокого уровня мотивации и вовлеченности пациентов [5, 73].
Факт нейронной реорганизации и нейропластичности на фоне использования VR-систем подтверждается данными фМРТ. Изучалось влияние VR-систем на функциональную активность сенсомоторной коры как для верхних, так и для нижних конечностей. Необходимо отметить, что при использовании VR-технологий для верхней конечности регистрировалось смещение функциональной активации сенсомоторной коры с ипсилатеральной или билатеральной на контралатеральную область [5]. Напротив, применение VR-технологий для нижней конечности способствовало двусторонней активации сенсомоторной коры [74]. В меньшей степени аналогичные функциональные изменения активности сенсомоторной коры наблюдались при использовании стандартной двигательной реабилитации у пациентов, перенесших мозговой инсульт [27, 75, 76].
Важно подчеркнуть, что большая часть исследований, посвященных VR-технологиям в двигательной нейрореабилитации, была проведена на пациентах в позднем восстановительном или резидуальном периодах инсульта [62, 77]. При этом использование VR-систем в раннем восстановительном периоде инсульта демонстрировало сравнительно лучшие результаты [62].
В двигательной постинсультной реабилитации применяют неспецифические (развлекательные видеоигры) и специфические (созданные специально для нейрореабилитации) VR-системы [78–89] (табл. 3).

|

|
Таблица 3. Эффективность неспецифических и специфических систем виртуальной реальности в зависимости от исходной степени тяжести двигательных нарушений и давности мозгового инсульта |
Неспецифические системы виртуальной реальности. К неспецифическим VR-системам, используемым в двигательной постинсультной реабилитации, относятся такие коммерческие игровые системы, как Wii (Nintendo, Япония) [79], Xbox Kinect (Microsoft, США) [80], PlayStation EyeToy (Sony Group Gorporation, Япония) [80]. Сравнение их эффективности со стандартной двигательной реабилитацией или обычными развлекательными играми (игры в карты, бинго и т.д.) не показало значимых различий между этими реабилитационными методиками в динамике восстановления моторных функций и двигательных исходах [81–84] (см. табл. 3). Полученные результаты согласуются с данными метаанализа M. Maier с соавт. [78], опубликованного в 2019 г., где авторы делают вывод о том, что применение неспецифических VR-систем не оказывает значимого влияния на успешность восстановления двигательных функций. Следовательно, их использование целесообразно только вне стен медицинской организации, на дому, с целью увеличения суммарного времени реабилитации и поддержания мотивационной составляющей.
Специфические системы виртуальной реальности. В настоящее время существует большое количество специфических VR-систем, созданных специально для двигательной реабилитации пациентов, перенесших инсульт. Среди них принято выделять неиммерсивные (не обеспечивающие полного погружения пациента в виртуальную среду) и иммерсивные (VR-программы, реализуемые посредством очков виртуальной реальности). В специфических VR-системах используются различные датчики отслеживания и регистрации движений, в свою очередь подразделяющиеся на носимые и неносимые. Носимые датчики фиксируются к телу пациента (например, перчатки или экзоскелет), а неносимые располагаются в помещении для реабилитации [85].
Необходимо подчеркнуть, что в настоящее время существует множество различных специфических VR-систем, однако оценить их эффективность в полном объеме не представляется возможным. Встречаются единичные крупные рандомизированные клинические исследования с высоким уровнем доказательности, в которых различия между специфическими VR-системами и стандартной двигательной реабилитацией не были зарегистрированы [86, 87]. При этом большинство исследований, посвященных изучению клинической эффективности данных систем, продемонстрировало значимое превосходство и лучшие функциональные исходы по сравнению со стандартной двигательной реабилитацией [5, 62, 88–91] (см. табл. 3).
Факторы, влияющие на эффективность двигательной реабилитации при использовании технологии виртуальной реальности. VR-системы, особенно специфические, считаются многообещающей технологией для восстановления моторных функций у пациентов, перенесших инсульт. Противоречивые данные о наличии или отсутствии положительного эффекта при их использовании могут быть обусловлены двумя группами причин. Во-первых, различными характеристиками VR-системы: наличием или отсутствием биологической обратной связи и степенью ее выраженности [62, 89]; наличием или отсутствием мультисенсорной стимуляции (визуальной, слуховой, тактильной) [62]; наличием или отсутствием возрастающей со временем сложности поставленных двигательных задач [80] и др. Во-вторых, к факторам, которые могут оказывать влияние на эффективность VR-систем в двигательной постинсультной реабилитации, можно отнести различия в построении лечебных программ: своевременности их проведения, интенсивности, числе повторений, кратности тренировок в виртуальной реальности и разной степени ориентированности на выполнение конкретной моторной задачи. В частности, M.J. Cano-Mañas и соавт. [80] считают, что VR-программа двигательной реабилитации в раннем восстановительном периоде мозгового инсульта должна включать 3 и более сеанса в неделю в течение как минимум 1 мес, продолжительностью не менее 30 мин за сеанс.
Таким образом, при наличии определенных характеристик специфических VR-систем и грамотном построении лечебных программ с использованием технологий виртуальной реальности, данный современный метод постинсультной двигательной реабилитации способен оказывать значительно большее влияние на восстановление моторных функций пациентов по сравнению со стандартной двигательной реабилитацией.
Нейрокомпьютерные интерфейсы
Нейрокомпьютерный интерфейс (brain–computer interface, BCI, синоним в русской литературе — интерфейс мозг–компьютер) представляет собой систему, позволяющую пользователю управлять внешним устройством (роботом, экзоскелетом, виртуальной реальностью) при изменении состояния возбудимости нейронов и воображении выполняемого движения [92]. Применение BCI основано на методе нейропсихологической практики с двигательными образами. Метод подразумевает моделирование движения (мысленные двигательные тренировки) на основе предшествовавшего опыта, без каких-либо самостоятельных движений в пространстве. Воображение, как и непосредственно само выполнение движения, активизирует сеть двигательных зеркальных нейронов, расположенных в структурах головного мозга и отвечающих за формирование двигательного акта [70, 71], что проявляется изменением сенсомоторных ритмов и может быть зарегистрировано при помощи ЭЭГ [93] или других инвазивных и неинвазивных нейрофизиологических методов [94, 95].
На первом этапе использования BCI при формировании мысленного двигательного образа происходит активация моторных областей головного мозга, что улавливается устройством регистрации нейрокомпьютерного интерфейса. На следующем этапе происходит движение виртуального аватара или запускается воспроизведение воображаемого движения собственной конечностью при помощи экзоскелета или функциональной электростимуляции [94, 96–100]. Таким образом, при использовании BCI пациент получает обратную зрительную и проприоцептивную связь, в результате чего замыкается рефлекторная дуга классического двигательного акта, реализующаяся за счет собственных сохранных эфферентных и афферентных путей [97, 98]. Кроме того, считается, что при использовании BCI восстановление двигательных функций возможно за счет активации альтернативных неповрежденных нейронных сетей [94]. Так, Q. Wu и соавт. [97] изучали функциональную активность головного мозга у пациентов в раннем восстановительном периоде мозгового инсульта до и после проведения нейрореабилитации с использованием нейрокомпьютерного интерфейса. После терапии с помощью фМРТ авторы регистрировали выраженное усиление активности меж- и внутриполушарных взаимодействий между разными областями моторной коры. Кроме того, функциональные изменения обнаруживались в сенсомоторной, зрительно-пространственной, зрительной областях и первичной слуховой коре головного мозга, что, как считают исследователи, может быть связано с техническими особенностями использованных методик.
Необходимо отметить, что в настоящее время отсутствуют крупные клинические исследования с длительным периодом наблюдения, изучавшие эффективность нейрокомпьютерного интерфейса в раннем восстановительном периоде инсульта. Участниками большинства пилотных работ являлись пациенты в позднем восстановительном периоде инсульта [94, 101]. Это связно с тем, что применение BCI в более ранние сроки считается менее безопасным из-за относительной нестабильности состояния и меньшей выносливости постинсультных пациентов [102]. Между тем немногочисленные исследования, посвященные оценке эффективности BCI у пациентов в раннем восстановительном периоде инсульта, демонстрировали некоторое преимущество нейрокомпьютерного интерфейса над стандартной двигательной реабилитацией [93, 97, 103] (табл. 4).

|
Таблица 4. Эффективность нейрокомпьютерных интерфейсов в зависимости от исходной степени тяжести двигательных нарушений и давности мозгового инсульта |
В целом использование BCI в двигательной постинсультной реабилитации имеет многообещающий потенциал.
Заключение
Современные технологии, доступные к применению в двигательной нейрореабилитации, можно разделить на методы, основанные на теории «межполушарной конкуренции» (ритмическая транскраниальная магнитная стимуляция, транскраниальная электрическая стимуляция постоянным током), и методы, основанные на теории «зеркальных нейронов» (системы виртуальной реальности и нейрокомпьютерные интерфейсы). В настоящее время к высокотехнологичным методам, применимым в раннем восстановительном периоде мозгового инсульта и способным повысить эффективность восстановления утраченных моторных функций конечностей, следует отнести большинство протоколов ритмической транскраниальной магнитной стимуляции, использование специфических систем виртуальной реальности и нейрокомпьютерных интерфейсов. В целом вопросы о целесообразности применения различных современных технологий и выборе оптимальных протоколов их использования в реабилитации пациентов с двигательными нарушениями в раннем восстановительном периоде мозгового инсульта изучены недостаточно, что требует проведения дополнительных клинических исследований в данном направлении.
Вклад авторов. А.Е. Хрулев — формулировка темы научной статьи, разработка концепции, критический анализ литературы, написание и редактирование текста статьи; К.М. Курятникова — разработка концепции, сбор материала, критический анализ литературы, написание текста статьи; А.Н. Белова — формулировка темы и редактирование текста научной статьи; П.С. Попова — написание текста статьи; С.Е. Хрулев — формулировка темы и редактирование текста научной статьи.
Информация об источниках финансирования. Публикация выполнена в рамках программы «Приоритет-2030».
Конфликта интересов нет.
Литература
- GBD 2019 Stroke Collaborators. Global, regional, and national burden of stroke and its risk factors, 1990–2019: a systematic analysis for the Global Burden of Disease Study 2019. Lancet Neurol 2021; 20(10): 795–820, https://doi.org/10.1016/s1474-4422(21)00252-0.
- Feigin V.L., Brainin M., Norrving B., Martins S., Sacco R.L., Hacke W., Fisher M., Pandian J., Lindsay P. World Stroke Organization (WSO): Global Stroke Fact Sheet 2022. Int J Stroke 2022; 17(1): 18–29, https://doi.org/10.1177/17474930211065917.
- Katan M., Luft A. Global burden of stroke. Semin Neurol 2018; 38(2): 208–211, https://doi.org/10.1055/s-0038-1649503.
- Hatem S.M., Saussez G., Della Faille M., Prist V., Zhang X., Dispa D., Bleyenheuft Y. Rehabilitation of motor function after stroke: a multiple systematic review focused on techniques to stimulate upper extremity recovery. Front Hum Neurosci 2016; 10: 442, https://doi.org/10.3389/fnhum.2016.00442.
- Wang Z.R., Wang P., Xing L., Mei L.P., Zhao J., Zhang T. Leap motion-based virtual reality training for improving motor functional recovery of upper limbs and neural reorganization in subacute stroke patients. Neural Regen Res 2017; 12(11): 1823–1831, https://doi.org/10.4103/1673-5374.219043.
- Twitchell T.E. The restoration of motor function following hemiplegia in man. Brain 1951; 74(4): 443–480, https://doi.org/10.1093/brain/74.4.443.
- Haghighi F.M., Kordi Yoosefinejad A., Razeghi M., Shariat A., Bagheri Z., Rezaei K. The effect of high-frequency repetitive transcranial magnetic stimulation on functional indices of affected upper limb in patients with subacute stroke. J Biomed Phys Eng 2021; 11(2): 175–184, https://doi.org/10.31661/jbpe.v0i0.879.
- Baniqued P.D.E., Stanyer E.C., Awais M., Alazmani A., Jackson A.E., Mon-Williams M.A., Mushtaq F., Holt R.J. Brain–computer interface robotics for hand rehabilitation after stroke: a systematic review. J Neuroeng Rehabil 2021; 18(1): 15, https://doi.org/10.1186/s12984-021-00820-8.
- van Lieshout E.C.C., van der Worp H.B., Visser-Meily J.M.A., Dijkhuizen R.M. Timing of repetitive transcranial magnetic stimulation onset for upper limb function after stroke: a systematic review and meta-analysis. Front Neurol 2019; 10: 1269, https://doi.org/10.3389/fneur.2019.01269.
- Dobkin B.H. Clinical practice. Rehabilitation after stroke. N Engl J Med 2005; 352(16): 1677–1684, https://doi.org/10.1056/nejmcp043511.
- Grefkes C., Fink G.R. Recovery from stroke: current concepts and future perspectives. Neurol Res Pract 2020; 2: 17, https://doi.org/10.1186/s42466-020-00060-6.
- Ward N.S., Cohen L.G. Mechanisms underlying recovery of motor function after stroke. Arch Neurol 2004; 61(12): 1844–1848, https://doi.org/10.1001/archneur.61.12.1844.
- Murase N., Duque J., Mazzocchio R., Cohen L.G. Influence of interhemispheric interactions on motor function in chronic stroke. Ann Neurol 2004; 55(3): 400–409, https://doi.org/10.1002/ana.10848.
- Du J., Yang F., Hu J., Hu J., Xu Q., Cong N., Zhang Q., Liu L., Mantini D., Zhang Z., Lu G., Liu X. Effects of high- and low-frequency repetitive transcranial magnetic stimulation on motor recovery in early stroke patients: evidence from a randomized controlled trial with clinical, neurophysiological and functional imaging assessments. Neuroimage Clin 2019; 21: 101620, https://doi.org/10.1016/j.nicl.2018.101620.
- Kobayashi M., Pascual-Leone A. Transcranial magnetic stimulation in neurology. Lancet Neurol 2003; 2(3): 145–456, https://doi.org/10.1016/s1474-4422(03)00321-1.
- Adeyemo B.O., Simis M., Macea D.D., Fregni F. Systematic review of parameters of stimulation, clinical trial design characteristics, and motor outcomes in non-invasive brain stimulation in stroke. Front Psychiatry 2012; 3: 88, https://doi.org/10.3389/fpsyt.2012.00088.
- Hummel F.C., Cohen L.G. Non-invasive brain stimulation: a new strategy to improve neurorehabilitation after stroke? Lancet Neurol 2006; 5(8): 708–712, https://doi.org/10.1016/s1474-4422(06)70525-7.
- Volz L.J., Vollmer M., Michely J., Fink G.R., Rothwell J.C., Grefkes C. Time-dependent functional role of the contralesional motor cortex after stroke. Neuroimage Clin 2017; 16: 165–174, https://doi.org/10.1016/j.nicl.2017.07.024.
- Luk K.Y., Ouyang H.X., Pang M.Y.C. Low-frequency rTMS over contralesional M1 increases ipsilesional cortical excitability and motor function with decreased interhemispheric asymmetry in subacute stroke: a randomized controlled study. Neural Plast 2022; 2022: 3815357, https://doi.org/10.1155/2022/3815357.
- Xu J., Branscheidt M., Schambra H., Steiner L., Widmer M., Diedrichsen J., Goldsmith J., Lindquist M., Kitago T., Luft A.R., Krakauer J.W., Celnik P.A.; SMARTS Study Group. Rethinking interhemispheric imbalance as a target for stroke neurorehabilitation. Ann Neurol 2019; 85(4): 502–513, https://doi.org/10.1002/ana.25452.
- Klomjai W., Katz R., Lackmy-Vallée A. Basic principles of transcranial magnetic stimulation (TMS) and repetitive TMS (rTMS). Ann Phys Rehabil Med 2015; 58(4): 208–213, https://doi.org/10.1016/j.rehab.2015.05.005.
- Червяков А.В., Пойдашева А.Г., Коржова Ю.Е., Супонева Н.А., Черникова Л.А., Пирадов М.А. Ритмическая транскраниальная магнитная стимуляция в неврологии и психиатрии. Журнал неврологии и психиатрии им. C.C. Корсакова 2015; 115(12): 7–18, https://doi.org/10.17116/jnevro20151151127-18.
- Lefaucheur J.P., Aleman A., Baeken C., Benninger D.H., Brunelin J., Di Lazzaro V., Filipović S.R., Grefkes C., Hasan A., Hummel F.C., Jääskeläinen S.K., Langguth B., Leocani L., Londero A., Nardone R., Nguyen J.P., Nyffeler T., Oliveira-Maia A.J., Oliviero A., Padberg F., Palm U., Paulus W., Poulet E., Quartarone A., Rachid F., Rektorová I., Rossi S., Sahlsten H., Schecklmann M., Szekely D., Ziemann U. Evidence-based guidelines on the therapeutic use of repetitive transcranial magnetic stimulation (rTMS): an update (2014–2018). Clin Neurophysiol 2020; 131(2): 474–528, https://doi.org/10.1016/j.clinph.2019.11.002.
- Matsuura A., Onoda K., Oguro H., Yamaguchi S. Magnetic stimulation and movement-related cortical activity for acute stroke with hemiparesis. Eur J Neurol 2015; 22(12): 1526–1532, https://doi.org/10.1111/ene.12776.
- Du J., Tian L., Liu W., Hu J., Xu G., Ma M., Fan X., Ye R., Jiang Y., Yin Q., Zhu W., Xiong Y., Yang F., Liu X. Effects of repetitive transcranial magnetic stimulation on motor recovery and motor cortex excitability in patients with stroke: a randomized controlled trial. Eur J Neurol 2016; 23(11): 1666–1672, https://doi.org/10.1111/ene.13105.
- Kim W.S., Kwon B.S., Seo H.G., Park J., Paik N.J. Low-frequency repetitive transcranial magnetic stimulation over contralesional motor cortex for motor recovery in subacute ischemic stroke: a randomized sham-controlled trial. Neurorehabil Neural Repair 2020; 34(9): 856–867, https://doi.org/10.1177/1545968320948610.
- Huang Y.Z., Lin L.F., Chang K.H., Hu C.J., Liou T.H., Lin Y.N. Priming with 1-Hz repetitive transcranial magnetic stimulation over contralesional leg motor cortex does not increase the rate of regaining ambulation within 3 months of stroke: a randomized controlled trial. Am J Phys Med Rehabil 2018; 97(5): 339–345, https://doi.org/10.1097/phm.0000000000000850.
- Kim J., Yim J. Effects of high-frequency repetitive transcranial magnetic stimulation combined with task-oriented mirror therapy training on hand rehabilitation of acute stroke patients. Med Sci Monit 2018; 24: 743–750, https://doi.org/10.12659/msm.905636.
- Guan Y.Z., Li J., Zhang X.W., Wu S., Du H., Cui L.Y., Zhang W.H. Effectiveness of repetitive transcranial magnetic stimulation (rTMS) after acute stroke: a one-year longitudinal randomized trial. CNS Neurosci Ther 2017; 23(12): 940–946, https://doi.org/10.1111/cns.12762.
- Tang Z., Han K., Wang R., Zhang Y., Zhang H. Excitatory repetitive transcranial magnetic stimulation over the ipsilesional hemisphere for upper limb motor function after stroke: a systematic review and meta-analysis. Front Neurol 2022; 13: 918597, https://doi.org/10.3389/fneur.2022.918597.
- Long H., Wang H., Zhao C., Duan Q., Feng F., Hui N., Mao L., Liu H., Mou X., Yuan H. Effects of combining high- and low-frequency repetitive transcranial magnetic stimulation on upper limb hemiparesis in the early phase of stroke. Restor Neurol Neurosci 2018; 36(1): 21–30, https://doi.org/10.3233/rnn-170733.
- Bajaj S., Housley S.N., Wu D., Dhamala M., James G.A., Butler A.J. Dominance of the unaffected hemisphere motor network and its role in the behavior of chronic stroke survivors. Front Hum Neurosci 2016; 10: 650, https://doi.org/10.3389/fnhum.2016.00650.
- McCambridge A.B., Stinear J.W., Byblow W.D. Revisiting interhemispheric imbalance in chronic stroke: a tDCS study. Clin Neurophysiol 2018; 129(1): 42–50, https://doi.org/10.1016/j.clinph.2017.10.016.
- Salehi Dehno N., Kamali F., Shariat A., Jaberzadeh S. Comparison of transcallosal inhibition between hemispheres and its relationship with motor behavior in patients with severe upper extremity impairment after subacute stroke. J Stroke Cerebrovasc Dis 2022; 31(6): 106469, https://doi.org/10.1016/j.jstrokecerebrovasdis.2022.106469.
- Wang Q., Zhang D., Zhao Y.Y., Hai H., Ma Y.W. Effects of high-frequency repetitive transcranial magnetic stimulation over the contralesional motor cortex on motor recovery in severe hemiplegic stroke: a randomized clinical trial. Brain Stimul 2020; 13(4): 979–986, https://doi.org/10.1016/j.brs.2020.03.020.
- Huang Y.Z., Edwards M.J., Rounis E., Bhatia K.P., Rothwell J.C. Theta burst stimulation of the human motor cortex. Neuron 2005; 45(2): 201–206, https://doi.org/10.1016/j.neuron.2004.12.033.
- Goldsworthy M.R., Pitcher J.B., Ridding M.C. The application of spaced theta burst protocols induces long-lasting neuroplastic changes in the human motor cortex. Eur J Neurosci 2012; 35(1): 125–134, https://doi.org/10.1111/j.1460-9568.2011.07924.x.
- Di Lazzaro V., Pilato F., Dileone M., Profice P., Oliviero A., Mazzone P., Insola A., Ranieri F., Meglio M., Tonali P.A., Rothwell J.C. The physiological basis of the effects of intermittent theta burst stimulation of the human motor cortex. J Physiol 2008; 586(16): 3871–3879, https://doi.org/10.1113/jphysiol.2008.152736.
- Nicolo P., Magnin C., Pedrazzini E., Plomp G., Mottaz A., Schnider A., Guggisberg A.G. Comparison of neuroplastic responses to cathodal transcranial direct current stimulation and continuous theta burst stimulation in subacute stroke. Arch Phys Med Rehabil 2018; 99(5): 862–872.e1, https://doi.org/10.1016/j.apmr.2017.10.026.
- Volz L.J., Rehme A.K., Michely J., Nettekoven C., Eickhoff S.B., Fink G.R., Grefkes C. Shaping early reorganization of neural networks promotes motor function after stroke. Cereb Cortex 2016; 26(6): 2882–2894, https://doi.org/10.1093/cercor/bhw034.
- Lin L.F., Chang K.H., Huang Y.Z., Lai C.H., Liou T.H., Lin Y.N. Simultaneous stimulation in bilateral leg motor areas with intermittent theta burst stimulation to improve functional performance after stroke: a feasibility pilot study. Eur J Phys Rehabil Med 2019; 55(2): 162–168, https://doi.org/10.23736/s1973-9087.18.05245-0.
- Meng Y., Zhang D., Hai H., Zhao Y.Y., Ma Y.W. Efficacy of coupling intermittent theta-burst stimulation and 1 Hz repetitive transcranial magnetic stimulation to enhance upper limb motor recovery in subacute stroke patients: a randomized controlled trial. Restor Neurol Neurosci 2020; 38(1): 109–118, https://doi.org/10.3233/rnn-190953.
- Nyffeler T., Vanbellingen T., Kaufmann B.C., Pflugshaupt T., Bauer D., Frey J., Chechlacz M., Bohlhalter S., Müri R.M., Nef T., Cazzoli D. Theta burst stimulation in neglect after stroke: functional outcome and response variability origins. Brain 2019; 142(4): 992–1008, https://doi.org/10.1093/brain/awz029.
- Paulus W. Transcranial electrical stimulation (tES – tDCS; tRNS, tACS) methods. Neuropsychol Rehabil 2011; 21(5): 602–617, https://doi.org/10.1080/09602011.2011.557292.
- Klomjai W., Lackmy-Vallée A., Roche N., Pradat-Diehl P., Marchand-Pauvert V., Katz R. Repetitive transcranial magnetic stimulation and transcranial direct current stimulation in motor rehabilitation after stroke: an update. Ann Phys Rehabil Med 2015; 58(4): 220–224, https://doi.org/10.1016/j.rehab.2015.05.006.
- Nitsche M.A., Paulus W. Excitability changes induced in the human motor cortex by weak transcranial direct current stimulation. J Physiol 2000; 527 Pt 3(Pt 3): 633–639, https://doi.org/10.1111/j.1469-7793.2000.t01-1-00633.x.
- Nitsche M.A., Fricke K., Henschke U., Schlitterlau A., Liebetanz D., Lang N., Henning S., Tergau F., Paulus W. Pharmacological modulation of cortical excitability shifts induced by transcranial direct current stimulation in humans. J Physiol 2003; 553(Pt 1): 293–301, https://doi.org/10.1113/jphysiol.2003.049916.
- Chang M.C., Kim D.Y., Park D.H. Enhancement of cortical excitability and lower limb motor function in patients with stroke by transcranial direct current stimulation. Brain Stimul 2015; 8(3): 561–566, https://doi.org/10.1016/j.brs.2015.01.411.
- Bornheim S., Croisier J.L., Maquet P., Kaux J.F. Transcranial direct current stimulation associated with physical-therapy in acute stroke patients — a randomized, triple blind, sham-controlled study. Brain Stimul 2020; 13(2): 329–336, https://doi.org/10.1016/j.brs.2019.10.019.
- Boasquevisque D.D.S., Servinsckins L., de Paiva J.P.Q., Dos Santos D.G., Soares P., Pires D.S., Meltzer J.A., Plow E.B., de Freitas P.F., Speciali D.S., Lopes P., Peres M.F.P., Silva G.S., Lacerda S., Conforto A.B. Contralesional cathodal transcranial direct current stimulation does not enhance upper limb function in subacute stroke: a pilot randomized clinical trial. Neural Plast 2021; 2021: 8858394, https://doi.org/10.1155/2021/8858394.
- Klomjai W., Aneksan B., Pheungphrarattanatrai A., Chantanachai T., Choowong N., Bunleukhet S., Auvichayapat P., Nilanon Y., Hiengkaew V. Effect of single-session dual-tDCS before physical therapy on lower-limb performance in sub-acute stroke patients: a randomized sham-controlled crossover study. Ann Phys Rehabil Med 2018; 61(5): 286–291, https://doi.org/10.1016/j.rehab.2018.04.005.
- Lefaucheur J.P., Antal A., Ayache S.S., Benninger D.H., Brunelin J., Cogiamanian F., Cotelli M., De Ridder D., Ferrucci R., Langguth B., Marangolo P., Mylius V., Nitsche M.A., Padberg F., Palm U., Poulet E., Priori A., Rossi S., Schecklmann M., Vanneste S., Ziemann U., Garcia-Larrea L., Paulus W. Evidence-based guidelines on the therapeutic use of transcranial direct current stimulation (tDCS). Clin Neurophysiol 2017; 128(1): 56–92, https://doi.org/10.1016/j.clinph.2016.10.087.
- Hesse S., Waldner A., Mehrholz J., Tomelleri C., Pohl M., Werner C. Combined transcranial direct current stimulation and robot-assisted arm training in subacute stroke patients: an exploratory, randomized multicenter trial. Neurorehabil Neural Repair 2011; 25(9): 838–846, https://doi.org/10.1177/1545968311413906.
- Achacheluee S.T., Rahnama L., Karimi N., Abdollahi I., Arslan S.A., Jaberzadeh S. The effect of unihemispheric concurrent dual-site transcranial direct current stimulation of primary motor and dorsolateral prefrontal cortices on motor function in patients with sub-acute stroke. Front Hum Neurosci 2018; 12: 441, https://doi.org/10.3389/fnhum.2018.00441.
- Chen J.L., Schipani A., Schuch C.P., Lam H., Swardfager W., Thiel A., Edwards J.D. Does cathodal vs. sham transcranial direct current stimulation over contralesional motor cortex enhance upper limb motor recovery post-stroke? A systematic review and meta-analysis. Front Neurol 2021; 12: 626021, https://doi.org/10.3389/fneur.2021.626021.
- Elsner B., Kwakkel G., Kugler J., Mehrholz J. Transcranial direct current stimulation (tDCS) for improving capacity in activities and arm function after stroke: a network meta-analysis of randomised controlled trials. J Neuroeng Rehabil 2017; 14(1): 95, https://doi.org/10.1186/s12984-017-0301-7.
- Van Hoornweder S., Vanderzande L., Bloemers E., Verstraelen S., Depestele S., Cuypers K., Dun K.V., Strouwen C., Meesen R. The effects of transcranial direct current stimulation on upper-limb function post-stroke: a meta-analysis of multiple-session studies. Clin Neurophysiol 2021; 132(8): 1897–1918, https://doi.org/10.1016/j.clinph.2021.05.015.
- Chow A.D., Shin J., Wang H., Kellawan J.M., Pereira H.M. Influence of transcranial direct current stimulation dosage and associated therapy on motor recovery post-stroke: a systematic review and meta-analysis. Front Aging Neurosci 2022; 14: 821915, https://doi.org/10.3389/fnagi.2022.821915.
- Wong P.L., Yang Y.R., Tang S.C., Huang S.F., Wang R.Y. Comparing different montages of transcranial direct current stimulation on dual-task walking and cortical activity in chronic stroke: double-blinded randomized controlled trial. BMC Neurol 2022; 22(1): 119, https://doi.org/10.1186/s12883-022-02644-y.
- Navarro-López V., Del Valle-Gratacós M., Fernández-Matías R., Carratalá-Tejada M., Cuesta-Gómez A., Molina-Rueda F. The long-term maintenance of upper limb motor improvements following transcranial direct current stimulation combined with rehabilitation in people with stroke: a systematic review of randomized sham-controlled trials. Sensors (Basel) 2021; 21(15): 5216, https://doi.org/10.3390/s21155216.
- Fitzgerald P.B., Brown T.L., Daskalakis Z.J., Chen R., Kulkarni J. Intensity-dependent effects of 1 Hz rTMS on human corticospinal excitability. Clin Neurophysiol 2002; 113(7): 1136–1141, https://doi.org/10.1016/s1388-2457(02)00145-1.
- Miclaus R., Roman N., Caloian S., Mitoiu B., Suciu O., Onofrei R.R., Pavel E., Neculau A. Non-immersive virtual reality for post-stroke upper extremity rehabilitation: a small cohort randomized trial. Brain Sci 2020; 10(9): 655, https://doi.org/10.3390/brainsci10090655.
- Zrenner C., Desideri D., Belardinelli P., Ziemann U. Real-time EEG-defined excitability states determine efficacy of TMS-induced plasticity in human motor cortex. Brain Stimul 2018; 11(2): 374–389, https://doi.org/10.1016/j.brs.2017.11.016.
- Pineda J.A. The functional significance of mu rhythms: translating “seeing” and “hearing” into “doing”. Brain Res Rev 2005; 50(1): 57–68, https://doi.org/10.1016/j.brainresrev.2005.04.005.
- Baur D., Galevska D., Hussain S., Cohen L.G., Ziemann U., Zrenner C. Induction of LTD-like corticospinal plasticity by low-frequency rTMS depends on pre-stimulus phase of sensorimotor μ-rhythm. Brain Stimul 2020; 13(6): 1580–1587, https://doi.org/10.1016/j.brs.2020.09.005.
- Lee J., Lee A., Kim H., Shin M., Yun S.M., Jung Y., Chang W.H., Kim Y.H. Different brain connectivity between responders and nonresponders to dual-mode noninvasive brain stimulation over bilateral primary motor cortices in stroke patients. Neural Plast 2019; 2019: 3826495, https://doi.org/10.1155/2019/3826495.
- Pineda J.A. Sensorimotor cortex as a critical component of an 'extended' mirror neuron system: does it solve the development, correspondence, and control problems in mirroring? Behav Brain Funct 2008; 4: 47, https://doi.org/10.1186/1744-9081-4-47.
- Marshall P.J., Meltzoff A.N. Neural mirroring systems: exploring the EEG μ rhythm in human infancy. Dev Cogn Neurosci 2011; 1(2): 110–123, https://doi.org/10.1016/j.dcn.2010.09.001.
- Filimon F., Rieth C.A., Sereno M.I., Cottrell G.W. Observed, executed, and imagined action representations can be decoded from ventral and dorsal areas. Cereb Cortex 2015; 25(9): 3144–3158, https://doi.org/10.1093/cercor/bhu110.
- Bajaj S., Butler A.J., Drake D., Dhamala M. Brain effective connectivity during motor-imagery and execution following stroke and rehabilitation. Neuroimage Clin 2015; 8: 572–582, https://doi.org/10.1016/j.nicl.2015.06.006.
- Hardwick R.M., Caspers S., Eickhoff S.B., Swinnen S.P. Neural correlates of action: comparing meta-analyses of imagery, observation, and execution. Neurosci Biobehav Rev 2018; 94: 31–44, https://doi.org/10.1016/j.neubiorev.2018.08.003.
- Levin M.F., Weiss P.L., Keshner E.A. Emergence of virtual reality as a tool for upper limb rehabilitation: incorporation of motor control and motor learning principles. Phys Ther 2015; 95(3): 415–425, https://doi.org/10.2522/ptj.20130579.
- Mekbib D.B., Zhao Z., Wang J., Xu B., Zhang L., Cheng R., Fang S., Shao Y., Yang W., Han J., Jiang H., Zhu J., Ye X., Zhang J., Xu D. Proactive motor functional recovery following immersive virtual reality-based limb mirroring therapy in patients with subacute stroke. Neurotherapeutics 2020; 17(4): 1919–1930, https://doi.org/10.1007/s13311-020-00882-x.
- Xiao X., Lin Q., Lo W.L., Mao Y.R., Shi X.C., Cates R.S., Zhou S.F., Huang D.F., Li L. Cerebral reorganization in subacute stroke survivors after virtual reality-based training: a preliminary study. Behav Neurol 2017; 2017: 6261479, https://doi.org/10.1155/2017/6261479.
- James G.A., Lu Z.L., VanMeter J.W., Sathian K., Hu X.P., Butler A.J. Changes in resting state effective connectivity in the motor network following rehabilitation of upper extremity poststroke paresis. Top Stroke Rehabil 2009; 16(4): 270–281, https://doi.org/10.1310/tsr1604-270.
- Enzinger C., Dawes H., Johansen-Berg H., Wade D., Bogdanovic M., Collett J., Guy C., Kischka U., Ropele S., Fazekas F., Matthews P.M. Brain activity changes associated with treadmill training after stroke. Stroke 2009; 40(7): 2460–2467, https://doi.org/10.1161/strokeaha.109.550053.
- Ögün M.N., Kurul R., Yaşar M.F., Turkoglu S.A., Avci Ş., Yildiz N. Effect of leap motion-based 3D immersive virtual reality usage on upper extremity function in ischemic stroke patients. Arq Neuropsiquiatr 2019; 77(10): 681–688, https://doi.org/10.1590/0004-282x20190129.
- Maier M., Rubio Ballester B., Duff A., Duarte Oller E., Verschure P.F.M.J. Effect of specific over nonspecific VR-based rehabilitation on poststroke motor recovery: a systematic meta-analysis. Neurorehabil Neural Repair 2019; 33(2): 112–129, https://doi.org/10.1177/1545968318820169.
- Türkbey T.A., Kutlay S., Gök H. Clinical feasibility of Xbox KinectTM training for stroke rehabilitation: a single-blind randomized controlled pilot study. J Rehabil Med 2017; 49(1): 22–29, https://doi.org/10.2340/16501977-2183.
- Cano-Mañas M.J., Collado-Vázquez S., Rodríguez Hernández J., Muñoz Villena A.J., Cano-de-la-Cuerda R. Effects of video-game based therapy on balance, postural control, functionality, and quality of life of patients with subacute stroke: a randomized controlled trial. J Healthc Eng 2020; 2020: 5480315, https://doi.org/10.1155/2020/5480315.
- Saposnik G., Cohen L.G., Mamdani M., Pooyania S., Ploughman M., Cheung D., Shaw J., Hall J., Nord P., Dukelow S., Nilanont Y., De Los Rios F., Olmos L., Levin M., Teasell R., Cohen A., Thorpe K., Laupacis A., Bayley M.; Stroke Outcomes Research Canada. Efficacy and safety of non-immersive virtual reality exercising in stroke rehabilitation (EVREST): a randomised, multicentre, single-blind, controlled trial. Lancet Neurol 2016; 15(10): 1019–1027, https://doi.org/10.1016/s1474-4422(16)30121-1.
- Choi J.H., Han E.Y., Kim B.R., Kim S.M., Im S.H., Lee S.Y., Hyun C.W. Effectiveness of commercial gaming-based virtual reality movement therapy on functional recovery of upper extremity in subacute stroke patients. Ann Rehabil Med 2014; 38(4): 485–93, https://doi.org/10.5535/arm.2014.38.4.485.
- Cannell J., Jovic E., Rathjen A., Lane K., Tyson A.M., Callisaya M.L., Smith S.T., Ahuja K.D., Bird M.L. The efficacy of interactive, motion capture-based rehabilitation on functional outcomes in an inpatient stroke population: a randomized controlled trial. Clin Rehabil 2018; 32(2): 191–200, https://doi.org/10.1177/0269215517720790.
- Kim W.S., Cho S., Park S.H., Lee J.Y., Kwon S., Paik N.J. A low cost Kinect-based virtual rehabilitation system for inpatient rehabilitation of the upper limb in patients with subacute stroke: a randomized, double-blind, sham-controlled pilot trial. Medicine (Baltimore) 2018; 97(25): e11173, https://doi.org/10.1097/md.0000000000011173.
- Kim W.S., Cho S., Ku J., Kim Y., Lee K., Hwang H.J., Paik N.J. Clinical application of virtual reality for upper limb motor rehabilitation in stroke: review of technologies and clinical evidence. J Clin Med 2020; 9(10): 3369, https://doi.org/10.3390/jcm9103369.
- Brunner I., Skouen J.S., Hofstad H., Aßmus J., Becker F., Sanders A.M., Pallesen H., Qvist Kristensen L., Michielsen M., Thijs L., Verheyden G. Virtual reality training for upper extremity in subacute stroke (VIRTUES): a multicenter RCT. Neurology 2017; 89(24): 2413–2421, https://doi.org/10.1212/wnl.0000000000004744.
- de Rooij I.J.M., van de Port I.G.L., Punt M., Abbink-van Moorsel P.J.M., Kortsmit M., van Eijk R.P.A., Visser-Meily J.M.A., Meijer J.G. Effect of virtual reality gait training on participation in survivors of subacute stroke: a randomized controlled trial. Phys Ther 2021; 101(5): pzab051, https://doi.org/10.1093/ptj/pzab051.
- Xie H., Zhang H., Liang H., Fan H., Zhou J., Lo W.L.A., Li L. A novel glasses-free virtual reality rehabilitation system on improving upper limb motor function among patients with stroke: a feasibility pilot study. Med Nov Technol Devices 2021; 11: 100069, https://doi.org/10.1016/j.medntd.2021.100069.
- Kiper P., Szczudlik A., Agostini M., Opara J., Nowobilski R., Ventura L., Tonin P., Turolla A. Virtual reality for upper limb rehabilitation in subacute and chronic stroke: a randomized controlled trial. Arch Phys Med Rehabil 2018; 99(5): 834–842.e4, https://doi.org/10.1016/j.apmr.2018.01.023.
- Rogers J.M., Duckworth J., Middleton S., Steenbergen B., Wilson P.H. Elements virtual rehabilitation improves motor, cognitive, and functional outcomes in adult stroke: evidence from a randomized controlled pilot study. J Neuroeng Rehabil 2019; 16(1): 56, https://doi.org/10.1186/s12984-019-0531-y.
- Rodríguez-Hernández M., Criado-Álvarez J.J., Corregidor-Sánchez A.I., Martín-Conty J.L., Mohedano-Moriano A., Polonio-López B. Effects of virtual reality-based therapy on quality of life of patients with subacute stroke: a three-month follow-up randomized controlled trial. Int J Environ Res Public Health 2021; 18(6): 2810, https://doi.org/10.3390/ijerph18062810.
- Graimann B., Allison B., Pfurtscheller G. Brain–computer interfaces: a gentle introduction. The Frontiers Collection. Springer-Verlag Berlin Heidelberg; 2010; p. 1–27, https://doi.org/10.1007/978-3-642-02091-9_1.
- Frolov A.A., Mokienko O., Lyukmanov R., Biryukova E., Kotov S., Turbina L., Nadareyshvily G., Bushkova Y. Post-stroke rehabilitation training with a motor-imagery-based brain-computer interface (BCI)-controlled hand exoskeleton: a randomized controlled multicenter trial. Front Neurosci 2017; 11: 400, https://doi.org/10.3389/fnins.2017.00400.
- Su F., Xu W. Enhancing brain plasticity to promote stroke recovery. Front Neurol 2020; 11: 554089, https://doi.org/10.3389/fneur.2020.554089.
- Liang W.D., Xu Y., Schmidt J., Zhang L.X., Ruddy K.L. Upregulating excitability of corticospinal pathways in stroke patients using TMS neurofeedback; a pilot study. Neuroimage Clin 2020; 28: 102465, https://doi.org/10.1016/j.nicl.2020.102465.
- Sebastián-Romagosa M., Cho W., Ortner R., Murovec N., Von Oertzen T., Kamada K., Allison B.Z., Guger C. Brain computer interface treatment for motor rehabilitation of upper extremity of stroke patients — a feasibility study. Front Neurosci 2020; 14: 591435, https://doi.org/10.3389/fnins.2020.591435.
- Wu Q., Yue Z., Ge Y., Ma D., Yin H., Zhao H., Liu G., Wang J., Dou W., Pan Y. Brain functional networks study of subacute stroke patients with upper limb dysfunction after comprehensive rehabilitation including BCI training. Front Neurol 2020; 10: 1419, https://doi.org/10.3389/fneur.2019.01419.
- Biasiucci A., Leeb R., Iturrate I., Perdikis S., Al-Khodairy A., Corbet T., Schnider A., Schmidlin T., Zhang H., Bassolino M., Viceic D., Vuadens P., Guggisberg A.G., Millán J.D.R. Brain-actuated functional electrical stimulation elicits lasting arm motor recovery after stroke. Nat Commun 2018; 9(1): 2421, https://doi.org/10.1038/s41467-018-04673-z.
- Bhagat N.A., Yozbatiran N., Sullivan J.L., Paranjape R., Losey C., Hernandez Z., Keser Z., Grossman R., Francisco G.E., O'Malley M.K., Contreras-Vidal J.L. Neural activity modulations and motor recovery following brain-exoskeleton interface mediated stroke rehabilitation. Neuroimage Clin 2020; 28: 102502, https://doi.org/10.1016/j.nicl.2020.102502.
- Kumari R., Janković M.M., Costa A., Savić A.M., Konstantinović L., Djordjević O., Vucković A. Short term priming effect of brain-actuated muscle stimulation using bimanual movements in stroke. Clin Neurophysiol 2022; 138: 108–121, https://doi.org/10.1016/j.clinph.2022.03.002.
- Ramos-Murguialday A., Curado M.R., Broetz D., Yilmaz Ö., Brasil F.L., Liberati G., Garcia-Cossio E., Cho W., Caria A., Cohen L.G., Birbaumer N. Brain–machine interface in chronic stroke: randomized trial long-term follow-up. Neurorehabil Neural Repair 2019; 33(3): 188–198, https://doi.org/10.1177/1545968319827573.
- Hashimoto Y., Kakui T., Ushiba J., Liu M., Kamada K., Ota T. Portable rehabilitation system with brain-computer interface for inpatients with acute and subacute stroke: a feasibility study. Assist Technol 2022; 34(4): 402–410, https://doi.org/10.1080/10400435.2020.1836067.
- Zhao C.G., Ju F., Sun W., Jiang S., Xi X., Wang H., Sun X.L., Li M., Xie J., Zhang K., Xu G.H., Zhang S.C., Mou X., Yuan H. Effects of training with a brain-computer interface-controlled robot on rehabilitation outcome in patients with subacute stroke: a randomized controlled trial. Neurol Ther 2022; 11(2): 679–695, https://doi.org/10.1007/s40120-022-00333-z.













