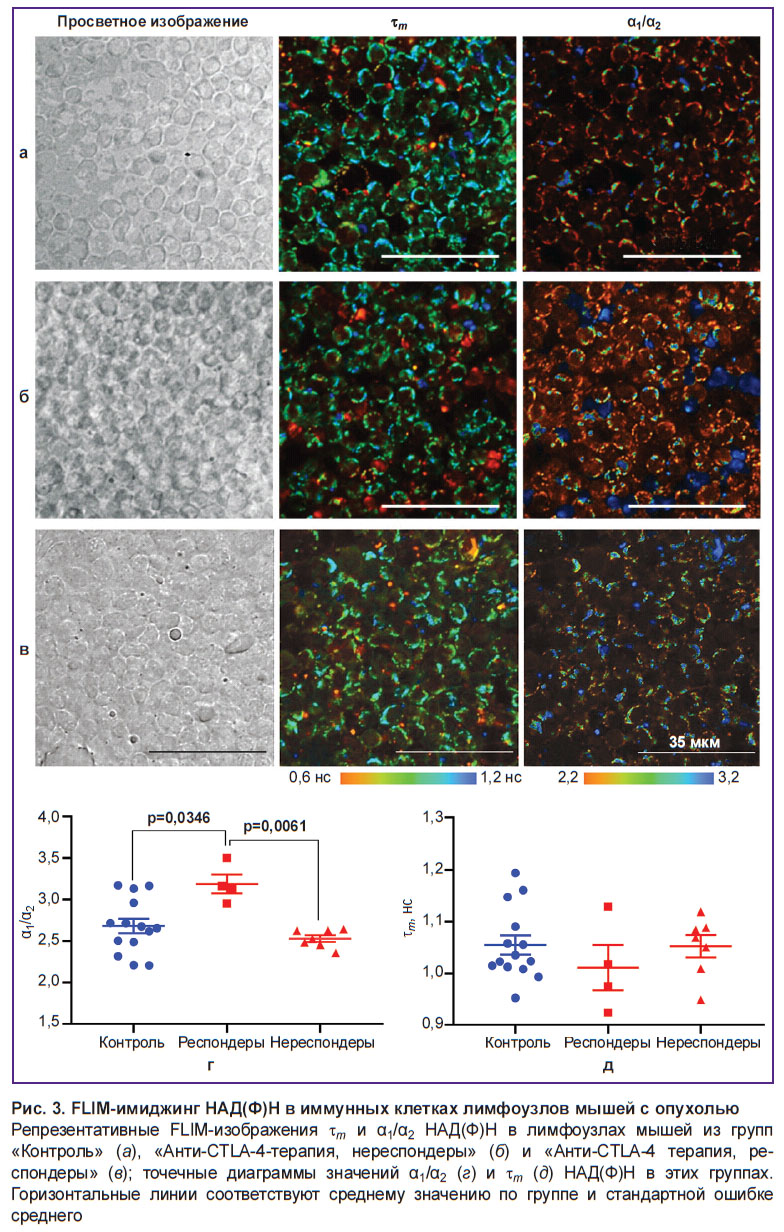
FLIM-имиджинг автофлуоресценции НАД(Ф)Н Т-клеток в лимфатических узлах для оценки эффективности анти-CTLA-4-иммунотерапии
Основными проблемами иммунотерапии опухолей являются отсутствие надежных биомаркеров, позволяющих заранее определять индивидуальную восприимчивость пациентов к лечению, а также недостаточные знания о механизмах резистентности.
Биомаркеры на основе автофлуоресценции метаболических коферментов в иммунных клетках могут стать новым мощным предиктором раннего ответа опухоли на лечение, а оптический метод FLIM — инструментом прогнозирования эффективности иммунотерапии, позволяющим сохранять пространственную структуру образца и получать данные о метаболическом статусе иммунных клеток в режиме реального времени.
Цель работы — исследование методом метаболического имиджинга автофлуоресценции метаболического кофермента НАД(Ф)Н в иммунных клетках свежевыделенных лимфатических узлов как потенциального маркера для оценки раннего ответа на иммунотерапию.
Материалы и методы. Исследование проводили на мышах линии C57Bl/6 FoxP3-EGFP с меланомой B16F0, привитой вблизи пахового лимфоузла. Мышам вводили антитела к CTLA-4 (Bio X Cell, США) по 250 мкг на мышь, внутрибрюшинно на 7-, 8-, 11- и 12-й дни роста опухоли. FLIM-изображения в канале кофермента никотинамидадениндинуклеотида (фосфата) — НАД(Ф)Н (возбуждение — 375 нм, регистрация — 435–485 нм) получали с помощью флуоресцентного конфокального лазерного сканирующего микроскопа LSM 880 (Carl Zeiss, Германия), оснащенного модулем FLIM Simple-Tau 152 TCSPC (Becker & Hickl GmbH, Германия). Проточную цитометрию проводили с использованием клеточного сортера BD FACSAria III (BD Biosciences, США).
Результаты. Иммунотерапия чекпоинт-ингибиторами приводила к выраженным метаболическим перестройкам в Т-клетках свежевыделенных лимфоузлов у мышей-респондеров с торможением роста опухоли. Данные FLIM-изображений НАД(Ф)Н свидетельствовали об увеличении свободной фракции НАДН α1, вклада формы, связанной с гликолизом, для обеспечения высоких потребностей активированных Т-клеток и синтеза провоспалительных цитокинов. Напротив, у мышей-нереспондеров с прогрессирующей опухолью наблюдались низкие значения отношения свободной фракции к связанной α1/α2, что может быть связано с механизмами резистентности к терапии.
Ответ на иммунотерапию был верифицирован данными по экспрессии активационных и пролиферативных маркеров, полученными с помощью проточной цитометрии. Мы наблюдали увеличение продукции провоспалительного цитокина IFN-ã в эффекторных Т-клетках у мышей-респондеров по сравнению с контролем (без лечения) и нереспондерами. Кроме того, зарегистрировано повышение экспрессии поверхностных активационных маркеров CD25 и CD69 по сравнению с контролем.
Заключение. Использование FLIM-метода позволило продемонстрировать, что автофлуоресценция кофермента НАД(Ф)Н чувствительна к ответу на чекпоинт-иммунотерапию и может быть использована в качестве надежного маркера эффективности ответа на лечение.
Введение
Терапия ингибиторами контрольных точек иммунитета (чекпоинтов) является одним из самых быстро развивающихся направлений современной онкоиммунологии и обладает высокой эффективностью у ряда пациентов при меланоме, немелкоклеточном раке легкого, раке мочевого пузыря, раке молочной железы и других формах злокачественных новообразований. В настоящее время одобрены препараты к двум чекпоинтам: CTLA-4 и PD-1 [1]. Но, несмотря на беспрецедентный успех применения данной терапии в клинике, существенная доля пациентов, получающих препараты этой группы, не демонстрируют ответа на лечение, что связано с индивидуальными особенностями иммунитета пациентов и характером взаимодействия опухоли с иммунной системой [2, 3].
Во всем мире ведется поиск предиктивных маркеров иммунотерапии чекпоинт-ингибиторами. За последнее десятилетие предложено множество биомаркеров, которые должны прогнозировать эффект иммунотерапии.
Рутинно используемыми при отборе больных для прохождения лечения предикторами являются комбинация данных исследования субпопуляционного состава опухоль-инфильтрирующих лимфоцитов и лимфоцитов периферической крови в сочетании с уровнем экспрессии чекпоинтов CTLA-4 и PD-1/PD-L1. Более сложные и дорогостоящие методы включают высокопроизводительное секвенирование, основанное на анализе транскриптома выделенных лимфоцитов у пациента с последующим определением их клонального состава, на оценке внутриопухолевой мутационной нагрузки и на определении аллельной композиции главного комплекса гистосовместимости [4–6].
Однако данные методы не всегда способны точно предсказывать эффективность терапии непосредственно перед лечением, крайне трудоемкие, требуют дорогостоящего оборудования и реактивов и дают отсроченные результаты, в связи с чем доля пациентов со значимым ответом на иммунотерапию для наиболее распространенных типов рака на сегодняшний день не превышает 30%. В связи с этим вопрос о надежных биомаркерах остается актуальным.
Одной из наиболее вероятных причин резистентности к иммунотерапии чекпоинт-ингибиторами является влияние опухолевого микроокружения на метаболический профиль Т-лимфоцитов. В частности, опухолевое окружение может мешать реализации метаболической программы эффекторных Т-клеток, конкурируя с ними за глюкозу, и, напротив, привлекать регуляторные и истощенные Т-лимфоциты избытком лактата и жирных кислот [7–9]. Известно, что изменения в метаболических процессах предшествуют развитию всех последующих событий в иммунных клетках (изменению экспрессионного профиля, пролиферации и т.д.), поэтому метаболический статус иммунных клеток потенциально может служить надежным предиктивным биомаркером, чувствительным к ранним иммунологическим перестройкам [1].
Инновационным подходом в области исследования клеточного метаболизма служит флуоресцентный времяразрешенный имиджинг (FLIM), который является высокочувствительным и безопасным методом регистрации автофлуоресценции метаболических кофакторов в живых клетках. FLIM позволяет быстро получать результаты оценки метаболизма и работать в режиме реального времени, не требует дополнительных окрасок и вмешательства в физиологические процессы [10, 11].
Мишенью для метаболического FLIM-имиджинга служат два кофермента: восстановленный никотинамидадениндинуклеотид (фосфат) (НАД(Ф)Н) и окисленный флавинадениндинуклеотид (ФАД), которые участвуют в качестве переносчиков электронов во многих биохимических реакциях. Анализ метаболического статуса по времени жизни флуоресценции коферментов основан на том, что время жизни их флуоресценции существенно зависит от микроокружения, взаимодействия с белками и их конформации [12, 13].
Визуализация автофлуоресценции широко используется для исследований метаболизма рака и других заболеваний [14, 15]. Однако ее применение для исследования функционального состояния иммунных клеток стало развиваться совсем недавно. Пока известно лишь несколько работ по оптической метаболической визуализации иммунных клеток. В 2020–2022 гг. были опубликованы результаты исследований по метаболическому FLIM-имиджингу макрофагов [16–18] и Т-лимфоцитов [19, 20]. Продемонстрирована способность метаболического имиджинга различать покоящиеся и активированные Т-клетки in vitro, а также различные субпопуляции клеток врожденного и адаптивного иммунитета [19, 20]. Однако в данных исследованиях субпопуляции Т-клеток были извлечены у здоровых доноров и культивированы in vitro, а различные состояния активации моделировались искусственно путем добавления неантигенных стимулов. Работы по метаболическому имиджингу Т-клеток доноров с онкологией до недавнего времени отсутствовали.
В 2022 г. нами впервые был разработан протокол по метаболической визуализации Т-клеток в свежей лимфоидной ткани, т.е. в условиях, приближенных к естественным [21]. На модели мышиной меланомы впервые продемонстрировано, что параметры автофлуоресценции НАД(Ф)Н в лимфоцитах чувствительны к развитию опухоли и могут выступать в роли надежного биомаркера для оценки иммунного ответа на опухоль.
Цель настоящей работы — валидация метода метаболического FLIM-имиджинга для решения задачи прогнозирования эффективности иммунотерапии на свежевыделенных лимфоцитах.
Известно, что меланома является одной из основных мишеней для иммунотерапии чекпоинт-ингибиторами благодаря высокой мутационной нагрузке, которая способствует ее высокой иммуногенности [1, 22], поэтому исследование проведено на мышах C57Bl/6 FoxP3-EGFP с меланомой B16F0. Эксперименты выполняли на свежевыделенных лимфоузлах на 13–14-е сутки после имплантации опухоли. Поскольку метаболические изменения являются самыми ранними событиями в иммунных клетках в ответ на лечение, лимфоузлы забирали через 1–2 дня после последней инъекции терапевтического антитела. Данный ранний срок был выбран на основе наших предыдущих исследований [23–25]. Активацию и пролиферацию эффекторных Т-клеток подтверждали с помощью проточной цитометрии.
Материалы и методы
Культивирование клеток. Опухолевые клетки мышиной меланомы B16F0 культивировали по стандартной методике на питательной среде RPMI (Roswell park memorial institute medium) (Gibco, США) с добавлением 0,06% L-глутамина, 10% фетальной телячей сыворотки (Gibco, США), 50 ед./мл пенициллина и 50 мкг/мл стрептомицина сульфата («ПанЭко», Россия) в культуральных флаконах (25 см3) (Corning, США) в инкубаторе в атмосфере 5% СО2 при температуре 37°С и 85% влажности. Снятие клеток осуществляли при помощи 25% раствора трипсин–ЭДТА («ПанЭко», Россия) в течение 5 мин.
Опухолевая модель. В качестве объекта исследования выступали мыши особой трансгенной линии FoxP3-EGFP на основе линии C57BL/6, у которых химерный фактор FoxP3, связанный с зеленым флуоресцентным белком EGFP, экспрессирован в регуляторных Т-лимфоцитах для их специфического мечения.
Эксперименты проводили на 43 трансгенных мышах C57BL/6-FoxP3-EGFP (любезно предоставлены Александром Руденским, Sloan Kettering Institute, Нью-Йорк, США). У этих мышей выполняли нокаут химерной конструкции EGFP, субклонированной в первый экзон гена FoxP3 [26], для идентификации регуляторных FoxP3+CD4+T-клеток.
Для получения опухолевой модели мышам (самкам в возрасте 2–4 мес) проводили инъекцию суспензии опухолевых клеток в дозе 100 000 клеток в 150 мкл фосфатно-солевого буфера (PBS). Инъекцию выполняли подкожно в положении животного на боку, ближе к большому и легко находимому паховому лимфоузлу.
На время всех оперативных процедур мыши были анестезированы внутримышечно с помощью смеси Золетила — 40 мг/кг, 50 мкл (Virbac France S.A., Франция) и 2% Ксилазина — 10 мкл, 10 мг/кг («Интерхеми веркер Де Аделаар Ести АС», Эстония). Все исследования на животных одобрены локальным этическим комитетом Приволжского исследовательского медицинского университета (протокол №12 от 5 августа 2022 г.).
Анти-CTLA-4-иммунотерапия. Мышам вводили антитела к CTLA-4 (Bio X Cell, США) (250 мкг на мышь, внутрибрюшинно, на 7-, 8-, 11- и 12-й дни роста опухоли). Данную схему лечения выбрали на основе наших предыдущих исследований [21, 23–25].
В качестве контрольной группы выступали мыши с опухолью без лечения. Для определения мышей-респондеров и нереспондеров проводили мониторинг роста опухолевого узла. Размер опухолей определяли с помощью штангенциркуля по двум измерениям для последующего вычисления объема по формуле V=a·b·b/2, где a — длина, b — ширина опухолевого узла.
Измерения проводили каждые 1–2 дня, начиная с 5-го дня после имплантации опухолевых клеток и кончая 13–14-м днем, когда выполняли забор пахового лимфоузла. Для этого мышей подвергали эвтаназии 90% Изофлураном (Laboratories Karizoo, Испания). Лимфоузлы сразу после умерщвления вырезали с помощью микрохирургических ножниц под стереомикроскопом Leica M50 (Leica Microsystems, Германия) и разделяли на два фрагмента: для FLIM-имиджинга и для проточной цитометрии соответственно.
FLIM-имиджинг. С использованием ранее разработанного протокола [21] проведена метаболическая визуализация Т-клеток в свежей лимфоидной ткани. Фрагмент лимфоузла (~1/3 часть толщиной ~1 мм) отрезали микрохирургическими ножницами и помещали срезом вниз на чашку FluoroDish со стеклянным дном (WPI, Китай), чтобы капсула лимфоузла не блокировала флуоресцентный сигнал от иммунных клеток. Фрагмент лимфоузла накрывали салфеткой, смоченной 0,9% физиологическим раствором, чтобы избежать высыхания и смещения образца во время микроскопии. Время от выделения лимфоузла до окончания эксперимента не превышало 20 мин.
Визуализацию проводили с помощью лазерного сканирующего микроскопа LSM 880 (Carl Zeiss, Германия). В качестве источника возбуждения служил фемтосекундный Τi:Sa-лазер (Spectra Physics, США) с частотой следования импульсов 80 МГц и длительностью 120 фс с перестраиваемой длиной волны в диапазоне 690–1040 нм. Детекцию времени жизни флуоресценции осуществляли с помощью FLIM-модуля Simple-Tau 152 ΤCSPC (Becker & Hickl GmbH, Германия), основанного на время-коррелированном счете единичных фотонов. Изображения получены с использованием масляного иммерсионного объектива C Plan-Apochrom at 40х/1.3. NA Oil DIC M27 (Carl Zeiss, Германия). Возбуждение флуоресценции метаболического кофермента НАД(Ф)Н осуществляли в двухфотонном режиме на длине волны 750 нм и принимали в диапазоне 450–490 нм. Мощность возбуждающего излучения составляла 7 мВт. Количество фотонов на пикселе — не менее 5000 при биннинге 3, время накопления сигнала — 60 с.
Однофотонную флуоресценцию EGFP возбуждали на длине волны 488 нм, а эмиссию регистрировали в диапазоне 500–570 нм.
Обработку данных FLIM проводили с помощью программного обеспечения SPCImage software (Becker & Hickl GmbH, Германия). Для определения параметров кривых затухания в каждом пикселе использовали аппроксимацию методом наименьших квадратов.
В случае НАД(Ф)Н короткая компонента времени жизни соответствовала его свободной форме, ассоциированной с гликолизом, а длинная — связанной с белками форме НАД(Ф)Н, ассоциированной с митохондриальной электрон-транспортной цепью и с участием в окислительном фосфорилировании.
Флуоресцентные кривые затухания были аппроксимированы би-экспоненциальной моделью, позволяющей определять короткий и длинный компоненты ( 1 и
1 и  2 соответственно) и относительные амплитуды этих компонент (α1 и α2 соответственно). По этим значениям определяли амплитудно-взвешенное среднее время жизни флуоресценции по формуле
2 соответственно) и относительные амплитуды этих компонент (α1 и α2 соответственно). По этим значениям определяли амплитудно-взвешенное среднее время жизни флуоресценции по формуле  m=α1
m=α1 1+α2
1+α2 2. Точность аппроксимации оценивали посредством параметра
2. Точность аппроксимации оценивали посредством параметра 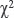 . Для всех данных
. Для всех данных 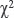 лежал в диапазоне 0,8–1,2.
лежал в диапазоне 0,8–1,2.
Изображение импортировали в программу, выбирали участки с допустимым значением 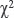 , выделяли область цитоплазмы клетки, исключая ядро. Для каждого лимфоузла получали по 2–3 поля зрения, суммарно 40–60 клеток.
, выделяли область цитоплазмы клетки, исключая ядро. Для каждого лимфоузла получали по 2–3 поля зрения, суммарно 40–60 клеток.
Проточная цитометрия. Для оценки влияния терапии на экспрессию основных активационных и пролиферативных маркеров фрагмент лимфоузла механически дезагрегировали в 100 мкл PBS. Для мечения живых клеток использовали антитела к рецепторам CD3, CD4, CD8, CD25 и CD69 (BD Biosciences, США). Для внутриклеточного окрашивания клетки фиксировали, пермеабилизировали и окрашивали антителами CD3, CD4, CD8 (BD Biosciences, США) и IFN- (Miltenyi Biotec, Германия) в соответствии с рекомендациями производителя набора Inside Stain Kit (Miltenyi Biotec, Германия). Меченые клетки анализировали на клеточном сортере BD FACSAria III (BD Biosciences, США). Собирали по 300 000 клеток с каждого лимфоузла. Данные анализировали с использованием программного обеспечения FlowJo (Tree Star, США).
(Miltenyi Biotec, Германия) в соответствии с рекомендациями производителя набора Inside Stain Kit (Miltenyi Biotec, Германия). Меченые клетки анализировали на клеточном сортере BD FACSAria III (BD Biosciences, США). Собирали по 300 000 клеток с каждого лимфоузла. Данные анализировали с использованием программного обеспечения FlowJo (Tree Star, США).
Статистический анализ. Для сравнительного анализа данных и их графического отображения использовали программное обеспечение GraphPad Prism 8.0.1 (GraphPad Software, США). Для анализа скорости роста опухолей вычисляли усредненный объем опухоли по всем мышам в каждой экспериментальной группе на определенный день. Данные представлены как среднее значение ± стандартная ошибка среднего (M±SEM). Для нахождения статистически значимых различий между исследуемыми группами «Контроль» и «Анти-CTLA-4 терапия» применяли непараметрический критерий Манна–Уитни (при р≤0,05 различия считали статистически значимыми).
Проверку непрерывных переменных на нормальность распределения проводили с использованием критерия Шапиро–Уилка (при р≤0,05 распределение считали нормальным).
Для анализа данных FLIM вычисляли усредненное значение каждого параметра — по 40–60 клеткам (2–3 поля зрения) в лимфоузле каждой мыши. Затем вычисляли усредненное значение по всем мышам в каждой экспериментальной группе. Для нахождения статистически значимых различий между исследуемыми группами «Контроль», «Анти-CTLA-4-терапия, респондеры» и «Анти-CTLA-4-терапия, нереспондеры» применяли непараметрический критерий Манна–Уитни (при р≤0,05 различия считали статистически значимыми).
Для анализа данных проточной цитометрии на клеточном сортере собирали по 300 000 клеток с каждого лимфоузла. Оценивали процент клеток, экспрессирующих определенный маркер, от общего числа клеток в конкретной субпопуляции Т-лимфоцитов. Вычисляли усредненное значение по всем мышам в каждой экспериментальной группе. Для нахождения статистически значимых различий между исследуемыми группами «Контроль», «Анти-CTLA-4-терапия, респондеры» и «Анти-CTLA-4-терапия, нереспондеры» применяли непараметрический критерий Манна–Уитни (при р≤0,05 различия считали статистически значимыми).
Результаты
Мониторинг роста опухолей у мышей. На первом этапе исследования был проведен мониторинг роста опухолей у мышей из групп «Контроль» и «Анти-CTLA-4-терапия» вплоть до дня забора лимфоузлов для FLIM-микроскопии и проточной цитометрии.
Анализ кривых усредненной скорости роста опухолей в группах «Контроль» и «Анти-CTLA-4-терапия» (рис. 1, а) показал, что в целом группа «Анти-CTLA-4-терапия» демонстрировала тенденцию к снижению скорости роста опухолей по сравнению с контрольной группой. Однако статистически значимые различия наблюдались только на 11-й день роста опухоли.
Известно, что меланома характеризуется высокой иммуногенностью, из-за чего наблюдается разброс в значениях скорости роста отдельных опухолей (рис. 1, б). При лечении данный разброс становится более выраженным вследствие гетерогенного ответа на иммунотерапию (рис. 1, в). Так, на день забора лимфоузлов объем опухолевого узла в группе «Анти-CTLA-4-терапия» варьировал от 45 до 470 мм3, тогда как в контрольной группе он варьировал меньше — от 110 до 380 мм3. В группе с лечением можно было выделить как мышей с выраженным торможением роста опухоли, так и со скоростью роста, сравнимой с контрольными опухолями либо выше.
Таким образом, выбранная схема иммунотерапии приводила к результату, схожему по данным клинической статистики с картиной, когда максимальный эффект достигается не более чем у 30% пациентов, и позволяла выделить мышей-респондеров и нереспондеров.
FLIM-имиджинг НАД(Ф)Н. На следующем этапе исследования проводили оценку автофлуоресценции метаболического кофермента НАД(Ф)Н в иммунных клетках лимфоузлов мышей. Установлены значения времен жизни короткой и длинной компонент  1 и
1 и  2, а также их относительных вкладов α1 и α2 и среднего времени жизни
2, а также их относительных вкладов α1 и α2 и среднего времени жизни  m НАД(Ф)Н в Т-клетках, которые были усреднены для каждого лимфоузла.
m НАД(Ф)Н в Т-клетках, которые были усреднены для каждого лимфоузла.
Абсолютные значения времен жизни НАД(Ф)Н, зарегистрированные в иммунных клетках обеих групп, соответствовали типичным значениям, указанным в литературе [10, 27] (см. таблицу). Для групп «Контроль» и «Анти-CTLA-4-терапия» время жизни свободной формы ( 1) составляло 0,48±0,01 и 0,49±0,01 нс, а связанной с белком формы (
1) составляло 0,48±0,01 и 0,49±0,01 нс, а связанной с белком формы ( 2) — 2,58±0,08 и 2,53±0,08 нс соответственно. Значения абсолютных времен жизни между группами статистически значимо не различались.
2) — 2,58±0,08 и 2,53±0,08 нс соответственно. Значения абсолютных времен жизни между группами статистически значимо не различались.
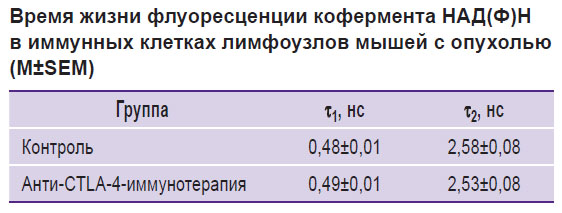 |
Время жизни флуоресценции кофермента НАД(Ф)Н в иммунных клетках лимфоузлов мышей с опухолью (M±SEM) |
Для оценки отношения вкладов α1/α2 и среднего времени жизни  m построены диаграммы распределения их значений в зависимости от объема опухоли на день забора лимфоузла (рис. 2, а).
m построены диаграммы распределения их значений в зависимости от объема опухоли на день забора лимфоузла (рис. 2, а).
Установлено, что параметр α1/α2 демонстрирует корреляцию с объемом опухоли. Обнаружено, что мыши с наименьшим объемом опухоли после анти-CTLA-4-терапии (45–95 мм3, мыши №1, №7 и №9, см. рис. 1, в) показывали самые высокие значения α1/α2 по сравнению с остальными мышами как с лечением, так и без. Кроме того, также высокое значение α1/α2 показывала мышь №2 из группы «Анти-CTLA-4-терапия» (объем опухоли — 191 мм3), у которой, несмотря на изначально большую опухоль, начиная с 11-го дня наблюдалось торможение роста опухоли и уменьшение размеров опухолевого узла.
Напротив, те мыши, которые, несмотря на терапию, имели прогрессирующую большую опухоль объемом 208–470 мм3, демонстрировали низкие значения α1/α2, сравнимые с показателями контрольных мышей без терапии.
На основании полученных данных мы можем выделить в группе «Анти-CTLA-4-терапия» две подгруппы мышей: респондеры (мыши №1, №2, №7 и №9) (красные квадратные точки на рис. 2) и нереспондеры (мыши №3, №4, №5, №6, №8, №10, №11) (красные треугольные точки на рис. 2).
Для  m подобной четкой зависимости не наблюдалось (рис. 2, б). Тем не менее отдельные мыши-респондеры (№1, №9) демонстрировали самые низкие значения
m подобной четкой зависимости не наблюдалось (рис. 2, б). Тем не менее отдельные мыши-респондеры (№1, №9) демонстрировали самые низкие значения  m. У остальных мышей после лечения значения
m. У остальных мышей после лечения значения  m не отличались от контроля.
m не отличались от контроля.
Для статистической обработки были построены точечные диаграммы, иллюстрирующие значения α1/α2 и  m для групп мышей «Контроль», «Анти-CTLA-4-терапия, респондеры» и «Анти-CTLA-4-терапия, нереспондеры» (рис. 3).
m для групп мышей «Контроль», «Анти-CTLA-4-терапия, респондеры» и «Анти-CTLA-4-терапия, нереспондеры» (рис. 3).
Установлено, что усредненное отношение α1/α2 в группе «Анти-CTLA-4-терапия, респондеры» составило 3,18±0,11 и было статистически значимо выше по сравнению со значением 2,68±0,08 в группе «Контроль» (р=0,0346) и со значением 2,52±0,04 в группе «Анти-CTLA-4-терапия, нереспондеры» (р=0,0061) (рис. 3, г).
Значимых различий между группой контрольных мышей и мышей-нереспондеров не наблюдалось.
Параметр  m показывал тенденцию к снижению в группе респондеров за счет роста вклада свободной (короткой) компоненты без статистической значимости (рис. 3, д).
m показывал тенденцию к снижению в группе респондеров за счет роста вклада свободной (короткой) компоненты без статистической значимости (рис. 3, д).
Таким образом, параметр α1/α2 может быть использован в качестве маркера эффективности ответа на иммунотерапию чекпоинт-ингибиторами. Увеличение вклада свободной формы и, соответственно, снижение вклада связанной с белком формы НАД(Ф)Н может быть ассоциировано со сдвигом клеточного метаболизма в сторону гликолиза.
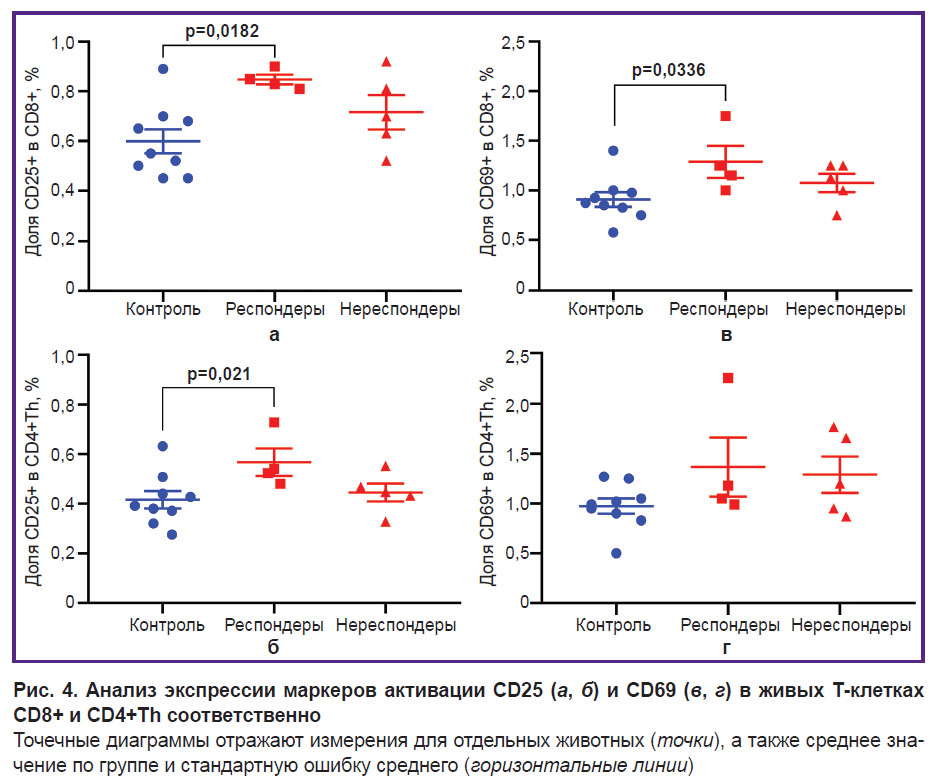
Экспрессия активационных и пролиферативных маркеров эффекторными Т-клетками. Для верификации ответа на иммунотерапию мы оценили активацию эффекторных Т-клеток в двух основных субпопуляциях: цитотоксических CD8+ Т-лимфоцитах и хелперных CD4+ Т-лимфоцитах (CD4+Th), выделенных из лимфоузлов.
Вначале был проведен анализ экспрессии поверхностных маркеров ранней (CD69) и средней (CD25 (IL-2Rα)) активации в живых иммунных клетках (рис. 4). Наблюдалось статистически значимое увеличение доли активированных клеток после терапии у мышей-респондеров по сравнению с контролем. Данные проточной цитометрии показали увеличение доли CD25+ клеток в субпопуляциях Т-лимфоцитов CD8+ (p=0,0182) и CD4+Th (p=0,021), а также доли CD69+ клеток среди CD8+ Т-клеток (p=0,0336). Группа «Анти-CTLA-4-терапия, нереспондеры» не отличалась по экспрессии поверхностных маркеров активации от групп «Анти-CTLA-4-терапия, респондеры» и «Контроль».
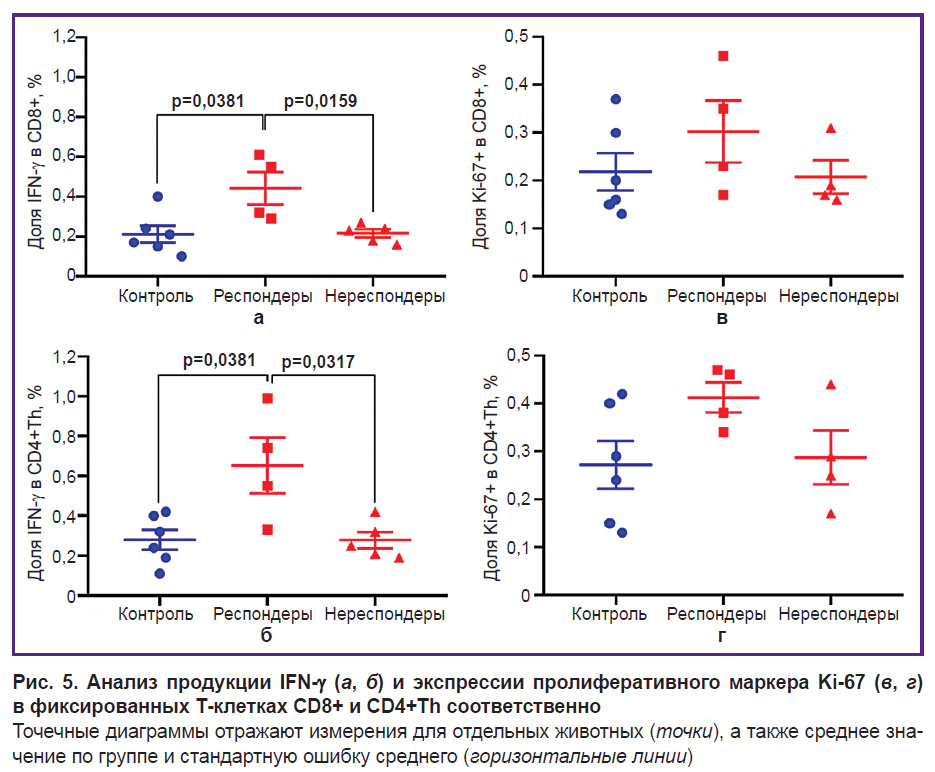
Оценка внутриклеточной экспрессии провоспалительного цитокина IFN- в качестве маркера ранней активации и пролиферативного маркера Ki-67 с помощью внутриклеточного окрашивания фиксированных иммунных клеток (рис. 5) выявила статистически значимое увеличение уровня продукции IFN-
в качестве маркера ранней активации и пролиферативного маркера Ki-67 с помощью внутриклеточного окрашивания фиксированных иммунных клеток (рис. 5) выявила статистически значимое увеличение уровня продукции IFN- у мышей-респондеров как по сравнению с контролем, так и по сравнению с мышами-нереспондерами. Увеличение доли IFN-
у мышей-респондеров как по сравнению с контролем, так и по сравнению с мышами-нереспондерами. Увеличение доли IFN- + клеток наблюдалось в обеих субпопуляциях эффекторных лимфоцитов CD8+ (p=0,0381 и p=0,0159) и CD4+Th (p=0,0381 и p=0,0317) по сравнению с группами «Контроль» и «Анти-CTLA-4-терапия, нереспондеры» соответственно.
+ клеток наблюдалось в обеих субпопуляциях эффекторных лимфоцитов CD8+ (p=0,0381 и p=0,0159) и CD4+Th (p=0,0381 и p=0,0317) по сравнению с группами «Контроль» и «Анти-CTLA-4-терапия, нереспондеры» соответственно.
Пролиферативный индекс Ki-67 не обнаружил статистически значимых различий между группами. Однако наблюдалась незначимая тенденция к увеличению доли Ki-67+ клеток у мышей-респондеров, более выраженная в субпопуляции CD4+Th.
Следовательно, эффекторные Т-клетки, как и ожидалось, активировались в ответ на иммунотерапию, и экспрессия основных маркеров активации повышалась только в группе мышей-респондеров. Поскольку выбранный срок забора лимфоузла соответствовал раннему ответу на терапию, мы наблюдали разницу между респондерами и нереспондерами только по продукции IFN- + как самого раннего маркера активации. Для данного срока также не обнаружено значимого усиления пролиферации иммунных клеток, которое характерно для более поздних стадий после лечения [23–25].
+ как самого раннего маркера активации. Для данного срока также не обнаружено значимого усиления пролиферации иммунных клеток, которое характерно для более поздних стадий после лечения [23–25].
Обсуждение
Ключевая проблема в иммунотерапии чекпоинт-ингибиторами опухолей — отсутствие надежных биомаркеров, позволяющих заранее определять восприимчивость индивидуальных пациентов к лечению, и недостаточные знания о механизмах резистентности [1]. Биомаркеры на основе автофлуоресценции метаболических коферментов могут стать новым мощным предиктором раннего ответа опухоли на лечение, а оптический метод FLIM — инструментом прогнозирования эффективности иммунотерапии, позволяющим сохранить пространственную структуру образца и быстро получать и обрабатывать данные о метаболическом статусе иммунных клеток.
В данной работе мы исследовали методом FLIM аутофлуоресценцию иммунных клеток в свежих фрагментах лимфоузлов в ходе анти-CTLA-4-терапии мышей с меланомой B16F0 на раннем этапе лечения. Метаболический имиджинг иммунных клеток при иммунотерапии был выполнен впервые.
Мишенью для метаболического имиджинга выбраны параметры времени жизни кофермента НАД(Ф)Н. Ранее [21] нами было показано, что именно эти параметры демонстрируют чувствительность к развитию опухоли. Мы наблюдали, что прогрессирование опухоли приводит к постепенному увеличению свободной формы НАДН α1, связанной с гликолизом, и появлению фосфорилированной компоненты НАДФН α3, связанной с биосинтетическими процессами, и это отражает усиление противоопухолевого иммунного ответа за счет нарастающего выброса опухолевых антигенов. Данные проточной цитометрии подтвердили, что изменения доли свободного НАДН коррелируют с активацией CD4+Th и CD8+ Т-клеток, а связанного НАДФН — с их пролиферацией [21].
В настоящем исследовании установлено, что параметр α1/α2 НАДН чувствителен к ответу на иммунотерапию чекпоинт-ингибиторами.
Увеличение вклада свободной формы НАДН α1 и, соответственно, снижение вклада связанной с белком формы НАДН α2 коррелируют с положительным ответом на анти-CTLA-4-терапию, выражающимся в торможении роста опухоли. Рост α1/α2 у респондеров может быть ассоциирован со сдвигом клеточного метаболизма в сторону гликолиза.
Известно, что ингибирующий рецептор CTLA-4 на Т-клетках в основном препятствует нормальной презентации им антигена антиген-презентирующими клетками (АПК), конкурируя с рецепторами CD28 за связывание с лигандами B7 (B7-1/CD80 и B7-2/CD86) на АПК и лишая Т-клетки костимулирующего сигнала [28, 29]. Кроме того, этот рецептор репрессирует коактиватор транскрипции PGC-1α, что приводит к нарушению метаболического переключения в сторону гликолиза [30]. Блокада же CTLA-4 позволяет реализоваться метаболической программе эффекторных Т-клеток в дренирующих лимфатических узлах [31]. Нормальная стимуляция Т-клеточного антигенного рецептора приводит к активации сигнального пути фосфатидилинозитол-3-киназы (PI3K)/Akt/mTORC1 и индукции Myc, что способствует усилению аэробного гликолиза и глутаминолиза для поддержания высоких энергетических и биосинтетических потребностей клетки [30, 31], и это согласуется с нашими результатами.
Однако подобный положительный ответ мы наблюдали лишь у 36% мышей, что согласуется с клинической статистикой, когда максимальный эффект чекпоинт-терапии достигается не более чем у 30% пациентов [1, 32]. Животные-нереспондеры демонстрировали низкие значения α1/α2, сравнимые со значениями у контрольных мышей без терапии, что может быть ассоциировано с нарушением метаболических путей, ответственных за переключение на гликолиз.
Причиной данной дисфункции могут служить следующие механизмы резистентности. Известно, что лечение блокирующими анти-CTLA-4- или анти-PD-1-антителами может вызывать активацию других ингибирующих рецепторов, таких как TIM-3, LAG-3 и VISTA, которые, в свою очередь, также подавляют гликолитические пути в эффекторных клетках. Кроме того, сами клетки меланомы поддерживают высокогликолитический профиль за счет активации сигнальных путей MAPK и (PI3K)/Akt/mTORC1 (посредством активации мутации в гене BRAF V600E или инактивации PTEN), конкурируя с эффекторными Т-клетками за глюкозу. Опухолевое окружение с избытком лактата и жирных кислот создает метаболический барьер для гликолитических эффекторных клеток и в то же время способствует стабильности регуляторных Т-клеток, что ограничивает эффективность чекпоинт-терапии анти-CTLA-4 [7, 33, 34].
Ответ на иммунотерапию был верифицирован данными по экспрессии активационных и пролиферативных маркеров с помощью проточной цитометрии. Мы наблюдали повышение экспрессии активационных маркеров CD25, CD69 и IFN- в эффекторных Т-клетках у мышей-респондеров. Однако только экспрессия IFN-
в эффекторных Т-клетках у мышей-респондеров. Однако только экспрессия IFN- как самого раннего маркера позволяла разделить респондеров и нереспондеров. Данный феномен коррелирует с данными FLIM по увеличению вклада свободной компоненты α1, ассоциированной с гликолизом, у респондеров. Известно, что аэробный гликолиз способствует выработке воспалительных цитокинов, таких как IFN-
как самого раннего маркера позволяла разделить респондеров и нереспондеров. Данный феномен коррелирует с данными FLIM по увеличению вклада свободной компоненты α1, ассоциированной с гликолизом, у респондеров. Известно, что аэробный гликолиз способствует выработке воспалительных цитокинов, таких как IFN- . Он поддерживает пулы ацетил-КоА-субстратов, которые необходимы для эпигенетического стимулирования экспрессии гена IFN-
. Он поддерживает пулы ацетил-КоА-субстратов, которые необходимы для эпигенетического стимулирования экспрессии гена IFN- , и усиливает трансляцию мРНК IFN-
, и усиливает трансляцию мРНК IFN- в белок [8, 35].
в белок [8, 35].
В отличие от предыдущего исследования [21], в настоящей работе не отмечено роста  2 и увеличения вклада фосфорилированной формы НАДФН α3, ассоциированной с биосинтетическими процессами и пролиферацией. Данные проточной цитометрии по экспрессии пролиферативного маркера Ki-67 коррелируют с данными FLIM, демонстрируя отсутствие статистически значимой разницы между исследуемыми группами. Наиболее вероятной причиной служат более ранний срок развития опухоли и ранний этап терапии в текущей работе.
2 и увеличения вклада фосфорилированной формы НАДФН α3, ассоциированной с биосинтетическими процессами и пролиферацией. Данные проточной цитометрии по экспрессии пролиферативного маркера Ki-67 коррелируют с данными FLIM, демонстрируя отсутствие статистически значимой разницы между исследуемыми группами. Наиболее вероятной причиной служат более ранний срок развития опухоли и ранний этап терапии в текущей работе.
Таким образом, иммунотерапия чекпоинт-ингибиторами приводит к значительному перепрограммированию метаболизма Т-клеток. Данные, получаемые с помощью FLIM-исследования НАД(Ф)Н, а именно увеличение α1/α2, отражают развитие противоопухолевого иммунного ответа в ответ на чекпоинт-терапию у животных-респондеров. Метаболический FLIM-имиджинг более чувствителен к индивидуальным изменениям на ранних этапах лечения, нежели уровень пролиферации клеток и экспрессии поверхностных рецепторов активации.
Заключение
Исследование показало, что иммунотерапия чекпоинт-ингибиторами приводит к выраженным метаболическим перестройкам в Т-клетках свежевыделенных лимфоузлов у мышей-респондеров с торможением роста опухоли. Данные по FLIM-имиджингу НАД(Ф)Н свидетельствуют об увеличении свободной фракции НАДН α1-формы, связанной с гликолизом для обеспечения высоких потребностей активированных Т-клеток и синтеза провоспалительных цитокинов. Напротив, у мышей-нереспондеров с прогрессирующей опухолью наблюдаются низкие значения α1/α2, что может быть связано с механизмами резистентности к терапии. Данные FLIM коррелировали с результатами проточной цитометрии по экспрессии активационных маркеров и продукции IFN- .
.
Полученные результаты свидетельствуют, что автофлуоресценция кофермента НАД(Ф)Н может быть использована в качестве надежного маркера эффективности ответа на чекпоинт-иммунотерапию.
Финансирование исследования. Работа проведена при поддержке гранта Российского научного фонда №21-74-00101.
Конфликт интересов. У авторов нет конфликта интересов.
Литература
- Huang A.C., Zappasodi R. A decade of checkpoint blockade immunotherapy in melanoma: understanding the molecular basis for immune sensitivity and resistance. Nat Immunol 2022; 23(5): 660–670, https://doi.org/10.1038/s41590-022-01141-1.
- Wolchok J.D., Chiarion-Sileni V., Gonzalez R., Grob J.J., Rutkowski P., Lao C.D., Cowey C.L., Schadendorf D., Wagstaff J., Dummer R., Ferrucci P.F., Smylie M., Butler M.O., Hill A., Márquez-Rodas I., Haanen J.B.A.G., Guidoboni M., Maio M., Schöffski P., Carlino M.S., Lebbé C., McArthur G., Ascierto P.A., Daniels G.A., Long G.V., Bas T., Ritchings C., Larkin J., Hodi F.S. Long-term outcomes with nivolumab plus ipilimumab or nivolumab alone versus ipilimumab in patients with advanced melanoma. J Clin Oncol 2022; 40(2): 127–137, https://doi.org/10.1200/jco.21.02229.
- Egen J.G., Ouyang W., Wu L.C. Human anti-tumor immunity: insights from immunotherapy clinical trials. Immunity 2020; 52(1): 36–54, https://doi.org/10.1016/j.immuni.2019.12.010.
- Bai R., Lv Z., Xu D., Cui J. Predictive biomarkers for cancer immunotherapy with immune checkpoint inhibitors. Biomark Res 2020; 8: 34, https://doi.org/10.1186/s40364-020-00209-0.
- Янус Г.А., Иевлева А.Г., Суспицын Е.Н., Тюрин В.И., Бизин И.В., Горустович О.А., Ни В.И., Холматов М.М., Лайдус Т.А., Чуйнышена С.А., Алексахина С.Н., Имянитов Е.Н. Предиктивные маркеры ответа на блокаторы контрольных точек иммунного ответа. Сибирский онкологический журнал 2020; 19(4): 123–131, https://doi.org/10.21294/1814-4861-2020-19-4-123-131.
- Lei Y., Li X., Huang Q., Zheng X., Liu M. Progress and challenges of predictive biomarkers for immune checkpoint blockade. Front Oncol 2021; 11: 617335, https://doi.org/10.3389/fonc.2021.617335.
- Li Y.Z., Zhang H.M. Recent advances in primary resistance mechanisms against immune checkpoint inhibitors. Curr Opin Oncol 2022; 34(1): 95–106, https://doi.org/10.1097/cco.0000000000000802.
- Leone R.D., Powell J.D. Metabolism of immune cells in cancer. Nat Rev Cancer 2020; 20: 516–531, https://doi.org/10.1038/s41568-020-0273-y.
- Hu C., Xuan Y., Zhang X., Liu Y., Yang S., Yang K. Immune cell metabolism and metabolic reprogramming. Mol Biol Rep 2022; 49(10): 9783–9795, https://doi.org/10.1007/s11033-022-07474-2.
- Kolenc O.I., Quinn K.P. Evaluating cell metabolism through autofluorescence imaging of NAD(P)H and FAD. Antioxid Redox Signal 2019; 30(6): 875–889, https://doi.org/10.1089/ars.2017.7451.
- Shirshin E.A., Shirmanova M.V., Gayer A.V., Lukina M.M., Nikonova E.E., Yakimov B.P., Budylin G.S., Dudenkova V.V., Ignatova N.I., Komarov D.V., Yakovlev V.V., Becker W., Zagaynova E.V., Shcheslavskiy V.I., Scully M.O. Label-free sensing of cells with fluorescence lifetime imaging: the quest for metabolic heterogeneity. Proc Natl Acad Sci U S A 2022; 119(9): e2118241119, https://doi.org/10.1073/pnas.2118241119.
- Datta R., Heaster T.M., Sharick J.T., Gillette A.A., Skala M.C. Fluorescence lifetime imaging microscopy: fundamentals and advances in instrumentation, analysis, and applications. J Biomed Opt 2020; 25(7): 1–43, https://doi.org/10.1117/1.jbo.25.7.071203.
- Kalinina S., Freymueller C., Naskar N., von Einem B., Reess K., Sroka R., Rueck A. Bioenergetic alterations of metabolic redox coenzymes as NADH, FAD and FMN by means of fluorescence lifetime imaging techniques. Int J Mol Sci 2021; 22(11): 5952, https://doi.org/10.3390/ijms22115952.
- Lukina M.M., Dudenkova V.V., Ignatova N.I., Druzhkova I.N., Shimolina L.E., Zagaynova E.V., Shirmanova M.V. Metabolic cofactors NAD(P)H and FAD as potential indicators of cancer cell response to chemotherapy with paclitaxel. Biochim Biophys Acta Gen Subj 2018; 1862(8): 1693–1700, https://doi.org/10.1016/j.bbagen.2018.04.021.
- Kuznetsova D.S., Rodimova S.A., Gulin A., Reunov D., Bobrov N., Polozova A.V., Vasin A., Shcheslavskiy V.I., Vdovina N., Zagainov V.E., Zagaynova E.V. Metabolic imaging and secondary ion mass spectrometry to define the structure and function of liver with acute and chronic pathology. J Biomed Opt 2019; 25(1): 1–14, https://doi.org/10.1117/1.jbo.25.1.014508.
- Hu L., Wang N., Cardona E., Walsh A.J. Fluorescence intensity and lifetime redox ratios detect metabolic perturbations in T cells. Biomed Opt Express 2020; 11(10): 5674–5688, https://doi.org/10.1364/boe.401935.
- Heaster T.M., Humayun M., Yu J., Beebe D.J., Skala M.C. Autofluorescence imaging of 3D tumor-macrophage microscale cultures resolves spatial and temporal dynamics of macrophage metabolism. Cancer Res 2020; 80(23): 5408–5423, https://doi.org/10.1158/0008-5472.can-20-0831.
- Miskolci V., Tweed K.E., Lasarev M.R., Britt E.C., Walsh A.J., Zimmerman L.J., McDougal C.E., Cronan M.R., Fan J., Sauer J.D., Skala M.C., Huttenlocher A. In vivo fluorescence lifetime imaging of macrophage intracellular metabolism during wound responses in zebrafish. Elife 2022; 11: e66080, https://doi.org/10.7554/elife.66080.
- Walsh A.J., Mueller K.P., Tweed K., Jones I., Walsh C.M., Piscopo N.J., Niemi N.M., Pagliarini D.J., Saha K., Skala M.C. Classification of T-cell activation via autofluorescence lifetime imaging. Nat Biomed Eng 2021; 5(1): 77–88, https://doi.org/10.1038/s41551-020-0592-z.
- Lemire S., Thoma O.M., Kreiss L., Völkl S., Friedrich O., Neurath M.F., Schürmann S., Waldner M.J. Natural NADH and FAD autofluorescence as label-free biomarkers for discriminating subtypes and functional states of immune cells. Int J Mol Sci 2022; 23(4): 2338, https://doi.org/10.3390/ijms23042338.
- Izosimova A.V., Shirmanova M.V., Shcheslavskiy V.I., Sachkova D.A., Mozherov A.M., Sharonov G.V., Zagaynova E.V., Yuzhakova D.V. FLIM of NAD(P)H in lymphatic nodes resolves T-cell immune response to the tumor. Int J Mol Sci 2022; 23(24): 15829, https://doi.org/10.3390/ijms232415829.
- Patton E.E., Mueller K.L., Adams D.J., Anandasabapathy N., Aplin A.E., Bertolotto C., Bosenberg M., Ceol C.J., Burd C.E., Chi P., Herlyn M., Holmen S.L., Karreth F.A., Kaufman C.K., Khan S., Kobold S., Leucci E., Levy C., Lombard D.B., Lund A.W., Marie K.L., Marine J.C., Marais R., McMahon M., Robles-Espinoza C.D., Ronai Z.A., Samuels Y., Soengas M.S., Villanueva J., Weeraratna A.T., White R.M., Yeh I., Zhu J., Zon L.I., Hurlbert M.S., Merlino G. Melanoma models for the next generation of therapies. Cancer Cell 2021; 39(5): 610–631, https://doi.org/10.1016/j.ccell.2021.01.011.
- Izosimova A.V., Yuzhakova D.V., Skatova V.D., Volchkova L.N., Zagainova E.V., Chudakov D.M., Sharonov G.V. Deciphering repertoire of B16 melanoma reactive TCRs by immunization, in vitro restimulation and sequencing of IFNγ-secreting T cells. Int J Mol Sci 2021; 22(18): 9859, https://doi.org/10.3390/ijms22189859.
- Yuzhakova D.V., Volchkova L.N., Pogorelyy M.V., Serebrovskaya E.O., Shagina I.A., Bryushkova E.A., Nakonechnaya T.O., Izosimova A.V., Zavyalova D.S., Karabut M.M., Izraelson M., Samoylenko I.V., Zagainov V.E., Chudakov D.M., Zagaynova E.V., Sharonov G.V. Measuring intratumoral heterogeneity of immune repertoires. Front Oncol 2020; 10: 512, https://doi.org/10.3389/fonc.2020.00512.
- Zhigalova E.A., Izosimova A.I., Yuzhakova D.V., Volchkova L.N., Shagina I.A., Turchaninova M.A., Serebrovskaya E.O., Zagaynova E.V., Chudakov D.M., Sharonov G.V. RNA-seq-based TCR profiling reveals persistently increased intratumoral clonality in responders to anti-PD-1 therapy. Front Oncol 2020; 10: 385, https://doi.org/10.3389/fonc.2020.00385.
- Fontenot J.D., Rasmussen J.P., Williams L.M., Dooley J.L., Farr A.G., Rudensky A.Y. Regulatory T cell lineage specification by the forkhead transcription factor foxp3. Immunity 2005; 22(3): 329–341, https://doi.org/10.1016/j.immuni.2005.01.016.
- Skala M.C., Riching K.M., Bird D.K., Gendron-Fitzpatrick A., Eickhoff J., Eliceiri K.W., Keely P.J., Ramanujam N. In vivo multiphoton fluorescence lifetime imaging of protein-bound and free nicotinamide adenine dinucleotide in normal and precancerous epithelia. J Biomed Opt 2007; 12(2): 024014, https://doi.org/10.1117/1.2717503.
- Waldman A.D., Fritz J.M., Lenardo M.J. A guide to cancer immunotherapy: from T cell basic science to clinical practice. Nat Rev Immunol 2020; 20(11): 651–668, https://doi.org/10.1038/s41577-020-0306-5.
- Liu Y., Zheng P. Preserving the CTLA-4 checkpoint for safer and more effective cancer immunotherapy. Trends Pharmacol Sci 2020; 41(1): 4–12, https://doi.org/10.1016/j.tips.2019.11.003.
- Zheng K., Zheng X., Yang W. The role of metabolic dysfunction in T-cell exhaustion during chronic viral infection. Front Immunol 2022; 13: 843242, https://doi.org/10.3389/fimmu.2022.843242.
- Seidel J.A., Otsuka A., Kabashima K. Anti-PD-1 and anti-CTLA-4 therapies in cancer: mechanisms of action, efficacy, and limitations. Front Oncol 2018; 8: 86, https://doi.org/10.3389/fonc.2018.00086.
- Pires da Silva I., Ahmed T., Reijers I.L.M., Weppler A.M., Betof Warner A., Patrinely J.R., Serra-Bellver P., Allayous C., Mangana J., Nguyen K., Zimmer L., Trojaniello C., Stout D., Lyle M., Klein O., Gerard C.L., Michielin O., Haydon A., Ascierto P.A., Carlino M.S., Lebbe C., Lorigan P., Johnson D.B., Sandhu S., Lo S.N., Blank C.U., Menzies A.M., Long G.V. Ipilimumab alone or ipilimumab plus anti-PD-1 therapy in patients with metastatic melanoma resistant to anti-PD-(L)1 monotherapy: a multicentre, retrospective, cohort study. Lancet Oncol 2021; 22(6): 836–847, https://doi.org/10.1016/s1470-2045(21)00097-8.
- Zappasodi R., Serganova I., Cohen I.J., Maeda M., Shindo M., Senbabaoglu Y., Watson M.J., Leftin A., Maniyar R., Verma S., Lubin M., Ko M., Mane M.M., Zhong H., Liu C., Ghosh A., Abu-Akeel M., Ackerstaff E., Koutcher J.A., Ho P.C., Delgoffe G.M., Blasberg R., Wolchok J.D., Merghoub T. CTLA-4 blockade drives loss of Treg stability in glycolysis-low tumours. Nature 2021; 591(7851): 652–658, https://doi.org/10.1038/s41586-021-03326-4.
- Zhou B., Gao Y., Zhang P., Chu Q. Acquired resistance to immune checkpoint blockades: the underlying mechanisms and potential strategies. Front Immunol 2021; 12: 693609, https://doi.org/10.3389/fimmu.2021.693609.
- Kishton R.J., Sukumar M., Restifo N.P. Metabolic regulation of T cell longevity and function in tumor immunotherapy. Cell Metab 2017; 26(1): 94–109, https://doi.org/10.1016/j.cmet.2017.06.016.