Применение алгоритмов глубокого машинного обучения на основе многослойной нейронной сети YOLOv8 для идентификации грибкового кератита
Цель исследования — разработка метода диагностики грибкового кератита на основе анализа фотографий переднего отрезка глаза при помощи алгоритмов глубокого машинного обучения с последующей оценкой чувствительности и специфичности на тестовом наборе данных в сравнении с результатами практикующих офтальмологов.
Материалы и методы. Исследование включало следующие этапы: набор данных, предварительная подготовка, аугментация и разметка изображений, выбор подхода к обучению и архитектуры нейронной сети, обучение модели, валидация с коррекцией гиперпараметров, оценка показателей эффективности алгоритма на тестовой выборке, определение чувствительности и специфичности выявления грибкового кератита практикующими врачами. Использовано 274 изображения переднего отрезка глаза: 130 фотографий глаз, пораженных грибковым кератитом, и 144 снимка — физиологическая норма, кератиты другой этиологии и различные заболевания переднего отрезка глаза. Исключали фотографии, сделанные после начала лечения, а также иллюстрирующие кератиты смешанной этиологии и перфорацию роговицы. Изображения тренировочной выборки размечали с помощью веб-приложения VGG Image Annotator, после чего использовали для обучения сверточной нейронной сети YOLOv8. Набор фотографий тестовой выборки был также предложен практикующим офтальмологам для определения точности диагностики грибкового кератита.
Результаты. Показатель чувствительностимодели составил 56,0%, уровень специфичности достигал 96,1%, доля правильных ответов алгоритма — 76,5%. Точность распознавания изображений практикующими офтальмологами составила 50,0%, специфичность — 41,7%, чувствительность — 57,7%. При этом точность и специфичность алгоритма статистически значимо превосходили результаты экспертной оценки (р<0,05).
Заключение. Исследование показало высокий потенциал алгоритмов глубокого машинного обучения в диагностике грибкового кератита и их преимущества в специфичности по сравнению с экспертной оценкой при условии отсутствия метаданных. Использование технологий «компьютерного зрения» может найти применение в качестве дополнительного метода диагностики при принятии решений в сложных случаях и в условиях телемедицинской помощи. Требуются дальнейшие исследования для сравнения разработанной модели с альтернативными подходами, расширение и стандартизация баз данных.
Введение
Обилие визуальной информации обусловило повышенный интерес к разработке и внедрению систем искусственного интеллекта в сферу охраны зрения [1], включая организацию телемедицинской помощи [2]. Медицинские технологии, основанные на методах машинного обучения, могут выступать в качестве виртуального ассистента врача, способствуя ускорению принятия решений и повышая точность диагностики, при этом снижая риски ошибок и затраты на обработку данных [3]. Последние достижения в области алгоритмов глубокого обучения, в частности сверточных нейронных сетей, сделали возможным выявление заболеваний с помощью технологий «компьютерного зрения», обученных на больших наборах медицинских изображений [4, 5].
Наибольшие успехи машинного обучения в офтальмологии достигнуты в направлении автоматизированной диагностики диабетической ретинопатии, возрастной макулярной дегенерации, глаукомы и катаракты [1, 6]. При этом возможности искусственного интеллекта для раннего выявления заболеваний роговицы остаются недостаточно изученными. Это связано с тем, что получение изображений переднего отрезка глаза менее унифицировано по сравнению с фоторегистрацией глазного дна из-за разнообразия структур и методов визуализации [7].
Помутнение роговицы является причиной двусторонней слепоты и выраженного снижения зрения у 5,5 млн человек в мире и причиной односторонней потери зрения у 6,2 млн человек [8]. Значительная доля помутнений роговицы обусловлена перенесенным инфекционным кератитом, заболеваемость которым в различных регионах колеблется в широких пределах: от 6,6 и 27,6 случаев в год на 100 000 человек в Австралии и США соответственно до 113 и 799 случаев в год на 100 000 человек в Индии и Непале соответственно [9].
Доля грибковых поражений в структуре заболеваемости инфекционным кератитом ежегодно возрастает в связи с широким и бесконтрольным использованием глазных капель, содержащих антибиотики и стероиды [10]. Заболевание наиболее распространено в тропических и субтропических регионах, где его частота достигает 81,5% от всех лабораторно подтвержденных инфекций роговицы [11, 12]. Бремя грибкового кератита для пациента и общества обусловлено длительной утратой трудоспособности и инвалидизацией, продолжительным и дорогостоящим лечением и реабилитацией, снижением качества жизни и ограничением социального функционирования в связи с потерей зрительных функций [13]. Высокая социальная значимость заболевания позволила определить грибковый кератит как «социальную и экономическую катастрофу» [14].
Грибковая инфекция известна своим агрессивным течением и устойчивостью возбудителя к противогрибковым препаратам, что связано с особенностями патогенеза и образованием биопленок [10]. Позднее начало специфического лечения ассоциировано с развитием осложнений, вынужденным проведением неотложных оперативных вмешательств и потерей зрения. Раннему выявлению грибкового кератита препятствуют недостаточная точность клинической диагностики, составляющая от 33 до 80% [15], ложноотрицательные результаты при использовании культуральных микробиологических методов исследования, достигающие 37–41% [11, 16], а также ограниченная доступность новых высокоинформативных методик [10]. Все это определяет актуальность поиска новых методов ранней диагностики заболевания [9, 10, 17], отвечающих требованиям быстроты проведения, высокой точности, независимости от клинического опыта специалиста и максимальной доступности. Подобным требованиям могут соответствовать диагностические системы, основанные на технологиях искусственного интеллекта, где применяются многослойные нейронные сети — глубокое обучение. В то же время лишь единичные исследования посвящены анализу возможностей искусственного интеллекта в распознавании изображений переднего отрезка глаза.
Цель исследования — разработка метода диагностики грибкового кератита на основе анализа фотографий переднего отрезка глаза при помощи алгоритмов глубокого машинного обучения с последующей оценкой чувствительности и специфичности на тестовом наборе данных в сравнении с результатами практикующих офтальмологов.
Материалы и методы
Исследование включало следующие этапы: набор данных, предварительная подготовка и разметка изображений, выбор подхода к обучению и архитектуры сети, обучение нейросети, валидация с коррекцией гиперпараметров, оценка показателей эффективности алгоритма на тестовой выборке, определение чувствительности и специфичности выявления грибкового кератита практикующими врачами. Исследование выполнено в соответствии с положениями Хельсинкской декларации (2013).
Ретроспективный набор данных осуществляли из базы фотографий переднего отрезка глаза, выполненных с помощью фундус-камеры Visucam 500 (Carl Zeiss, Германия) в офтальмологическом отделении Приволжского окружного медицинского центра Федерального медико-биологического агентства (Н. Новгород) в период с 2015 по 2022 г. Полученный набор дополнялся данными из баз открытого доступа PubMed Central и Retina Image Bank. Основными критериями были достаточное качество изображений по параметрам сфокусированности, центрации, яркости, доступности роговицы для рассмотрения (прикрытие веками не более чем на 1/3), а также наличие достоверной информации о диагнозе пациента.
На этапе подготовки данных изображения были разделены на классы, включающие 130 фотографий глаз, пораженных грибковым кератитом, и 144 фотографии, иллюстрирующие физиологическую норму и другие виды патологии переднего отрезка глаза, в том числе катаракту, дистрофию роговицы, птеригиум, кератиты вирусной и бактериальной этиологии.
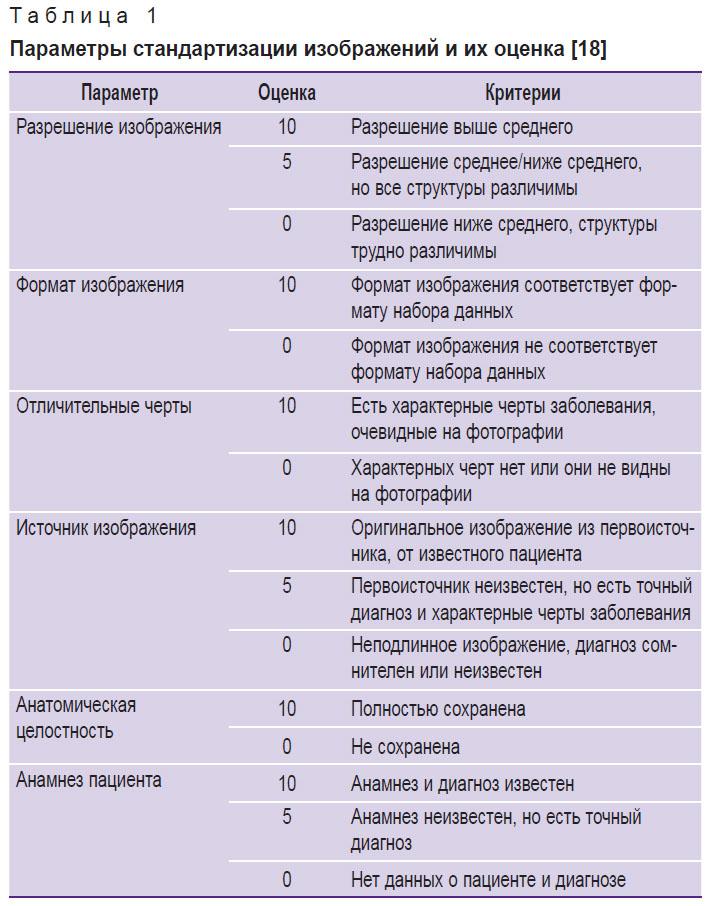
В связи со сложностью стандартизации изображений переднего отрезка глаза в 2023 г. были предложены критерии комплексной оценки качества таких изображений для включения их в наборы данных при разработке систем искусственного интеллекта [18]. Эти критерии применялись нами для стандартизации набора данных и повышения надежности исследования. Каждое изображение оценивали в баллах по таким параметрам, как разрешение, формат, наличие отличительных черт интересующей патологии, источник изображения, анатомическая целостность и наличие информации о пациенте (табл. 1).
|
Таблица 1. Параметры стандартизации изображений и их оценка [18] |
Изображения с оценкой «0» хотя бы по одному параметру исключали из базы данных. Преимуществом обладали фотографии из архива собственной фундус-камеры, имевшие оценку, близкую к 10 баллам в целом по всем пунктам.
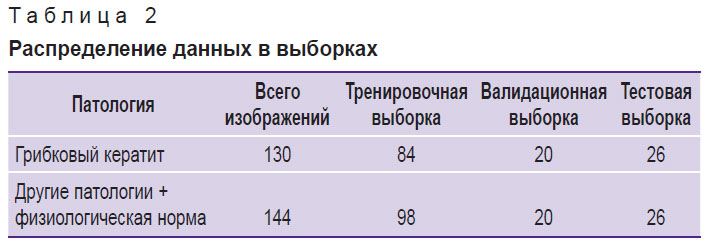
Критерием включения в группу грибкового кератита было наличие верифицированного грибкового поражения роговицы любого размера и локализации. При этом исключались фотографии, сделанные после начала лечения, а также иллюстрирующие кератиты смешанной этиологии и перфорацию роговицы. Во вторую группу были отнесены изображения с физиологической нормойи различной патологией органа зрения, визуализируемой на фотографиях переднего отрезка глаза (заболевания роговицы, радужной оболочки, хрусталика), которые могли быть приняты за грибковое поражение роговицы. Для обучения нейронной сети фотографии из каждой группы были случайным образом разделены на тренировочную, валидационную и тестовую выборки (табл. 2). Все изображения были приведены к единому формату 320×320 пикселей и анонимизированы.
|
Таблица 2. Распределение данных в выборках |
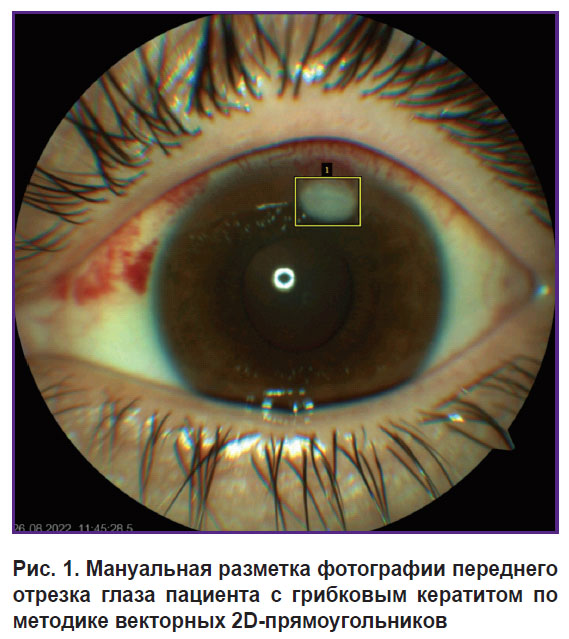
На этапе разметки на всех изображениях тренировочной выборки выделяли область интереса по методике векторных 2D-прямоугольников (bounding box) с помощью веб-приложения VGG Image Annotator (рис. 1). В процессе разметки мы придерживались нескольких принципов: интересующие зоны выделяли прямоугольником, несколько близко расположенных мелких очагов объединяли единой рамкой, границы разметки устанавливали максимально близко к краям очага. Рамку располагали таким образом, чтобы в ее пределы не попадали края век и световые рефлексы на изображении.
|
Рис. 1. Мануальная разметка фотографии переднего отрезка глаза пациента с грибковым кератитом по методике векторных 2D-прямоугольников |
Выбор подходов к обучению и созданию архитектуры алгоритмов машинного обучения определялся поставленной целью дифференциальной диагностики поражения роговицы грибковым агентом от других заболеваний. С точки зрения технической терминологии это предполагает решение задачи классификации изображений и детекции объектов. В связи с этим был выбран способ обучения многослойной нейронной сети с учителем. Из множества сверточных нейронных сетей использовали алгоритм YOLOv8 (You Only Look Once), обеспечивающий классификацию и детекцию объектов в режиме реального времени. Модель YOLOv8 демонстрирует высокие показатели скорости и точности в различных областях компьютерного зрения, опережая модели предыдущих поколений [19]. В отличие от других двухуровневых сверточных нейросетей YOLOv8 оценивает все выделенные области изображений одновременно, что значительно ускоряет процесс обучения [20].
Для обучения нейросети были использованы 182 размеченных изображения тренировочной выборки. Принцип обучения можно описать в виде следующих последовательных этапов. Сначала изображение подается на вход нейросети, где происходят его анализ и формирование значений, по которым нейронная сеть сопоставляет интересующие регионы с участками входного изображения. Далее выделяются регионы, в которых находятся объекты, подлежащие распознаванию [21]. Так создается пробная модель, способная анализировать набор признаков и классифицировать объекты. Алгоритм сверяет свой результат с заданным и корректирует модель согласно «верному» ответу. Данный процесс многократно повторяется до тех пор, пока алгоритм не сможет правильно классифицировать объекты. Дополнительно на каждой итерации к изображениям применяются различные аугментации, т.е. незначительные изменения объектов (например, уменьшение или приближение). Данное действие позволяет искусственно расширить обучающую выборку, сделать модель более устойчивой к фотографиям различного качества и ракурса.
Обучение модели было закончено, когда перестали регистрироваться улучшения, что позволило избежать переобучения.
На следующем этапе оценивали точность обученной модели с помощью неизвестной для нее полностью уникальной валидационной выборки из 40 изображений, что позволяло вручную корректировать внешние переменные конфигурации, или гиперпараметры. По достижении удовлетворительных значений чувствительности модели на вход подавалась тестовая выборка, не имеющая повторений с тренировочным и валидационным датасетами, для определения показателей эффективности диагностики грибкового кератита. Исследование выполнено с помощью аппаратного обеспечения NVIDIA GTX TITAN Xp Pascal с объемом видеопамяти 12 Гб, необходимой для распознавания и обработки изображений.
Четырем практикующим офтальмологам со стажем работы не менее 7 лет было предложено провести диагностику грибкового кератита по фотографиям тестовой выборки для сравнения их результатов с чувствительностью и специфичностью обученной нейросети. Перед каждым экспертом была поставлена задача выявить изображения с грибковым поражением роговицы без дополнительной информации о пациенте, что значительно усложняло диагностику [22].
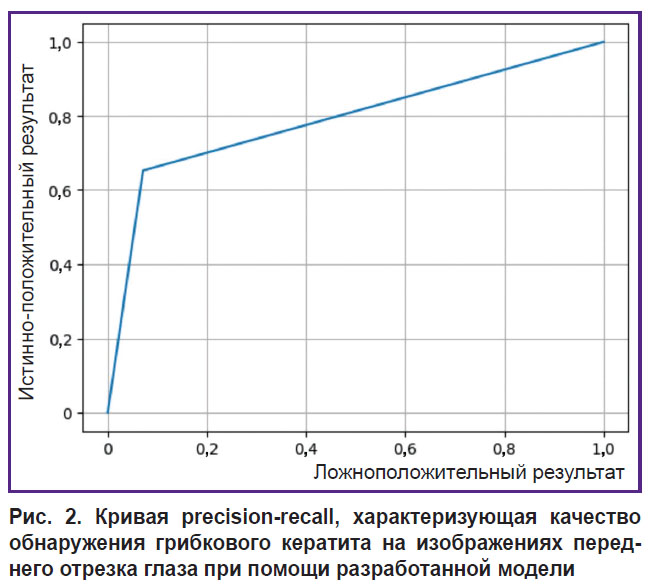
Статистический анализ данных включал расчет показателей чувствительности, специфичности и точности, точности (precision) и полноты (recall), а также построение кривых precision-recall для оценки качества обнаружения грибкового кератита на изображениях переднего отрезка глаза при помощи разработанной модели. Кривые precision-recall являются аналогом ROC-кривых для визуализации результатов применения алгоритмов машинного обучения. Сравнение показателей эффективности модели и практикующих врачей осуществляли при помощи критерия ÷2, принятый уровень значимости — 0,05.
Результаты
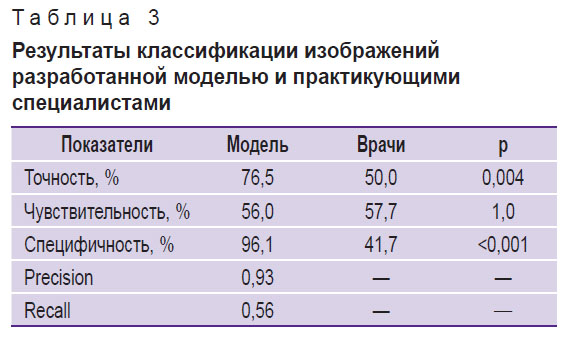
Процесс обучения нейронной сети YOLOv8 включал 118 итераций и длился 413 мин. Доля правильных ответов алгоритма составила 76,5% на тестовой выборке, вероятность ошибки — 23,5% (рис. 2). Чувствительность модели по результатам тестирования составила 56,0%, а специфичность — 96,0% (табл. 3). Классификация 52 фотографий опытными офтальмологами показала среднее значение доли правильных ответов (Acc — 50,0%); специфичность — 41,7%, чувствительность — 57,7%. Точность и специфичность разработанного алгоритма статистически значимо превосходили результаты экспертной оценки (р<0,05) (см. табл. 3).
|
Рис. 2. Кривая precision-recall, характеризующая качество обнаружения грибкового кератита на изображениях переднего отрезка глаза при помощи разработанной модели |
|
Таблица 3. Результаты классификации изображений разработанной моделью и практикующими специалистами |
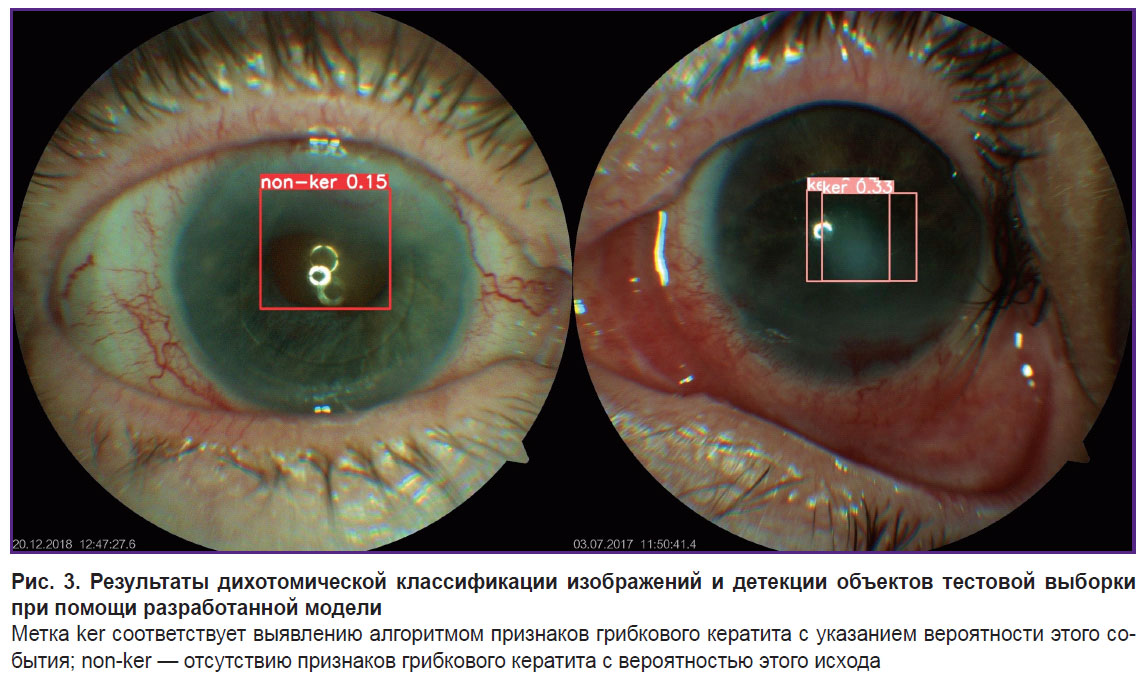
В результате оценки алгоритмом тестовой выборки были получены размеченные изображения с метками, соответствующими предположению модели относительно того, является ли выделенная патология грибковым кератитом (рис. 3). Установлено, что модель адекватно осуществляет разметку изображений в 76,5% случаев.
Таким образом, настоящее исследование продемонстрировало высокую эффективность алгоритмов машинного обучения, разработанных на основе сверточной многослойной нейронной сети YOLOv8, в диагностике грибкового кератита на фотографиях переднего отрезка глаза, сравнимую с результатами практикующих офтальмологов. Оригинальность подхода заключалась в сочетании задач классификации изображений с детекцией патологических объектов, а также включении в набор данных невоспалительных заболеваний переднего отрезка глаза, что максимально приближало моделируемую ситуацию к условиям телемедицинского мониторинга.
Обсуждение
Клиническиe данные, включая анамнез и объективную картину, обнаруживаемую при биомикроскопии, лежат в основе дифференциальной диагностики кератитов различной этиологии. Наиболее сложным для верификации является грибковое поражение, при котором точность экспертной оценки практикующими офтальмологами характеризуется большим разбросом значений. В частности, доля правильных ответов при дифференциации грибкового и бактериального кератитов по фотографиям переднего отрезка глаза составляет 49–67% [22–24], что соотносится с полученным нами показателем (50,0%). Относительно низкие показатели эффективности могут быть связаны с тем, что задействованные в нашем исследовании врачи не являлись узкоспециализированными специалистами по инфекционной патологии глаза, в то же время они имели опыт работы в сфере транспланатации роговицы не менее 5 лет.
Сравнение показателей точности алгоритмов с результатами практикующих врачей является важным компонентом исследований, посвященных разработке технологий «компьютерного зрения». Так, в исследовании M.T. Kuo с соавт. [24] алгоритм с аналогичным дизайном, построенный на основе архитектуры DenseNet, демонстрировал показатели чувствительности, превышающие таковые у практикующих офтальмологов, и более низкую специфичность по сравнению с врачами. В работе S. Hu с соавт. [25] при сравнении точности диагностики инфекционного кератита экспертная диагностика также уступала предложенным методам машинного обучения.
Диагностическая точность алгоритмов глубокого обучения в первую очередь зависит от количества и качества использованных данных, при этом прослеживается прямая связь между количеством данных и точностью результата [6]. В исследовании M. Soleimani с соавт. [26] удалось собрать уникальную базу из 9329 фотографий, выполненных в ходе биомикроскопии 977 пациентов, что позволило достичь 84% точности при дифференцировании бактериального и грибкового кератитов и 77,5% — в определении типа грибов (нитчатых или дрожжевых патогенов). В исследовании A. Koyama с соавт. [27] аналогичные задачи этиологической диагностики решались с помощью алгоритма на основе архитектуры ResNet50, который обеспечивал высокую точность диагностики акантамебного (96,7%), бактериального (77,6%), грибкового (84,2%) поражения роговицы, а для вируса простого герпеса доля правильных ответов достигала 91,7%.
Для совершенствования разработанной нами методики необходимо дальнейшее увеличение объема выборки за счет не только изображений грибкового кератита, но и поражений роговицы другой этиологии и иных заболеваний переднего отрезка глаза, что позволит повысить качество работы алгоритма. Пути решения данной проблемы включают вовлечение новых исследовательских центров, обладающих уникальными базами офтальмологических изображений. Примером подобной коллаборации является работа M. Tiwari с соавт. [28], где пополнение базы фотографий обеспечивалось объединением наборов данных, хранящихся в архиве клинических испытаний по программам “Steroids for Corneal Ulcers Trial (SCUT)” и “Mycotic Ulcer Treatment Trial (MUTT)”, а также изображений из локального архива Стэнфордского университета.
В перспективе достигнутые нами показатели могут быть улучшены посредством не только увеличения объема выборки, но и повышения качества данных, совершенствования критериев отбора изображений и более детальной проработки параметров нейросети. Препятствием к этому являются критерии включения и исключения объектов выборки, поскольку достаточно часто пациенты попадают к офтальмологу после безуспешных попыток самостоятельного лечения или на поздних стадиях заболевания, когда могут наблюдаться язвенные изменения, перфорация роговицы или присоединение вторичной инфекции. Сложность также заключается в необходимости унификации изображений по техническим параметрам. В частности, причиной невысоких значений доли правильных ответов алгоритма могла стать неоткорректированная яркость фотографий. При подборе данных из выборки исключались очевидно яркие и слишком темные изображения, однако точное определение оптимального диапазона яркости с целью предварительного редактирования и нормирования фотографий представляется актуальной научной задачей [29]. В исследовании A. Hanif с соавт. [30], посвященном анализу влияния качества фотографических снимков переднего отрезка глаза на результаты эффективности нейросети, установлено, что наличие световых рефлексов, а также попадание в кадр краев век и ресниц значимо отражается на итоговых диагностических показателях. Применение разметки изображений повышает точность диагностики на 16% [31], а включение в алгоритм распознавания фотографий этапа автоматической сегментации изображений может обеспечить прирост эффективности на 7% [32].
Выбор варианта архитектуры нейронной сети также влияет на результативность системы, поскольку ее характеристики подбирают в зависимости от типа информации и задач исследования. Ряд работ, посвященных анализу офтальмологических изображений, был успешно реализован на базе таких нейросетей, как ResNet50 и FasterCNN [31]. В исследовании [33], посвященном классификации бактериального и грибкового кератита, модель на основе ResNet50 обеспечивала чувствительность 80% и специфичность 70%, что несколько превосходит наши значения. Однако это может быть обусловлено объемом выборки, исключением иных видов патологии роговицы и переднего отрезка глаза, а также использованием заранее обученной нейронной сети. При сравнении диагностической точности нескольких нейросетей точность диагностики грибкового кератита варьировала в широких пределах — от 26 до 66%, в то время как при диагностике бактериального кератита доля правильных ответов алгоритма составляла не менее 79,6% [34]. В отличие от грибкового поражения сравнение эффективности алгоритмов на основе нейросетей ResNet50, ResNeXt50, DenseNet121, SE-ResNet50, EfficientNets B0, B1, B2 и B3 в распознавании бактериального кератита не показало статистически значимых различий [35]. Учитывая отсутствие работ, использовавших современное поколение нейросетей YOLOv8 для выявления грибкового кератита, мы считаем целесообразным дальнейшее исследование возможностей данной архитектуры в сравнении с другими сверточными нейросетями, применяемыми для анализа большого количества изображений.
Для улучшения алгоритмов глубокого обучения важно понимать, в каких случаях появляются ложноположительные и ложноотрицательные результаты. При разборе причин ошибок в работе H. Gu с соавт. [36] установлено, что у пациентов с поражением центральной зоны роговицы модель ложно диагностировала катаракту в связи c локализацией поражения в области зрачка; осложненную катаракту алгоритм идентифицировал как инфекционный кератит, а неинфекционный кератит распознавался как инфекционный и нейронной сетью, и врачами-офтальмологами.
Значительные успехи диагностики кератитов различной этиологии с помощью методов глубокого обучения были достигнуты при анализе изображений конфокальной микроскопии роговицы; в случае идентификации грибкового кератита точность достигала 97%, а специфичность — 96% [37]. Однако ограниченная доступность конфокальной микроскопии обусловливает необходимость дальнейших исследований в области распознавания фотографий переднего отрезка глаза [10], что особенно актуально для обмена данными в ходе проведения телемедицинских консультаций. Все это доказывает сложность идентификации грибкового кератита и подтверждает необходимость оптимизации работы алгоритмов и обогащения наборов данных.
Помимо технических затруднений, возникающих в процессе обучения моделей, перед исследователями и врачами стоит вопрос о том, насколько широко и как скоро могут быть применены данные технологии. Методология нашего исследования предполагала распознавание фотографий переднего отрезка глаза без метаданных, в связи с чем сравнение результатов экспертов и разработанного алгоритма нельзя полностью экстраполировать на условия реальной клинической практики, поскольку даже в условиях телемедицинских консультаций врач обладает дополнительными ценными для диагностики сведениями из анамнеза пациента. При этом технологии компьютерного зрения позволяют классифицировать изображения по категориям, что имеет колоссальный потенциал для практической медицины и развития здравоохранения в целом. Цифровая медицина названа ведущим направлением совершенствования здравоохранения согласно стратегии развития обрабатывающей промышленности РФ до 2035 года [38]. Внедрение технологий искусственного интеллекта позволит осуществлять комплексный скрининг многих заболеваний, в том числе грибкового кератита. Однако это сопряжено с рядом сложностей, многие из которых пока остаются нерешенными [39]. Так, обсуждаются проблемы этики использования данных пациентов, обеспечения информационной безопасности и правовой ответственности. Техническим ограничением для развития технологии является отсутствие единых стандартов сбора данных. Исследователи в разных клиниках используют оригинальные принципы сбора и обработки данных, что приводит к низкой воспроизводимости результатов даже при схожем техническом обеспечении. И этические, и технические аспекты должны быть регламентированы, что требует совершенствования законодательной базы в сфере биомедицинского искусственного интеллекта.
К преимуществам настоящего исследования можно отнести достаточный объем изображений с редкими офтальмологическими патологиями, выполнение разметки всех фотографий обучающей выборки и сравнительный характер работы. Решение задачи автоматизированной диагностики грибкового кератита в сочетании с детекцией патологических объектов на фотографиях переднего отрезка глаза с применением нейронной сети YOLOv8 в научной литературе представлено впервые.
Заключение
Визуализация структур переднего отрезка глаза лежит в основе диагностики заболеваний роговицы, однако интерпретация полученных данных зависит от опыта офтальмолога, что может сказываться на сроках оказания помощи и адекватности назначаемой терапии. Исключительно клинический подход не всегда может оправдать свою простоту, в том числе в случае с грибковым кератитом, который требует быстрой диагностики на ранних этапах. Автоматизированная классификация медицинских изображений имеет значительный потенциал в решении подобных проблем, так как использование искусственного интеллекта способствует снижению нагрузки на врачей и повышению эффективности скрининговых методов.
В настоящем исследовании разработана методика диагностики грибкового кератита с помощью автоматизированной классификации и детекции патологических объектов на фотографиях переднего отрезка глаза сверточной нейронной сетью YOLOv8. Доля правильных ответов алгоритма составила 76,5%, а чувствительность и специфичность — 57,7 и 96,1% соответственно, что не уступало средним результатам врачей-офтальмологов.
Перспективными задачами для дальнейших исследований являются сбор большего объема данных и их тщательная обработка, унификация технических параметров, совершенствование алгоритмов глубокого машинного обучения для лучшей производительности, оценка возможностей метода для дифференциальной диагностики различных видов патологии роговицы.
Финансирование. Исследование выполнено за счет гранта Российского научного фонда №23-75-01007, https://rscf.ru/project/23-75-01007/.
Конфликт интересов отсутствует.
Литература
- Апрелев А.Е., Манкибаева Р.И., Манкибаев Б.С., Апрелева Е.В. Применение систем с искусственным интеллектом в диагностике офтальмологических заболеваний. Вестник Башкирского государственного медицинского университета 2019; 3: 10–14.
- Sharma M., Jain N., Ranganathan S., Sharma N., Honavar S.G., Sharma N., Sachdev M.S. Tele-ophthalmology: need of the hour. Indian J Ophthalmol 2020; 68(7): 1328–1338, https://doi.org/10.4103/ijo.IJO_1784_20.
- Глизница П.В., Тахчиди Х.П., Светозарский С.Н., Бурсов А.И., Шустерзон К.А. Машинное обучение в диагностике и лечении офтальмологических заболеваний. Голова и шея. Российский журнал 2022; 10(1): 83–90, https://doi.org/10.25792/HN.2022.10.1.83-90.
- Litjens G., Kooi T., Bejnordi B.E., Setio A.A.A., Ciompi F., Ghafoorian M., van der Laak J.A.W.M., van Ginneken B., Sánchez C.I. A survey on deep learning in medical image analysis. Med Image Anal 2017; 42: 60–88, https://doi.org/10.1016/j.media.2017.07.005.
- LeCun Y., Bengio Y., Hinton G. Deep learning. Nature 2015; 521(7553): 436–444, https://doi.org/10.1038/nature14539.
- Гарри Д.Д., Саакян С.В., Хорошилова-Маслова И.П., Цыганков А.Ю., Никитин О.И., Тарасов Г.Ю. Методы машинного обучения в офтальмологии. Обзор литературы. Офтальмология 2020; 17(1): 20–31, https://doi.org/10.18008/1816-5095-2020-1-20-31.
- Ursuleanu T.F., Luca A.R., Gheorghe L., Grigorovici R., Iancu S., Hlusneac M., Preda C., Grigorovici A. Deep learning application for analyzing of constituents and their correlations in the interpretations of medical images. Diagnostics (Basel) 2021; 11(8): 1373, https://doi.org/10.3390/diagnostics11081373.
- Wang E.Y., Kong X., Wolle M., Gasquet N., Ssekasanvu J., Mariotti S.P., Bourne R., Taylor H., Resnikoff S., West S. Global trends in blindness and vision impairment resulting from corneal opacity 1984–2020: a meta-analysis. Ophthalmology 2023; 130(8): 863–871, https://doi.org/10.1016/j.ophtha.2023.03.012.
- Cabrera-Aguas M., Khoo P., Watson S.L. Infectious keratitis: a review. Clin Exp Ophthalmol 2022; 50(5): 543–562, https://doi.org/10.1111/ceo.14113.
- Sitnova A.V., Svetozarskiy S.N. Modern technologies in diagnosis of fungal keratitis (review). Sovremennye tehnologii v medicine 2023; 15(2): 73, https://doi.org/10.17691/stm2023.15.2.07.
- Brown L., Leck A.K., Gichangi M., Burton M.J., Denning D.W. The global incidence and diagnosis of fungal keratitis. Lancet Infect Dis 2021; 21(3): e49–e57, https://doi.org/10.1016/S1473-3099(20)30448-5.
- Hoffman J.J., Burton M.J., Leck A. Mycotic keratitis — a global threat from the filamentous fungi. J Fungi (Basel) 2021; 7(4): 273, https://doi.org/10.3390/jof7040273.
- Brown L., Kamwiziku G., Oladele R.O., Burton M.J., Prajna N.V., Leitman T.M., Denning D.W. The case for fungal keratitis to be accepted as a neglected tropical disease. J Fungi (Basel) 2022; 8(10): 1047, https://doi.org/10.3390/jof8101047.
- Whitcher J.P., Srinivasan M., Upadhyay M.P. Prevention of corneal ulceration in the developing world. Int Ophthalmol Clin 2002; 42(1): 71–77, https://doi.org/10.1097/00004397-200201000-00010.
- Ung L., Bispo P.J.M., Shanbhag S.S., Gilmore M.S., Chodosh J. The persistent dilemma of microbial keratitis: global burden, diagnosis, and antimicrobial resistance. Surv Ophthalmol 2019; 64(3): 255–271, https://doi.org/10.1016/j.survophthal.2018.12.003.
- Deorukhkar S., Katiyar R., Saini S. Epidemiological features and laboratory results of bacterial and fungal keratitis: a five-year study at a rural tertiary-care hospital in western Maharashtra, India. Singapore Med J 2012; 53(4): 264–267.
- Светозарский С.Н., Андреев А.Н., Щербакова С.В. Грибковый кератит после сквозной кератопластики. Вестник офтальмологии 2019; 135(4): 98–102, https://doi.org/10.17116/oftalma201913504198.
- Shao Y., Jie Y., Liu Z.G.; Expert Workgroup of Guidelines for the application of artificial intelligence in the diagnosis of anterior segment diseases (2023); Ophthalmic Imaging and Intelligent Medicine Branch of Chinese Medicine Education Association; Ophthalmology Committee of International Association of Translational Medicine; Chinese Ophthalmic Imaging Study Groups. Guidelines for the application of artificial intelligence in the diagnosis of anterior segment diseases (2023). Int J Ophthalmol 2023; 16(9): 1373–1385, https://doi.org/10.18240/ijo.2023.09.03.
- Redmon J., Divvala S., Girshick R., Farhadi A. You only look once: unified, real-time object detection. Proceedings of the IEEE Conference on Computer Vision and Pattern Recognition (CVPR) 2016; 779–788, https://doi.org/10.1109/CVPR.2016.91.
- Bochkovskiy A., Wang C.-Y., Liao Н.-Y.M. YOLOv4: optimal speed and accuracy of object detection. ArXiv 2020, https://doi.org/10.48550/arXiv.2004.10934.
- Брехт Э.А., Коншина В.Н. Применение нейронной сети YOLO для распознавания дефектов. Интеллектуальные технологии на транспорте 2022; 2(30): 41–47.
- Xu Y., Kong M., Xie W., Duan R., Fang Z., Lin Y., Zhu Q., Tang S., Wu F., Yao Y.-F. Deep sequential feature learning in clinical image classification of infectious keratitis. Engineering 2021; 7(7): 1002–1010, https://doi.org/10.1016/j.eng.2020.04.012.
- Dalmon C., Porco T.C., Lietman T.M., Prajna N.V., Prajna L., Das M.R., Kumar J.A., Mascarenhas J., Margolis T.P., Whitcher J.P., Jeng B.H., Keenan J.D., Chan M.F., McLeod S.D., Acharya N.R. The clinical differentiation of bacterial and fungal keratitis: a photographic survey. Invest Ophthalmol Vis Sci 2012; 53(4): 1787–1791, https://doi.org/10.1167/iovs.11-8478.
- Kuo M.T., Hsu B.W., Yin Y.K., Fang P.C., Lai H.Y., Chen A., Yu M.S., Tseng V.S. A deep learning approach in diagnosing fungal keratitis based on corneal photographs. Sci Rep 2020; 10(1): 14424, https://doi.org/10.1038/s41598-020-71425-9.
- Hu S., Sun Y., Li J., Xu P., Xu M., Zhou Y., Wang Y., Wang S., Ye J. Automatic diagnosis of infectious keratitis based on slit lamp images analysis. J Pers Med 2023; 13(3): 519, https://doi.org/10.3390/jpm13030519.
- Soleimani M., Esmaili K., Rahdar A., Aminizadeh M., Cheraqpour K., Tabatabaei S.A., Mirshahi R., Bibak Z., Mohammadi S.F., Koganti R., Yousefi S., Djalilian A.R. From the diagnosis of infectious keratitis to discriminating fungal subtypes; a deep learning-based study. Sci Rep 2023; 13(1): 22200, https://doi.org/10.1038/s41598-023-49635-8.
- Koyama A., Miyazaki D., Nakagawa Y., Ayatsuka Y., Miyake H., Ehara F., Sasaki S.I., Shimizu Y., Inoue Y. Determination of probability of causative pathogen in infectious keratitis using deep learning algorithm of slit-lamp images. Sci Rep 2021; 11(1): 22642, https://doi.org/10.1038/s41598-021-02138-w.
- Tiwari M., Piech C., Baitemirova M., Prajna N.V., Srinivasan M., Lalitha P., Villegas N., Balachandar N., Chua J.T., Redd T., Lietman T.M., Thrun S., Lin C.C. Differentiation of active corneal infections from healed scars using deep learning. Ophthalmology 2022; 129(2): 139–146, https://doi.org/10.1016/j.ophtha.2021.07.033.
- Ghosh A.K., Thammasudjarit R., Jongkhajornpong P., Attia J., Thakkinstian A. Deep learning for discrimination between fungal keratitis and bacterial keratitis: deepkeratitis. Cornea 2022; 41(5): 616–622, https://doi.org/10.1097/ICO.0000000000002830.
- Hanif A., Prajna N.V., Lalitha P., NaPier E., Parker M., Steinkamp P., Keenan J.D., Campbell J.P., Song X., Redd T.K. Assessing the impact of image quality on deep learning classification of infectious keratitis. Ophthalmol Sci 2023; 3(4): 100331, https://doi.org/10.1016/j.xops.2023.100331.
- Takhchidi K.P., Gliznitsa P.V., Svetozarskiy S.N., Bursov A.I., Shusterzon K.A. Labelling of data on fundus color pictures used to train a deep learning model enhances its macular pathology recognition capabilities. Bulletin of Russian State Medical University 2021; (4): 28–33, https://doi.org/10.24075/brsmu.2021.040.
- Li D.J., Huang B.L., Peng Y. Comparisons of artificial intelligence algorithms in automatic segmentation for fungal keratitis diagnosis by anterior segment images. Front Neurosci 2023; 17: 1195188, https://doi.org/10.3389/fnins.2023.1195188.
- Redd T.K., Santina L.D., Prajna N.V., Lalitha P., Acharya N., Lietman T. Automated differentiation of bacterial from fungal keratitis using deep learning. Invest Ophthalmol Vis Sci 2021; 62(8): 2161.
- Hung N., Shih A.K.-Y., Lin C., Kuo M.-T., Hwang Y.-S., Wu W.-C., Kuo C.-F., Kang E.Y.-C., Hsiao C.-H. Using slit-lamp images for deep learning-based identification of bacterial and fungal keratitis: model development and validation with different convolutional neural networks. Diagnostics 2021; 11(7): 1246, https://doi.org/10.3390/diagnostics11071246.
- Kuo M.T., Hsu B.W., Lin Y.S., Fang P.C., Yu H.J., Chen A., Yu M.S., Tseng V.S. Comparisons of deep learning algorithms for diagnosing bacterial keratitis via external eye photographs. Sci Rep 2021; 11(1): 24227, https://doi.org/10.1038/s41598-021-03572-6.
- Gu H., Guo Y., Gu L., Wei A., Xie S., Ye Z., Xu J., Zhou X., Lu Y., Liu X., Hong J. Deep learning for identifying corneal diseases from ocular surface slit-lamp photographs. Sci Rep 2020; 10(1): 17851, https://doi.org/10.1038/s41598-020-75027-3.
- Essalat M., Abolhosseini M., Le T.H., Moshtaghion S.M., Kanavi M.R. Interpretable deep learning for diagnosis of fungal and acanthamoeba keratitis using in vivo confocal microscopy images. Sci Rep 2023; 13(1): 8953, https://doi.org/10.1038/s41598-023-35085-9.
- Крутиков В.К., Косогорова Л.А., Якунина М.В., Якунина В.А., Шаров С.В. Стандарты применения искусственного интеллекта в отечественной медицине. Экономика и предпринимательство 2022; 3(140): 1184–1186.