Оценка восстановления кожи после лечения склерозирующего лихена вульвы фракционным CO2-лазером с использованием мультимодальной оптической когерентной томографии
Цель исследования — оценить влияние воздействия фракционного СО2-лазера на кожу вульвы при лечении склерозирующего лихена методом мультимодальной оптической когерентной томографии (ММ ОКТ).
Материалы и методы. В исследование включено 3 клинических случая склерозирующего лихена вульвы (СЛВ), гистологически классифицированного как ранний, ранний с отеком дермы и поздний, и для контроля — 2 пациента без патологии вульвы. Пациентам с СЛВ выполнено 3 процедуры воздействия фракционного СО2-лазера с интервалом в 30–40 дней. У пациентов без патологии вульвы ММ ОКТ-исследование проведено однократно, у пациентов с СЛВ — непосредственно до панч-биопсии, сразу после 1-го сеанса лазерного воздействия и через 1 мес после полного курса лечения в точке наибольшего видимого поражения кожи.
Результаты. Полученные данные демонстрируют, что результат восстановления кожи вульвы через 1 мес после лечения фракционным СО2-лазером зависит от состояния дермы до лечения.
При раннем СЛВ и раннем СЛВ с отеком дермы (случаи 1 и 2) до лечения при ММ ОКТ-исследовании наблюдалось снижение толщины эпидермиса, нарушение контрастности границы эпидермиса и дермы, снижение значений коэффициента затухания ОКТ-сигнала в дерме, снижение плотности сосудистой сети. После лечения отмечалось полное восстановление ММ ОКТ-структуры кожи вульвы, а все вычисляемые по изображениям количественные показатели достигали уровня, характерного для нормальной кожи вульвы. Поздний СЛВ (случай 3) до лечения характеризовался наличием зоны гомогенизации (склероза) дермы, которая четко прослеживалась на ММ ОКТ-изображениях. После лечения полного восстановления ММ ОКТ-структуры кожи вульвы не наблюдалось, зона склероза сохранялась, однако визуально отмечено увеличение плотности кровеносных и лимфатических сосудов в зоне поражения до уровня, характерного для нормальной кожи вульвы.
Заключение. ММ ОКТ может быть предложена в качестве перспективного неинвазивного способа контроля восстановления кожи после лечения СЛВ с помощью фракционного СО2-лазера.
Введение
Оптическая когерентная томография (ОКТ) — ценный неинвазивный метод оптической визуализации ткани на глубину до 2 мм в режиме реального времени. ОКТ функционирует как разновидность «оптической биопсии» в ближнем инфракрасном диапазоне и позволяет визуализировать микроструктуру ткани с разрешением, приближающимся к гистологическому. Многочисленные исследования продемонстрировали широкий спектр использования ОКТ в гинекологии [1], однако в последнее время выделилось новое актуальное направление, связанное с диагностикой заболеваний вульвы и влагалища (вульварной интраэпителиальной неоплазии [2], вульварных дерматозов [2, 3], генитоуринарного менопаузального синдрома [4, 5], пролапса стенок влагалища [6]), а также с контролем лечения данных патологий [5]. По сравнению с гистологическим исследованием ОКТ обладает рядом преимуществ: неинвазивностью, что позволяет изучать структуру ткани прижизненно; возможностью получать информацию в режиме реального времени, проводить исследования во множестве участков и оценивать результаты в динамике. Использование мультимодальной ОКТ (ММ ОКТ) позволяет получать информацию одновременно о состоянии эпителия, дермы, кровеносных и лимфатических сосудов.
Склерозирующий лихен вульвы (СЛВ) — хроническое прогрессирующее иммуноопосредованное воспалительное заболевание кожи вульвы, требующее длительного лечения для достижения и поддержания ремиссии [7]. СЛВ проявляется изнурительными симптомами (зудом, болью в области вульвы, диспареунией, затруднением мочеиспускания, снижением сексуальной активности, появлением трещин и сращений), которые снижают качество жизни женщин [7, 8]. СЛВ с 5% вероятностью является предрасполагающим фактором развития плоскоклеточного рака вульвы [7, 8]. Стандартная терапия (терапия первой и второй линии) заключается в применении топических ультрапотентных глюкокортикоидов или ингибиторов кальциневрина, что облегчает симптомы заболевания, предотвращает сращение тканей вульвы и снижает риск злокачественной трансформации [9, 10]. Адекватное лечение требует четкого соблюдения режима длительного применения препаратов данных групп, при этом у части пациентов зафиксировано рефрактерное течение СЛВ [11]. Хотя терапия первой и второй линии эффективна, перечисленные препараты обладают серьезными местными и системными побочными эффектами, а в ряде случаев стандартное лечение не приносит желаемых результатов [12].
Предложен новый метод лечения с использованием фракционной абляции CO2-лазера [13], который быстро получил распространение в мировой практике. Первоначальные исследования показали улучшение клинических симптомов (особенно сухости и диспареунии), эластичности и васкуляризации кожи вульвы [13, 14]. В дальнейшем такая терапия продемонстрировала лучший контроль симптомов, а также большую удовлетворенность пациентов лечением по сравнению с применением топических глюкокортикоидов [15]. В исследовании D. BalchanderиP. Nyirjesy продемонстрирована эффективность фракционного CO2-лазера в терапии СЛВ, резистентного к глюкокортикоидам [16].
Принцип воздействия фракционного CO2-лазера на биоткани заключается в создании зон микроабляций (испарения), по периферии которых возникают участки термического повреждения ткани [17]. Механизм терапевтического действия фракционного CO2-лазера при СЛВ до конца не установлен. Предполагается, что в результате микроабляций удаляется часть склеротической ткани, а термическое повреждение пограничных участков стимулирует ремоделирование соединительной ткани за счет выработки белков теплового шока. При этом усиливаются пролиферация фибробластов, синтез новых коллагеновых и эластических волокон, увеличивается число кровеносных сосудов [18].
Несмотря на успешное применение данного метода лечения, до сих пор не разработано объективного метода контроля эффективности терапии. Были предприняты попытки анализа гистологических изменений ткани вульвы в ответ на терапию фракционным CO2-лазером. Зафиксировано статистически значимое увеличение толщины эпидермиса и уменьшение зоны склероза, незначимое уменьшение выраженности воспалительного инфильтрата через один месяц после трех процедур лазерного лечения [19]. Однако гистологическое исследование не может быть рекомендовано для стандартной оценки результатов терапии или для контроля за развитием рецидивов в силу инвазивности.
Цель исследования — оценить возможность неинвазивного контроля восстановления структур кожи вульвы после лечения склерозирующего лихена вульвы фракционным СО2-лазером с использованием метода мультимодальной оптической когерентной томографии.
Наши предыдущие исследования продемонстрировали способность ММ ОКТ прижизненно диагностировать СЛВ даже на ранних стадиях, а также дифференцировать различные степени поражения дермы [20]. Кроме того, ММ ОКТ позволила наблюдать ранние гистологические признаки рецидива СЛВ после фотодинамической терапии, что делает ее перспективным методом для неинвазивного контроля пациентов после лечения [21].
Материалы и методы
Пациенты и ММ ОКТ-исследование. Исследование проведено на базе Научного центра акушерства, гинекологии и перинатологии им. академика В.И. Кулакова (Москва) и построено на анализе данных трех клинических случаев гистологически подтвержденного СЛВ. Все пациенты находились в постменопаузе, им проведено лечение фракционным СО2-лазером в амбулаторных условиях. ММ ОКТ-исследование выполняли перед проведением панч-биопсии, сразу после первой процедуры лечения фракционным СО2-лазером, а также через один месяц после полного курса лечения (включает три процедуры с интервалом 30–40 дней). ММ ОКТ-исследование проводили в точке наибольшего видимого поражения ткани на малых половых губах, что соответствовало месту проведения биопсии. Зону исследования помечали медицинским маркером и фиксировали на фото. Однократное ММ ОКТ-исследование выполнено в области малых половых губ у двух пациенток в постменопаузе (возраст — 68 лет и 73 года) без патологии вульвы.
ММ ОКТ-исследование абсолютно безболезненно и не требует применения анестезии.
Исследование одобрено локальным этическим комитетом НМИЦ АГП им. В.И. Кулакова (протокол №08 от 21 сентября 2023 г.). Все пациентки подписали информированное согласие на проведение лечения и исследования.
Лечение фракционным CO2-лазером. Лечение пациентов осуществляли с использованием отечественного хирургического СО2-лазерного аппарата «Л’Мед-1» («Русский инженерный клуб», Тула; рег. удостоверение РЗН 2014/1923). Обработку кожи вульвы выполняли в режиме фракционной абляции. Курс состоял из трех процедур с интервалом 30–40 дней. Параметры воздействия первой процедуры: длительность суперимпульса — 900 мкс; плотность заполнения — 150 микроучастков на 1 см2; количество импульсов в точку — 1; глубина проникновения излучения в ткань — 1100 мкм. Вторую и третью процедуру проводили со следующими параметрами: длительность суперимпульса — 900 мкс; плотность заполнения — 150 микроучастков на 1 см2; количество импульсов в точку — 2; глубина проникновения излучения в ткань — 1400 мкм. Размер зоны фракционного сканирования составлял 9×9 мм, диаметр микроучастка абляции — 300 мкм. Подробнее принцип выбора параметров фракционного СО2-лазера описан в работах [22, 23].
Перед проведением лазерного воздействия проводили однократную санацию вульвы и влагалища с помощью низкочастотной ультразвуковой кавитации водным растровом хлоргексидина, затем на кожу вульвы наносили аппликационную анестезию (прилокаин 25 мг + лидокаин 25 мг) с экспозицией 60 мин. Зона лечения включала область вульвы и прианальную область, обрабатывалась вся площадь ткани однократно, обработанные области не накладывались друг на друга.
Мультимодальная оптическая когерентная томография. В данном исследовании использовали спектральную мультимодальную ОКТ-систему «ОКТ 1300-Е» («Биомедтех», Россия; рег. удостоверение ФСР 2012/13479), оснащенную гибким волоконно-оптическим зондом контактного типа, длина контактной части зонда — 5 см, диаметр — 1 см. Для точного позиционирования зонда на ткани используется шарнирный штатив.
ОКТ-система работает на центральной длине волны 1310 нм с шириной спектра 100 нм. Скорость визуализации составляет 20 000 А-сканов/с, разрешение по глубине — 10 мкм, поперечное разрешение — 15 мкм. ОКТ-система создает набор 3D-данных за 26 с, который состоит по глубине из 256 пикселей (2 мм в воздухе) и 512×512 пикселей в горизонтальной плоскости (3,4×3,4 мм).
Из 3D-набора данных в режиме реального времени строятся структурные ОКТ-изображения поперечного сечения (В-скан) в ко- и кросс-поляризации, ОКТ-ангиографическое изображение в проекции en face и ОКТ-лимфангиографические изображения в той же проекции en face (рис. 1, а).
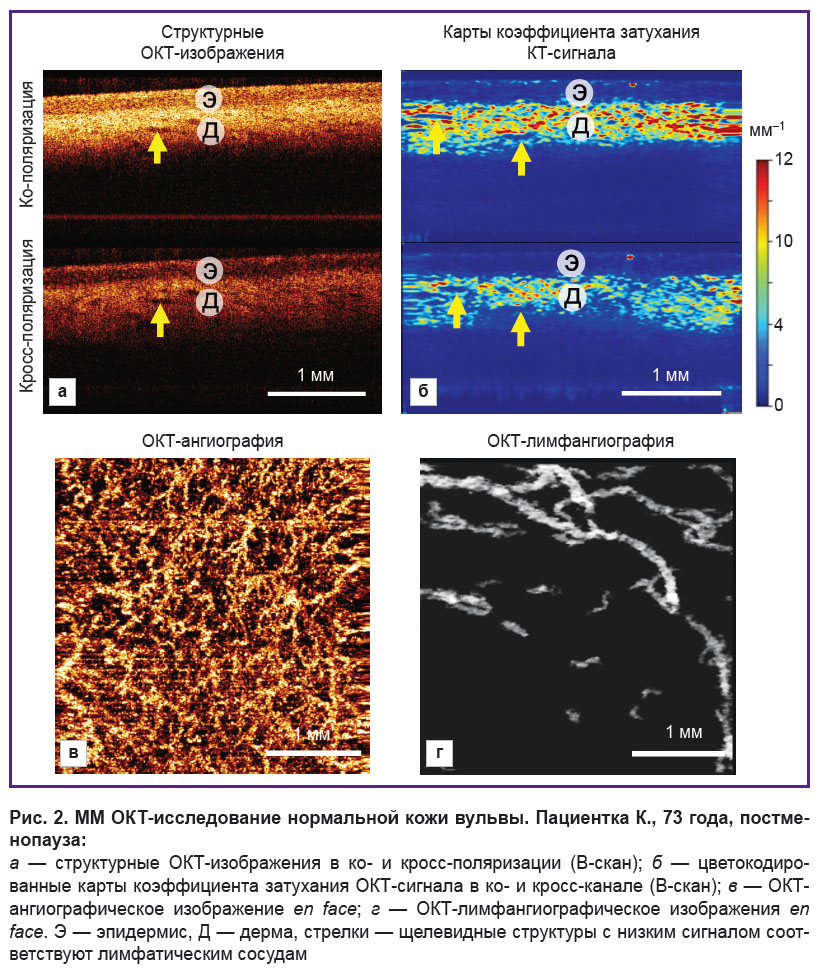
Структурные изображения представлены как два сопряженных В-скана: в ко- и кросс-поляризациях (рис. 2, а). Особенностью кросс-канала ОКТ является чувствительность к анизотропным (изменяющим направление поляризации света) структурам, таким как коллагеновые пучки дермы и кератинизированный (роговой) слой эпидермиса (рис. 2, б).
ОКТ-ангиография основана на оценке вариаций спеклов ОКТ-сигнала, которая фиксирует 3D-картину микроциркуляторного русла ткани на глубину проникновения ОКТ-сигнала. Используется алгоритм, обеспечивающий компенсацию движений зонда, а также дыхательных и сердечных движений пациента. ОКТ-лимфангиография использует алгоритм, основанный на трехмерном распределении коэффициента затухания ОКТ-сигнала с разрешением по глубине. Полученные трехмерные сосудистые сети представлены на двухмерных изображениях в проекции максимальной интенсивности для кровеносных сосудов и средней интенсивности — для лимфатических сосудов в диапазоне глубины дермы 0–350 мкм.
Дополнительно строятся цветокодированные карты распределения коэффициента затухания ОКТ-сигнала в ткани в проекции В-скан (рис. 1, б). Такое представление коэффициента затухания ОКТ-сигнала повышает контрастность и улучшает визуализацию структур ткани по сравнению со структурными ОКТ-изображениями. Расчет коэффициента затухания ОКТ-сигнала является объективным и общепринятым подходом, который описывает потерю ОКТ-сигнала с глубиной из-за рассеяния и поглощения зондирующего излучения [24].
Визуальная оценка ММ ОКТ-изображений. При оценке структурных ОКТ-изображений кожи и карт коэффициента затухания ОКТ-сигнала описывается слоистая структура данного органа (формируется за счет эпидермиса и подлежащей волокнистой соединительной ткани — дермы). Можно выделить следующие ОКТ-признаки:
толщина первого слоя (эпидермиса) может быть как увеличена за счет гипертрофии или акантоза эпидермиса, так и снижена в результате атрофии;
высокий сигнал на поверхности первого слоя (соответствует роговому слою эпидермиса) обусловлен гиперкератозом (ортокератозом или паракератозом);
граница между первым (эпидермисом) и вторым слоем (дермой) может быть контрастной или менее контрастной. Данный параметр зависит от совокупного состояния эпидермиса и дермы. Контраст формируется за счет более низкого уровня ОКТ-сигнала от эпидермиса и более высокого уровня ОКТ-сигнала от дермы (рис. 2, а, б). Контрастность границы может быть увеличена при повышении уровня ОКТ-сигнала от дермы (например, в результате сниженного количества лимфатических сосудов в дерме). Контраст может быть снижен в нескольких случаях: за счет повышения уровня ОКТ-сигнала от эпидермиса (например, в результате гипергранулеза — повышенного накопления гранул кератогиалина в кератиноцитах) или за счет снижения ОКТ-сигнала от дермы (в результате гомогенизации коллагеновых пучков и/или отека поверхностной дермы при СЛВ, а также в результате выраженного клеточного воспалительного инфильтрата);
наличие и количество щелевидных структур в дерме с низким уровнем ОКТ-сигнала (соответствуют лимфатическим сосудам), которое может быть снижено, например при СЛВ.
При оценке ангиографических и лимфангиографических ОКТ-изображений (в проекции en face) кожи можно визуально оценить количество и плотность расположения в дерме кровеносных и лимфатических сосудов. Их количество при СЛВ обычно снижено по сравнению с нормой.
Количественная оценка ОКТ-данных. Разработанное нашей группой программное обеспечение для анализа данных ОКТ позволяет получать количественные значения коэффициента затухания ОКТ-сигнала, а также плотности сети кровеносных и лимфатических сосудов на заданной глубине объема 3D-данных.
Для расчета коэффициента затухания ОКТ-сигнала применяли метод с разрешением по глубине, предложенный K.A. Vermeer [25] и модифицированный A. Moiseev [26]. Распределение значений коэффициента затухания для каждого набора данных ОКТ представлено в виде цветокодированных карт (В-скан). Минимальное и максимальное значения цветокодированной шкалы (синий и красный соответственно) были выбраны с учетом оптимального контраста (диапазон значений 0–12 мм–1). Количественные значения рассчитаны для всей площади дермы и представлены как среднее значение ± стандартное отклонение (по одному кадру).
Количественную оценку плотности сети кровеносных и лимфатических сосудов проводили на двумерных картах, построенных в исследуемом диапазоне глубин (0–350 мкм). Рассчитывали суммарную площадь всех визуализируемых сосудов на единицу площади двумерных карт, при этом диаметр просвета сосуда вычисляли как удвоенное расстояние между границей бинарного изображения сосуда и его скелетом. Сосудам с перекрывающимися бинарными границами и скелетами была присвоена толщина в 1 пиксель [27]. Для латерального разрешения используемого метода ОКТ это соответствует диаметру сосуда менее 15 мкм.
Толщину эпидермиса рассчитывали по цветокодированным картам коэффициента затухания ОКТ-сигнала путем измерения от поверхности эпидермиса до границы с дермой в 5 участках, значения представлены как среднее значение ± стандартное отклонение.
Гистологический анализ. Гистологическое исследование проводили до лечения с целью диагностики, оценки степени поражения дермы при СЛВ, а также для верификации полученных ОКТ-данных. Гистологическую структуру кожи оценивали с помощью окрашивания пикрофуксином по методу Ван-Гизона: коллагеновые волокна приобретают малиново-красный цвет, ядра клеток — черный цвет, другие тканевые элементы — желтый цвет. Данная окраска более информативна, чем стандартное окрашивание гематоксилином и эозином в случае оценки структурных изменений коллагеновых волокон дермы. Анализ гистологических препаратов осуществляли с использованием автоматизированной системы визуализации EVOS M7000 (Thermo Fisher Scientific, США).
Результаты и обсуждение
ММ ОКТ-исследование кожи вульвы без патологии в постменопаузу. Строение нормальной ткани вульвы зависит от анатомической области и от наступления менопаузы, что важно учитывать при анализе ММ ОКТ-данных. В зависимости от локализации нормальная ткань вульвы может быть представлена волосистой кожей, безволосой кожей или гликогенированной слизистой оболочкой. Ранее мы демонстрировали ММ ОКТ-характеристику с гистологической верификацией как нормальной слизистой оболочки вульвы [28], так и кожи вульвы [20]. Известно, что кожа вульвы является гормонозависимой тканью, что ожидаемо приводит к изменению строения после наступления менопаузы [29]. В данной статье мы рассматриваем строение безволосой кожи вульвы малых половых губ в постменопаузу.
Безволосая кожа вульвы характеризуется слоистостью, которая наблюдается на структурных ОКТ-изображениях и соответствующих им картах коэффициента затухания ОКТ-сигнала (рис. 2, а, б). Эпидермис имеет толщину 167±25 мкм. Граница между эпидермисом и дермой контрастная. Дерма обладает высоким уровнем сигнала и высокими значениями коэффициента затухания в ко- и кросс-канале (5,9±1,7 и 3,1±1,2 мм–1 соответственно). В дерме присутствуют щелевидные структуры с низким сигналом — лимфатические сосуды (рис. 2, а, б, стрелки). ОКТ-ангиография демонстрирует многочисленные кровеносные сосуды разного диаметра (рис. 2, в), которые расположены в ткани с высокой плотностью — (3,7±0,3)·10–4 усл. ед. ОКТ-лимфангиография демонстрирует лимфатические сосуды более крупного диаметра, чем кровеносные (рис. 2, г), их плотность — (4,5±0,6)·10–2 усл. ед.
ММ ОКТ и гистологическое исследование кожи вульвы при склерозирующем лихене. СЛВ за время течения болезни меняет морфологическую структуру ткани вульвы. Принято выделять ранний и поздний варианты СЛВ клинически и гистологически. Клиническое деление основано на структурных изменениях анатомии вульвы, которые происходят на поздней стадии (сужение входа во влагалище, слияние или атрофия половых губ, склероз капюшона клитора и др.) [30, 31]. Гистологическое деление основано на оценке изменений дермы, которые на поздней стадии приводят к ее склерозу (гомогенизации) [32]. Гистологическая классификация учитывает микроструктуру ткани и подходит для интерпретации ММ ОКТ-данных, однако не всегда соответствует клинической классификации.
В данной работе мы рассматриваем три клинических случая, которые гистологически были идентифицированы как ранний, ранний с выраженным отеком дермы и поздний вариант СЛВ. Во всех случаях пациентки находились в постменопаузе.
Клинический случай 1. Ранний склерозирующий лихен вульвы (пациентка К., 72 года). Краткое клиническое описание: длительность симптомов — 1 мес; предъявляет жалобы на выраженный зуд и жжение в области больших половых губ, ануса, которые усиливаются к вечеру; при визуальном осмотре отмечены участки побеления кожи вульвы и перианальной области, экскориации.
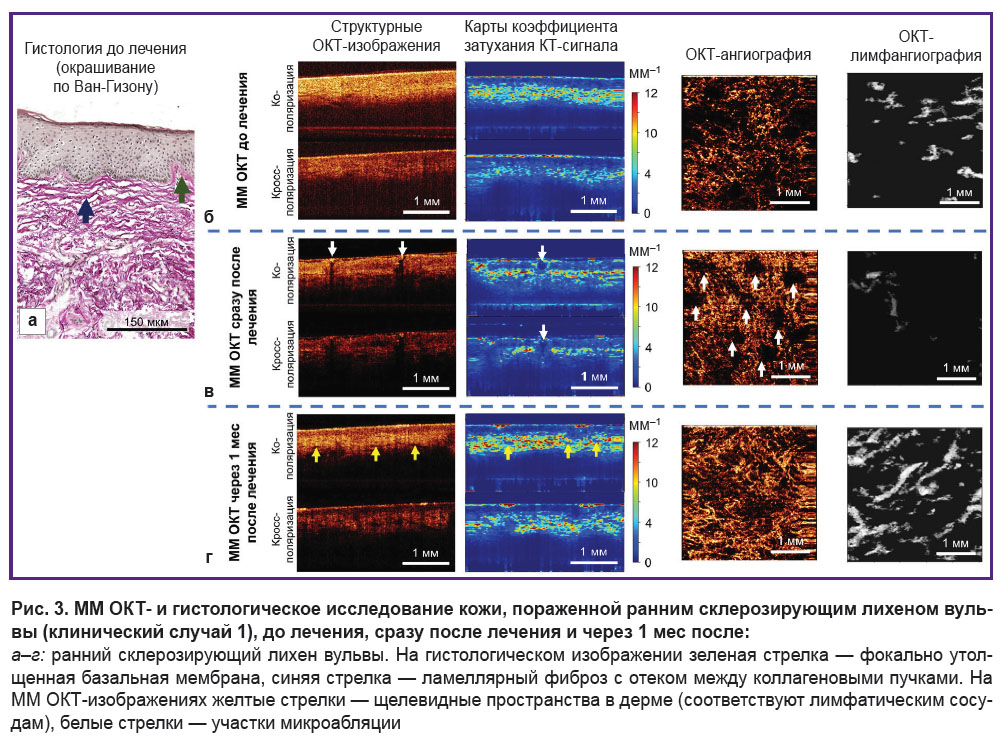
Гистологическое исследование демонстрирует стандартные признаки раннего СЛВ. Эпидермис — нормальной толщины, с ортокератозом; количество эпидермальных сосочков снижено, единичные базальные кератиноциты вакуолизированы. Наблюдается очаговое утолщение базальной мембраны (рис. 3, а, зеленая стрелка). Непосредственно под эпидермисом расположены длинные, извилистые, утолщенные коллагеновые пучки (рис. 3, а, синяя стрелка), пространства между пучками расширены за счет умеренного отека. Признаки формирования склеротической зоны отсутствуют. Присутствует слабый лихеноидный лимфоцитарный воспалительный инфильтрат.
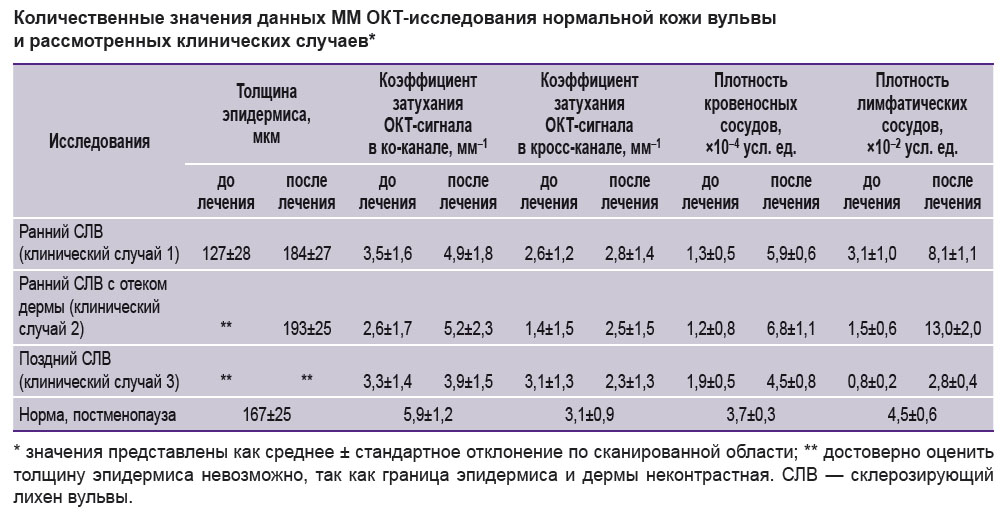
При ММ ОКТ-исследовании наблюдаются значительные изменения структуры ткани в сравнении с нормой (рис. 3, б). На структурных ОКТ-изображениях контрастность границы эпидермиса и дермы снижена как в ко-, так и в кросс-канале. Карты коэффициента затухания ОКТ-сигнала являются более информативными, что позволяет наблюдать как достаточно контрастную границу между эпидермисом и дермой, так и роговой слой с высокими значениями коэффициента затухания. Толщина эпидермиса снижена (127±28 мкм). Коэффициент затухания дермы как в ко- (3,5±1,6 мм–1), так и в кросс-канале (2,6±1,2 мм–1) снижен по сравнению с нормой. Щелевидные структуры (лимфатические сосуды) в дерме практически отсутствуют. ОКТ-лимфангиография демонстрирует наличие единичных лимфатических сосудов в ткани (плотность — (3,1±1,0)·10–2 усл. ед.). ОКТ-ангиография демонстрирует резко сниженную плотность кровеносных сосудов в ткани — (1,3±0,5)·10–4 усл. ед.
Клинический случай 2. Ранний склерозирующий лихен вульвы с отеком дермы (пациентка С., 59 лет).
Краткое клиническое описание: длительность симптомов заболевания — 2 года. Жалобы на длительно существующий зуд в области вульвы, отмечает появление зуда в области клитора, сухость и стянутость кожи. При визуальном осмотре: малые половые губы деформированы, уменьшены в размерах, наблюдаются участки побеления кожи.
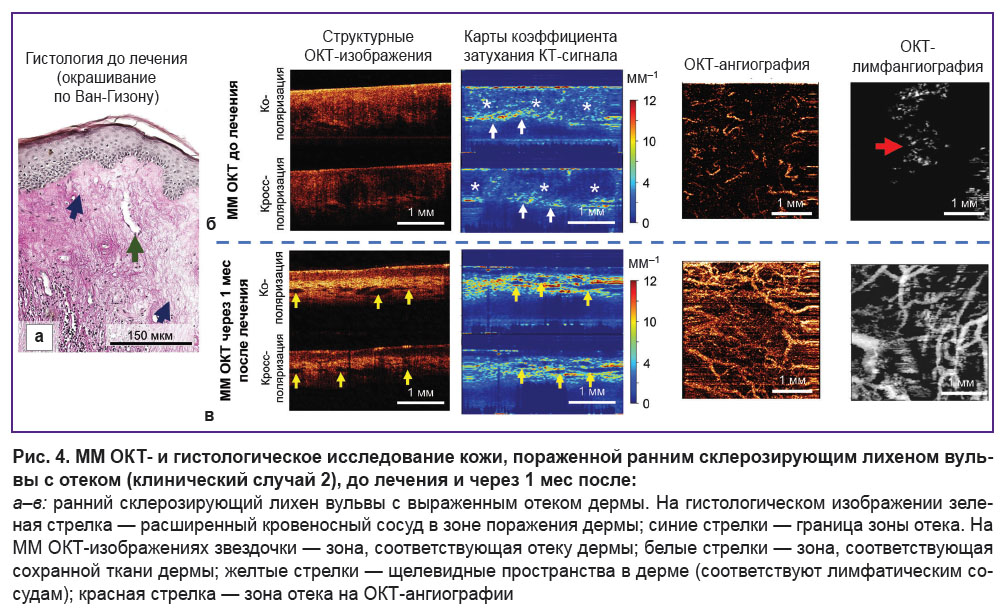
Гистологическое исследование демонстрирует картину, характерную для раннего СЛВ с отеком дермы (рис. 4, а), — атрофия эпидермиса с ортокератозом, количество эпидермальных сосочков снижено. Наблюдаются дегенерация базальных кератиноцитов с их вакуолизацией, а также утолщение базальной мембраны на всем протяжении биоптата. Поверхностная дерма состоит из большого количества довольно тонких коллагеновых пучков, наблюдается выраженный отек дермы (рис. 4, а, синие стрелки). Кровеносные сосуды в зоне поражения единичные, просветы их расширены, стенки утолщены (рис. 4, а, зеленая стрелка).
ММ ОКТ-исследованиев сравнении с ранним СЛВ (клинический случай 1)демонстрирует особенности структуры, связанные с отеком дермы. Так, на картах коэффициента затухания ОКТ-сигнала визуализируется зона отека (рис. 4, б, звездочки), содержащая тонкие коллагеновые пучки, расположенные с низкой плотностью. Значения коэффициента затухания резко снижены как в ко-канале (2,6±1,7 мм–1), так и в кросс-канале (1,4±1,5 мм–1). Ниже зоны отека наблюдается зона с сохранными коллагеновыми волокнами (рис. 4, б, белые стрелки) и высокими значениями коэффициента затухания ОКТ-сигнала. На лимфангиографических ОКТ-изображениях отек визуализируется как «облако» (рис. 4, б, красная стрелка). Визуализация отека на лимфангиографических ОКТ-изображениях связана со слабым рассеиванием света как лимфой, так и отечной жидкостью.
Клинический случай 3. Поздний склерозирующий лихен вульвы (пациентка Г., 55 лет). Краткое клиническое описание: длительность симптомов заболевания — 4 года; жалобы на умеренный зуд в области вульвы, перианальной области, сухость вульвы; при визуальном осмотре: атрофия малых и больших половых губ, трещины задней спайки, побеление кожи вульвы и перианальной области в виде «замочной скважины».
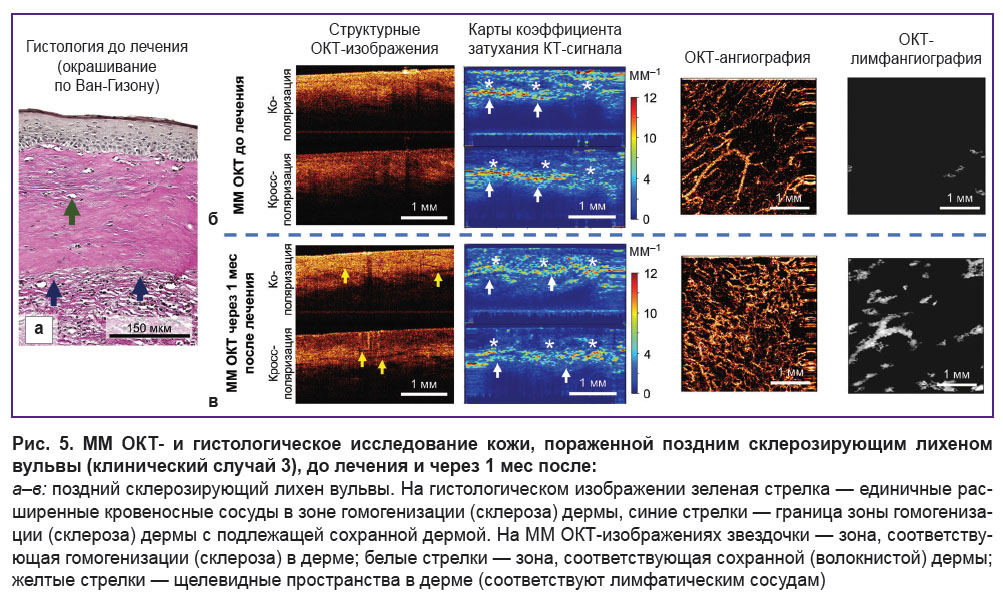
Гистологическое исследование демонстрирует классическую патогномоничную картину для позднего СЛВ (рис. 5, а). Наблюдаются выраженная атрофия эпидермиса (эпидермальные сосочки отсутствуют), спонгиоз и вакуолизация базальных кератиноцитов. Непосредственно под эпидермисом присутствует широкая зона гомогенизации коллагеновых пучков — зона склероза (рис. 5, а, синие стрелки). Ниже зоны склероза дерма содержит сохранные коллагеновые пучки и маловыраженный лимфоцитарный воспалительный инфильтрат. Кровеносные сосуды в зоне склероза — единичные, расширены, с утолщенной стенкой.
ММ ОКТ-исследованиев сравнении с ранним СЛВ (клинический случай 1)демонстрируетособенности, связанные с образованием зоны склероза дермы. Так, на картах коэффициента затухания ОКТ-сигнала зона склероза (рис. 5, б, звездочки)имеет сниженные значения как в ко- (3,3±1,4 мм–1), так и в кросс-канале (3,1±1,3 мм–1), что связано с потерей как рассеивающих, так и анизотропных свойств гомогенизированной (склеротической) дермы. Ниже склеротической ткани лежит дерма с сохранными коллагеновыми пучками, которая обладает высокими значениями коэффициента затухания и образует с ней четкую, контрастную границу (рис. 5, б, белые стрелки).
ММ ОКТ-контроль за восстановлением кожи через 1 мес после курса лечения фракционным СО2-лазером. Непосредственно после фракционного лазерного воздействия на структурных ОКТ-изображениях и картах коэффициента затухания ОКТ-сигнала можно наблюдать участки микроабляции (испарения) кожи вульвы. Участки микроабляции обладают низким ОКТ-сигналом и низкими значениями его коэффициента затухания (рис. 3, в, белые стрелки). Их диаметр составляет 285–300 мкм. На ангиографическом ОКТ-изображении в участках микроабляции отсутствуют кровеносные сосуды, а между ними наблюдается увеличение плотности кровеносных сосудов ((2,4±0,5)·10–4 усл. ед.) относительно состояния до воздействия ((1,3±0,5)·10–4 усл. ед.). По всей вероятности, это связано с вазодилатацией и увеличением количества функционирующих сосудов микроциркуляторного русла.
Через 1 мес после курса лечения фракционным СО2-лазером ММ ОКТ-исследование выявило значительные изменения кожи вульвы, которые зависели от исходного состояния ткани при СЛВ.
Клинический случай 1. Ранний склерозирующий лихен вульвы. Краткое клиническое описание: пациентка отмечает полное отсутствие симптомов заболевания; при визуальном осмотре вульвы участки побеления кожи стали менее заметны, кожа приобрела более физиологическую окраску.
ММ ОКТ-исследование показало улучшение контраста границы эпидермиса и дермы как на структурных ОКТ-изображениях, так и на картах коэффициента затухания ОКТ-сигнала. Ороговевающий слой сохраняется, хоть и менее выражен, чем до лечения. Толщина эпидермиса — 184±27 мкм. В дерме появляются щелевидные пространства — лимфатические сосуды (рис. 3, г, желтые стрелки). Значения коэффициента затухания в дерме увеличиваются по сравнению с состоянием до лечения как в ко- (4,9±1,8 мм–1) так и в кросс-канале (2,8±1,4 мм–1) и приближаются к значениям, установленным для нормальной кожи, что свидетельствует о восстановлении структуры дермы. ОКТ-ангиография и лимфангиография демонстрируют повышение плотности кровеносных и лимфатических сосудов в ткани ((5,9±0,6)·10–4 и (8,1±1,1)·10–2 усл. ед. соответственно), что приближается к значениям, установленным для нормальной кожи вульвы (см. таблицу).
|
Количественные значения данных ММ ОКТ-исследования нормальной кожи вульвы и рассмотренных клинических случаев* |
Клинический случай 2. Ранний склерозирующий лихен вульвы с отеком дермы. Краткое клиническое описание:пациентка отмечает снижение зуда вульвы, зуд в области клитора отсутствует, ощущение сухости и стянутости вульвы отсутствует. При визуальном осмотре: деформация малых половых губ сохраняется, однако окраска кожи имеет более физиологический вид.
ММ ОКТ-картина восстановления кожи вульвы полностью соответствует клиническому случаю 1 (рис. 4, б, таблица), признаки отека дермы как на картах коэффициента затухания ОКТ-сигнала, так и на ангиографических ОКТ-изображениях отсутствуют.
Клинический случай 3. Поздний склерозирующий лихен вульвы. Краткое клиническое описание: пациентка отмечает некоторое уменьшение зуда вульвы и перианальной области, симптом сухости отсутствует; при визуальном осмотре атрофия малых и больших половых губ сохраняется, трещины задней спайки отсутствуют, побеление кожи вульвы и перианальной области сохраняется.
ММ ОКТ-исследование продемонстрировало, чтоконтрастность дерма-эпидермальной границы не восстанавливается. На картах коэффициента затухания сохраняется зона с низкими значениями как в ко- (3,9±1,5 мм–1), так и в кросс-канале (2,3±1,3 мм–1), соответствующая зоне склероза дермы. Однако ОКТ-ангиография и лимфангиография демонстрируют повышение плотности кровеносных и лимфатических сосудов в ткани ((4,5±0,8)·10–4 и (2,8±0,4)·10–2 усл. ед.) относительно состояния до лечения, что свидетельствует о реваскуляризации зоны склероза.
Таким образом, впервые проведенная ММ ОКТ-оценка качественных и количественных изменений кожи при раннем и позднем СЛВ до лечения и через 1 мес после трех процедур воздействия фракционным СО2-лазером продемонстрировала, что результат восстановления кожи вульвы зависит от степени повреждения дермы до начала лечения. При раннем СЛВ, когда поражение сосредоточено в области дермо-эпидермального соединения, после курса лечения наблюдается полное восстановление ММ ОКТ-структуры кожи до ее физиологического цвета. Отмечено восстановление значений коэффициента затухания ОКТ-сигнала в ко- и кросс-канале, а также плотности кровеносных и лимфатических сосудов до уровня, характерного для нормальной кожи вульвы. При позднем СЛВ, когда поражение представлено обширной зоной склероза, полного восстановления ММ ОКТ-структуры кожи вульвы не наблюдается. При визуальном осмотре атрофия структур вульвы сохраняется, однако имеет место разрешение трещин, что, по всей вероятности, связано с увеличением эластичности ткани. Через 1 мес после курса лечения зона склероза сохраняется, в то же время наблюдается увеличение плотности кровеносных и лимфатических сосудов в дерме, которая также достигала уровня, характерного для нормальной кожи.
Ограничения исследования. Недостатком данного исследования является короткий срок наблюдения за восстановлением кожи после лечения и небольшое число пациентов. Однако срока в 1 мес достаточно, чтобы прошел период регенерации кожи после терапии фракционным СО2-лазером [33]. Дальнейший мониторинг (через 3, 6 и 12 мес) стоит проводить с целью контроля развития рецидива СЛВ, как продемонстрировано в наших исследованиях на примере фотодинамической терапии СЛВ [21]. Продолжение исследования подразумевает увеличение выборки пациентов и проведение статистического анализа.
Заключение
ММ ОКТ-исследование кожи вульвы продемонстрировало положительный эффект от использования терапии фракционным СО2-лазером склерозирующего лихена вульвы на толщину эпидермиса, состояние коллагеновых пучков дермы, а также на плотность сети кровеносных и лимфатических сосудов. При этом наблюдался разный результат восстановления кожи после терапии в зависимости от исходной степени поражения дермы. Так, при раннем склерозирующем лихене вульвы все исследуемые параметры достигали уровня, характерного для нормальной кожи вульвы, при позднем отмечался минимальный эффект на гомогенизированные коллагеновые пучки в зоне склероза, однако увеличивалась плотность кровеносной и лимфатической сети. Таким образом, ММ ОКТ может быть предложена в качестве перспективного неинвазивного способа контроля восстановления кожи после фракционного СО2-лазерного лечения склерозирующего лихена вульвы.
Конфликт интересов. Авторы заявляют об отсутствии возможных конфликтов интересов.
Финансирование. Исследование выполнено при финансовой поддержке Российского научного фонда, соглашение №19-75-10084.
Литература
- Kirillin M., Motovilova T., Shakhova N. Optical coherence tomography in gynecology: a narrative review. J Biomed Opt 2017; 22(12): 1–9, https://doi.org/10.1117/1.JBO.22.12.121709.
- Huisman B.W., Pagan L., Naafs R.G.C., Ten Voorde W., Rissmann R., Piek J.M.J., Damman J., Juachon M.J., Osse M., Niemeyer-van der Kolk T., van Hees C.L.M., van Poelgeest M.I.E. Dermatoscopy and optical coherence tomography in vulvar high-grade squamous intraepithelial lesions and lichen sclerosus: a prospective observational trial. J Low Genit Tract Dis 2023; 27(3): 255–261, https://doi.org/10.1097/LGT.0000000000000731.
- Xu L., Ma Q., Lin S., Ju J., Feng S., Shi Z., Bai Y., Song J., Du J., Wang B. Study on the application and imaging characteristics of optical coherence tomography in vulva lesions. Sci Rep 2022; 12(1): 3659, https://doi.org/10.1038/s41598-022-07634-1.
- Sudol N.T., Miao Y., Li Y., Chen J.J., Jing J.C., Zhu J., Tadir Y., Chen Z., Lane F. Optical vaginal biopsy using optical coherence tomography. Female Pelvic Med Reconstr Surg 2020; 26(2): 155–158, https://doi.org/10.1097/SPV.0000000000000839.
- Miao Y., Sudol N.T., Li Y., Chen J.J., Arthur R.A., Qiu S., Jiang Y., Tadir Y., Lane F., Chen Z. Optical coherence tomography evaluation of vaginal epithelial thickness during CO2 laser treatment: a pilot study. J Biophotonics 2022; 15(11): e202200052, https://doi.org/10.1002/jbio.202200052.
- Gubarkova E., Potapov A., Moiseev A., Kiseleva E., Krupinova D., Shatilova K., Karabut M., Khlopkov A., Loginova M., Radenska-Lopovok S., Gelikonov G., Grechkanev G., Gladkova N., Sirotkina M. Depth-resolved attenuation mapping of the vaginal wall under prolapse and after laser treatment using cross-polarization optical coherence tomography: a pilot study. Diagnostics (Basel) 2023; 13(22): 3487, https://doi.org/10.3390/diagnostics13223487.
- De Luca D.A., Papara C., Vorobyev A., Staiger H., Bieber K., Thaçi D., Ludwig R.J. Lichen sclerosus: the 2023 update. Front Med (Lausanne) 2023; 10: 1106318, https://doi.org/10.3389/fmed.2023.1106318.
- Аполихина И.А., Соколова А.В., Гумова З.Д. Склероатрофический лишай наружных половых органов: ведущие причины, клиника, диагностика и лечение. Медицинский оппонент 2018; 2: 77–82.
- Kirtschig G., Becker K., Günthert A., Jasaitiene D., Cooper S., Chi C.C., Kreuter A., Rall K.K., Aberer W., Riechardt S., Casabona F., Powell J., Brackenbury F., Erdmann R., Lazzeri M., Barbagli G., Wojnarowska F. Evidence-based (S3) guideline on (anogenital) lichen sclerosus. J Eur Acad Dermatol Venereol 2015; 29(10): e1–e43, https://doi.org/10.1111/jdv.13136.
- Аполихина И.А., Плахова К.И., Соколова А.В., Чернуха Л.В. Склерозирующий лихен вульвы. Акушерство и гинекология 2020; S9: 8–13.
- Lee A., Bradford J., Fischer G. Long-term management of adult vulvar lichen sclerosus: a prospective cohort study of 507 women. JAMA Dermatol 2015; 151(10): 1061–1067, https://doi.org/10.1001/jamadermatol.2015.0643.
- van Cranenburgh O.D., Nijland S.B.W., Lindeboom R., de Korte J., de Rie M.A., Ter Stege J.A., Prinsen C.A.C. Patients with lichen sclerosus experience moderate satisfaction with treatment and impairment of quality of life: results of a cross-sectional study. Br J Dermatol 2017; 176(6): 1508–1515, https://doi.org/10.1111/bjd.15125.
- Baggish M.S. Fractional CO2 laser treatment for vaginal atrophy and vulvar lichen sclerosus. Journal of Gynecologic Surgery 2016; 32(6): 309–317.
- Аполихина И.А., Соколова А.В., Балашов И.С., Чернуха Л.В., Ермакова Е.И. Лечение склерозирующего лихена вульвы фракционным CO2-лазером: проспективное клиническое исследование. Акушерство и гинекология: новости, мнения, обучение 2020; 8(2): 48–58.
- Burkett L.S., Siddique M., Zeymo A., Brunn E.A., Gutman R.E., Park A.J., Iglesia C.B. Clobetasol compared with fractionated carbon dioxide laser for lichen sclerosus: a randomized controlled trial. Obstet Gynecol 2021; 137(6): 968–978, https://doi.org/10.1097/AOG.0000000000004332.
- Balchander D., Nyirjesy P. Fractionated CO2 laser as therapy in recalcitrant lichen sclerosus. J Low Genit Tract Dis 2020; 24(2): 225–228, https://doi.org/10.1097/LGT.0000000000000512.
- Omi T., Numano K. The role of the CO2 laser and fractional CO2 laser in dermatology. Laser Ther 2014; 23(1): 49–60, https://doi.org/10.5978/islsm.14-RE-01.
- Orringer J.S., Sachs D.L., Shao Y., Hammerberg C., Cui Y., Voorhees J.J., Fisher G.J. Direct quantitative comparison of molecular responses in photodamaged human skin to fractionated and fully ablative carbon dioxide laser resurfacing. Dermatol Surg 2012; 38(10): 1668–1677, https://doi.org/10.1111/j.1524-4725.2012.02518.x.
- Dieter A.A., Iglesia C.B., Lee J.H., Etcheverry M.J., Gonzales M.K., Sokol A.I., Tefera E., Cardis M.A. A prospective pilot study to assess for histologic changes on vulvar biopsies in postmenopausal women with lichen sclerosus treated with fractionated CO2 laser therapy. Lasers Surg Med 2023; 55(6): 521–527, https://doi.org/10.1002/lsm.23669.
- Potapov A.L., Loginova M.M., Moiseev A.A., Radenska-Lopovok S.G., Kuznetsov S.S., Kuznetsova I.A., Mustafina N.N., Safonov I.K., Gladkova N.D., Sirotkina M.A. Cross-polarization optical coherence tomography for clinical evaluation of dermal lesion degrees in vulvar lichen sclerosus. Sovremennye tehnologii v medicine 2023; 15(1): 53, https://doi.org/10.17691/stm2023.15.1.06.
- Potapov A., Matveev L., Moiseev A., Sedova E., Loginova M., Karabut M., Kuznetsova I., Levchenko V., Grebenkina E., Gamayunov S., Radenska-Lopovok S., Sirotkina M., Gladkova N. Multimodal OCT control for early histological signs of vulvar lichen sclerosus recurrence after systemic PDT: pilot study. Int J Mol Sci 2023; 24(18): 13967, https://doi.org/10.3390/ijms241813967.
- Горбунова Е.А., Аполихина И.А., Рамазанова М.О. Применение фракционного фототермолиза CO2-лазером в гинекологической практике. Акушерство и гинекология 2023; 7: 155–161, https://doi.org/10.18565/aig.2023.176.
- Аполихина И.А., Соколова А.В., Плахова К.И., Чернуха Л.В., Саидова А.С. Способ лечения склероатрофического лихена вульвы у женщин. Патент РФ 2755805C1. 2021.
- Gong P., Almasian M., van Soest G., de Bruin D., van Leeuwen T., Sampson D., Faber D. Parametric imaging of attenuation by optical coherence tomography: review of models, methods, and clinical translation. J Biomed Opt 2020; 25(4): 1–34, https://doi.org/10.1117/1.JBO.25.4.040901.
- Vermeer K.A., Mo J., Weda J.J., Lemij H.G., de Boer J.F. Depth-resolved model-based reconstruction of attenuation coefficients in optical coherence tomography. Biomed Opt Express 2013; 5(1): 322–337, https://doi.org/10.1364/BOE.5.000322.
- Moiseev A., Sherstnev E., Kiseleva E., Achkasova K., Potapov A., Yashin K., Sirotkina M., Gelikonov G., Matkivsky V., Shilyagin P., Ksenofontov S., Bederina E., Medyanik I., Zagaynova E., Gladkova N. Depth-resolved method for attenuation coefficient calculation from optical coherence tomography data for improved biological structure visualization. J Biophotonics 2023; 16(12):e202100392, https://doi.org/10.1002/jbio.202100392.
- Maslennikova A.V., Sirotkina M.A., Moiseev A.A., Finagina E.S., Ksenofontov S.Y., Gelikonov G.V., Matveev L.A., Kiseleva E.B., Zaitsev V.Y., Zagaynova E.V., Feldchtein F.I., Gladkova N.D., Vitkin A. In-vivo longitudinal imaging of microvascular changes in irradiated oral mucosa of radiotherapy cancer patients using optical coherence tomography. Sci Rep 2017; 7(1): 16505, https://doi.org/10.1038/s41598-017-16823-2.
- Потапов А.Л., Коновалова Е.А., Сироткина М.А., Вагапова Н.Н., Сафонов И.К., Тимакова А.А., Раденска-Лоповок С.Г., Кузнецов С.С., Загайнова Е.В., Кузнецова И.А., Гладкова Н.Д. Новый метод мультимодальной оптической когерентной томографии для диагностики склеротического лихена вульвы. Акушерство и гинекология 2020; 12: 169–176, https://doi.org/10.18565/aig.2020.12.169-176.
- Farage M.A., Maibach H.I. Morphology and physiological changes of genital skin and mucosa. Curr Probl Dermatol 2011; 40: 9–19, https://doi.org/10.1159/000321042.
- Latini A., Cota C., Orsini D., Cristaudo A., Tedesco M. Male and female genital lichen sclerosus. Clinical and functional classification criteria. Postepy Dermatol Alergol 2018; 35(5): 447–453, https://doi.org/10.5114/ada.2018.77236.
- Соколова А.В., Аполихина И.А., Зайцев Н.В., Чернуха Л.В. Клинико-морфологические стадии склерозирующего лихена вульвы. Гинекология 2020; 22(4): 22–27, https://doi.org/10.26442/20795696.2020.4.200278.
- Regauer S., Liegl B., Reich O. Early vulvar lichen sclerosus: a histopathological challenge. Histopathology 2005; 47(4): 340–347, https://doi.org/10.1111/j.1365-2559.2005.02209.x.
- Lei Y., Gold M.H., Ouyang H., Tan J. Fractional CO2 laser-assisted scar regeneration and repair: a review. Dermatological Reviews 2021; 2(1): 23–33, https://doi.org/10.1002/der2.61.