Прогнозирование госпитальной летальности у больных инфарктом миокарда с подъемом сегмента ST: эволюция технологий рискометрии и оценка их эффективности (обзор)
Стратификация рисков госпитальной летальности у больных инфарктом миокарда с подъемом сегмента ST на электрокардиограмме является важным этапом оказания специализированной медицинской помощи. В систематическом обзоре представлены данные научной литературы, характеризующие предсказательную ценность как классических прогностических шкал (GRACE, CADDILLAC, TIMI risk score for STEMI, РЕКОРД и др.), так и новых инструментов рискометрии, разработанных на основе современных методов машинного обучения. Большинство исследований по данной проблеме чаще всего сосредоточено на поиске новых предикторов неблагоприятных событий, позволяющих детализировать взаимосвязи показателей клинико-функционального статуса больных и конечной точки исследования. Важной задачей при этом является разработка прогностических алгоритмов госпитальной летальности, обладающих свойствами объяснимого искусственного интеллекта и пользующихся доверием врачей.
Введение
Ишемическая болезнь сердца (ИБС) занимает ведущую позицию среди причин инвалидизации и смертности населения в большинстве стран мира. Инфаркт миокарда с подъемом сегмента ST на электрокардиограмме (ИМпST) относится к наиболее тяжелой клинической форме ИБС, ассоциированной с высоким риском неблагоприятных исходов, включая госпитальную летальность (ГЛ). В РФ показатель ГЛ при ИМпST варьирует в диапазоне 13–14%, что сопоставимо с данными европейских стран и указывает на необходимость совершенствования инструментов рискометрии, позволяющих своевременно оценить вероятность развития неблагоприятных событий [1]. Для оценки риска ГЛ у больных ИМпST в различных странах было разработано более 50 шкал и прогностических алгоритмов, часть из которых рекомендована профессиональными сообществами к широкому применению и доказала свою эффективность в реальной клинической практике [2–61]. К таким шкалам относят GRACE (Global Registry of Acute Coronary Events), CADILLAC (Controlled Abciximab and Device Investigation to Lower Late Angioplasty Complications), TIMI risk score for STEMI (Thrombolysis in Myocardial Infarction risk score for ST-segment elevation myocardial infarction), РЕКОРД и др. [3–6]. В настоящее время продолжаются исследования, направленные на поиск новых предикторов ГЛ, которыми дополняют структуру ранее разработанных «классических» шкал, добиваясь повышения точности прогноза. Вместе с тем постоянное расширение регистров больных ИМпST требует использования современных методов машинного обучения (МО) для обработки и анализа больших данных. Это позволяет извлекать новые знания, детализирующие взаимосвязи потенциальных предикторов с конечной точкой исследования. Прогностические алгоритмы на основе методов МО все чаще применяют для оценки риска неблагоприятных событий в различных областях клинической медицины, поэтому повышение их качества является предметом многочисленных исследований.
Цель данного обзора — проанализировать научные публикации, посвященные прогнозированию госпитальной летальности у больных ИМпST и оценить возможность совершенствования инструментов рискометрии на основе современных методов машинного обучения.
Методология поиска литературы
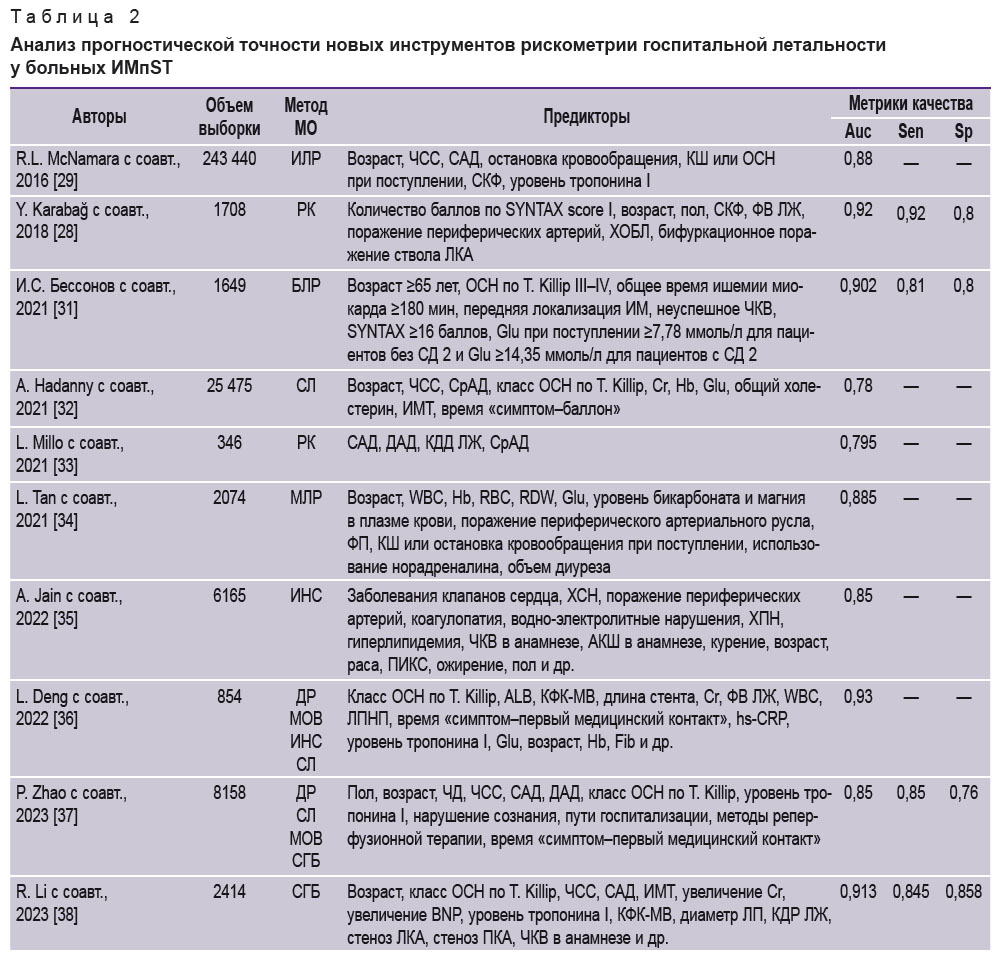
Поиск литературы проводили в базах данных PubMed (MEDLINE), Web of Science, Scopus, eLIBRARY.RU и Cochrane Database of Systematic Reviews с использованием следующих ключевых слов: «инфаркт миокарда с подъемом сегмента ST и летальность», «инфаркт миокарда с подъемом сегмента ST и прогностические шкалы», «инфаркт миокарда с подъемом сегмента ST и прогноз», «ST segment elevation myocardial infarction and mortality”, “ST segment elevation myocardial infarction and prognostic scales”, “ST segment elevation myocardial infarction and prognosis”, “scale prognosis of in-hospital mortality and TEMI”, “ST segment elevation myocardial infarction and prognosis scale in hospital mortality”. По результатам поискового запроса выбрано 46 134 работы. Были удалены дубликаты и исключены работы, которые не содержали необходимые для анализа данные (методы разработки прогностических моделей, индикаторы их точности, информацию о предикторах); полнотекстовые материалы в свободном доступе; а также исследования с недостаточным размером выборки (<200). В окончательный вариант систематического обзора включено 102 работы, опубликованные с 1999 по 2024 г. Наиболее цитируемые из них представлены в табл. 1, 2.

|
Таблица 1. Анализ прогностической точности классических моделей госпитальной летальности у больных ИМпST |
|
Таблица 2. Анализ прогностической точности новых инструментов рискометрии госпитальной летальности у больных ИМпST |
«Классические» шкалы для прогнозирования риска госпитальной летальности у больных ИМпST
Актуализация научного направления, связанного с разработкой прогностических шкал для стратификации риска ГЛ у больных с острыми формам ИБС, наблюдается с конца прошлого столетия и является следствием двух основных причин: возрастающей заболеваемости и смертности населения в большинстве стран мира от сердечно-сосудистых заболеваний и интенсивного развития методов МО. Для разработки прогностических моделей МО в клинической медицине чаще всего используют многофакторную логистическую регрессию (МЛР), регрессию Кокса (РК), случайный лес (СЛ), деревья решений (ДР), искусственные нейронные сети (ИНС), стохастический градиентный бустинг (СГБ), метод опорных векторов (МОВ) и ансамбли моделей [62–66].
Одной из первых профессиональному сообществу была представлена шкала PREDICT, разработанная в 1999 г. по результатам Миннесотского кардиологического исследования (MHS), которое включало данные 6134 пациентов из регистра острого коронарного синдрома (ОКС), и валидированная на выборке из 3570 больных ИМпST [7]. Прогностический алгоритм на основе МЛР демонстрировал приемлемую точность прогноза ГЛ (AUC — 0,79).
В 2000 г. по данным регистра InTIME II, содержащего результаты обследования и лечения 15 078 больных ИМпST, была разработана шкала TIMI risk score for STEMI [5]. Она включала предикторы ГЛ, которые в дальнейшем использовались в других рискометрических инструментах и не утратили актуальности до настоящего времени. К ним относятся возраст больных, класс острой сердечной недостаточности (ОСН) по T. Killip, частота сердечных сокращений (ЧСС) и систолическое артериальное давление (САД). Комбинация указанных признаков с такими факторами, как сахарный диабет 2-го типа (СД 2), артериальная гипертензия (АГ), масса тела, стенокардия в анамнезе, время до реваскуляризации >4 ч и локализация ИМ, позволила добиться приемлемой точности прогноза (AUC — 0,784), заложив фундамент для будущих исследований. Шкала была валидирована на 3687 больных ИМпST из исследования TIMI-9, а вероятность ГЛ стратифицирована с выделением групп низкого, среднего и высокого риска.
Шкала GUSTО была разработана в 2000 г. по результатам одноименного многоцентрового исследования, содержащего данные 41 021 пациента с ИМпST [8]. Прогностический алгоритм на основе РК помимо возраста больных, ЧСС, локализации ИМ и признака хронической сердечной недостаточности (ХСН) впервые включал показатель фракции выброса левого желудочка (ФВ ЛЖ). Вместе с тем наличие данного фактора в структуре модели не обеспечило ожидаемого повышения ее точности (AUC — 0,8), которая была сопоставимой с алгоритмами, не содержащими этот предиктор. Прогностический «нейтралитет» фактора ФВ ЛЖ в данной модели может объясняться отсутствием его категоризации с выделением пороговых значений, усиливающих предиктивный потенциал [67].
Представленная в 2004 г. шкала PAMI, основанная на 4 регистрах больных ИМпST, не превосходила по точности ранее созданные инструменты прогнозирования [9]. Предикторами прогностической модели МЛР были возраст больных, класс ОСН по T. Killip, ЧСС, СД 2 и локализация ИМ. Наличие в структуре данного алгоритма показателей с ранее доказанной взаимосвязью с ГЛ обеспечило ему приемлемую прогностическую точность, сопоставимую со шкалой TIMI risk score for STEMI (AUC — 0,784).
Авторы шкалы Zwolle (2004) [10] впервые обратили внимание на предсказательную ценность таких потенциальных предикторов ГЛ, как трехсосудистое поражение коронарного русла (ТПКР) и степень восстановления коронарного кровотока по TIMI. Комбинация этих факторов с показателями возраста больных, класса ОСН по T. Killip, времени до реваскуляризации миокарда >4 ч и передним ИМ демонстрировала отличную прогностическую точность (AUC — 0,902).
Шкала CADILLAC, разработанная в 2005 г. по результатам анализа данных одноименного регистра и валидированная на когорте больных из исследования Stent-PAMI, объединила в своей структуре предикторы ГЛ и годовой летальности пациентов с ИМпST [4]. Прогностический алгоритм на основе МЛР был представлен показателями возраста больных, класса ОСН по T. Killip, скоростью клубочковой фильтрации (СКФ), ФВ ЛЖ, индикаторами восстановления коронарного кровотока по TIMI, гематокритом (Ht) и ТПКР. Показатели СКФ и Ht были впервые апробированы в качестве предикторов ГЛ и в дальнейшем использовались в других прогностических алгоритмах. Шкала CADILLAC демонстрировала хорошую прогностическую точность по отношению к ГЛ, в том числе у больных ИМпST после чрескожного коронарного вмешательства (ЧКВ) (AUC — 0,83) [4].
Шкала GRACE была разработана в 2006 г. с помощью РК по данным одноименного международного регистра больных ОКС, содержащего сведения о 43 810 пациентах (21 688 — выборка для обучения модели, 22 122 — для ее валидации), и в дальнейшем рекомендована к клиническому применению в большинстве стран мира [3]. В структуру шкалы вошли ранее известные предикторы ГЛ: возраст больных, ЧСС, САД, класс ОСН по T. Killip, которые были дополнены показателями концентрации креатинина (Cr) в сыворотке крови, элевации сегмента ST, диагностически значимого повышения уровня кардиоспецифических ферментов и остановкой сердца на момент поступления больного в стационар. Преимуществом шкалы GRACE является сочетание хорошей прогностической точности (AUC — 0,83) и доступности предикторов для стратификации риска ГЛ (низкий, средний и высокий). Обновленная в 2014 г. версия шкалы (GRACE 2.0) позволяет оценить риск летального исхода через 1 и 3 года после ОКС [11]. В ряде работ модификация шкалы GRACE осуществлялась путем дополнения ее структуры новыми факторами риска ГЛ [12–23]. Наиболее точным прогнозом (AUC — 0,927) отличалась модель, в состав предикторов которой входили показатели ФВ ЛЖ и содержания лейкоцитов крови [24].
Первым российским инструментом рискометрии, позволяющим оценить вероятность ГЛ у больных ИМпST, была шкала РЕКОРД, разработанная в 2010 г. методами однофакторной логистической регрессии и МЛР по данным 796 больных ОКС из региональных лечебных учреждений, включенных в одноименный регистр [6]. Структура шкалы была представлена шестью предикторами: возраст больных, класс ОСН по Т. Killip, САД, СД 2, элевация сегмента ST и содержание гемоглобина (Hb) в крови. Вероятность ГЛ была стратифицирована с выделением групп низкого и высокого риска. Доступность предикторов и хороший уровень прогностической точности (AUC — 0,856) являются главными преимуществами этой шкалы. К ее недостаткам принято относить отсутствие валидации на крупных независимых выборках. Для оценки риска ГЛ у больных ИМпST, выполненной на догоспитальном этапе, был предложен модифицированный алгоритм РЕКОРД, из структуры которого исключался показатель Hb, что не снижало точность прогноза [25].
Новые инструменты рискометрии госпитальной летальности при ИМпST
Повышение качества прогностических алгоритмов связано с использованием методов объяснимого искусственного интеллекта, которые позволяют разрабатывать интерпретируемые модели МО, обеспечивающие возможность клинического обоснования генерируемого заключения [26]. Важность их применения возрастает при прогнозировании ГЛ после экстренной реваскуляризации миокарда. Это обусловлено необходимостью оценки степени поражения коронарного русла, которая осуществляется с помощью шкалы SYNTAX score I (SS I), разработанной в 2006 г., и SYNTAX score II (SS II), представленной в 2013 г. [27, 68]. Комплекс предикторов SS II помимо анатомических индикаторов нарушений коронарного кровотока содержит клинико-анамнестические данные больных: возраст, пол, СКФ, ФВ ЛЖ, поражение периферических артерий, наличие хронической обструктивной болезни легких. В последние годы увеличивается количество публикаций, в которых шкала SS II используется для прогнозирования ГЛ у больных ИМпST. Среди них работа Y. Karabağ с соавт. [28], где продемонстрирована отличная прогностическая точность прогноза ГЛ после ЧКВ (AUC — 0,92). Прогностические алгоритмы ГЛ до проведения ЧКВ были представлены в работе R.L. McNamara с соавт. [29]. Разработанные на данных регистра ACTION (243 440 больных ОКС) методом иерархической логистической регрессии, эти алгоритмы показали равноценную точность в группах больных ИМпST и ИМбпST (AUC — 0,88). По результатам прогноза вероятность ГЛ была стратифицирована на 5 степеней риска, минимальная из которых соответствовала 0,4%, а максимальная — 49,5%.
Оценку взаимосвязи ГЛ и эффективности тромболитической терапии (ТЛТ) анализировали с помощью шкалы EERIAM-HCC в исследовании [30]. Модель была разработана с использованием ансамбля методов МО и демонстрировала отличную точность прогноза (AUC — 0,92). Наибольшее влияние на ГЛ оказывали показатель концентрации глюкозы в крови (Glu) в непрерывной форме и категориальный признак продолжительности интервала QT>60 мс.
В исследовании [31] представлена прогностическая модель ГЛ после ЧКВ на основе бинарной логистической регрессии, включавшая 7 предикторов, в том числе длительность общей ишемии миокарда и признаки неуспешности ЧКВ. Прогностический алгоритм обладал отличной точностью (AUC — 0,902).
В работе A. Hadanny с соавт. [32] на основе анализа данных 2782 больных ИМпST из регистра ОКС (ACSIS) методом СЛ была разработана прогностическая модель ГЛ после ЧКВ, валидированная на 22 693 пациентах с ИМпST (регистр ОКС MINAP). Модель включала 10 предикторов, в том числе длительность периода «симптом–баллон». Несмотря на наличие в структуре шкалы известных факторов неблагоприятного исхода, она соответствовала только приемлемой точности прогноза (AUC — 0,78).
В работе L. Millo с соавт. [33] на когорте из 346 больных ИМпST старше 60 лет была разработана шкала LASH для оценки риска ГЛ после ЧКВ. В этом исследовании для моделирования прогноза ГЛ использовали данные мониторинга центральной гемодинамики, включавшие показатели среднего артериального давления и конечно-диастолического давления левого желудочка после выполнения ЧКВ в комбинации с параметрами САД и ДАД. При сопоставлении с алгоритмами TIMI risk score for STEMI и GRACE эта шкала демонстрировала меньшую точность прогноза (AUC — 0,881 для TIMI risk score for STEMI и 0,847 для GRACE vs 0,795 для LASH). Несмотря на более низкие значения метрик качества, данная шкала может быть полезна для оценки риска ГЛ у больных ИМпST с кардиогенным шоком, при котором индикаторы текущего гемодинамического статуса имеют ключевое значение для определения прогноза. Развитие данного подхода было продолжено L. Tan с соавт. [34] на данных 2074 больных ИМпST и ИМбпST из регистра eICU-CRD. На основе МЛР разработана прогностическая модель ГЛ для отделений реанимации и интенсивной терапии (ОРИТ), валидированная на 1026 больных из базы данных MIMIC-III. Она включала 14 предикторов ГЛ, из которых наибольшее влияние на конечную точку оказывали 2 фактора: остановка кровообращения (ОШ — 3,87) и использование норадреналина для стабилизации гемодинамики (ОШ — 2). Данная модель превосходила по точности прогноза классические шкалы-рискометры, используемые в ОРИТ (AUC — 0,885 vs 0,86 для SAPS II; 0,84 для OASIS и 0,81 для SOFA).
Особого внимания заслуживает работа A. Jain с соавт. [35], выполненная на данных 6165 больных ИМпST в возрасте от 18 до 44 лет. Разработанная в этом исследовании прогностическая модель ГЛ на основе ИНС обладала хорошей точностью (AUC — 0,85) и включала 22 предиктора, среди которых впервые были выделены табакокурение, злоупотребление алкоголем, наркотическая зависимость и депрессия. Вместе с тем наиболее тесную взаимосвязь с фатальным событием имели 2 фактора: поражение клапанов сердца и водно-электролитные нарушения.
В работе L. Deng и соавт. [36] были использованы методы ДР, СЛ, МОВ и ИНС для построения моделей ГЛ на данных 854 больных ИМпST после ЧКВ. В данном исследовании дополнительной конечной точкой была частота развития феномена невосстановленного коронарного кровотока после ЧКВ. Модели на основе СЛ обладали отличной прогностической точностью для ГЛ (AUC — 0,93) и приемлемой для no-reflow (AUC — 0,78). В исследовании P. Zhao с соавт. [37] на основе данных 8158 больных ИМпST были разработаны прогностические модели ГЛ с помощью 4 методов МО (ДР, СЛ, МОВ, СГБ). Помимо классических факторов ГЛ, в качестве предикторов учитывались пути госпитализации, методы реперфузионной терапии (первичное ЧКВ, ТЛТ, ТЛТ + ЧКВ, отсутствие терапии), время «симптом–первый медицинский контакт». Лучшую точность прогноза ГЛ имели модели на основе МОВ (AUC — 0,85). Наибольшее влияние на конечную точку оказывали методы реперфузионной терапии, возраст больных и САД, а наименьшее — длительность периода «симптом–первый медицинский контакт» и признак нарушения сознания. Противоположные результаты были представлены в работе [38], где на примере модели на основе СГБ (AUC — 0,913) было показано, что влияние на ГЛ факторов возраста, класса ОСН по T. Killip и САД менее значимо, чем показателей ИМТ, концентрации мозгового натрийуретического пептида (BNP) и диаметра левого предсердия. В этом исследовании предиктивная ценность факторов ЧСС и Cr была доминирующей.
В работе [26] на основе МЛР, СЛ и СГБ построены прогностические модели ГЛ для различных этапов оказания медицинской помощи (до и после выполнения экстренного ЧКВ) с хорошей (AUC — 0,85) и отличной (AUC — 0,9) точностью прогноза соответственно. В данном исследовании апробированы новые методы выделения пороговых значений предикторов, позволяющие отнести их к факторам риска ГЛ и дать клиническое обоснование результатам прогноза.
В работе X. Zhu с соавт. [39] на когорте 5836 больных ИМпST и ИМбпST после ЧКВ (3587 — обучающая выборка, 1196 — тестовая, 1053 — выборка для валидации) с помощью 7 методов МО были разработаны модели ГЛ, обладающие отличной точностью прогноза. Модель на основе ансамблевого метаалгоритма (Bagging) имела наиболее высокую точность (AUC — 0,932) и включала 8 предикторов, среди которых D-димер, BNP и концентрация фосфора в крови ранее не использовались в анализируемых алгоритмах. Примечательно, что наибольшее влияние на ГЛ оказывали показатели D-димера и BNP, а вклад в реализацию конечной точки нейтрофилов и протромбинового индекса был сопоставим с фактором кардиогенного шока.
Обсуждение
В последние годы методы предиктивной аналитики все шире используются в клинической медицине, что подтверждается возрастающим числом научных исследований по этой проблеме [69–80]. Особую актуальность данное направление приобретает при жизнеугрожающих состояниях, к которым относится ИМпST. В систематическом обзоре представлен анализ публикаций, демонстрирующих эволюцию технологий прогнозирования ГЛ при ИМпST за последние 25 лет. Большинство «классических» шкал были созданы и валидированы на крупных выборках больных в первом десятилетии нашего века (см. табл. 1). При этом 3 из них (PREDICT, GRACE, РЕКОРД) разработаны по данным одноименных регистров больных с ОКС и 5 шкал (GUSTО, TIMI risk score for STEMI, Zwolle, PAMI и CADILLAC) — по данным регистров пациентов с ИМпST. Структура большинства анализируемых шкал включала предикторы ГЛ, которые относят к эталонным (возраст больных, класс ОСН по T. Killip, ЧСС и САД). В шкалах CADILLAC и Zwolle представлены также индикаторы ТПКР и ТIMI, что ассоциируется с более точной стратификацией риска ГЛ после ЧКВ. Лабораторные показатели Cr, СКФ, Ht и Hb дополняют состав предикторов в шкалах PREDICT, CADILLAC, GRACE и РЕКОРД, а показатели ФВ ЛЖ и время до реваскуляризации миокарда >4 ч — в шкалах TIMI risk score for STEMI и Zwolle. В соответствии с классификатором значений AUC [81] отличной точностью прогноза (AUC≥0,9) обладала только шкала Zwolle, хорошей (0,8≤AUC<0,9) — шкалы GRACE, CADILLAC, GUSTO и РЕКОРД, а приемлемой (0,7≤AUC<0,8) — PREDICT, TIMI risk score for STEMI и PAMI. Известно, что наилучшее качество прогностические модели чаще всего демонстрируют в тех популяциях, откуда были получены исходные данные [82]. Вместе с тем в многочисленных исследованиях показано, что шкалы GRACE и CADILLAC на внешних выборках отличались более высокой точностью прогноза, чем другие классические шкалы [83, 84]. Необходимо отметить, что все анализируемые шкалы были построены с помощью базовых методов МО: МЛР и РК, преимуществом которых является прозрачность предсказательных решений, а недостатком — учет только линейных взаимосвязей между предикторами и конечной точкой исследования, что ограничивает их прогностический потенциал.
В настоящее время продолжается активный поиск новых предикторов неблагоприятных событий, ассоциированных с ИМпST. В различных публикациях вновь выделенные предикторы ГЛ у этой категории больных представлены признаками коморбидности, клинико-биохимическими и гематологическими индикаторами воспалительного ответа, показателями метаболического статуса, размерами камер сердца, фибрилляцией предсердий, BNP, D-димером и др. В связи с доминирующей стратегией реваскуляризации миокарда методом ЧКВ возрастает потребность в разработке рискометрических инструментов, связанных с ГЛ после ее выполнения. По данным литературы, фатальные исходы после экстренной ЧКВ фиксируются у 4–7% больных ИМпST, что актуализирует проблему стратификации риска ГЛ [62]. К предикторам ГЛ после ЧКВ чаще всего относят признаки его неуспешности по TIMI — 0–2 (феномены slow-reflow и no-reflow), критерии поражения коронарного русла по данным SS I или SS II, показатели гемодинамики, уровень глюкозы в крови и др. [85–98].
Для повышения информативности предикторов и построения интерпретируемых моделей МО в последние годы используют методы объяснимого искусственного интеллекта. Эти методы включают выделение пороговых значений предикторов, отклонение от которых повышает их предсказательную ценность и позволяет отнести к факторам риска неблагоприятных событий [67]. Новым подходом в разработке моделей МО является также фенотипирование факторов риска и ранжирование отдельных предикторов по интенсивности их влияния на конечную точку исследования [26, 99–102]. Анализ публикаций последних лет показал, что большинство актуальных прогностических моделей разработаны с помощью современных методов МО (СЛ, МОВ, ДР, СГБ, ИНС, ансамбли моделей), которые в большинстве случае отличаются хорошей или отличной точностью (см. табл. 2). Их преимуществом является возможность выявления скрытых или неочевидных закономерностей, а также извлечение новых знаний из большого объема данных. Важным направлением рискометрии при ИМпST остается разработка прогностических моделей ГЛ для больных, находящихся в ОРИТ в связи с осложненным течением данного заболевания. В обзоре представлены публикации с примерами таких алгоритмов, к предикторам которых относятся инвазивные индикаторы кардиогемодинамики, показатели доставки и потребления кислорода, концентрация лактата крови, использование вазоактивных препаратов и др. Данные модели превосходили по точности классические шкалы-рискометры неотложных состояний (APACHE II, SAPS, SI) [40–43].
Заключение
Анализ научной литературы указывает на возрастающий интерес исследователей к совершенствованию прогностических технологий, обеспечивающих надежную стратификацию рисков госпитальной летальности при ИМпST. Развитие этого направления связано с разработкой интерпретируемых моделей МО, которые могут объяснять генерируемые заключения, что способствует доверию со стороны врачей. Важной задачей при этом является имплементация прогностических моделей неблагоприятных событий в системы поддержки принятия врачебных решений, которые дополняют необходимой информацией оценку рисков госпитальной летальности в повседневной клинической практике. Необходимым условием для эволюции прогностических технологий госпитальной летальности являются также формирование и постоянная актуализация региональных и национальных регистров больных ИМпST, учитывающих специфику ресурсного обеспечения кардиологической службы.
Вклад авторов: Б.И. Гельцер предложил концепцию исследования, осуществлял руководство и подготовил рукопись; И.Г. Домжалов, Е.А. Кокарев, Р.Л. Пак отвечали за сбор данных, интерпретацию результатов; К.И. Шахгельдян разрабатывала дизайн исследования; Н.С. Куксин, В.Н. Котельников анализировали данные и готовили текст публикации.
Финансирование. Работа выполнена в рамках проекта Минобрнауки России FZNS-2023-0010 Госзадания ДВФУ.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Литература
- Алекян Б.Г., Бойцов С.А., Маношкина Е.М., Ганюков В.И. Реваскуляризация миокарда в Российской Федерации при остром коронарном синдроме в 2016–2020 гг. Кардиология 2021; 61(12): 4–15, https://doi.org/10.18087/cardio.2021.12.n1879.
- Grabowski M., Filipiak K.J., Opolski G., Glowczynska R. How to improve prognostic value of popular risk scores used in acute coronary syndrome — a single center experience in a long term follow-up. Curr Res Cardiol 2018; 5(3): 30–33, https://doi.org/10.4172/2368-0512.1000108.
- Fox K.A., Dabbous O.H., Goldberg R.J., Pieper K.S., Eagle K.A., Van de Werf F., Avezum A., Goodman S.G., Flather M.D., Anderson F.A. Jr, Granger C.B. Prediction of risk of death and myocardial infarction in the six months after presentation with acute coronary syndrome: prospective multinational observational study (GRACE). BMJ 2006; 333(7578): 1091, https://doi.org/10.1136/bmj.38985.646481.55.
- Halkin A., Singh M., Nikolsky E., Grines C.L., Tcheng J.E., Garcia E., Cox D.A., Turco M., Stuckey T.D., Na Y., Lansky A.J., Gersh B.J., O’Neill W.W., Mehran R., Stone G.W. Prediction of mortality after primary percutaneous coronary intervention for acute myocardial infarction: the CADILLAC risk score. J Am Coll Cardiol 2005; 45(9): 1397–1405, https://doi.org/10.1016/j.jacc.2005.01.041.
- Morrow D.A., Antman E.M., Charlesworth A., Cairns R., Murphy S.A., de Lemos J.A., Giugliano R.P., McCabe C.H., Braunwald E. TIMI risk score for ST-elevation myocardial infarction: a convenient, bedside, clinical score for risk assessment at presentation: an intravenous nPA for treatment of infarcting myocardium early II trial substudy. Circulation 2000; 102(17): 2031–2037, https://doi.org/10.1161/01.cir.102.17.2031.
- Эрлих А.Д. Шкала для ранней оценки риска смерти и развития инфаркта миокарда в период пребывания в стационаре больных с острыми коронарными синдромами (на основании данных регистра РЕКОРД). Кардиология 2010; 10: 11–16.
- Jacobs D.R. Jr, Kroenke C., Crow R., Deshpande M., Gu D.F., Gatewood L., Blackburn H. PREDICT: a simple risk score for clinical severity and long-term prognosis after hospitalization for acute myocardial infarction or unstable angina: the Minnesota heart survey. Circulation 1999; 100(6): 599–607, https://doi.org/10.1161/01.cir.100.6.599.
- Califf R.M., Pieper K.S., Lee K.L., Van De Werf F., Simes R.J., Armstrong P.W., Topol E.J. Prediction of 1-year survival after thrombolysis for acute myocardial infarction in the global utilization of streptokinase and TPA for occluded coronary arteries trial. Circulation 2000; 101(19): 2231–2238, https://doi.org/10.1161/01.cir.101.19.2231.
- Addala S., Grines C.L., Dixon S.R., Stone G.W., Boura J.A., Ochoa A.B., Pellizzon G., O’Neill W.W., Kahn J.K. Predicting mortality in patients with ST-elevation myocardial infarction treated with primary percutaneous coronary intervention (PAMI risk score). Am J Cardiol 2004; 93(5): 629–632, https://doi.org/10.1016/j.amjcard.2003.11.036.
- De Luca G., Suryapranata H., van’t Hof A.W., de Boer M.J., Hoorntje J.C., Dambrink J.H., Gosselink A.T., Ottervanger J.P., Zijlstra F. Prognostic assessment of patients with acute myocardial infarction treated with primary angioplasty: implications for early discharge. Circulation 2004; 109(22): 2737–2743, https://doi.org/10.1161/01.CIR.0000131765.73959.87.
- Fox K.A., Fitzgerald G., Puymirat E., Huang W., Carruthers K., Simon T., Coste P., Monsegu J., Gabriel Steg P., Danchin N., Anderson F. Should patients with acute coronary disease be stratified for management according to their risk? Derivation, external validation and outcomes using the updated GRACE risk score. BMJ Open 2014; 4(2): e004425, https://doi.org/10.1136/bmjopen-2013-004425.
- Szabo D., Szabo A., Magyar L., Banhegyi G., Kugler S., Pinter A., Juhasz V., Ruppert M., Olah A., Ruzsa Z., Edes I.F., Szekely A., Becker D., Merkely B., Hizoh I. Admission lactate level and the GRACE 2.0 score are independent and additive predictors of 30-day mortality of STEMI patients treated with primary PCI-results of a real-world registry. PLoS One 2022; 17(11): e0277785, https://doi.org/10.1371/journal.pone.0277785.
- Xiao L., Jia Y., Wang X., Huang H. The impact of preoperative fibrinogen-albumin ratio on mortality in patients with acute ST-segment elevation myocardial infarction undergoing primary percutaneous coronary intervention. Clin Chim Acta 2019; 493: 8–13, https://doi.org/10.1016/j.cca.2019.02.018.
- Klingenberg R., Aghlmandi S., Räber L., Gencer B., Nanchen D., Heg D., Carballo S., Rodondi N., Mach F., Windecker S., Jüni P., von Eckardstein A., Matter C.M., Lüscher T.F. Improved risk stratification of patients with acute coronary syndromes using a combination of hsTnT, NT-proBNP and hsCRP with the GRACE score. Eur Heart J Acute Cardiovasc Care 2018; 7(2): 129–138, https://doi.org/10.1177/2048872616684678.
- Xiong S., Chen Q., Chen X., Hou J., Chen Y., Long Y., Yang S., Qi L., Su H., Huang W., Liu H., Zhang Z., Cai L. Adjustment of the GRACE score by the triglyceride glucose index improves the prediction of clinical outcomes in patients with acute coronary syndrome undergoing percutaneous coronary intervention. Cardiovasc Diabetol 2022; 21(1): 145, https://doi.org/10.1186/s12933-022-01582-w.
- Pang S., Miao G., Zhou Y., Du Y., Rui Z., Zhao X. Addition of TyG index to the GRACE score improves prediction of adverse cardiovascular outcomes in patients with non-ST-segment elevation acute coronary syndrome undergoing percutaneous coronary intervention: a retrospective study. Front Cardiovasc Med 2022; 9: 957626, https://doi.org/10.3389/fcvm.2022.957626.
- Li Q., Ma X., Shao Q., Yang Z., Wang Y., Gao F., Zhou Y., Yang L., Wang Z. Prognostic impact of multiple lymphocyte-based inflammatory indices in acute coronary syndrome patients. Front Cardiovasc Med 2022; 9: 811790, https://doi.org/10.3389/fcvm.2022.811790.
- Dalimunthe N.N., Alwi I., Nasution S.A., Shatri H. The role of Tei index added to the GRACE risk score for prediction of in-hospital MACE after acute myocardial infarction. Rom J Intern Med 2022; 60(4): 222–228, https://doi.org/10.2478/rjim-2022-0012.
- Xiong S., Luo Y., Chen Q., Chen Y., Su H., Long Y., Chen X., Yang S., Qi L., Huang W., Hou J., Liu H., Cai L. Adjustment of the GRACE score by the stress hyperglycemia ratio improves the prediction of long-term major adverse cardiac events in patients with acute coronary syndrome undergoing percutaneous coronary intervention: a multicenter retrospective study. Diabetes Res Clin Pract 2023; 198: 110601, https://doi.org/10.1016/j.diabres.2023.110601.
- Chen X., Xiong S., Chen Y., Cheng L., Chen Q., Yang S., Qi L., Liu H., Cai L. The predictive value of different nutritional indices combined with the GRACE score in predicting the risk of long-term death in patients with acute coronary syndrome undergoing percutaneous coronary intervention. J Cardiovasc Dev Dis 2022; 9(10): 358, https://doi.org/10.3390/jcdd9100358.
- Liu X.J., Wan Z.F., Zhao N., Zhang Y.P., Mi L., Wang X.H., Zhou D., Wu Y., Yuan Z.Y. Adjustment of the GRACE score by hemoglobinA1c enables a more accurate prediction of long-term major adverse cardiac events in acute coronary syndrome without diabetes undergoing percutaneous coronary intervention. Cardiovasc Diabetol 2015; 14: 110, https://doi.org/10.1186/s12933-015-0274-4.
- Zhang S., Wan Z., Zhang Y., Fan Y., Gu W., Li F., Meng L., Zeng X., Han D., Li X. Neutrophil count improves the GRACE risk score prediction of clinical outcomes in patients with ST-elevation myocardial infarction. Atherosclerosis 2015; 241(2): 723–728, https://doi.org/10.1016/j.atherosclerosis.2015.06.035.
- Chen Q., Su H., Yu X., Chen Y., Ding X., Xiong B., Wang C., Xia L., Ye T., Lan K., Hou J., Xiong S., Cai L. The stress hyperglycemia ratio improves the predictive ability of the GRACE score for in-hospital mortality in patients with acute myocardial infarction. Hellenic J Cardiol 2023; 70: 36–45, https://doi.org/10.1016/j.hjc.2022.12.012.
- Гельцер Б.И., Шахгельдян К.И., Домжалов И.Г., Куксин Н.С., Кокарев Е.А., Котельников В.Н., Рублев В.Ю. Прогнозирование внутригоспитальной летальности у больных острым инфарктом миокарда с подъемом сегмента ST после чрескожного коронарного вмешательства. Российский кардиологический журнал 2023; 28(6): 5414, https://doi.org/10.15829/1560-4071-2023-5414.
- Эрлих А.Д. Возможность отбора пациентов для первичного инвазивного вмешательства при ОКС с подъемом сегмента ST при помощи модифицированной шкалы «РЕКОРД». Трудный пациент 2013; 11(7): 36–39.
- Shakhgeldyan K.I., Kuksin N.S., Domzhalov I.G., Rublev V.Y., Geltser B.I. Interpretable machine learning for in-hospital mortality risk prediction in patients with ST-elevation myocardial infarction after percutaneous coronary interventions. Comput Biol Med 2024; 170: 107953, https://doi.org/10.1016/j.compbiomed.2024.107953.
- Farooq V., van Klaveren D., Steyerberg E.W., Meliga E., Vergouwe Y., Chieffo A., Kappetein A.P., Colombo A., Holmes D.R. Jr, Mack M., Feldman T., Morice M.C., Ståhle E., Onuma Y., Morel M.A., Garcia-Garcia H.M., van Es G.A., Dawkins K.D., Mohr F.W., Serruys P.W. Anatomical and clinical characteristics to guide decision making between coronary artery bypass surgery and percutaneous coronary intervention for individual patients: development and validation of SYNTAX score II. Lancet 2013; 381(9867): 639–650, https://doi.org/10.1016/S0140-6736(13)60108-7.
- Karabağ Y., Çağdaş M., Rencuzogullari I., Karakoyun S., Artaç İ., İliş D., Yesin M., Öterkus M., Gokdeniz T., Burak C., Tanboğa I.H. Comparison of SYNTAX score II efficacy with SYNTAX score and TIMI risk score for predicting in-hospital and long-term mortality in patients with ST segment elevation myocardial infarction. Int J Cardiovasc Imaging 2018; 34(8): 1165–1175, https://doi.org/10.1007/s10554-018-1333-1.
- McNamara R.L., Kennedy K.F., Cohen D.J., Diercks D.B., Moscucci M., Ramee S., Wang T.Y., Connolly T., Spertus J.A. Predicting in-hospital mortality in patients with acute myocardial infarction. J Am Coll Cardiol 2016; 68(6): 626–635, https://doi.org/10.1016/j.jacc.2016.05.049.
- Rodríguez-Jiménez A.E., Negrín-Valdés T., Cruz-Inerarity H., Castellano-Gallo L.A., Chávez-González E. Prognostic scale to stratify risk of intrahospital death in patients with acute myocardial infarction with ST-segment elevation. MEDICC Rev 2020; 22(3): 46–53, https://doi.org/10.37757/MR2020.V22.N3.10.
- Бессонов И.С., Кузнецов В.А., Сапожников С.С., Горбатенко Е.А., Шадрин А.А. Шкала оценки риска госпитальной летальности у пациентов с острым инфарктом миокарда с подъемом сегмента ST электрокардиограммы. Кардиология 2021; 61(9): 11–19, https://doi.org/10.18087/cardio.2021.9.n1720.
- Hadanny A., Shouval R., Wu J., Shlomo N., Unger R., Zahger D., Matetzky S., Goldenberg I., Beigel R., Gale C., Iakobishvili Z. Predicting 30-day mortality after ST elevation myocardial infarction: machine learning-based random forest and its external validation using two independent nationwide datasets. J Cardiol 2021; 78(5): 439–446, https://doi.org/10.1016/j.jjcc.2021.06.002.
- Millo L., McKenzie A., De la Paz A., Zhou C., Yeung M., Stouffer G.A. Usefulness of a novel risk score to predict in-hospital mortality in patients ≥60 years of age with ST elevation myocardial infarction. Am J Cardiol 2021; 154: 1–6, https://doi.org/10.1016/j.amjcard.2021.05.036.
- Tan L., Xu Q., Shi R. A nomogram for predicting hospital mortality in intensive care unit patients with acute myocardial infarction. Int J Gen Med 2021; 14: 5863–5877, https://doi.org/10.2147/IJGM.S326898.
- Jain A., Fong H.K., Ijaz H.M., Desai R. Predictors of in-hospital mortality in young adults hospitalized with ST-elevation myocardial infarction: an artificial neural network analysis using a nationwide cohort. J Am Coll Cardiol 2022; 79(9): 1064, https://doi.org/10.1016/s0735-1097(22)02055-1.
- Deng L., Zhao X., Su X., Zhou M., Huang D., Zeng X. Machine learning to predict no reflow and in-hospital mortality in patients with ST-segment elevation myocardial infarction that underwent primary percutaneous coronary intervention. BMC Med Inform Decis Mak 2022; 22(1): 109, https://doi.org/10.1186/s12911-022-01853-2.
- Zhao P., Liu C., Zhang C., Hou Y., Zhang X., Zhao J., Sun G., Zhou J. Using machine learning to predict the in-hospital mortality in women with ST-segment elevation myocardial infarction. Rev Cardiovasc Med 2023, 24(5): 126, https://doi.org/10.31083/j.rcm2405126.
- Li R., Shen L., Ma W., Yan B., Chen W., Zhu J., Li L., Yuan J., Pan C. Use of machine learning models to predict in-hospital mortality in patients with acute coronary syndrome. Clin Cardiol 2023; 46(2): 184–194, https://doi.org/10.1002/clc.23957.
- Zhu X., Xie B., Chen Y., Zeng H., Hu J. Machine learning in the prediction of in-hospital mortality in patients with first acute myocardial infarction. Clin Chim Acta 2024; 554: 117776, https://doi.org/10.1016/j.cca.2024.117776.
- Norton J.M., Reddy P.K., Subedi K., Fabrizio C.A., Wimmer N.J., Urrutia L.E. Utilization of an ICU severity of illness scoring system to triage patients with ST-elevation myocardial infarction. J Intensive Care Med 2021; 36(8): 857–861, https://doi.org/10.1177/0885066620928263.
- Guo C., Luo X.L., Gao X.J., Wang J., Liu R., Li J., Zhang J., Yang W.X., Hu F.H., Wu Y., Yang Y.J., Qiao S.B. Comparison on the predictive value of different scoring systems for risk of short-term death in patients with acute myocardial infarction complicating cardiogenic shock. Zhonghua Xin Xue Guan Bing Za Zhi 2018; 46(7): 529–535, https://doi.org/10.3760/cma.j.issn.0253-3758.2018.07.005.
- Chiang C.Y., Lin C.F., Liu P.H., Chen F.C., Chiu I.M., Cheng F.J. Clinical validation of the shock index, modified shock index, delta shock index, and shock index-C for emergency department ST-segment elevation myocardial infarction. J Clin Med 2022; 11(19): 5839, https://doi.org/10.3390/jcm11195839.
- Wang S., Zhang Y., Cheng Q., Qi D., Wang X., Zhu Z., Li M., Zhang J., Hu D., Gao C. Shock index-based risk indices as prognostic predictor for in-hospital mortality in patients with ST-elevation myocardial infarction, the results from Henan STEMI registry. Preprint (Version 1) 2022 Apr 11, https://doi.org/10.21203/rs.3.rs-1512785/v1.
- Li F., Li D., Yu J., Jia Y., Jiang Y., Chen X., Gao Y., Ye L., Wan Z., Cao Y., Zeng Z., Zeng R. Prognostic value of the Nutritional Risk Screening 2002 Scale in patients with acute myocardial infarction: insights from the retrospective multicenter study for early evaluation of acute chest pain. J Cardiovasc Nurs 2021; 36(6): 546–555, https://doi.org/10.1097/JCN.0000000000000786.
- Jia Y., Li H., Li D., Li F., Li Q., Jiang Y., Gao Y., Wan Z., Cao Y., Zeng Z., Zeng R. Prognostic value of Braden Scale in patients with acute myocardial infarction: from the retrospective multicenter study for early evaluation of acute chest pain. J Cardiovasc Nurs 2020; 35(6): E53–E61, https://doi.org/10.1097/JCN.0000000000000735.
- Ndrepepa G., Holdenrieder S., Kastrati A. Prognostic value of De Ritis ratio in patients with acute myocardial infarction. Clin Chim Acta 2022; 535: 75–81, https://doi.org/10.1016/j.cca.2022.08.016.
- Rivera-Fernández R., Arias-Verdú M.D., García-Paredes T., Delgado-Rodríguez M., Arboleda-Sánchez J.A., Aguilar-Alonso E., Quesada-García G., Vera-Almazán A. Prolonged QT interval in ST-elevation myocardial infarction and mortality: new prognostic scale with QT, Killip and age. J Cardiovasc Med (Hagerstown) 2016; 17(1): 11–19, https://doi.org/10.2459/JCM.0000000000000015.
- Kwon J.M., Jeon K.H., Kim H.M., Kim M.J., Lim S., Kim K.H., Song P.S., Park J., Choi R.K., Oh B.H. Deep-learning-based risk stratification for mortality of patients with acute myocardial infarction. PLoS One 2019; 14(10): e0224502, https://doi.org/10.1371/journal.pone.0224502.
- Sherazi S.W.A., Zheng H., Lee J.Y. A machine learning-based applied prediction model for identification of acute coronary syndrome (ACS) outcomes and mortality in patients during the hospital stay. Sensors (Basel) 2023; 23(3): 1351, https://doi.org/10.3390/s23031351.
- Kasim S., Malek S., Song C., Wan Ahmad W.A., Fong A., Ibrahim K.S., Safiruz M.S., Aziz F., Hiew J.H., Ibrahim N. In-hospital mortality risk stratification of Asian ACS patients with artificial intelligence algorithm. PLoS One 2022; 17(12): e0278944, https://doi.org/10.1371/journal.pone.0278944.
- Singh A., Miller R.J.H., Otaki Y., Kavanagh P., Hauser M.T., Tzolos E., Kwiecinski J., Van Kriekinge S., Wei C.C., Sharir T., Einstein A.J., Fish M.B., Ruddy T.D., Kaufmann P.A., Sinusas A.J., Miller E.J., Bateman T.M., Dorbala S., Di Carli M., Liang J.X., Huang C., Han D., Dey D., Berman D.S., Slomka P.J. Direct risk assessment from myocardial perfusion imaging using explainable deep learning. JACC Cardiovasc Imaging 2023; 16(2): 209–220, https://doi.org/10.1016/j.jcmg.2022.07.017.
- Hizoh I., Banhegyi G., Domokos D., Major L., Andrassy P., Andreka P., Becker D., Buttl A., Cziraki A., Dezsi C.A., Edes I., Forster T., Herczeg B., Janosi A., Katona A., Kiss R., Koszegi Z., Lupkovics G., Nagy G., Nagy L., Noori E., Tomcsanyi J., Veress G., Ruzsa Z., Merkely B. TCT-804 comparative validation of the ALPHA score, a novel risk model including vascular access site for predicting 30-day mortality in patients treated with primary PCI. J Am Coll Cardiol 2018; 72 (13 Suppl): B320–B321, https://doi.org/10.1016/j.jacc.2018.08.2039.
- Hizoh I., Domokos D., Banhegyi G., Becker D., Merkely B., Ruzsa Z. Mortality prediction algorithms for patients undergoing primary percutaneous coronary intervention. J Thorac Dis 2020; 12(4): 1706–1720, https://doi.org/10.21037/jtd.2019.12.83.
- Zhang X.T., Lin Z.R., Zhang L., Zhao Z.W., Chen L.L. MELD-XI score predict no-reflow phenomenon and short-term mortality in patient with ST-segment elevation myocardial infarction undergoing primary percutaneous coronary intervention. BMC Cardiovasc Disord 2022; 22(1): 113, https://doi.org/10.1186/s12872-022-02556-2.
- Toprak K., Toprak İ.H., Acar O., Ermiş M.F. The predictive value of the HALP score for no-reflow phenomenon and short-term mortality in patients with ST-elevation myocardial infarction. Postgrad Med 2024; 136(2): 169–179, https://doi.org/10.1080/00325481.2024.2319567.
- Safak O., Yildirim T., Emren V., Avci E., Argan O., Aktas Z., Yildirim S.E., Akgun D.E., Kisacik H.L. Prognostic nutritional index as a predictor of no-reflow occurrence in patients with ST-segment elevation myocardial infarction who underwent primary percutaneous coronary intervention. Angiology 2024; 75(7): 689–695, https://doi.org/10.1177/00033197231193223.
- Kumar R., Ahmed I., Rai L., Khowaja S., Hashim M., Huma Z., Sial J.A., Saghir T., Qamar N., Karim M. Comparative analysis of four established risk scores for prediction of in-hospital mortality in patients undergoing primary percutaneous coronary intervention. Am J Cardiovasc Dis 2022; 12(6): 298–306.
- Сивков О.Г. Факторы, ассоциированные с госпитальной летальностью при остром инфаркте миокарда. Кардиология 2023; 63(11): 29–35, https://doi.org/10.18087/cardio.2023.11.n2406.
- Semaan C., Charbonnier A., Pasco J., Darwiche W., Saint Etienne C., Bailleul X., Bourguignon T., Fauchier L., Angoulvant D., Ivanes F., Genet T. Risk scores in ST-segment elevation myocardial infarction patients with refractory cardiogenic shock and veno-arterial extracorporeal membrane oxygenation. J Clin Med 2021; 10(5): 956, https://doi.org/10.3390/jcm10050956.
- Reindl M., Reinstadler S.J., Tiller C., Kofler M., Theurl M., Klier N., Fleischmann K., Mayr A., Henninger B., Klug G., Metzler B. ACEF score adapted to ST-elevation myocardial infarction patients: the ACEF-STEMI score. Int J Cardiol 2018; 264: 18–24, https://doi.org/10.1016/j.ijcard.2018.04.017.
- Sevdımbas S., Satar S., Gulen M., Acehan S., Acele A., Koksaldı Sahin G., Aka Satar D. Blood urea nitrogen/albumin ratio on admission predicts mortality in patients with non ST segment elevation myocardial infarction. Scand J Clin Lab Invest 2022; 82(6): 454–460, https://doi.org/10.1080/00365513.2022.2122075.
- Гельцер Б.И., Рублев В.Ю., Циванюк М.М., Шахгельдян К.И. Машинное обучение в прогнозировании ближайших и отдаленных результатов реваскуляризации миокарда: систематический обзор. Российский кардиологический журнал 2021; 26(8): 4505, https://doi.org/10.15829/1560-4071-2021-4505.
- Chen P., Wang B., Zhao L., Ma S., Wang Y., Zhu Y., Zeng X., Bai Z., Shi B. Machine learning for predicting intrahospital mortality in ST-elevation myocardial infarction patients with type 2 diabetes mellitus. BMC Cardiovasc Disord 2023; 23(1): 585, https://doi.org/10.1186/s12872-023-03626-9.
- Xiao C., Guo Y., Zhao K., Liu S., He N., He Y., Guo S., Chen Z. Prognostic value of machine learning in patients with acute myocardial infarction. J Cardiovasc Dev Dis 2022; 9(2): 56, https://doi.org/10.3390/jcdd9020056.
- D’Ascenzo F., De Filippo O., Gallone G., Mittone G., Deriu M.A., Iannaccone M., Ariza-Solé A., Liebetrau C., Manzano-Fernández S., Quadri G., Kinnaird T., Campo G., Simao Henriques J.P., Hughes J.M., Dominguez-Rodriguez A., Aldinucci M., Morbiducci U., Patti G., Raposeiras-Roubin S., Abu-Assi E., De Ferrari G.M.; PRAISE study group. Machine learning-based prediction of adverse events following an acute coronary syndrome (PRAISE): a modelling study of pooled datasets. Lancet 2021; 397(10270): 199–207, https://doi.org/10.1016/S0140-6736(20)32519-8.
- Zhao J., Zhao P., Li C., Hou Y. Optimized machine learning models to predict in-hospital mortality for patients with ST-segment elevation myocardial infarction. Ther Clin Risk Manag 2021; 17: 951–961, https://doi.org/10.2147/TCRM.S321799.
- Шахгельдян К.И., Гельцер Б.И., Куксин Н.С., Домжалов И.Г. Многоуровневая категоризация непрерывных переменных в задачах объяснения прогнозных оценок моделей машинного обучения в клинической медицине. Врач и информационные технологии 2023; 3: 44–57, https://doi.org/10.25881/18110193_2023_3_44.
- Ong A.T., Serruys P.W., Mohr F.W., Morice M.C., Kappetein A.P., Holmes D.R. Jr, Mack M.J., van den Brand M., Morel M.A., van Es G.A., Kleijne J., Koglin J., Russell M.E. The SYNergy between percutaneous coronary intervention with TAXus and cardiac surgery (SYNTAX) study: design, rationale, and run-in phase. Am Heart J 2006; 151(6): 1194–1204, https://doi.org/10.1016/j.ahj.2005.07.017.
- Lee S., Chu Y., Ryu J., Park Y.J., Yang S., Koh S.B. Artificial intelligence for detection of cardiovascular-related diseases from wearable devices: a systematic review and meta-analysis. Yonsei Med J 2022; 63(Suppl): S93–S107, https://doi.org/10.3349/ymj.2022.63.S93.
- Popat A., Yadav S., Patel S.K., Baddevolu S., Adusumilli S., Rao Dasari N., Sundarasetty M., Anand S., Sankar J., Jagtap Y.G. Artificial intelligence in the early prediction of cardiogenic shock in acute heart failure or myocardial infarction patients: a systematic review and meta-analysis. Cureus 2023; 15(12): e50395, https://doi.org/10.7759/cureus.50395.
- Zhang Z., Zhao Y., Canes A., Steinberg D., Lyashevska O.; written on behalf of AME Big-Data Clinical Trial Collaborative Group. Predictive analytics with gradient boosting in clinical medicine. Ann Transl Med 2019; 7(7): 152, https://doi.org/10.21037/atm.2019.03.29.
- Wu Y., Chen H., Li L., Zhang L., Dai K., Wen T., Peng J., Peng X., Zheng Z., Jiang T., Xiong W. Construction of novel gene signature-based predictive model for the diagnosis of acute myocardial infarction by combining random forest with artificial neural network. Front Cardiovasc Med 2022; 9: 876543, https://doi.org/10.3389/fcvm.2022.876543.
- Chang Y., Antonescu C., Ravindranath S., Dong J., Lu M., Vicario F., Wondrely L., Thompson P., Swearingen D., Acharya D. Early prediction of cardiogenic shock using machine learning. Front Cardiovasc Med 2022; 9: 862424, https://doi.org/10.3389/fcvm.2022.862424.
- Gong M., Liang D., Xu D., Jin Y., Wang G., Shan P. Analyzing predictors of in-hospital mortality in patients with acute ST-segment elevation myocardial infarction using an evolved machine learning approach. Comput Biol Med 2024; 170: 107950, https://doi.org/10.1016/j.compbiomed.2024.107950.
- Oliveira M., Seringa J., Pinto F.J., Henriques R., Magalhães T. Machine learning prediction of mortality in acute myocardial infarction. BMC Med Inform Decis Mak 2023; 23(1): 70, https://doi.org/10.1186/s12911-023-02168-6.
- Khera R., Haimovich J., Hurley N.C., McNamara R., Spertus J.A., Desai N., Rumsfeld J.S., Masoudi F.A., Huang C., Normand S.L., Mortazavi B.J., Krumholz H.M. Use of machine learning models to predict death after acute myocardial infarction. JAMA Cardiol 2021; 6(6): 633–641, https://doi.org/10.1001/jamacardio.2021.0122.
- Lee H.C., Park J.S., Choe J.C., Ahn J.H., Lee H.W., Oh J.H., Choi J.H., Cha K.S., Hong T.J., Jeong M.H.; Korea Acute Myocardial Infarction Registry (KAMIR) and Korea Working Group on Myocardial Infarction (KorMI) Investigators. Prediction of 1-year mortality from acute myocardial infarction using machine learning. Am J Cardiol 2020; 133: 23–31, https://doi.org/10.1016/j.amjcard.2020.07.048.
- Aziz F., Malek S., Ibrahim K.S., Raja Shariff R.E., Wan Ahmad W.A., Ali R.M., Liu K.T., Selvaraj G., Kasim S. Short- and long-term mortality prediction after an acute ST-elevation myocardial infarction (STEMI) in Asians: a machine learning approach. PLoS One 2021; 16(8): e0254894, https://doi.org/10.1371/journal.pone.0254894.
- Liu R., Wang M., Zheng T., Zhang R., Li N., Chen Z., Yan H., Shi Q. An artificial intelligence-based risk prediction model of myocardial infarction. BMC Bioinformatics 2022; 23(1): 217, https://doi.org/10.1186/s12859-022-04761-4.
- Tarabanis C., Kalampokis E., Khalil M., Alviar C.L., Chinitz L.A., Jankelson L. Explainable SHAP-XGBoost models for in-hospital mortality after myocardial infarction. Cardiovasc Digit Health J 2023; 4(4): 126–132, https://doi.org/10.1016/j.cvdhj.2023.06.001.
- Hosmer D.W. Jr, Lemeshow S., Sturdivant R.X. Applied logistic regression, 3rd edition: guide to logistic regression modeling. John Wiley & Sons, Inc; 2013; 177 p.
- Alizadehsani R., Abdar M., Roshanzamir M., Khosravi A., Kebria P.M., Khozeimeh F., Nahavandi S., Sarrafzadegan N., Acharya U.R. Machine learning-based coronary artery disease diagnosis: a comprehensive review. Comput Biol Med 2019; 111: 103346, https://doi.org/10.1016/j.compbiomed.2019.103346.
- Wang C.H., Wang H.T., Wu K.H., Cheng F.J., Cheng C.I., Kung C.T., Chen F.C. Comparison of different risk scores for prediction of in-hospital mortality in STEMI patients treated with PPCI. Emerg Med Int 2022; 2022: 5389072, https://doi.org/10.1155/2022/5389072.
- Ji C., Song F., Huang X., Qu X., Qiu N., Zhu J. Comparison of the predictive value of the modified CADILLAC, GRACE and TIMI risk scores for the risk of short-term death in patients with acute ST segment elevation myocardial infarction after percutaneous coronary intervention. Zhonghua Wei Zhong Bing Ji Jiu Yi Xue 2023; 35(3): 299–304, https://doi.org/10.3760/cma.j.cn121430-20220727-00696.
- Ali M., Lange S.A., Wittlinger T., Lehnert G., Rigopoulos A.G., Noutsias M. In-hospital mortality after acute STEMI in patients undergoing primary PCI. Herz 2018; 43(8): 741–745, https://doi.org/10.1007/s00059-017-4621-y.
- Kocas B.B., Cetinkal G., Kocas C., Arslan S., Abaci O., Dalgic Y., Ser O.S., Batit S., Yildiz A., Dogan S.M. Usefulness of the SYNTAX score II to predict in-hospital and long-term mortality in ST-segment elevation myocardial infarction patients undergoing primary percutaneous coronary intervention. Sisli Etfal Hastan Tip Bul 2022; 56(2): 182–188, https://doi.org/10.14744/SEMB.2021.33410.
- Saygi M., Tanalp A.C., Tezen O., Pay L., Dogan R., Uzman O., Karabay C.Y., Tanboga I.H., Kacar F.O., Karagoz A. The prognostic importance of the Naples prognostic score for in-hospital mortality in patients with ST-segment elevation myocardial infarction. Coron Artery Dis 2024; 35(1): 31–37, https://doi.org/10.1097/MCA.0000000000001285.
- Szabó G.T., Ágoston A., Csató G., Rácz I., Bárány T., Uzonyi G., Szokol M., Sármán B., Jebelovszki É., Édes I.F., Czuriga D., Kolozsvári R., Csanádi Z., Édes I., Kőszegi Z. Predictors of hospital mortality in patients with acute coronary syndrome complicated by cardiogenic shock. Sensors (Basel) 2021; 21(3): 969, https://doi.org/10.3390/s21030969.
- El Farissi M., Zimmermann F.M., De Maria G.L., van Royen N., van Leeuwen M.A.H., Carrick D., Carberry J., Wijnbergen I.F., Konijnenberg L.S.F., Hoole S.P., Marin F., Fineschi M., Pijls N.H.J., Oldroyd K.G., Banning A.P., Berry C., Fearon W.F. The index of microcirculatory resistance after primary PCI: a pooled analysis of individual patient data. JACC Cardiovasc Interv 2023; 16(19): 2383–2392, https://doi.org/10.1016/j.jcin.2023.08.030.
- Lu X., Lin X., Cai Y., Zhang X., Meng H., Chen W., Yu P., Chen X. Association of the triglyceride-glucose index with severity of coronary stenosis and in-hospital mortality in patients with acute ST elevation myocardial infarction after percutaneous coronary intervention: a multicentre retrospective analysis cohort study. BMJ Open 2024; 14(3): e081727, https://doi.org/10.1136/bmjopen-2023-081727.
- Huang L., Zhang J., Huang Q., Cui R., Chen J. In-hospital major adverse cardiovascular events after primary percutaneous coronary intervention in patients with acute ST-segment elevation myocardial infarction: a retrospective study under the China chest pain center (standard center) treatment system. BMC Cardiovasc Disord 2023; 23(1): 198, https://doi.org/10.1186/s12872-023-03214-x.
- Vatan M.B., Çakmak A.C., Ağaç S., Eynel E., Erkan H. The systemic immune-inflammation index predicts impaired myocardial perfusion and short-term mortality in ST-segment elevation myocardial infarction patients. Angiology 2023; 74(4): 365–373, https://doi.org/10.1177/00033197221106886.
- Kim K., Kang M.G., Park H.W., Koh J.S., Park J.R., Hwang S.J., Hwang J.Y. Prognostic utility of culprit SYNTAX score in patients with cardiogenic shock complicating ST-segment elevation myocardial infarction. Am J Cardiol 2021; 154: 14–21, https://doi.org/10.1016/j.amjcard.2021.05.035.
- Biccirè F.G., Farcomeni A., Gaudio C., Pignatelli P., Tanzilli G., Pastori D. D-dimer for risk stratification and antithrombotic treatment management in acute coronary syndrome patients: asystematic review and metanalysis. Thromb J 2021; 19(1): 102, https://doi.org/10.1186/s12959-021-00354-y.
- Бессонов И.С., Сапожников С.С., Шадрин А.А., Каштанов М.Г., Попов С.В. Влияние времени «дверь–баллон» на результаты лечения пациентов с острым инфарктом миокарда с элевацией сегмента ST в зависимости от длительности догоспитальной задержки. Кардиология 2023; 63(6): 28–36, https://doi.org/10.18087/cardio.2023.6.n2245.
- Wang K., Zeng D., Chen Z., Yu W. Impact of left atrial diameter on all-cause mortality of patients with STEMI undergoing primary percutaneous coronary intervention. Saudi Med J 2023; 44(12): 1260–1268, https://doi.org/10.15537/smj.2023.44.12.20230235.
- Goins A.E., Rayson R., Caughey M.C., Sola M., Venkatesh K., Dai X., Yeung M., Stouffer G.A. Correlation of infarct size with invasive hemodynamics in patients with ST-elevation myocardial infarction. Catheter Cardiovasc Interv 2018; 92(5): E333–E340, https://doi.org/10.1002/ccd.27625.
- Frydland M., Møller J.E., Wiberg S., Lindholm M.G., Hansen R., Henriques J.P.S., Møller-Helgestad O.K., Bang L.E., Frikke-Schmidt R., Goetze J.P., Udesen N.L.J., Thomsen J.H., Ouweneel D.M., Obling L., Ravn H.B., Holmvang L., Jensen L.O., Kjaergaard J., Hassager C. Lactate is a prognostic factor in patients admitted with suspected ST-elevation myocardial infarction. Shock 2019; 51(3): 321–327, https://doi.org/10.1097/SHK.0000000000001191.
- Гельцер Б.И., Шахгельдян К.И., Рублев В.Ю., Домжалов И.Г., Циванюк М.М., Шекунова О.И. Фенотипирование факторов риска и прогнозирование внутригоспитальной летальности у больных ишемической болезнью сердца после коронарного шунтирования на основе методов объяснимого искусственного интеллекта. Российский кардиологический журнал 2023; 28(4): 5302, https://doi.org/10.15829/1560-4071-2023-5302.
- Paolisso P., Foà A., Bergamaschi L., Angeli F., Fabrizio M., Donati F., Toniolo S., Chiti C., Rinaldi A., Stefanizzi A., Armillotta M., Sansonetti A., Magnani I., Iannopollo G., Rucci P., Casella G., Galiè N., Pizzi C. Impact of admission hyperglycemia on short and long-term prognosis in acute myocardial infarction: MINOCA versus MIOCA. Cardiovasc Diabetol 2021; 20(1): 192, https://doi.org/10.1186/s12933-021-01384-6.
- Zweck E., Thayer K.L., Helgestad O.K.L., Kanwar M., Ayouty M., Garan A.R., Hernandez-Montfort J., Mahr C., Wencker D., Sinha S.S., Vorovich E., Abraham J., O’Neill W., Li S., Hickey G.W., Josiassen J., Hassager C., Jensen L.O., Holmvang L., Schmidt H., Ravn H.B., Møller J.E., Burkhoff D., Kapur N.K. Phenotyping cardiogenic shock. J Am Heart Assoc 2021; 10(14): e020085, https://doi.org/10.1161/JAHA.120.020085.
- Shetty M.K., Kunal S., Girish M.P., Qamar A., Arora S., Hendrickson M., Mohanan P.P., Gupta P., Ramakrishnan S., Yadav R., Bansal A., Zachariah G., Batra V., Bhatt D.L., Gupta A., Gupta M. Machine learning based model for risk prediction after ST-elevation myocardial infarction: insights from the North India ST elevation myocardial infarction (NORIN-STEMI) registry. Int J Cardiol 2002; 362: 6–13, https://doi.org/10.1016/j.ijcard.2022.05.023.










